半乳糖基转移酶β4GalT1对膀胱上皮细胞迁移行为的影响
李鸿姣, 郭 佳, 杨刚龙, 刘昌梅, 李 想, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
半乳糖基转移酶β4GalT1对膀胱上皮细胞迁移行为的影响
李鸿姣, 郭 佳, 杨刚龙, 刘昌梅, 李 想, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
在肿瘤发生发展过程中常伴随着糖基化的异常,而糖类结构是糖基转移酶的催化所形成,所以以膀胱癌细胞株为模型研究β1,4-半乳糖基转移酶1(β1,4-galactosyltransferase 1,β4GalT1)对细胞行为的影响。以人源正常膀胱上皮细胞HCV29和人源浸润性膀胱癌细胞YTS1为研究对象,通过凝集素荧光染色技术检测发现YTS1中末端乳糖胺结构含量升高,蛋白免疫印迹和实时荧光定量PCR技术检测发现YTS1中β4GalT1的表达显著高于HCV29。利用转化生长因子(transforming growth factor beta,TGF-β)诱导HCV29发生上皮间质转化(epithelial-mesenchymal transition,EMT)过程,经检测发现,末端乳糖胺结构与β4GalT1的表达显著升高。HCV29过表达β4GalT1后,细胞迁移速度明显变快,而干扰YTS1细胞中的β4GalT1后,细胞迁移速度明显变慢。由此表明,β4GalT1能促进膀胱细胞的迁移能力,但其对膀胱癌发生发展的影响有待深入研究。
β4GalT1;膀胱癌;糖链;细胞迁移
糖基化修饰是蛋白翻译后修饰最普遍的形式,是在糖基转移酶作用下将糖类转移至蛋白质上并和蛋白质上特殊的氨基酸残基形成糖苷键的过程,对很多蛋白质的结构和功能起着重要作用。蛋白质糖基化根据糖类物质与蛋白质结合方式的不同分为N-糖基化和O-糖基化,其中N-糖基化是糖链与蛋白质上的天冬氨酸共价连接而形成,而O-糖基化是糖链与蛋白质上的苏氨酸或丝氨酸共价连接形成。异常糖基化是癌细胞的普遍特征,并且某些特征性糖类结构被公认为肿瘤发展的标志物。
β4GalT1是研究最广泛的糖基转移酶之一,在哺乳动物的糖基转移酶中,β4GalT1是最早被克隆出来的糖基转移酶。β4GalT1属于β-1,4-半乳糖基转移酶家族,是合成糖蛋白上N-糖和O-糖核心结构2的Galβ1-4GlcNAc的关键糖基转移酶(图1)。β4GalT1是一种II型跨膜蛋白,它以两种形式——长型和短型广泛存在于细胞中。长型的β4GalT1和短型的β4GalT1具有相同的催化区和跨膜区,但是由于有着不同的转录起始位点,使长型的β4GalT1比短型的β4GalT1在胞浆区多了13个氨基酸,正是由于这种差异,造成了β4GalT1定位以及功能的不同[1-3]。β4GalT1的表达与很多生物过程有关,如细胞周期[4]、细胞凋亡[5]及癌细胞的转移[6]。Pratt等[7]发现β4GalT1与卵子透明带糖蛋白ZP3的结合介导精卵的识别,沈爱国等[8]发现β4GalT1与层黏蛋白(laminin,LN)结合促进神经元轴突生长以及损伤神经的再生,周慧敏等[9]发现β4GalT1的过表达增强白血病细胞的耐药性,最近的报道表明肝癌细胞表面表达的β4GalT1可以与表皮生长因子受体(epidermal growth factor receptor,EGFR)相互作用,影响到细胞的生长[10]。
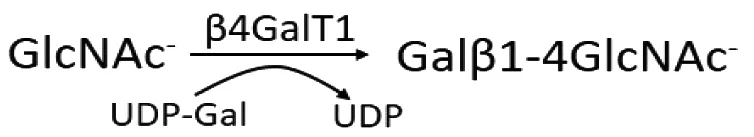
图1 β4GalT1在糖链合成中的作用示意图
Fig 1 Function of β4GalT1 in glycan synthesis
上皮间质转化过程(epithelial-mesenchmyal transition,EMT),是肿瘤细胞转移的主要机制之一,指上皮细胞通过特定程序转化为具有间质细胞表型的生物学过程,常通过外源添加TGF-β诱导发生[11],用于肿瘤的形成和发展研究中。
本文以人正常膀胱上皮细胞HCV29和恶性膀胱癌细胞YTS1为研究对象,分析两者中末端乳糖胺结构含量的差异以β4GalT1在转录水平和蛋白水平上的表达差异,建立过表达β4GalT1和干扰β4GalT1细胞模型,比较转染前后细胞迁移能力的变化,证实β4GalT1对膀胱细胞的迁移具有促进作用,为进一步探究β4GalT1对膀胱癌发生发展的影响奠定理论基础。
1 材料与方法
1.1 材料
人正常膀胱上皮细胞株HCV29和人浸润性膀胱癌细胞株YTS1为美国华盛顿大学Hakomori教授馈赠。大肠杆菌JM109及质粒pLVX,psPAX2,pMD2.G由本实验室保存。
抑肽酶,苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF),RIPA裂解液和Hoechst染色液购自美国Thermo Fisher公司;BCA蛋白检测试剂盒和辣根过氧化酶标记山羊抗兔IgG抗体购自碧云天生物技术研究所;β4GalT1抗体购于英国Abcam公司;GAPDH抗体购于美国BD公司;Pro-Light HRP化学发光检测试剂购于天根生化科技有限公司;细胞RNA提取试剂盒、UltraSYBR Mixture试剂盒和质粒提取试剂盒购于北京康为世纪生物科技有限公司;鸡冠刺桐凝集素(Erythrinacristagallilectin,ECL),麦胚素(Wheat germ agglutinin,WGA)购于美国Vector公司;Lipofectamine 2000转染试剂购于Thermo Fisher 公司;嘌呤霉素(Puromycin,puro)购于美国Sigma公司。
1.2 方法
1.2.1 细胞培养
细胞株均使用含10%胎牛血清(fetal bovine serum,FBS)、100 U/mL青霉素/链霉素的RPMI 1640培养基(HyClone,USA)培养,培养条件为37℃,5%CO2。
1.2.2 细胞稳定转染
在T25培养瓶接种293T细胞,细胞融合度达到70%~80%时转染,吸去原有的培养基,加入新鲜完全培养基,放置于37℃,待转染。取两个离心管,分别加入250 μL DMEM空白培养基。其中一管中加入25 μL Lipofectamine 2000,混合均匀。在另一管中加入质粒(重组质粒,psPAX2,pMD2.G),混合均匀。将两管混合均匀,在室温下孵育5 min后,转移至293T细胞的培养液中,摇匀。转染48 h后,荧光显微镜观察转染效果。收集293T细胞上清液,以0.22 μm滤膜过滤上清液,分装成1 mL/管,保存于-80℃。
将待转染的细胞接种于12孔板中,生长至细胞融合度10%~20%进行细胞转染。吸去原有的培养基,加入1 mL病毒液。4 h后再加入1 mL完全培养基。24 h后,吸去含病毒的培养液,换新鲜的完全培养基,继续培养24 h,换相应浓度的puro抗生素筛选72 h,挑选细胞单克隆,再添加筛选浓度一半的puro抗生素浓度的培养基中扩大培养,提取总蛋白,利用蛋白质印迹法进行验证,得到稳定转染细胞株。
1.2.3 实时荧光定量PCR(quantitative real-time PCR,Realtime-PCR)
用RNA提取试剂盒从HCV29、YTS-1细胞中提取RNA,并反转录为cDNA。根据GenBank序列,按照Realtime-PCR的引物要求设计引物序列。使用UltraSYBR Mixture试剂盒进行PCR,条件为95℃预变性10 min;95℃变性15 s,60℃退火、延伸1 min,共40个循环。荧光定量PCR检测系统进行荧光扩增,测定溶解曲线。根据Ct值,使用2-ΔΔCt法计算目的基因相对内参GAPDH表达的倍性关系。
1.2.4 蛋白质印记与凝集素印迹
收集细胞,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗细胞3次,加入蛋白裂解液(1 mL RIPA、1%PMSF、0.1%抑肽酶),在冰上裂解细胞30 min,12 000 r/min 离心细胞裂解液15 min,取上清,用BCA法测蛋白浓度。样品加入5×Loading buffer,煮沸5 min,取30 μg蛋白,用10%聚丙烯酰胺凝胶电泳。电泳后,将蛋白转移至0.22 μm PVDF膜,用5%脱脂奶粉37℃封闭2 h,一抗或生物素标记的凝集素ECL和WGA 4℃孵育过夜,TBST漂洗5次,每次5 min,再将膜与辣根过氧化物酶HRP标记的二抗或VECTOR的ABC KIT,室温孵育1 h;TBST漂洗5次,每次5 min,采用Pro-Light HRP化学发光检测试剂显色,用ChemiDocTMXRS+成像系统进行图像采集及定量分析。
1.2.5 凝集素细胞染色
以2×104个/孔接种细胞于24孔板中并制作细胞爬片,培养12~24 h至细胞融合度到60%~70%,用PBS洗涤3次,用新配制的2%的多聚甲醛固定细胞15 min;用PBS洗涤3次,每次5 min;用0.2%~0.3%的TritonX-100室温通透15 min;再用PBS洗涤3次,3%的牛血清蛋白(Bovine serum albumin,BSA)溶液4℃封闭过夜,然后用Cy3标记浓度为0.7 mg/L ECL和WGA室温避光孵育3 h,PBS洗涤3次,每次5 min,5 mg/L 4,6-二脒基-2-苯基吲哚(2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI)染色10 min,最后将爬片倒扣在滴有Glycergel固封剂的载玻片上,晾干后于4℃下避光保存。用Leica TCS SP8共聚焦显微镜在10×40倍下观察拍照。
1.2.6 细胞免疫组化
将灭菌圆形盖玻片置于24孔细胞培养板中,加入RPMI 1640培养基,接种适量细胞。PBS冲洗3次,加入2%的多聚甲醛置于室温固定15 min,吸去固定液,加入PBS洗涤3次,每次5 min;用0.2%~0.3%的Triton X-100室温通透15 min;再用PBS洗涤3次,3%的BSA溶液37℃封闭2 h。吸去封闭液,一抗4℃孵育过夜,PBST漂洗5次,每次5 min,Cy3标记的二抗,室温孵育1 h;PBST漂洗5次,每次5 min。最后将爬片倒扣在滴有Glycergel固封剂的载玻片上,晾干后于4℃条件下避光保存。用Leica TCS SP8共聚焦显微镜在10×40倍下观察拍照。
1.2.7 细胞划痕实验
将适量的6株细胞分别接入6孔板中,在完全培养基中培养过夜,吸取培养基,分别用加样器枪头在每个孔中划线,用PBS冲洗3次,加入不含血清的培养基,分别在培养0、12 h时进行拍照。
2 结果与分析
2.1 膀胱细胞中β4GalT1表达的检测
利用凝集素染色技术检测了HCV29、YTS1细胞中的Galβ1→4GlcNAc糖链水平的差异。实验所选取的凝集素为ECL,其为一种可以特异性识别末端Galβ1→4GlcNAc糖链结构。为了防止过多的唾液酸连接在糖链末端,阻碍凝集素对Galβ1→4GlcNAc糖链的识别,在细胞ECL凝集素染色之前,用唾液酸酶(Neuramidinase,Neu)处理细胞,切掉糖链末端的唾液酸,使Galβ1→4GlcNAc糖链结构暴露在外面,有利于凝集素的结合。实验结果表明与YTS1细胞相比,HCV29中Galβ1→4GlcNAc糖链结构含量降低(图2-A和2-B)。Real time-PCR检测了半乳糖基转移酶家族7个基因在2个细胞株中的表达差异,发现在半乳糖基转移酶家族中,β4GalT2、β4GalT4、β4GalT5、β4GalT6及β4GalT7在YTS1中表达量低于在HCV29中,而β4GalT1和β4GalT3在YTS1中表达量高于在HCV29中(图2-C)。之后利用蛋白印迹技术检测两株细胞中β4GalT1蛋白水平表达的差异。蛋白印迹结果表明β4GalT1在HCV29中表达量低,在YTS1细胞中表达量高(图2-D)。结果与凝集素细胞染色和Real time-PCR结果一致。

图2 β4GalT1在膀胱癌细胞中的表达
A:细胞中Galβ1→4GlcNAc糖链结构的检测,细胞核用DAPI染色(蓝色),Galβ1→4GlcNAc用连有Cy3的ECL染色(红色),标尺为50 μm;B:凝集素细胞染色量化图;C:β4GalT1转录水平检测;D:β4GalT1蛋白水平检测
2.2 人正常膀胱上皮细胞发生EMT前后β4GalT1的表达变化
用不同浓度的TGF-β处理HCV29细胞48 h,建立EMT细胞模型。利用蛋白印迹和Real time-PCR检测HCV29细胞经TGF-β处理前后β4GalT1表达的变化。实验结果发现HCV29细胞经TGF-β处理后,β4GalT1在蛋白水平和转录水平的表达均上调,且随着TGF-β浓度的增大,β4GalT1的表达量也增多(图3-A、3-B)。而细胞凝集素荧光染色证明EMT过程中,HCV29细胞表面Galβ1→4GlcNAc糖链结构增多(图3-C和3-D)。
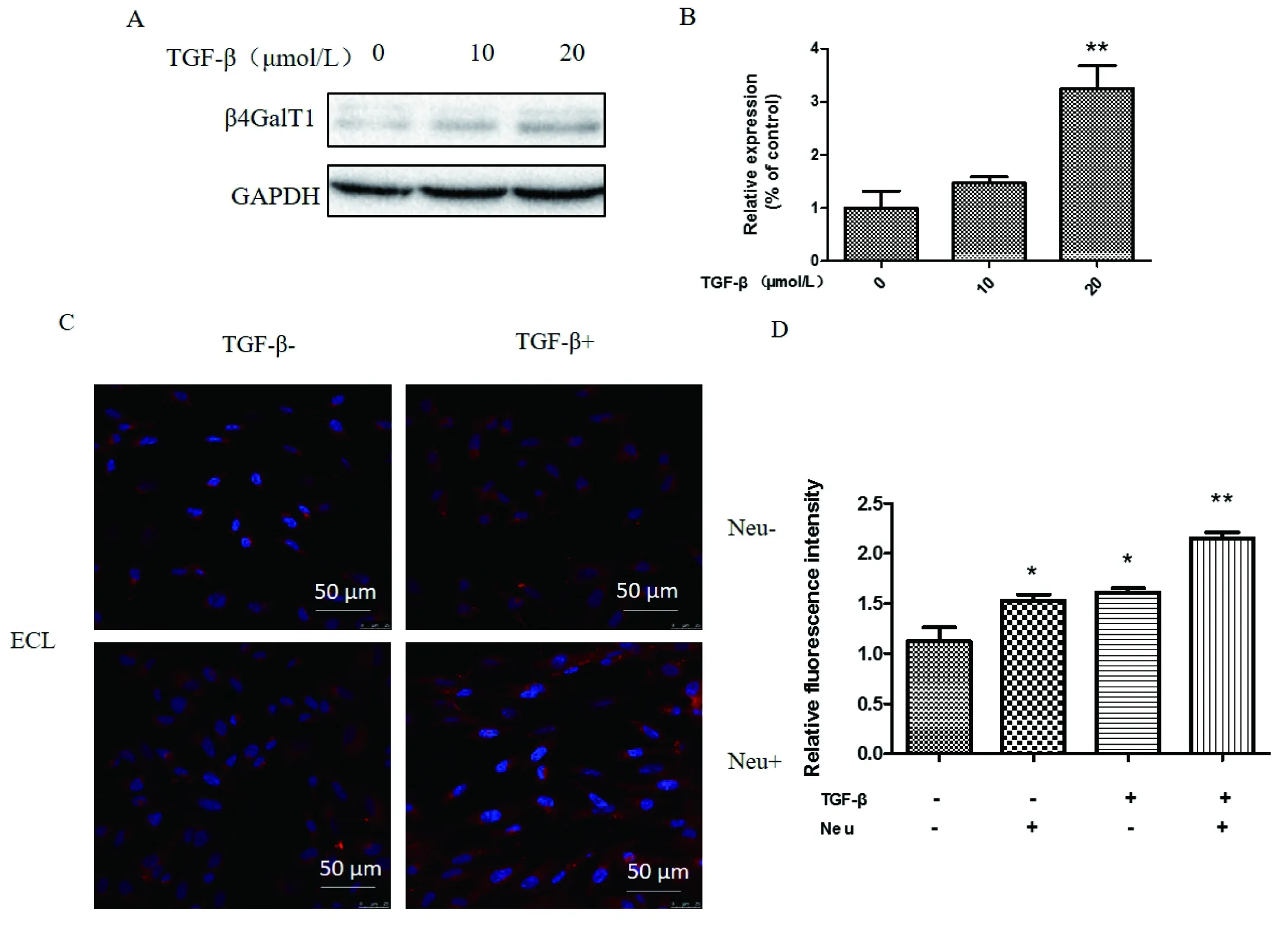
图3 HCV29在EMT过程中β4GalT1的表达
A:β4GalT1蛋白水平检测;B:β4GalT1转录水平检测;C:HCV29发生上皮间质转化前后Galβ1→4GlcNAc表达差异。*:P<0.05;**:P<0.01;***:P<0.001
2.3 β4GalT1过表达质粒及干扰质粒的构建及验证
利用分子克隆手段构建长型β4GalT1和短型β4GalT1过表达质粒,分别命名为pLVX-β4GalT1-L和pLVX-β4GalT1-S。用菌落PCR筛选阳性菌,核酸电泳图显示条带大小为1197 bp和1158 bp说明质粒成功导入(图4-A)。由于长型β4GalT1和短型β4GalT1仅相差39 bp,核酸电泳上显示区别不明显。后经基因测序,测序结果与GenBank中人源β4GalT1一致,表明pLVX-β4GalT1-L和pLVX-β4GalT1-S质粒构建成功(图4-C)。
按照上述试验方法构建pLVX-shβ4GalT1-1,pLVX-shβ4GalT1-2和pLVX-shNC重组质粒。以构建pLVX-shβ4GalT1-1为例,采用菌落PCR的方法筛选阳性转化子,核酸电泳结果显示有大小为550 bp的条带即为阳性转化子(图4-B)。后经测序与设计的干扰序列相符,说明pLVX-shβ4GalT1-1,pLVX-shβ4GalT1-2和pLVX-shNC重组质粒构建成功。
2.4 长型β4GalT1和短型β4GalT1过表达HCV29细胞株的筛选
通过蛋白印迹与Realtime-PCR筛选长型β4GalT1和短型β4GalT1过表达HCV29细胞。对比空转质粒的HCV29细胞,转染后的细胞在85 ku位置出现GFP-β4GalT1的融合蛋白条带(图5-A),并且β4GalT1的表达增加,而长型β4GalT1和短型β4GalT1仅相差13个氨基酸,故在分子质量上无法区分。而Real time-PCR的结果,与对照组相比,长型β4GalT1和短型β4GalT1过表达后β4GalT1在转录水平也显著升高(图5-B)。采用ECL和单一性识别GlcNAc的凝集素WGA,进行凝集素印迹结果显示过表达长型和短型β4GalT1后,HCV29细胞的Galβ1→4GlcNAc糖链均明显增加,而对细胞内GlcNAc的含量没有影响(图5-C)。细胞荧光染色结果也证实这个结论(图5-D)。
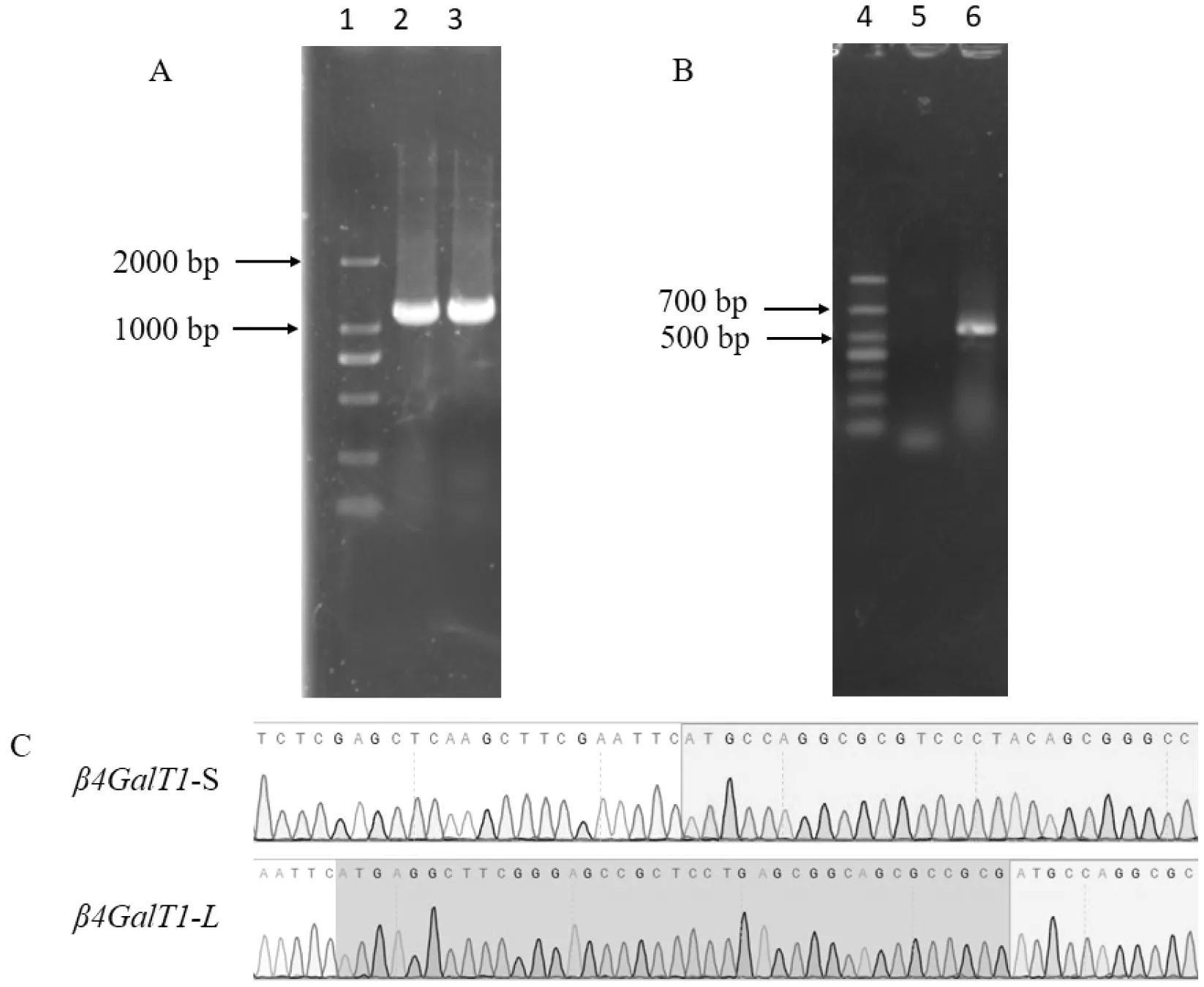
图4 重组质粒pLVX-β4GalT1和重组干扰质粒pLVX-shβ4GalT1-1菌落PCR验证图
A、B为核酸电泳图,1:DL2000 Marker;2:重组质粒pLVX-β4GalT1-L;3:重组质粒pLVX-β4GalT1-S;4:DL1000 Marker;5:pLVX;6:pLVX-shβ4GalT1-1。C:基因测序图谱,白色区域为质粒载体部分序列;深色区域为长型β4GalT1的5′端特有序列;浅色区域为长型和短型β4GalT1共有序列
2.5 β4GalT1干扰细胞株的筛选
通过蛋白印迹筛选β4GalT1干扰YTS1细胞株,通过筛选发现转染pLVX-shβ4GalT1-1和pLVX-shβ4GalT1-2的YTS1细胞株中β4GalT1的表达明显低于转染pLVX-shNC重组质粒的YTS1细胞株,表明成功干扰YTS1细胞株中β4GalT1的表达(图6-A)。凝集素印迹结果显示干扰β4GalT1的表达后,YTS1细胞中Galβ1→4GlcNAc糖链明显减少(图6-B)。

图5 蛋白免疫印迹、实时荧光定量PCR、凝集素印迹检验过表达β4GalT1的HCV29细胞株
A: 蛋白免疫印迹β4GalT1在蛋白表达检测;B: Realtime-PCR检测B4GALT1在转录水平的表达;C: 凝集素印迹检测糖链变化;D: 细胞免疫组化检测细胞内β4GalT1的表达变化,细胞核用DAPI染色(蓝色),β4GalT1用相应连有Cy3的二抗染色(红色)。*:P<0.05;**:P<0.01;***:P<0.001
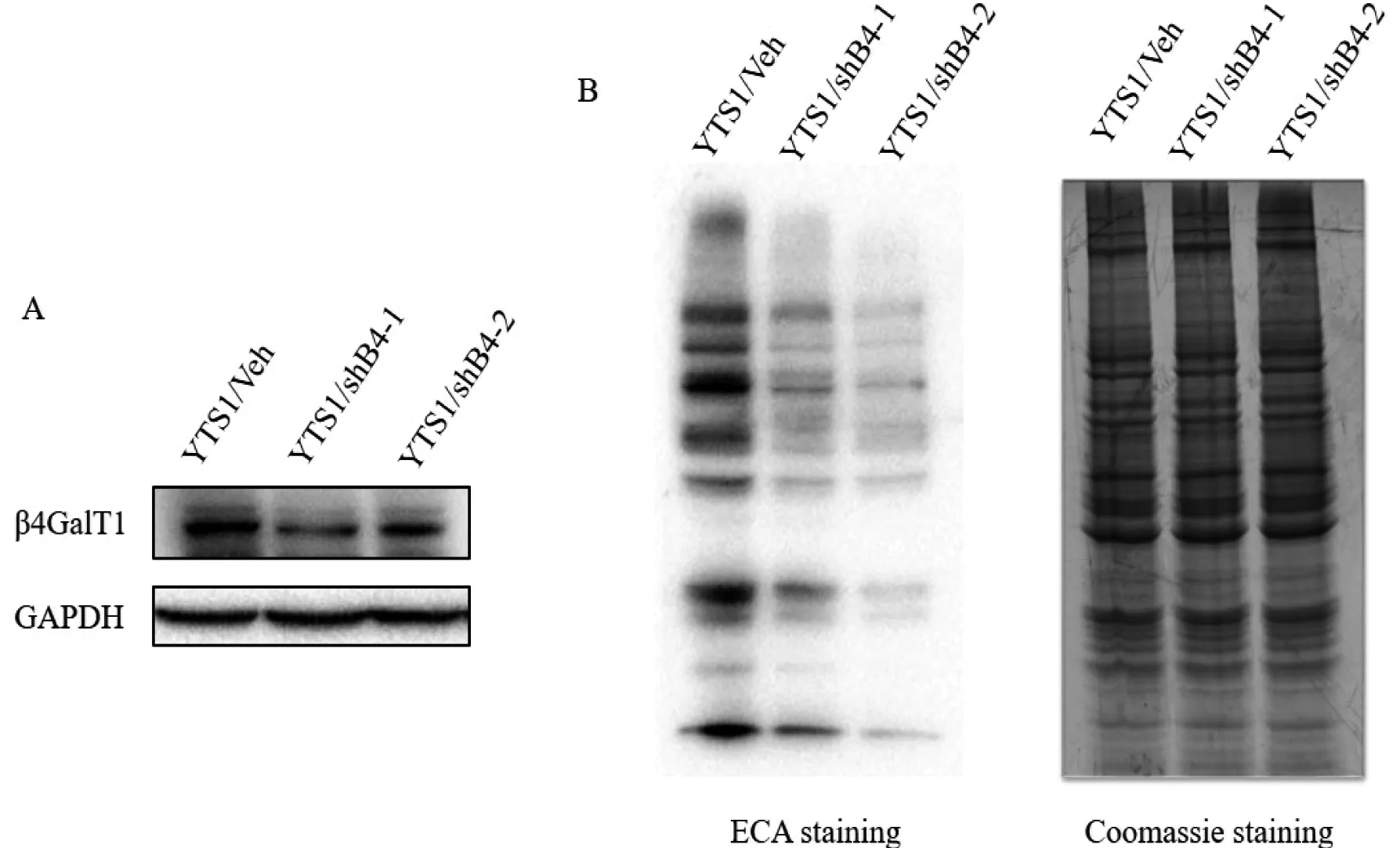
图6 蛋白免疫印迹、凝集素印迹检验干扰β4GalT1的YTS1细胞株
A:YTS1干扰β4GalT1稳转株蛋白水平干扰效果;B:YTS1干扰β4GalT1稳转株糖链水平干扰效果
2.6 过表达和干扰β4GalT1对细胞迁移能力的影响
将过表达β4GalT1的HCV29细胞和干扰β4GalT1的YTS1细胞进行划痕实验,结果表明12 h后过表达长型和短型β4GalT1的HCV29细胞迁移能力均显著高于对照组(图7-A和7-B),而干扰β4GalT1的YTS1细胞迁移能力显著低于对照组(图7-C和7-D)。
3 讨论
近年来,越来越多的研究发现,在一些恶性肿瘤细胞中,例如黑色素瘤、星形细胞瘤、肺癌中均发现随着肿瘤迁移和侵袭能力的增加,β4GalT1的表达也增加。Villegas-Comonfort等[12]报道了花生四烯酸能够增加β4GalT1的表达并且增加了乳腺癌细胞MDA-MB-231的细胞迁移能力。Choi等[13]报道雌激素能够增加MCF-7细胞中β4GalT1的表达并且增强细胞的迁移能力。
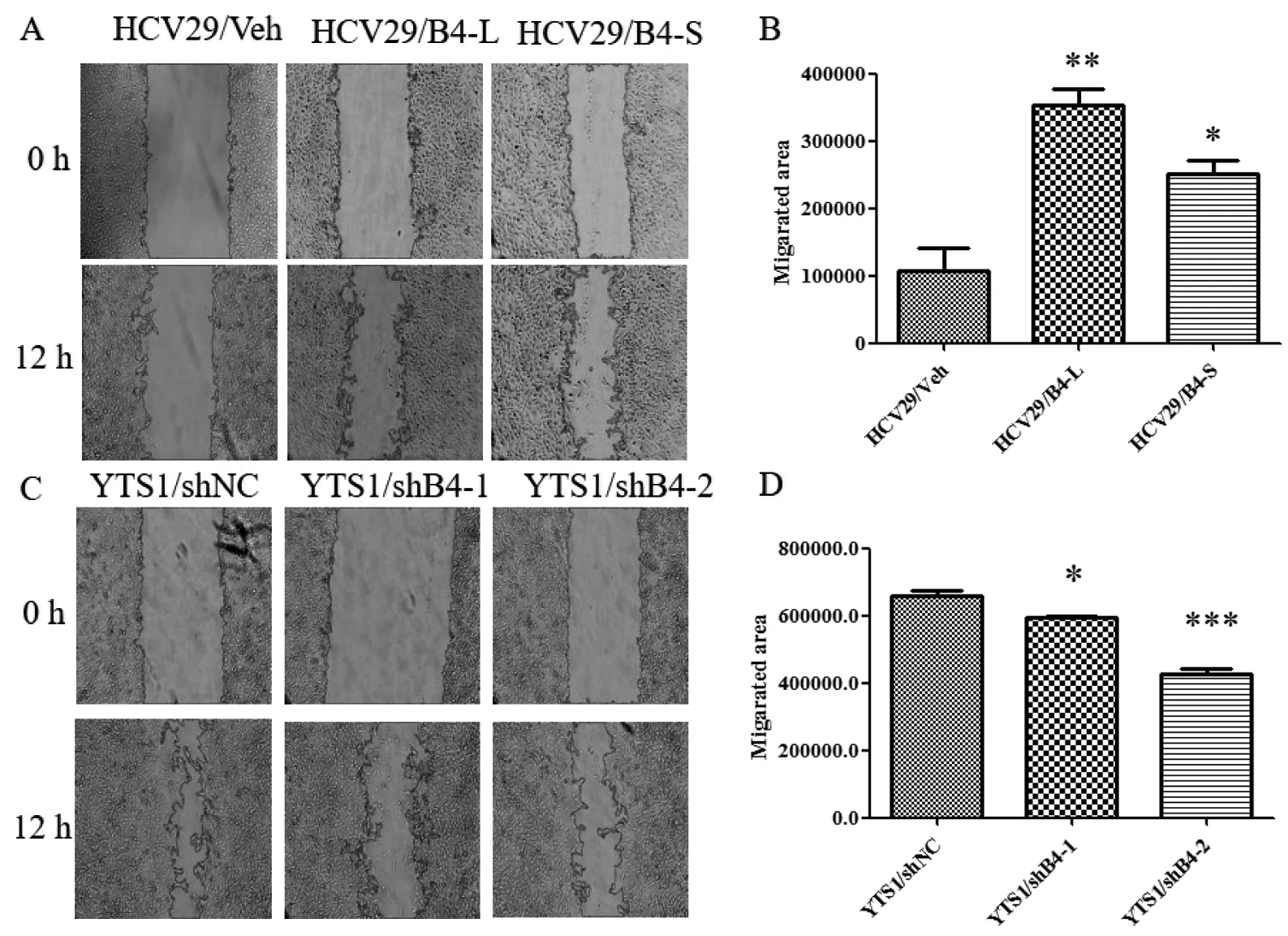
图7 过表达和干扰β4GalT1对HCV29、YTS1细胞迁移的影响
*:P<0.05;**:P<0.01;***:P<0.001
本实验结果证实长型β4GalT1和短型β4GalT1在促进细胞迁移方面具有重要作用。长型β4GalT1可与细胞外基质中的层黏连蛋白1结合,帮助伪足形成,细胞铺展和迁移[14]。在F9胚胎细胞中,长型β4GalT1与参与细胞黏附的跨膜受体E-钙黏连蛋白相互作用[15]。这些相互作用可能是长型β4GalT1促进细胞迁移的原因。但是短型β4GalT1促进细胞迁移的原因还有待进一步研究。
本实验结果证实β4GalT1在恶性浸润性膀胱癌细胞中表达明显高于正常膀胱细胞,细胞发生EMT后,β4GalT1的表达量增加,而过表达长型和短型的β4GalT1均能增加细胞的迁移速度。而且本实验所构建的HCV29过表达长型β4GalT1和短型β4GalT1稳转细胞株以及YTS1干扰β4GalT1稳转细胞株可为后面研究β4GalT1对细胞增殖、凋亡、细胞周期及细胞耐药性等方面研究提供良好的细胞模型,也能为进一步探究长型β4GalT1和短型β4GalT1在膀胱癌的发生发展过程中的作用做贡献。
[1]丁怡甜, 辛现良, 耿美玉. 细胞表面 β1, 4-半乳糖基转移酶 1 功能研究进展[J]. 生物物理学报, 2007,23(5):351-356.
[2]SHUR B D, EVANS S, LU Q. Cell surface galactosyltransferase: current issues[J]. Glycoconjugate Journal, 1998,15(6):537-548.
[3]RAMAKRISHNAN B, QASBA P K. Structure-based design of β1, 4-galactosyltransferase I (β4Gal-T1) with equally efficient N-acetylgalactosaminyltransferase activity point mutation broadens β4Gal-T1 donor specificity[J]. Journal of Biological Chemistry, 2002, 277(23):20833-20839.
[4]WEI Y, LIU D, ZHOU F, et al. Identification of β-1, 4-galactosyltransferase I as a target gene of HBx-induced cell cycle progression of hepatoma cell[J]. Journal of Hepatology, 2008, 49(6):1029-1037.
[5]ZHU X, CHEN S, YIN X, et al. Constitutively active PKB/Akt inhibited apoptosis and down-regulated β1, 4-galactosyltransferase 1 in hepatocarcinoma cells[J]. Biochemical and Biophysical Research Communications, 2003, 309(2):279-285.
[6]ZHU X, JIANG J, SHEN H, et al. Elevated β1, 4-galactosyltransferase I in highly metastatic human lung cancer cells identification of E1AF as important transcription activator[J]. Journal of Biological Chemistry, 2005, 280(13):12503-12516.
[7]PRATT S A, SCULLY N F, SHUR B D. Cell surface beta 1, 4-galactosyltransferase on primary spermatocytes facilitates their initial adhesion to Sertoli cells in vitro[J]. Biology of Reproduction, 1993, 49(3):470-482.
[8]SHEN A, YAN J, DING F, et al. Overexpression of β-1, 4-galactosyltransferase I in rat Schwann cells promotes the growth of co-cultured dorsal root ganglia[J]. Neuroscience Letters, 2003, 342(3):159-162.
[9]ZHOU H, MA H, WEI W, et al. B4GALT family mediates the multidrug resistance of human leukemia cells by regulating the hedgehog pathway and the expression of p-glycoprotein and multidrug resistance-associated protein 1[J]. Cell Death & Disease, 2013, 4(6):e654.
[10]TANG W, WENG S, ZHANG S, et al. Direct interaction between surface β1, 4-galactosyltransferase 1 and epidermal growth factor receptor (EGFR) inhibits EGFR activation in hepatocellular carcinoma[J]. Biochemical and Biophysical Research Communications, 2013, 434(3):449-454.
[11]VALCOURT U, KOWANETZ M, NIIMI H, et al. TGF-β and the smad signaling pathway support transcriptomic reprogramming during epithelial-mesenchymal cell transition[J]. Molecular Biology of the Cell, 2005, 16:1987-2002.
[12]VILLEGAS-COMONFORT S, SERNA-MARQUEZ N, GALINDO-HERNANDEZ O, et al. Arachidonic acid induces an increase of β-1, 4-galactosyltransferase I expression in MDA-MB-231 breast cancer cells[J]. Journal of Cellular Biochemistry, 2012, 113(11):3330-3341.
[13]CHOI H J, CHUNG T W, KIM C H, et al. Estrogen induced β-1, 4-galactosyltransferase 1 expression regulates proliferation of human breast cancer MCF-7 cells[J]. Biochemical and Biophysical Research Communications, 2012, 426(4):620-625.
[14]APPEDDU P A, SHUR B D. Molecular analysis of cell surface beta-1, 4-galactosyltransferase function during cell migration[J]. Proceedings of the National Academy of Sciences, 1994, 91(6):2095-2099.
[15]MAILLET C M, SHUR B D. Uvomorulin, LAMP-1, and laminin are substrates for cell surface β-1, 4-galactosyltransferase on F9 embryonal carcinoma cells: comparisons between wild-type and mutant 5.51 att-cells[J]. Experimental Cell Research, 1993, 208(1):282-295.
Effectoncellmigrationinbladderepithelialcellbygalactosyltransferaseβ4GalT1
LI Hong-jiao, GUO Jia, YANG Gang-long, LIU Chang-mei, LI Xiang, GUAN Feng
(Key Laboratory of Carbohydrate Chemistry & Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Aberrant glycosylation is known to be closely associated with cancer progression, and glycans are synthesized by glycosyltransferases. Therefore, we studied the effect of β4GalT1 on cell behavior in bladder cancer. In this study, human HCV29 non-malignant urothelial cells and YTS1 bladder cancer cells were used as the cell models. The terminal lactosyl epitopes were elevated in YTS1 by lectin staining and the expression of β4GalT1 was found up-regulated in YTS1 compared with HCV29 using western blot and Realtime-PCR test. In TGF-β induced EMT process, the expression of β4GalT1 and terminal lactosyl epitopes significantly increased in TGF-β-treated HCV29. The cell migration increased in β4GalT1 overexpressed HCV29, and the cell migration decreased in β4GalT1 knockdown HCV29, which demonstrated that β4GalT1 could promote the migration of bladder cells. Further research is required to understand the effect of β4GalT1 on the cancer progression.
β4GalT1; bladder cancer; glycan; migration
2016-12-16;
2017-01-03
国家自然科学基金项目(No. 81672537);江苏省自然科学基金项目(BK20161132)
李鸿姣,硕士研究生,专业方向为制糖工程,E-mail:hj-lee@foxmail.com
关 锋,博士,教授,研究方向为糖生物学,E-mail:fengguan@jiangnan.edu.cn
10.3969/j.issn.2095-1736.2017.06.007
R737.1
A
2095-1736(2017)06-0007-06

