膀胱过度活动症患者脑1H-MRS成像特点及临床相关分析
周 洋 王双坤* 左 龙 王 飚 顾 华
(1.首都医科大学附属北京朝阳医院放射科,北京 100020;2.首都医科大学附属北京朝阳医院泌尿外科,北京 100020)
·神经系统疾病的基础和临床研究·
膀胱过度活动症患者脑1H-MRS成像特点及临床相关分析
周 洋1王双坤1*左 龙1王 飚2顾 华1
(1.首都医科大学附属北京朝阳医院放射科,北京 100020;2.首都医科大学附属北京朝阳医院泌尿外科,北京 100020)
目的利用氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)成像探讨膀胱过度活动症(overactive bladder,OAB)患者特定脑区的代谢变化。方法选择临床确诊的膀胱过度活动症患者23例,健康志愿者23例,记录所有受试者的抑郁自评量表(Self-rating Depression Scale,SDS)评分及患者的膀胱过度活动症患者自我评价量表(Overactive Bladder Symptom Score,OABSS)评分。所有受试者接受颅脑多体素1H-MRS扫描,并利用专用的后处理软件计算双侧额叶前部、中部、后部及双侧扣带回前部、后部的N-乙酰基天门冬氨酸(N-acetyl aspartate,NAA)/磷酸肌酸(creatine,Cr)、胆碱化合物(choline,Cho)/Cr比值,进行组间比较。并且,利用Pearson相关系数对NAA/Cr、Cho/Cr比值与SDS、OABSS评分进行相关分析。结果OAB患者双侧额叶前部、右侧额叶中部、双侧前扣带回、左侧后扣带回的NAA/Cr值较对照组降低,其余指标差异无统计学意义(P>0.05)。OAB组右侧额叶中部NAA/Cr比值与SDS评分呈负相关(r=-0.361,P<0.05)。结论1H-MRS能够反映OAB患者的脑部代谢变化,为进一步的治疗提供理论依据。
膀胱过度活动症;磁共振波谱成像;脑
膀胱过度活动症(overactive bladder,OAB)越来越受到人们的重视,不仅因为其逐年增高的发病率,并且,本病对患者的工作、生活质量都会产生不良影响,危害患者的身体及心理健康[1-2]。目前为止,氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)成像是唯一无创性研究活体器官、组织代谢、生物化学变化及化合物定量分析的方法,可提供脑的代谢信息。本研究利用多体素波谱成像,对OAB患者特定脑区的代谢变化进行研究。
1 对象与方法
1.1 研究对象
选择2016年3月至12月于首都医科大学附属北京朝阳医院泌尿外科就诊的临床确诊为膀胱过度活动症的患者23例作为研究对象。入组标准:①经医生诊断为膀胱过度活动症;②病史6个月以上;③右利手;④尿液各项实验室检查正常;⑤自愿参加本研究,并接受MR检查及量表调查。排除标准:①近3个月内接受过关于排尿障碍的治疗;②精神障碍、有头部外伤史、手术史、颅内占位性病变或其他神经系统疾病;③妊娠;④有泌尿生殖道肿瘤、下尿路梗阻、重度尿潴留、神经源性膀胱及以压力性尿失禁为主要临床表现者。其中,男性3人,女性20人,年龄27~75岁,平均年龄约为(51.2±13.3)岁。选取与患者年龄、性别相匹配的健康志愿者23人作为对照组,既往无尿路疾病病史,无颅脑手术史、外伤史及神经系统疾病病史。本试验获得伦理委员会批准,所有受试者均了解本研究目的、内容并签署知情同意书。
采集了所有受试者的性别、年龄等基本信息,并嘱所有受试者完成抑郁自评量表(Self-rating Depression Scale,SDS),所有OAB患者完成膀胱过度活动症患者自我评价量表(Overactive Bladder Symptom Score,OABSS),记录总分。
1.2 扫描序列和参数
采用Siemens Prisma 3.0T超导型MR成像仪进行MR检查,用64通道头颈联合线圈,对患者进行MR扫描,包括以下序列:T2加权成像(T2-weighted imaging,T2WI)横轴位扫描,重复时间(repetition time,TR):5 000 ms,回波时间(echo time,TE):54 ms,层厚:5 mm,层数:20;T1加权磁化强度预备梯度回波序列(T1 weighted magnetization-prepared rapid acquisition gradient-echo,T1-MP2RAGE)矢状位扫描,TR:5 000 ms,TE:2.98 ms,层厚:1 mm,层数:176;1H-MRS多体素成像。1H-MRS成像,选用点分辨波谱(pointed resolved selective spectroscopy,PRESS)序列行多体素波谱采集。采集时间6 min 53 s,TR:1 700 ms,TE:135 ms,Averages:3,体素10 mm×10 mm×15 mm,感兴趣区(volume of interest,VOI):80 mm×80 mm×15 mm,将感兴趣区放置在脑室上层面,平行于前连合-后连合放置,尽量避开脑脊液、鼻窦干扰,利用T2WI及T1-MP2RAGE序列精确定位,确保同一体素在矢、冠、轴定位相上的位置一致,并在上、下及四周增加饱和带减少污染。扫描开始前匀场,要求水峰窄尖、水抑制充分,半高全宽(full width at half maximum,FWHM)<20 Hz,主磁场频率偏移在1Hz以内。
1.3 图像后处理和分析
将图像传至工作站进行后处理分析,后处理步骤包括水参照处理、过滤、零填充、傅立叶变换、频率偏移校正、基线校正、相位校正。由2位研究人员选择感兴趣区,感兴趣区包括双侧扣带回前部、扣带回后部及双侧额叶皮质的前、中、后部,如两位研究人员意见不一致则商讨后决定。软件自动算出N-乙酰基天门冬氨酸(N-acetyl aspartate,NAA)、胆碱化合物(choline,Cho)、磷酸肌酸(creatine,Cr)的曲线下面积,以Cr峰为参照,计算出NAA/Cr值、Cho/Cr值(图1)。
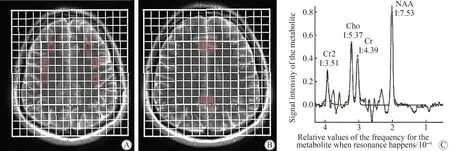
图1 氢质子磁共振波谱感兴趣区标示及谱线Fig.1 Region of interest of 1H-MRS and spectral map of one voxel
A: region of interest in both frontal lobe;B: region of interest in both cingulate gyrus;C: spectral map of one voxel;1H-MRS:proton magnetic resonance spectroscopy;NAA:N-acetyl aspartate;Cho:choline;Cr:creatine;I:Integral.
1.4 统计学方法

2 结果
2.1 临床量表结果
OAB患者OABSS平均分为(8.261±2.454)分,OAB患者组及健康对照组SDS评分分别为(53.826±8.359)分及(44.565±8.938)分,OAB患者组SDS评分高于对照组,2组间差异有统计学意义(P<0.05)。
2.2 1H-MRS的测量结果
同一受试者左、右两侧的1H-MRS各项指标服从正态分布,对同一受试者左、右两侧的1H-MRS各项指标进行配对t检验,差异无统计学意义(P>0.05)。
OAB组和对照组各区域的1H-MRS指标均服从正态分布,2组样本均数的方差齐同。对OAB组和对照组的各区域的1H-MRS指标进行两独立样本t检验,发现OAB患者双侧额叶前部、右侧额叶中部、双侧前扣带回、左侧后扣带回的NAA/Cr值较对照组降低,差异有统计学意义(P<0.05),其余指标差异无统计学意义(P>0.05,表1)。
表1 两组间双侧额叶及扣带回NAA/Cr、Cho/Cr比值的比较Tab.1 1H-MRS values of OAB group and control group
2.3 相关分析结果
OAB组内各区域NAA/Cr、Cho/Cr比值与OABSS评分不存在相关性。OAB组右侧额叶中部NAA/Cr比值与SDS评分呈负相关(r=-0.361,P<0.05),余数值与SDS评分不存在明确相关性。
3 讨论
2002年,国际尿控协会(International Continence Society,ICS)将OAB定义为在排除感染及其他病理改变的前提下,以尿急症为特征的症候群,常伴有尿频和夜尿增多,可伴或不伴急迫性尿失禁[3]。2006年,Abrams等[4]提出将“急迫性尿失禁”改为“尿急性尿失禁”,并用“日间尿频”代替“尿频”,因此重新将OAB定义为尿急、通常有日间尿频和夜尿增多,伴或不伴有尿急性尿失禁。中华医学会泌尿外科学分会[2]于2010 年6 月公布了我国首个OAB的大规模流行病学调查数据:OAB 在我国成年人中的总体发病率大约为4.7%~6.0%,女性人群发病率远远高于男性,年龄越大发病率越高,我国40 岁以上人群OAB 发病率高达11.3%[1-2]。
然而,迄今为止,膀胱过度活动症的致病机制尚不明确。目前,得到公认的假说包括中枢神经系统、外周神经系统调节、膀胱平滑肌的抑制失控和异常兴奋、心理因素或精神因素所致行为障碍、受体的缺失或异常或其他尚未发现的理论和机制[5]。众所周知,排尿活动是一种受意识控制的神经性反射活动,由脑排尿反射高级中枢、脊髓反射弧和膀胱逼尿肌共同作用下方得以完成。近年来有研究[6]提出了“脑-膀胱控制网络”理论,认为脑功能异常在OAB 发病机制中具有重要地位。本研究尝试利用1H-MRS技术检测OAB患者脑区的代谢变化,以探讨膀胱过度活动症患者的发病机制。
近年来,随着PET、SPECT、fMRI等技术的兴起,这些新技术逐渐被应用到“脑-膀胱控制网络”的研究中来。Blok等[7]发现,在排尿过程中或有排尿意愿时,PET显示额叶的脑血流量增多,前扣带回的血流量减少,其中,右侧增多占主导地位。后来的研究[8]显示,在膀胱存储阶段,额叶外侧及前部被激活,但中线附近的额叶皮质很少被激活;在憋尿时,前额内侧皮质和前扣带回被激活。额叶前部皮质(位于运动区及补充运动区前方的额叶皮质)与计划复杂的认知行为和适当的社会行为有关,但是,目前额叶前部皮质对排尿行为是刺激作用还是抑制作用尚不明确[9]。虽然额叶前部皮质与排尿回路的联系仍不明确,但是,研究[6]呈现,额叶前部皮质与前扣带回之间存在多项联系,并且,额叶前部皮质、前扣带回与和排尿自主控制相关的下丘脑、导水管周围灰质及其他区域存在直接或间接联系。额叶前部皮质对导水管周围灰质及桥脑排尿中枢均起抑制作用,从而抑制膀胱排尿直到合适的排尿时机出现[6]。动物研究[10]也表明,额叶前部皮质同时分布着抑制排尿和刺激排尿的神经元。因此,额叶前部皮质并不是一个孤立的中心,而是“脑-膀胱控制网络”的一部分,它处理来自外周的感觉信息,根据环境做出是否排尿决定,并将决定付诸行动[9,11]。前扣带回与膀胱充盈的感觉及排尿控制有关,还与盆底肌肉的收缩有关[7,12]。此外,前扣带回不仅参与排尿的感觉运动控制,还与排尿动机及情感方面有关[13]。
本研究结果显示,OAB组双侧额叶前部、右侧额叶中部及双侧扣带回前部、左侧扣带回后部的NAA/Cr值较对照组的NAA/Cr值减低,提示神经元数目减少或神经元损伤、活性减低,从代谢水平说明OAB患者在这些脑区存在异常,进而导致额叶前部皮质及前扣带回的神经功能异常,造成膀胱充盈感觉障碍,接收信息不能被正确处理,致使患者的“脑-膀胱控制网络”功能紊乱,从而导致患者出现尿频、尿急乃至尿失禁的症状,这与先前的研究[9-12]结果一致。理论上,由于额叶前部是指位于运动区及补充运动区之前的区域,那么,本研究中的双侧额叶后部的NAA/Cr值也应降低,但考虑到扫描时VOI区域有限,所以未能包全双侧额叶后部皮质,仅覆盖白质区域,因此与理论不符。
另外,有研究[14]显示,大多数抑郁症患者的后扣带回的功能连接异常,抑郁症患者后扣带回与额颞叶脑区、岛叶的功能连接减弱,也有研究[15]显示抑郁症患者的后扣带回与扣带回膝部的连接增多;截至目前,后扣带回的功能连接异常机制尚无定论。研究[16]显示,27.5%的OAB患者患有抑郁症。本研究中,采用在临床中广泛应用的SDS对OAB患者进行评价,结果显示,OAB患者的SDS评分高于对照组,提示存在抑郁倾向,因此,笔者推测左侧后扣带回NAA/Cr值降低可能与抑郁症的发病机制有关。基于低频振幅的fMRI研究[17]显示,抑郁症患者默认网络的双侧额叶、双侧扣带回的BOLD信号减低,抑郁症患者的快感缺失与各奖赏加工环节障碍有关,且内在的奖赏环路结构异常及功能调控异常可能是抑郁症快感缺失的生物学内表型[18-19],因此,笔者推测抑郁症导致双侧额叶、双侧扣带回的功能异常,而这些脑区与排尿环路障碍密切相关。本研究中,OAB组右侧额叶中部NAA/Cr比值与SDS评分呈负相关,也证实了这种假设的可能性。当然,这种假设还需进一步的证实。此外,由于入组标准严格,本研究仅纳入23例OAB患者,尚需大样本数据对本研究结果进行验证。
目前,利用PET、SPECT、fMRI等技术研究“脑-膀胱控制网络”的试验较多,利用1H-MRS技术探讨膀胱过度活动症患者发病机制的报道却极少,本研究利用1H-MRS技术发现OAB患者双侧额叶前部及前扣带回等区域的NAA降低,证实了这些区域与膀胱过度活动症的发生有关,不仅功能连接异常,代谢活动也发生改变,为进一步的研究提供理论依据。
[1] Wang Y,Xu K,Hu H,et al.Prevalence,risk factors,and impact on health related quality of life of overactive bladder in China[J].Neurourol Urodyn,2011,30(8):1448-1455.
[2] 王驭良,许克新,胡浩,等.北京地区成年女性膀胱过度活动症流行病学调查及对患者生活质量的影响[J].中华泌尿外科杂志,2010,31(8):550-554.
[3] Abrams P,Cardozo L,Fall M,et al.The standardisation of terminology of lower urinary tract function: report from the standardisation sub-committee of the international continence society[J].Am J Obstet Gynecol,2002,187(1):116-126.
[4] Abrams P,Artibani W,Cardozo L,et al.Reviewing the ICS 2002 terminology report: the ongoing debate[J].Neurourol Urodyn,2006,25(3):293.
[5] Osman N I,Chapple C R.Overactive bladder syndrome: current pathophysiological concepts and therapeutic approaches[J].Arab J Urol,2013,11(4):313-318.
[6] Fowler C J,Griffiths D J.A decade of functional brain imaging applied to bladder control [J].Neurourol Urodyn,2010,29(1):49-55.
[7] Blok B F,Willemsen A T,Holstege G.A PET study on brain control of micturition in humans[J].Brain,1997,120(Pt 1):111-121.
[8] Griffiths D,Tadic S D.Bladder control,urgency,and urge incontinence: evidence from functional brain imaging[J].Neurourol Urodyn,2008,27(6):466-474.
[9] Kitta T,Mitsui T,Kanno Y,et al.Brain-bladder control network: the unsolved 21st century urological mystery[J].Int J Urol,2015,22(4):342-348.
[10] Nishijima S,Sugaya K,Kadekawa K,et al.Effect of chemical stimulation of the medial frontal lobe on the micturition reflex in rats[J].J Urol,2012,187(3):1116-1120.
[11] Kable J W,Glimcher P W.The neurobiology of decision: consensus and controversy[J].Neuron,2009,63(6):733-745.
[12] Griffiths D,Clarkson B,Tadic S D,et al.Brain mechanisms underlying urge incontinence and its response to pelvic floor muscle training[J].J Urol,2015,194(3):708-715.
[13] Torta D M,Cauda F.Different functions in the cingulate cortex,a meta-analytic connectivity modeling study[J].Neuroimage,2011,56(4):2157-2172.
[14] Yang R,Gao C,Wu X,et al.Decreased functional connectivity to posterior cingulate cortex in major depressive disorder[J].Psychiatry Res,2016,255:15-23.
[15] Berman M G,Peltier S,Nee D E,et al.Depression,rumination and the default network[J].Soc Cogn Affect Neurosc,2011,6(5):548-555.
[16] Lai H H,Shen B,Rawal A,et al.The relationship between depression and overactive bladder/urinary incontinence symptoms in the clinical OAB population[J].BMC Urol,2016,16(1):60.
[17] Dutta A,McKie S,Deakin J F.Resting state networks in major depressive disorder[J].Psychiatry Res,2014,224(3):139-151.
[18] 何灿灿,龚亮,谢春明,等.抑郁症快感缺失的神经环路基础研究[J].中华精神科杂志,2016,49(3):189-192.
[19] 段乙南,夏志军,许海楠.环磷酰胺腹腔注射法及膀胱灌注法制备膀胱过度活动大鼠模型的研究[J].中国医科大学学报,2016,45(7):587-590.
Brain1H-MRSimagingcharacteristicsinpatientswithoveractivebladderanditscorrelationwithclinicalsymptoms
Zhou Yang1,Wang Shuangkun1*,Zuo Long1,Wang Biao2,Gu Hua1
(1.DepartmentofRadiology,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100020,China;2.DepartmentofUrology,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100020,China)
ObjectiveTo measure the metabolic changes of the brain using the proton magnetic resonance spectroscopy (1H-MRS) in the patients with overactive bladder (OAB).MethodsWe recruited 23 patients with OAB and 23 healthy controls respectively.All participants were evaluated with Self-Rating Depression Scale (SDS) and 23 patients were evaluated with Overactive Bladder Symptom Score (OABSS).Multi-voxel1H-MRS was performed with a volume of interest located in the centrum semiovale which contains both frontal lobe and cingulate gyrus.Two main ratios of N-acetyl aspartate (NAA)/creatine (Cr) and choline (Cho)/Cr were obtained.The ratios in both frontal lobe and cingulategyrus between the two groups were compared.And the correlation between NAA/Cr,Cho/Cr and SDS,OABSS scores were analyzed.ResultsWe found significantly lower levels of NAA/Cr ratios in both anterior frontal cortex,right medial frontal cortex,both anterior cingulate cortex and left posterior cingulate cortex in patients with OAB than in healthy controls (P<0.05).NAA/Cr in right medial frontal cortex was negatively correlated with SDS scores (r=-0.361,P<0.05).ConclusionThe primary finding of the study is significant reduction in the ratios of NAA/Cr in both anterior frontal cortex,right medial frontal cortex,both anterior cingulate cortex and left posterior cingulate cortex in OAB patients,which indicates a marker of neuronal loss or dysfunction in patients with OAB.
overactive bladder;magnetic resonance spectroscopy;brain
国家自然科学基金(81541129)。The study was supported by National Natural Science Foundation of China (81541129).
*Corresponding author,E-mail:shuangkunwang@126.com
时间:2017-12-13 21∶25
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2125.044.html
10.3969/j.issn.1006-7795.2017.06.014]
R445.2
2017-10-01)
编辑 慕 萌

