母细胞性浆细胞样树突细胞肿瘤2例的临床病理特点(附文献复习)
张兵林,林 洁,张红雷,笪冀平
(中日友好医院 病理科,北京 100029)
母细胞性浆细胞样树突细胞肿瘤2例的临床病理特点(附文献复习)
张兵林,林 洁,张红雷,笪冀平⋆
(中日友好医院 病理科,北京 100029)
目的:探讨母细胞性浆细胞样树突细胞肿瘤(BPDCN)的临床病理特征和鉴别诊断。方法结合文献复习,分析2例BPDCN的临床表现、组织形态和免疫表型。结果2例病例形态符合BPDCN的特点,免疫组化可排除髓系、自然杀伤(NK)系、B 系及 T 系细胞来源。分别为 LCA(+)、CD56(+)、CD123(+)、CD4(+)、MPO(-)、TdT(-)和 LCA(+)、CD56(+)、CD123(+)、CD4(+)、MPO(-)、TdT(-)、CD34(-)。结论BPDCN 是一组罕见肿瘤,较难确诊及治疗,具有独特的免疫表型、临床特点和病理形态。CD4、CD56和CD123的联合表达在BPDCN的诊断中具有重要价值。
母细胞性浆细胞样树突细胞肿瘤;临床病理特点
母细胞性浆细胞样树突状细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,BPDCN)是一种罕见的侵袭性造血组织肿瘤,最早报道于1994年[1],之后在世界各地陆续有少量病例报道。我们收集2例BPDCN,结合相关文献探讨其肿瘤起源、临床表现、组织学形态、免疫表型、预后与鉴别诊断。
1 对象与方法
1.1 资料来源
收集2012年~2015年我院BPDCN病例,共2例,男、女各1例,患者年龄分别是67岁和78岁。 临床特征:病例1,门诊患者,女性,78岁。因左背部一红色肿物4个月就诊。就诊时一般情况可,自述背部肿物生长迅速,临床检查肿物位于背部皮肤及皮下,皮肤表面略粗糙,未见破溃,肿物质地中等,无压痛,周界不清,活动度差,就诊时没有血液系统受累。临床取左背部肿物及表面皮肤送检。病例2,男性,67岁,因乏力、头晕、心悸伴纳差、消瘦2个月余,偶有高热、寒战,双侧颌下、颈部、腋窝、腹股沟可触及多枚肿大淋巴结,质地中等硬,无明显压痛,活动度可,最大者约3cm×4cm,肝脾肿大,诊断时未见皮肤受损表现。在外院曾行骨穿提示骨髓增生明显活跃,原始淋巴细胞比例67%,考虑淋巴瘤细胞白血病,为进一步诊治收入院。入院后行右髂前上棘骨穿取骨髓活检送病理。
1.2 活检染色方法
(1)所有标本均经4%中性甲醛固定,常规组织处理,石蜡包埋,3μm厚连续切片,常规HE染色。观察2例HE染色切片,总结其形态学特征。
(2)采用EnVision法进行免疫组化染色,DAB显色,苏木精对比染色。用已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。检测指 标有 :LCA、CD2、CD3、CD4、CD5、CD7、CD8、CD10、CD15、CD20、CD21、CD30、CD38、CD56、
CD123、CD138、CD1a、bcl-2、bcl-6、CK20、髓过氧化物酶 (MPO)、末端脱氧核苷酸转移酶(TdT)、NSE、CgA、S-100、 粒酶 B、T 细胞胞质内抗原(TIA-1)、Ki-67,试剂大部分购自北京中山金桥生物技术有限公司。
(3)原位杂交:进行EB病毒原位杂交,试剂购自北京中山金桥生物技术有限公司,胞核着色为阳性。病理诊断以2008年WHO分类为依据。
2 结果
2.1 送检标本大体病理
病例1,送检皮肤及皮下组织,皮表面积1.5cm×0.5cm,皮面略粗糙,皮肤及皮下组织厚1cm,切面见皮肤结节 1.5cm×1cm×0.5cm,灰白、实性,质地中等,周界不清。病例2,送检骨穿组织一条,长1.2cm,直径0.1cm,灰褐色,质硬。
2.2 组织学形态
病例1,皮肤结节活检镜下病理检查示:皮肤组织表皮萎缩变薄,真皮、皮下脂肪小叶间及小叶内可见大量淋巴样肿瘤细胞密集成片浸润,其间可见粗大胶原纤维穿插其中,肿瘤细胞形态单一,瘤细胞体积偏大,细胞核大,圆形或不规则形,染色质细腻,核仁不明显,细胞质稀少,可见核分裂象,类似淋巴母细胞或髓造血母细胞。表皮未受侵犯,皮肤附属器破坏消失(图1,见封底)。
病例2,本院骨穿结果:骨髓增生极度活跃,正常造血成分显著减少,髓腔内由均匀一致的淋巴母样肿瘤细胞呈塞实状增生填满,肿瘤细胞形态单一,瘤细胞体积偏大,细胞核大,圆形或不规则形,染色质细腻,核仁不明显,细胞质稀少,可见核分裂象,未见坏死(图2,见封底)。
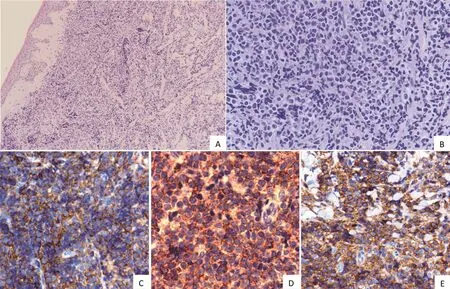
图1 病例1的组织学表现及免疫组化表型。图A:皮肤组织表皮萎缩变薄,真皮、皮下脂肪小叶间及小叶内可见大量淋巴样肿瘤细胞密集成片浸润,未向上侵入表皮(HE×100);图B:肿瘤细胞形态单一,瘤细胞体积偏大,细胞核大,圆形或不规则形,染色质细腻,核仁不明显,细胞质稀少,可见核分裂象,类似淋巴母细胞或髓造血母细胞(HE×400);图C:肿瘤细胞CD4+(免疫组化×400);图D:肿瘤细胞CD56+(免疫组化×400);图E:肿瘤细胞CD123+(免疫组化×400)。
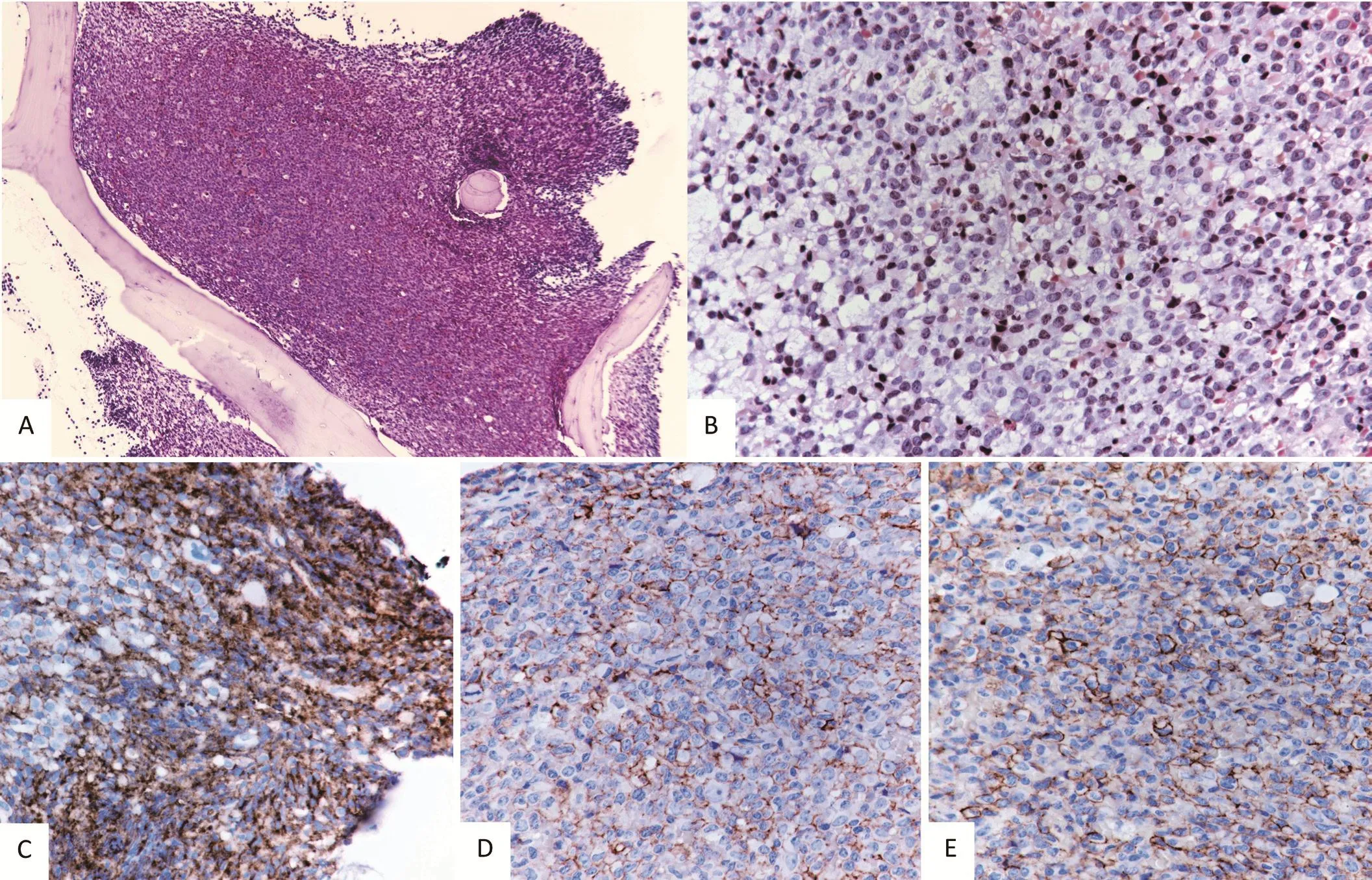
图2 病例2的组织学表现及免疫组化表型。图A:骨髓腔内大量肿瘤细胞呈填塞状聚集(HE×100);图B:髓腔内肿瘤细胞为均匀一致的类似淋巴母样肿瘤细胞(HE×400);图C:肿瘤细胞CD4+(免疫组化×400);图D:肿瘤细胞CD56+(免疫组化×400);图E:肿瘤细胞CD123+(免疫组化×400)。
2.3 免疫表型
病例1,免疫组化显示肿瘤细胞表达LCA(+)、CD56(+)、CD123(+)、CD4(+)、BCL2(+)、TIA(散在+), 不表达 CD2、CD3、CD5、CDl0、CD20、CD30、CD21、CD38、CD15、CD138、CDla、BCL6、CK20、MPO、TdT、NSE、CgA、S-100,Ki-67 约 30%~50%,原位杂交检测EBER阴性(图1,见封底)。
病例2,免疫组化显示肿瘤细胞表达CD4(+)、CD56 (+)、CD123 (+), 不表达 CD1a、CD2、CD3、CD5、CD7、CD8、CD10、CD20、CD34、CD43、CD61、CD79a、CD138、MPO、TdT、TIA、 颗粒酶 B、S100,Ki-67约 30%(图2,见封底)。 以上 2例免疫表型均符合2008年WHO分类中BPDCN肿瘤诊断依据。
2.4 随访结果
病例1,患者发病4个月确诊后失访。病例2,确诊后按急性淋巴细胞白血病(ALL)化疗无效,发病后5个月死亡。
3 讨论及文献复习
3.1 肿瘤起源
BPDCN属罕见肿瘤,其细胞起源一直备受争议,以前曾被认为是来源于CD56+的母细胞性NK(自然杀伤细胞)的淋巴瘤,1999年被发现可以表达树突状细胞标记CD123+[2],2005年被确认实际起源于CD4+/CD56+的浆细胞样树突状细胞前体(pDC),组织起源与髓系、NK系、B系及T系淋巴细胞无关,被称为无颗粒性CD4+/CD56+血液皮肤肿瘤 (agranular CD4+/CD56+hematodermic neoplasm),以体现其特殊免疫表型及皮肤受累的突出特点[3]。在2008年版WHO血液与淋巴组织肿瘤分类中最终命名为BPDCN[4]。从这一肿瘤命名就可以看出,随着其免疫表型的不断发现,从一开始的CD56+母细胞性自然杀伤细胞的淋巴瘤到无颗粒性CD4+/CD56+血液皮肤肿瘤,再到母细胞性浆细胞样树突状细胞肿瘤。CD123是IL-3受体的α链,在浆细胞样树突状细胞(PDC)及BPDCN中均有强表达,提示PDC及BPDCN具有同源性,目前大多数文献认为BPDCN肿瘤起源于pDC。实际上有关其组织起源的争议并没有停止,最近有研究显示通过基因谱对照和细胞功能分析更倾向BPDCN肿瘤起源于髓样树突状细胞(mDC)而非pDC[6],只是该肿瘤性mDC具备pDC的一些特征,如CD123阳性。到目前为止有关BPDCN的常用的诊断性标记,无论是CD4/CD56还是CD123,都不是完全特异的,其病理诊断最终要通过免疫组化和/或流式细胞检查排除髓系、NK系、B系及T系淋巴细胞等来源后才能确定。另外BPDCN肿瘤的EBV检测为阴性,提示与EB病毒感染无关[7]。
3.2 临床特征
BPDCN通常以皮肤病变为首发症状,之后多累及淋巴结和骨髓,病情进展迅速,治疗缓解后易复发,且病死率高,在临床上极易误诊。由于该淋巴瘤少见,仅占皮肤原发淋巴瘤的0.7%,以及该淋巴瘤与T细胞淋巴瘤、髓系肿瘤在免疫表型上有重叠,使得对该肿瘤的诊断比较困难[5]。BPDCN肿瘤最常出现在中老年人。中位年龄65岁,但可发病于任何年龄,文献报道最小的发病年龄仅2个月,男女比例至少2:1[8]。文献中报道75%的BPDCN肿瘤在最初诊断时仅有皮肤病变,皮肤病变可以表现为斑块、结节或溃疡,最常累及头面部,其次是躯干、四肢,常常是无症状或伴有疼痛的皮肤病变,病变进展迅速,逐渐累及其他器官,累及骨髓常见,表现为白血病和骨髓异常全血细胞减少,以血小板减少最为显著,很少累及中枢神经系统。累及骨髓者多表现为同时有皮肤病变,也有一些患者仅有白血病症状,无并发的皮肤病变。本文病例1发病时仅有皮肤病变,确诊时尚未发展到累及骨髓;而病例2确诊时仅表现为白血病症状,无并发的皮肤病变。表现为白血病的BPDCN肿瘤患者与表现为皮肤疾患BPDCN肿瘤患者在年龄、性别及预后上并无差别,大约40%~50%的BPDCN患者有淋巴结肿大[9]。最新的研究表明BPDCN的临床表现与其细胞的成熟程度相关[10]。
3.3 组织学形态和免疫表型
典型的BPDCN皮肤病变形态表现为真皮见肿瘤细胞呈弥漫性分布,肿瘤细胞一般不侵及病变区的表皮。瘤细胞较单一,中等大小,核圆形或不规则,染色质细,不见核仁或核仁不明显,胞质少,嗜碱性,常见核分裂象。皮肤附属器可被破坏,一般无血管侵犯及坏死[11]。骨髓或外周血中的瘤细胞类似淋巴母或髓母细胞,或伴有不规则核、突出核仁和较丰富胞浆的幼稚细胞。这些肿瘤细胞多呈弥漫或部分占据骨髓腔。累及淋巴结的BPDCN肿瘤细胞中等大小,弥漫排列,可见星空现象,易见核分裂及细胞凋亡[12]。
BPDCN肿瘤免疫表型非常复杂,其免疫表型与很多淋巴造血系统肿瘤有相当的重叠,特别是与伴有单核细胞分化的急性髓细胞性白血病(acute myeloid leukemia,AML), 及 T-ALL/lymphoblastic淋巴瘤,这也预示着BPDCN肿瘤与其它肿瘤有着相似的起源细胞,或者存在彼此间紧密的抗原递呈联系。2008年WHO分类提示BPDCN 一 般 表 达 CD4、CD56、CD123、CD43、CIM5RA、BDCA-2/CD303、TCLl、CLA,50% 的 病例表达CD68,30%的病例表达 TdT;部分表达CD2、CD36和CD38;B系、T系、 髓系和 NK 细胞标志物通常为阴性。以上标记中,CD4、CD56和CD123的联合表达在BPDCN的诊断中具有重要价值[13],深入的流式细胞技术研究显示几乎所有的 BPDCN 病 例 表 达 CD4、CD56、CD123、CD43、CD45RA和HLA-DR[14]。
3.4 鉴别诊断和预后
BPDCN形态学和免疫表型多样,易与以下肿瘤混淆:(1)髓系白血病累及皮肤:BPDCN最易与髓系肿瘤混淆,从细胞形态学角度认为成熟的PDC与慢性髓单核细胞白血病和髓性肿瘤伴单核细胞分化有关,髓系白血病可以表达PDC标志物CD123等,而BPDCN也常伴有MDS[15],这时需要借助BPDCN其他特异标志如CD4、CD56;而且BPDCN不表达 MPO、CD117和 CD34这些标志物。 (2)结外 NK/T 细胞淋巴瘤(鼻型)(nasal type NK/TCL):二者均表达 CD56。 但 NK/TCL 细胞形态多样,伴有大量炎性细胞浸润,常有血管侵犯及片状凝固性坏死,原位杂交EB病毒阳性,CD4、CD123和TdT等阴性均有助鉴别。(3)淋巴母细胞淋巴瘤 (LBL):BPDCN的细胞形态呈母细胞样,且部分病例TdT阳性,两者难以鉴别。但形态学上,LBL一般细胞核呈“粉尘样”,核仁不明显,有时可见“星空”现象及坏死,LBL免疫组织化学CD56和CD123阴性,可供鉴别。(4)皮肤原发性外周T细胞淋巴瘤,肿瘤细胞常有明显多形性的核,常存在反应性小淋巴细胞、嗜酸性粒细胞和浆细胞的炎性改变背景,可以表达CD4,不表达CD56和 CD123。
目前没有一个单个标记物对BPDCN是绝对特异性的,该淋巴瘤与T细胞淋巴瘤、髓系肿瘤在免疫表型上有重叠。例如CD123在急性白血病中也表达,最大的免疫标记重合是 BPDCN与MS/AML,特别是伴有单核细胞分化的,BPDCN不 表 达 lysozyme,CD14,CD36/CD64,MPO 或CD34,这些标记更支持MS/AML诊断。因此BPDCN的确诊需要多种免疫组化标记共同应用后才能做出,其中CD4、CD56和CD123的联合表达在BPDCN的诊断中具有重要价值。对于BPDCN还没有标准化治疗方案,通常按照AML或ALL化疗可获得短暂的缓解,但非常易复发。BPDCN患者总体生存期非常短,常常少于1年。然而,在一小部分接受高剂量化疗后并接受骨髓移植的患者(包括老年患者),获得了较长的疾病缓解期[16,17]。
[1]Adachi M,Maeda K,Takekawa M,et al.High expression of CD56 (N-CAM) in a patient with cutaneous CD4-positive lymphoma[J].Am J Hematol,1994,47:278-282.
[2]Lucio P,Parreira A,Orfao A.CD123hi dendritic cell lymphoma:anunusual case of non-Hodgkin lymphoma[J].Ann Intern Med,1999,131:549-550.
[3]Willemze R,Jaffe ES,Burg G,et al.WHO-EORTC classification forcutaneouslymphomas[J].Blood,2005,105:3768-3785.
[4]Facchetti F,Jones M,Petrella T.Blastic plasmacytoid dendritic cell neoplasm.In:WHO classification of tumors of hematopoietic and lymphoid tissues[J].4th ed.International A-gency for Research on Cancer (IARC)Lyon,France,2008,145-147.
[5]Yang Shi,EndiWang.Blastic plasmacytoid dendritic cell neoplasm,a clinicopathologic review [J].Arch PatholLab Med,2014,138(4):564-569.
[6]Haisheng Yu,Peng Zhang,Xiangyun Yin,et al.Human BDCA2+CD123+CD56+dendritic cells (DCs) related to blastic plasmacytoid dendritic cellneoplasm representa unique myeloid DC subset[J].Protein Cell,2015,6(4):297-306.
[7]桑伟,王朝夫,成宇帆.母细胞性浆细胞样树突细胞肿瘤临床病理学观察[J].中华病理学杂志,2012,41(5):326-330.
[8]孙晶晶,王光明,潘云.婴儿母细胞性浆细胞样树突细胞肿瘤一例报告并文献复习[J].中国血液学杂志,2014,35(7):656-657.
[9]John K.Lee,Gary Schiller.Blastic plasmacytoid dendritic cell neoplasm[J].Clinical Advances in Hematology&Oncology,2012,10(1):60-62.
[10]Lourdes Martin-Martin,Antonio Lopez,Belen Vidriales,et al.Classification and clinical behavior of blastic plasmacytoid dendritic cell neoplasms according to their maturation associated immunophenotypic profile[J].Oncotarget,2015,5:1-13.
[11]Cota C,Vale E,Viana I,et al.Cutaneous manifestations of blastic plasmacytoid dendritic cell neoplasm-morphologic and phenotypic variability in a series of 33 patients[J].Am J Surg Pathol,2010,34(1):75-87.
[12]Chaperot L,Bendriss N,Manches O,et al.Identification of a leukemic counterpart of the plasmacytoid dendritic cells[J].Blood,2001,97:3210-3217.
[13]Herling M,Jones D.CD4+/CD56+hematodermic tumor:the features of anevolving entity and its relationship to dendritic cells[J].Am J Clin Pathol,2007,127(5):687-700.
[14]Dijkman R,van Doorn R,Szuhai K,et al.Geneexpression profilingand array-based CGH classifyCD4+CD56+hematodermic neoplasm and cutaneous myelomonocytic leukemia asdistinctdisease entities[J].Blood,2007,109(4):1720-1727.
[15]QT Kong M,Zhang H,Sang J Chen.Blastic plasmacytoid dendritic cell neoplasm of the skin associated with myelodysplastic syndrome[J].Dermatology Journal,2015,21(3):18.
[16]Marie P,Shieh Niloufar Reisian V,Walavalkar,et al.Excessive therapeutic response in a case of blastic plasmacytoid dendritic cell neoplasm[J].Clinical Advances in Hematology&Oncology,2012,10(1):56-59.
[17]Tomohiro Aoki,Ritsuro Suzuki,Yachiyo Kuwatsuka,et al.Long-term survivalfollowing autologousand allogeneic stem cell transplantation for blastic plasmacytoid dendritic cell neoplasm[J].Blood,2015,125(23):3559-3563.
Blastic plasmacytoid dendritic cell neoplasm:the clinicopathologic features of 2 cases and literature review
ZHANG Bing-lin,LIN Jie,ZHANG Hong-lei,et al
Journal of China-Japan Friendship Hospital,2017 Oct,31(5):291-294
Objective:To study the pathological characteristics and differrential diagnosis of blastic plasmacytoid dendritic cell neoplasm (BPDCN).MethodsThe clinical,morphology and immunophenotype features were analyzed in 2 cases of blastic plasmacytoid dendritic cell neoplasm,with review of literature.ResultsThe clinical,morphological changes of these tumors accorded with those of blastic plasmacytoid dendritic cell neoplasma.The immunophenotypes of these two cases were LCA(+),CD56(+),CD123(+),CD4(+),MPO(-),TdT(-)and LCA(+),CD56(+),CDl23(+),CD4(+),MPO(-),TdT(-),CD34(-),respectively.Immunophenotype features of them could exclude T,B,myeloid and NK lineage cell origined tumors.ConclusionBlastic plasmacytoid dendritic cell neoplasm (BPDCN)is a rare disease that is difficult for pathologists to diagnose and for clinicians to manage.It has its unique clinical,morphological and immunophenotype features.The combined expression of CD4,CD56 and CD123 has important value in the definite diagnosis of BPDCN.
blastic plasmacytoid dendritic cell neoplasm;clinicopathologic feature
Author’s addressDepartment of Pathology,China-Japan Friendship Hospital,Beijing 100029,China
R733.7
A
1001-0025(2017)05-0291-04
10.3969/j.issn.1001-0025.2017.05.007
* 本文通讯作者。
张兵林(1966-),男,主治医师,医学博士。
2017-03-03
2017-06-08

