铅锌尾矿区土壤有机菌肥改良后植物根际菌群的特性及多样性研究
刘相君,冯冲凌,吴晓芙,冀泽华,张 爽,李刘刚
(中南林业科技大学 环境科学与工程学院,湖南 长沙 410004)
铅锌尾矿区土壤有机菌肥改良后植物根际菌群的特性及多样性研究
刘相君,冯冲凌,吴晓芙,冀泽华,张 爽,李刘刚
(中南林业科技大学 环境科学与工程学院,湖南 长沙 410004)
以辣椒的根际菌群为研究对象,通过纯培养的正交试验对比分析有机菌肥改良前后根际菌群去除铅锌能力及特性的差异,同时利用Illumina Miseq平台对根际菌群的16S rRNA基因V4区域进行测序,分析细菌群落结构及多样性的变化。结果表明:施用有机菌肥提高了可培养根际菌群去除铅、锌的能力,去除率增量最大分别可达40.2%、12.7%。同时,菌群去除铅的最佳培养条件发生了改变,铅锌浓度和培养基类型对铅去除率影响的显著性有所提高。有机菌肥对锌去除率的影响在试验分析中体现不明显。培养基种类是影响菌群去除铅锌的最主要因素,菌群中的原核生物较真核生物更具去除铅锌的优势。有机菌肥的应用对细菌群落结构产生了一定影响,微生物的相对丰度发生了改变,菌群多样性得到了丰富,但硫杆菌属Thiobacillus仍是绝对的优势菌。
根际菌群;有机菌肥;正交实验;16S rRNA;铅;锌
课题组前期以湖南资兴铅锌尾矿区土壤作为基质,开展了植物-有机菌肥联合修复盆栽试验,结果显示有机菌肥的施用可显著增强试验植物根部重金属的耐受性,促进植物的生长[15]。本文以试验植物辣椒的根际菌群作为研究对象,从纯培养和分子生物学两个层面进行分析,通过正交试验对比有机菌肥改良前后根际菌群去除铅锌的能力及特性的差异,同时结合高通量测序技术分析细菌群落的结构与多样性,为进一步探究有机菌肥的改良机制和微生物群落整体功能的机理提供依据和参考数据。
1 材料与方法
1.1 菌群来源及接菌液制备
菌群LJ、LJ0分别来源于盆栽试验中实验组、对照组的辣椒根际土壤。取20 g新鲜土壤稀释于180 mL无菌水,恒温摇床上振荡30 min,制成10-1土壤悬液作为接菌液。
对照组:100%铅锌尾矿区土壤+植物。
实验组:80%铅锌尾矿区土壤+20%有机菌肥+植物。
1.2 培养基及培养条件
牛肉膏蛋白胨培养基[16]:牛肉浸粉3 g/L、蛋白胨10 g/L、氯化钠3 g/L;沙氏培养基[16]:蛋白胨10 g/L、葡萄糖40 g/L;ISP2培养基[17]:酵母浸粉4 g/L、麦芽浸粉10 g/L、葡萄糖4 g/L;马丁氏培养基[16]:葡萄糖10 g/L、蛋白胨5 g/L、磷酸二氢钾1 g/L、七水硫酸镁0.5 g/L、1%孟加拉红水溶液3 mL。将培养基与铅锌母液分别于1×105Pa灭菌20 min,冷却后定量混合,pH保持自然。所有实验均在28℃、120 r/min摇瓶培养下进行。
1.3 正交试验设计
本试验选用L16(44)正交表在4个水平上对铅(锌)浓度、接菌量、培养时间、培养基种类这4个因素进行极差、方差分析,以铅、锌去除率作为测定指标。其因素与水平设计如表1所示。
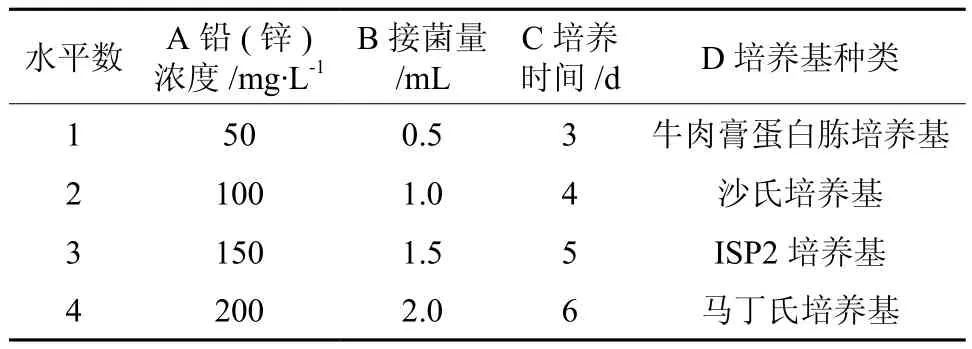
表1 L16(44)正交试验设计Table 1 L16(44) orthogonal design for the factors and levels
1.4 去除率的测定
按设计的实验条件培养后,将培养基通过0.45 μm的微孔滤膜,分离菌体与培养基,用火焰原子吸收仪测定滤液中铅、锌的含量。去除率的计算公式如下:
Pb2+(Zn2+)去除率(%)=[空白样中Pb2+(Zn2+)-实验样滤液残留的Pb2+(Zn2+)]/[空白样中Pb2+(Zn2+)浓度 ]×100。
习近平总书记强调:工会是党联系职工群众的桥梁和纽带,工会工作是党治国理政的一项经常性、基础性工作。并指出,中国特色社会主义工会发展道路是中国特色社会主义道路的重要组成部分,深刻反映了中国工会的性质和特点,是工会组织和工会工作始终沿着正确方向前进的重要保证,要始终坚持这条道路,不断拓展这条道路,努力使这条道路越走越宽广。
注:以无菌水替代接菌液作为空白,每组实验设置3个平行。
1.5 细菌群落组成及多样性的测定
提取辣椒根际土壤样本的DNA,利用1%的琼脂糖凝胶电泳检测提取的基因组DNA。用引物对338F和806R对16S rRNA基因的V4区进行扩增[18]。将扩增产物在Illumina MiSeq平台上测序。采用Uparse软件对操作分类单元(OTU)进行聚类;采用QIIME软件对OTU代表序列进行分类学分析,对物种注释及评估;以Shannon曲线、Rank-Abundance Curve分析群落多样性[19-20];利用Venn图分析菌群差异;利用FastTree软件+R语言制作热图。该部分主要由北京诺禾致源生物信息科技有限公司完成。
2 结果与分析
2.1 菌群去除铅锌能力的对比分析
根据正交表L16(44)分别对两组菌群进行16组实验,结果如表2所示。总体而言,菌群LJ(加有机菌肥)的铅、锌去除率较菌群LJ0(未加有机菌肥)有不同程度的提高,最大增量可达40.2%、12.7%。实验号6、8、11和15出现了LJ0的铅、锌去除率高于LJ的现象,差距均在1 %左右,可能是实验误差所致。但上述实验号均以培养真菌为主的马丁氏和沙氏作为实验培养基,可能有机菌肥的施用对根际菌群中真菌的影响较小。有研究发现,在矿区土壤复垦过程中,三大微生物类群中真菌的增幅最小[21]。在各培养条件下,菌群的铅、锌去除率差异明显,总体上,两组菌群对铅的去除效果均优于锌。
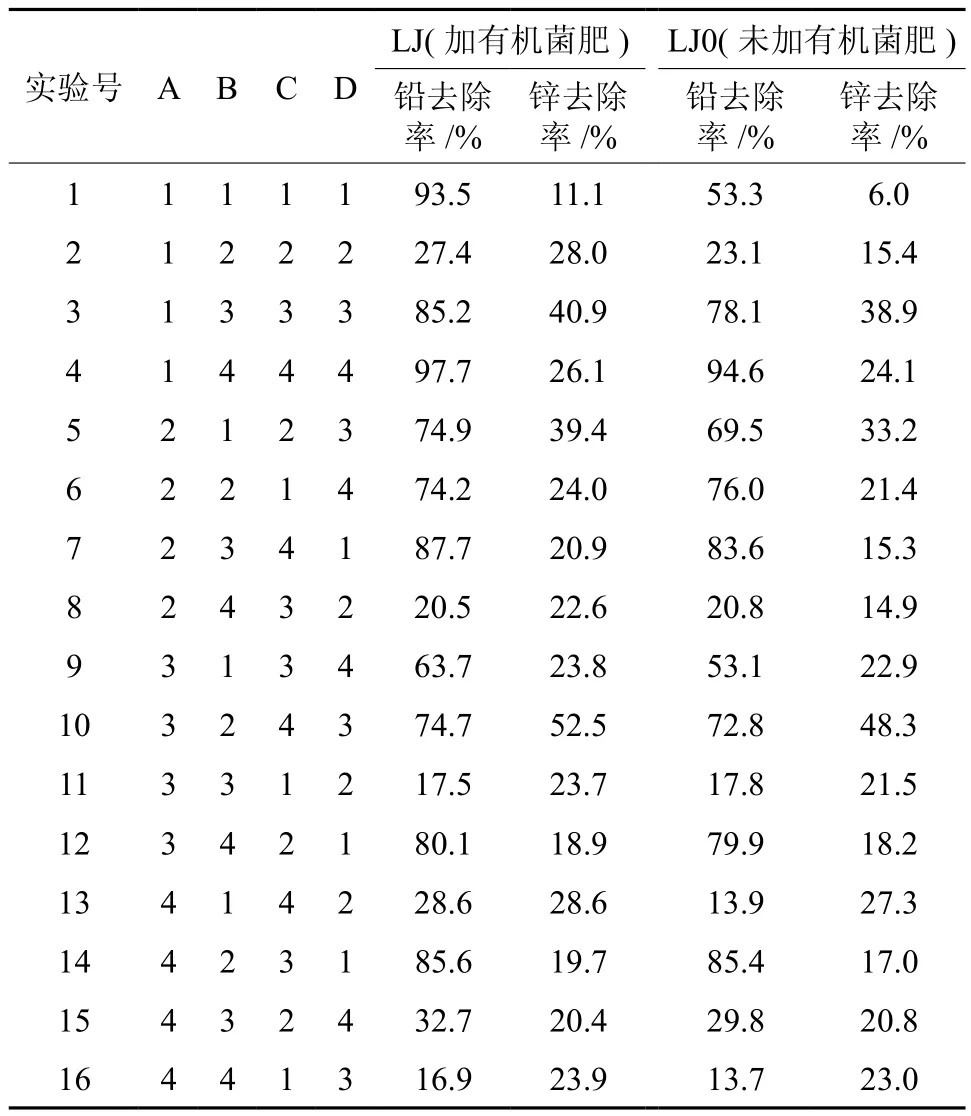
表2 L16(44)正交实验分配及结果†Table 2 Disposition and result of orthogonal experimental design L16(44)
2.2 菌群对铅的去除特性对比分析
由表3、4的极差、方差分析结果可知,菌群LJ(加有机菌肥)去除铅的最佳培养条件组合为铅(锌)浓度A=50 mg/L、接菌量B=1.0 mL、培养时间C=6 d、培养基D为牛肉膏蛋白胨,菌群LJ0(未加有机菌肥)则为A=100 mg/L、B=1.0 mL、C=6 d、D为牛肉膏蛋白胨培养基。显然,施用有机菌肥后,B、C、D三因素的最佳水平未发生改变,A的最佳水平由100 mg/L降低到50 mg/L。各因素对两组菌群铅去除率的影响规律相似,其主次顺序均为,培养基种类>铅(锌)浓度>培养时间>接菌量。对菌群LJ而言,培养基种类对铅去除率的影响在α=0.01水平上显著。其次,铅(锌)浓度对铅去除率的影响在α=0.05水平上显著,接菌量和培养天数的影响均不显著。对菌群LJ0而言,培养基种类对铅去除率的影响在α=0.05水平上有显著性意义,其他3个因素的影响均不显著。对比可知,施用有机菌肥后,培养基种类、铅(锌)浓度对菌群铅去除率的影响显著性有所提高。由方差分析中的校正误差项可知,实验误差较大,这一定程度掩盖了接菌量和培养时间对实验结果的影响。

表3 铅去除效果的极差分析Table 3 Range analysis of removal rate of Pb
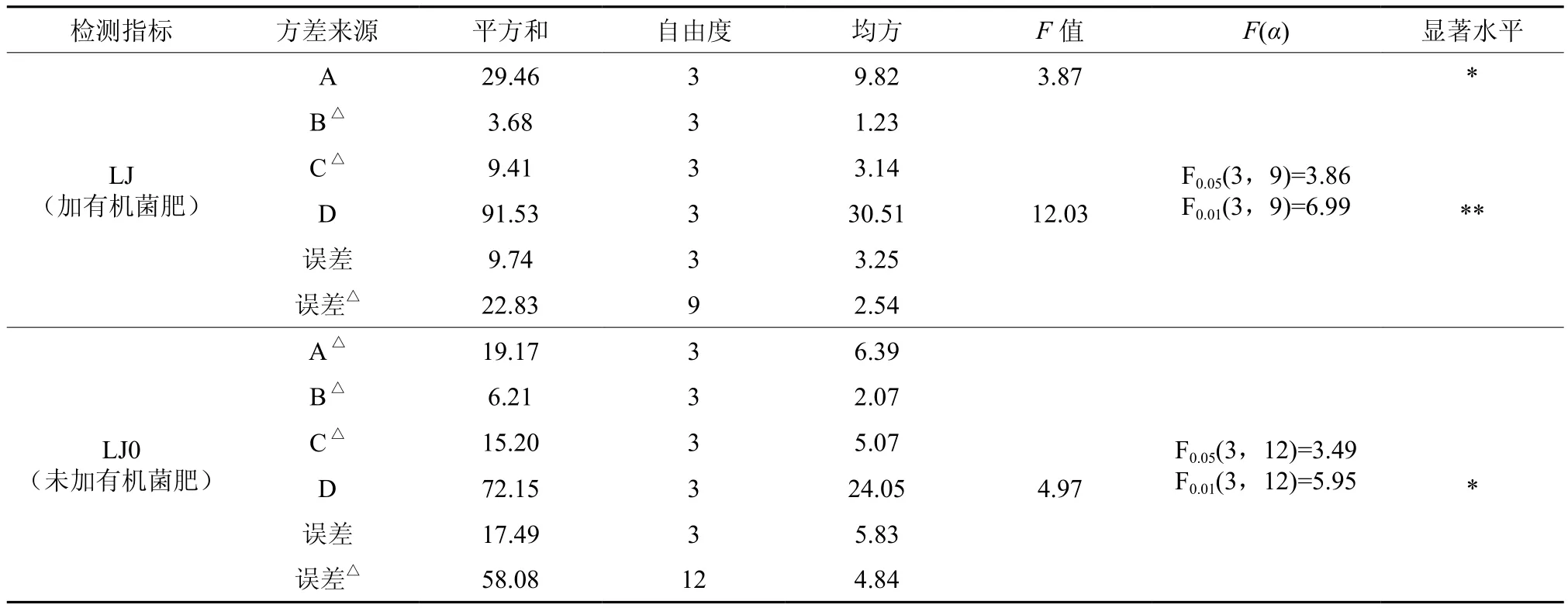
表4 铅去除效果的方差分析†Table 4 Variance analysis of removal rate of Pb
2.3 菌群对锌的去除特性对比分析
表5极差分析结果显示,两组菌群对锌的去除效果最佳的培养条件组合均为铅(锌)浓度A=150 mg/L、接菌量B=1.0 mL、培养时间C= 6 d、培养基类型D为ISP2。各因素对两组菌群锌去除率影响的主次顺序存在差异。对菌群LJ(加有机菌肥)而言,各因素影响的主次顺序为:D>C>B>A,菌群LJ0(未加有机菌肥)则为D>C>A>B。但由表6的方差分析结果可知,除培养基种类以外,其它3因素对锌去除率的影响均无统计学显著性意义。显然,与铅的去除不同,施用有机菌肥对菌群锌去除率的影响在极差、方差分析结果中体现并不明显。在铅锌复合胁迫下,两组菌群均呈现以铅去除为主的特征,这可能对锌的去除产生一定干扰,需通过单一胁迫试验进一步探究。铅去除效果最佳培养基为牛肉膏蛋白胨培养基、锌去除效果最佳的为ISP2培养基。可以发现,在正交试验中,以细菌、放线菌为主的原核微生物较以真菌为主的真核生物更具去除铅锌的优势。有研究发现,细菌、放线菌对铅锌污染较真菌更敏感,但在铅锌矿区土壤中,细菌、放线菌的数量仍占优势[22-23]。
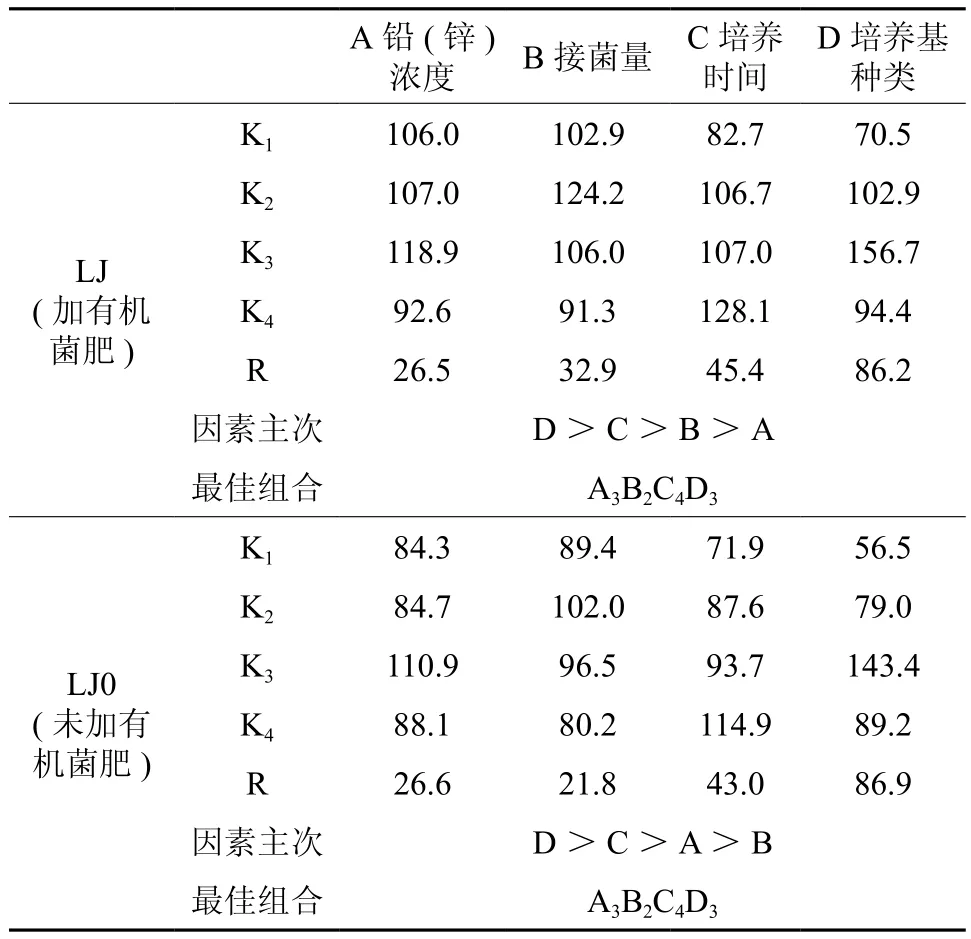
表5 锌去除效果的极差分析Table 5 Range analysis of removal rate of Zn
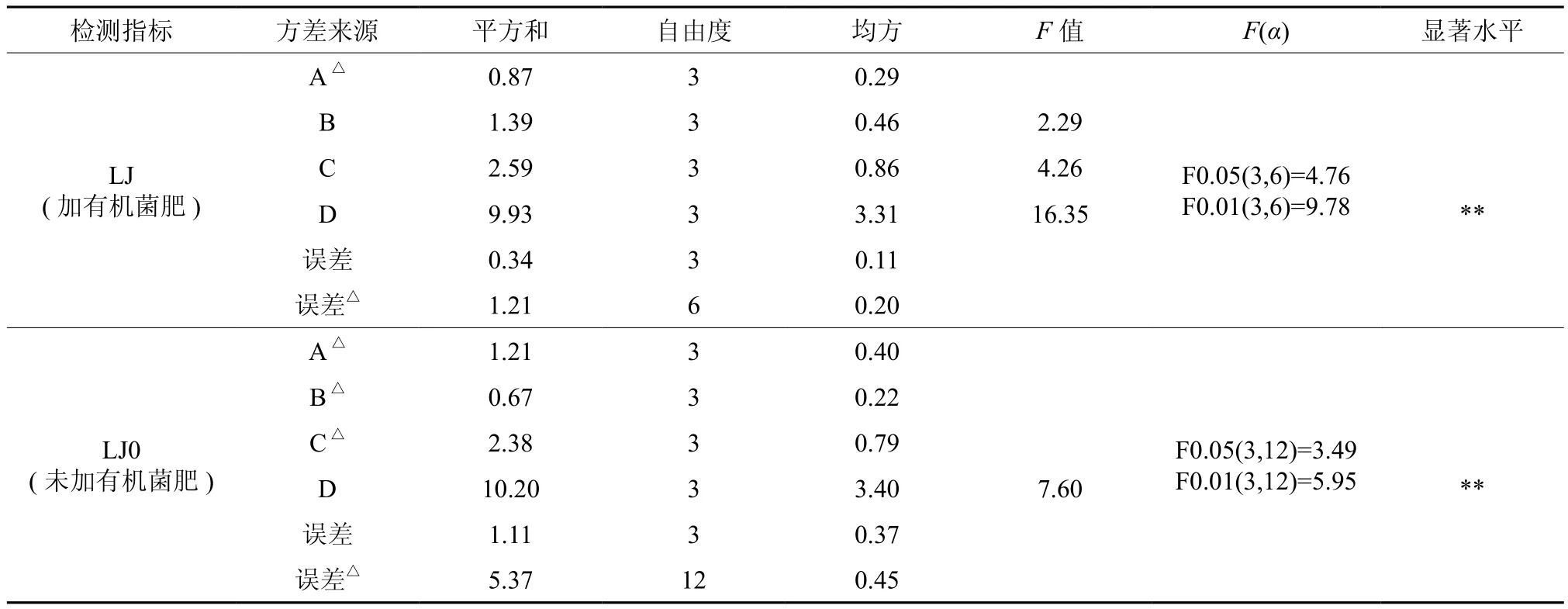
表6 锌去除效果的方差分析†Table 6 Variance analysis of removal rate of Zn
2.4 细菌群落结构及多样性对比分析
2.4.1 OTUs数量统计及Venn图分析
由图1、表7可知,LJ0(未加有机菌肥)共获得76 791条Tags(包括69 957条可获得分类信息的Tags和6 834条低频Tags),分为1 249个OTUs,可注释到25 507个属,501个种。而LJ(加有机菌肥)共获得68 527条Tags(包括63 383条可获得分类信息的Tags和5 144条低频Tags),分为1 254个OTUs,可注释到27 188个属,686个种。从图2可以看出,LJ与LJ0间共有的细菌OTU数目为951个,占较大比例。

表7 各分类水平上的序列数目Table 7 Number of sequences at each classification level
2.4.2 物种注释分析
两组菌群中相对丰度排名前十的属所对应的OTUs的系统发生关系如图3所示,菌群LJ(加有机菌肥)、LJ0(未加有机菌肥)中细菌均主要分布于以下10个属:A4属、红游动菌属Rhodoplanes、Kaistobacter属、不动杆菌属Acinetobacter、溶杆菌属Lysobacter、寡养单胞菌属 Stenotrophomonas、Steroidobacter属、欧文氏菌属Erwinia、硫杆菌属Thiobacillus、短根瘤菌属Bradyrhizobium。由OTUs丰度聚类图(图4)可知,菌群LJ各菌属的相对丰度由大到小依次排列为:硫杆菌属Thiobacillus> Kaistobacter属>不动杆菌属Acinetobacter>溶杆菌属Lysobacter>寡养单胞菌属Stenotrophomonas>红游动菌属Rhodoplanes>Steroidobacter属> A4属>欧文氏菌属Erwinia>短根瘤菌属Bradyrhizobium。LJ0为:硫杆菌属Thiobacillus>不动杆菌属Acinetobacter>A4属>红游动菌属Rhodoplanes> Steroidobacter属> Kaistobacter属>寡养单胞菌属Stenotrophomonas>短根瘤菌属Bradyrhizobium>欧文氏菌属Erwinia>溶杆菌属Lysobacter。不难发现,施加有机菌肥后,菌群各菌属的相对丰度发生改变,但硫杆菌属Thiobacillus仍是优势菌属。
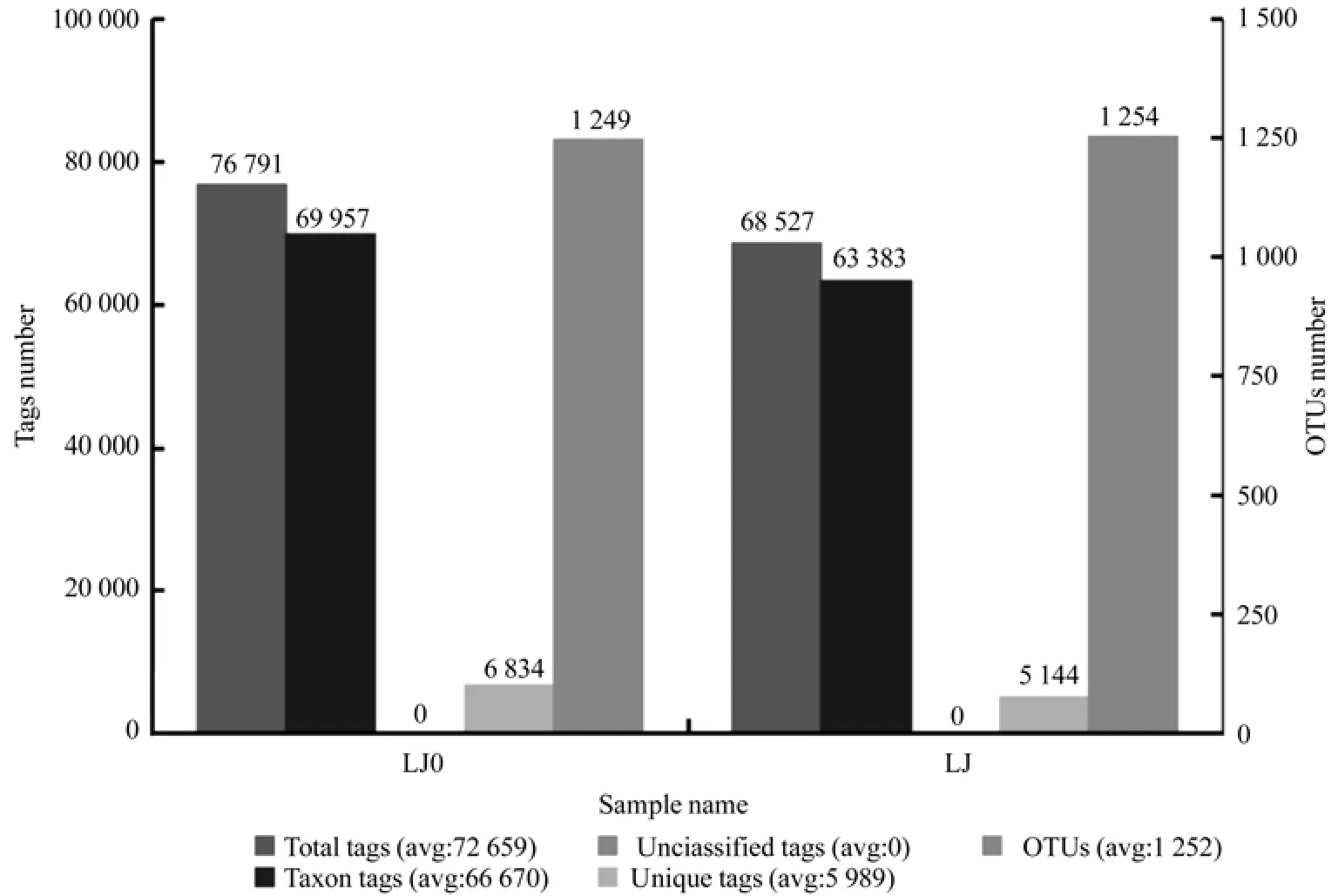
图1 样品的Tags和OTUs数目统计Fig.1 Statistics of the numbers of tags and OTUs in sample
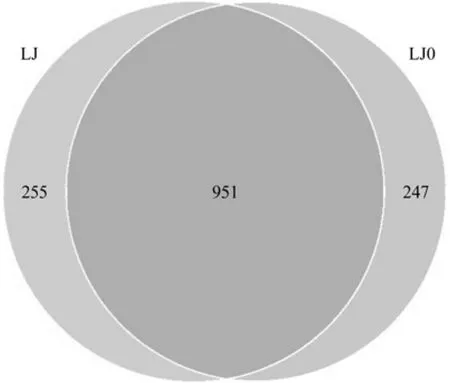
图2 样本LJ、LJ0的Venn图Fig.2 Venn diagrams of LJ and LJ0
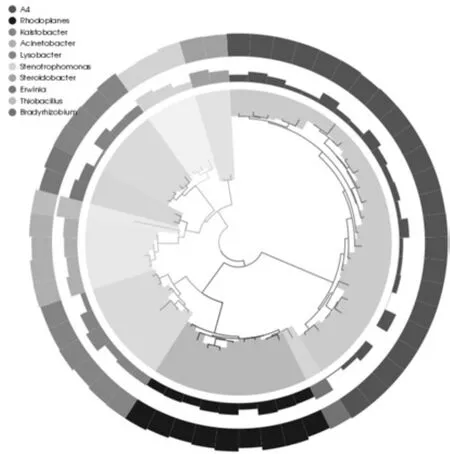
图3 OTUs的系统发育关系及其物种注释Fig.3 Phylogenetic relationship and species annotation of OTUs
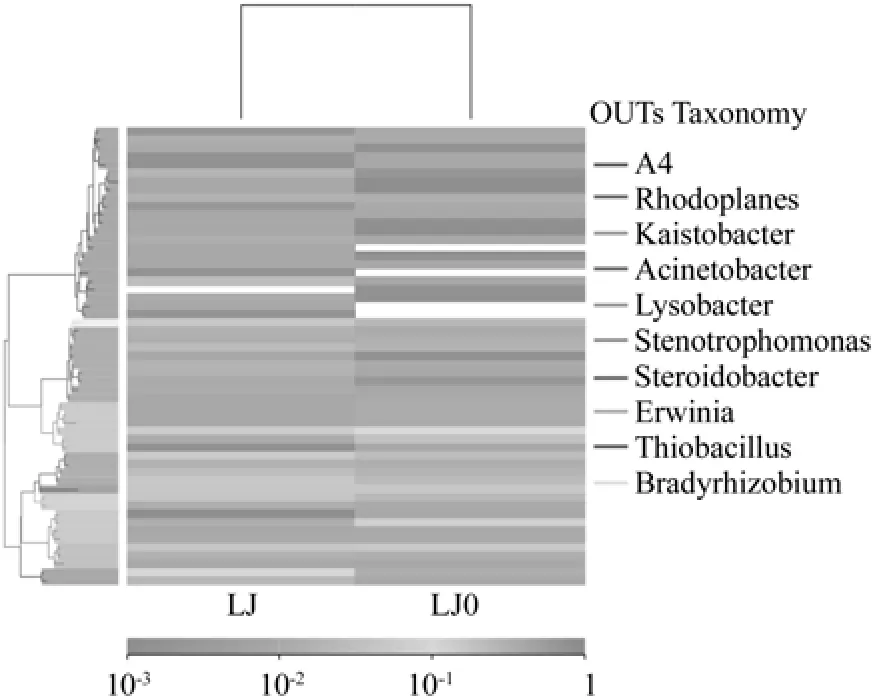
图4 OTUs丰度聚类图Fig.4 Abundance clustering plot of OTUs
2.4.3 多样性分析
从Shannon指数曲线来看(图5),两组菌群的Shannon指数在10 000的测序数量范围内增幅较大,接近20 000后曲线趋于平缓,因此,测序数据量足够反映样品中绝大多数的微生物信息。显然,LJ(加有机菌肥)的Shannon指数高于LJ0(未加有机菌肥),菌群LJ的物种多样性高于LJ0[24]。图6的Rank-Abundance曲线显示, LJ和LJ0在水平方向的跨度相当,LJ稍大于LJ0。但在垂直方向的平滑程度,LJ更小,说明LJ的细菌物种分布越均匀。显然,有机菌肥提高了根际菌群的物种多样性及均匀度。有研究发现,接种菌剂能显著增加植物根际土壤的微生物数量,改良根系土壤结构及酶活性,增加土壤的保水透气能力,促进植物生长[25-26]。与之一致,有机菌肥对植物根系土壤环境的影响是根际菌群结构及多样性改变的重要原因。
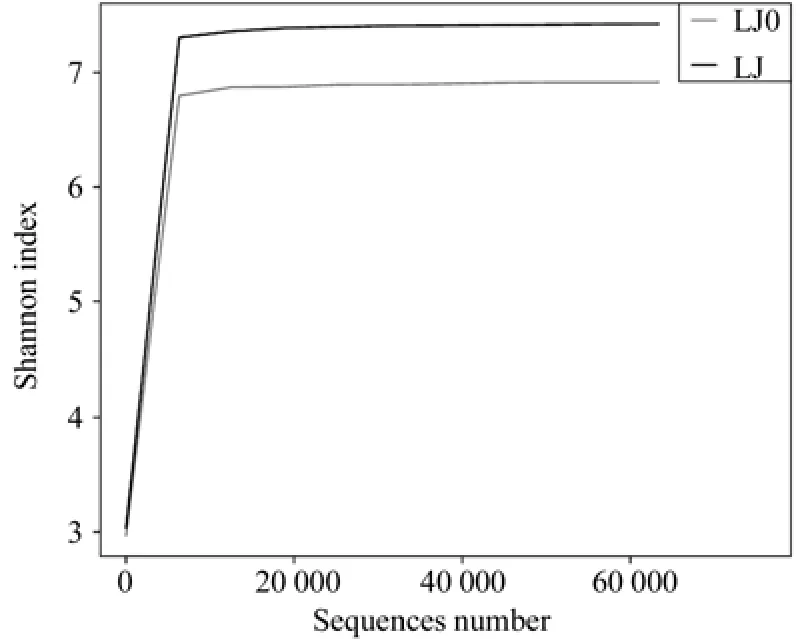
图5 Shannon指数曲线Fig.5 Shannon index curve
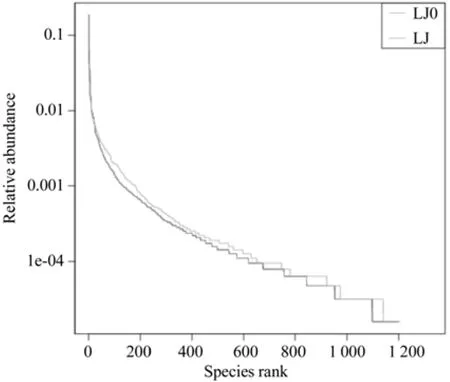
图6 Rank-Abundance曲线Fig.6 Rank-Abundance curve
3 结论与讨论
生物群落能通过生理生化与遗传特征的改变、以耐性类群生物代替敏感类群产生污染诱导群落耐性(PICT)[27],微生物群落亦不例外。有研究发现,微生物群落对重金属的PICT与重金属的生物有效性存在一定正相关关系[28-30]。有机菌肥能通过吸附、络合等作用改变土壤中重金属的生物有效性[31],因此改良前后辣椒根际菌群所产生的PICT会存在差异。本文通过正交试验对根际菌群去除铅锌的能力及特性进行了研究,印证了两组菌群PICT差异的存在。菌群LJ0(未加有机菌肥)能在较菌群LJ(加有机菌肥)更高的铅锌浓度下达到自身最佳的铅去除效果,可见重金属有效性相对较高的环境生存的菌群LJ0具有较菌群LJ更强的耐铅能力。值得提出的是,本试验中的比较是基于相同且营养充足的环境,重金属污染相对严重的环境往往也面临养分贫瘠等问题,在此生境生存的菌群受多因素限制而对重金属更加敏感[32]。高通量测序对改良前后根际菌群结构及多样性的分析也证实了微生物群落功能与结构的相关性。但本文也存在一定的局限性,改良前后根际菌群变化的相关分析不足以阐释有机菌肥的改良机制以及微生物群落整体功能机理,缺少的根际土壤分析作数据支撑,未来还需对功能微生物甚至深入到功能基因做进一步的研究。
本研究主要的结论如下:
(1)有机菌肥应用显著地提高了可培养根际菌群去除铅、锌的能力,铅、锌去除率的最大增量值分别为40.2%、12.7%。
(2)菌群去除铅锌的能力及特性受培养基种类、铅锌浓度等因子的影响,而培养基是最主要的影响因素。
(3)以细菌、放线菌为主的原核生物较真菌为主的真核生物更具去除铅锌的优势。
(4)16S测序分析结果表明,施用有机菌肥对微生物丰度、各物种的相对丰度都有一定影响,但硫杆菌属Thiobacillus仍是绝对优势菌。总体上,有机菌肥的应用提高了菌群物种的多样性。
[1]Li M S. Ecological restoration of mineland with particular reference to the metalliferous mine wasteland in china: a review of research and practice[J]. Science of the Total Environment,2006, 357(1): 38-53.
[2]黄铭洪,骆永明. 矿区土地修复与生态恢复[J]. 土壤学报,2003, 40(2): 161-169.
[3]张雪峰,胡 滨. 微生物肥料对土壤生态环境修复效应的影响[J]. 绿色科技, 2011 (2): 98-100.
[4]Asensio V, Covelo E F, Kandeler E. Soil management of copper mine tailing soils - sludge amendent and tree vegetation could improve biological soil quality[J]. Science of the Total Environment, 2013, 456-457(7): 82-90.
[5]李韵诗,冯冲凌,吴晓芙,等. 重金属污染土壤植物修复中的微生物功能研究进展[J]. 生态学报, 2015, 35(20): 6881-6890.
[6]牛之欣,孙丽娜,孙铁珩. 重金属污染土壤的植物-微生物联合修复研究进展[J]. 生态学杂志, 2009, 28(11): 2366-2373.
[7]陈永华,张富运,吴晓芙,等. 改良剂对4种木本植物的铅锌耐性、亚细胞分布和化学形态的影响[J]. 环境科学, 2015,36(10): 3852-3859.
[8]李建华,郜春花,卢朝东,等. 菌剂与肥料配施对矿区复垦土壤白三叶草生长的影响[J]. 中国生态农业学报, 2011, 19(2):280-284.
[9]王海娟,包玉英,牛天心,等. 菌剂与肥料配施对露天矿排土场苜蓿生长及土壤养分含量的影响[J]. 华北农学报, 2014,29(4): 186-191.
[10]Wang F Y, Wang L, Shi Z Y. Effects of am inoculation and organic amendment,alone or in combination,on growth,p nutrition,and heavy-metal uptake of tobacco in pb-cdcontaminated soil[J]. Plant Growth Regul, 2012, 31(4): 529-559.
[11]Fernández D A, Roldán A, Azcón R, et al. Effects of water stress, organic amendment and mycorrhizal inoculation on soil microbial community structure and activity during the establishment of two heavy metal-tolerant native plant species[J].Environmental Microbiology, 2012, 63(4): 794-803.
[12]江业根,陆俊锟,康丽华,等. 菌剂与化肥对降香黄檀苗期生长、结瘤的影响[J]. 中南林业科技大学学报,2016,36(5):12-16,31.
[13]苏小青,陈慧洁,冯丽贞,等. 不同配比菌肥对土壤养分及油茶生长的影响[J]. 福建林学院学报, 2014, 34(4): 71-76.
[14]谭益民,何苑皞,郭文平. 基于分子技术的土壤微生物多样性研究进展[J]. 中南林业科技大学学报, 2014, 34(10): 7-15.
[15]李韵诗. 铅锌矿区根际土壤专用有机菌肥改良机理与效应分析[D]. 长沙: 中南林业科技大学, 2015.
[16]沈 萍,陈向东. 微生物学实验[M]. 北京: 高等教育出版社,2007: 241-242.
[17]Shirling E B, Gottlieb D. Methods for characterization of streptomyces species[J]. International Journal of Systematic Bacteriology, 1966, 16(3): 313-340.
[18]Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8.
[19]陈泽斌,李 冰,王定康,等. 应用Illumina MiSeq高通量测序技术分析玉米内生细菌多样性[J]. 现代食品科技, 2016,32(2): 121-128.
[20]窦 妍,赵晓伟,丁 君,等. 基于高通量测序技术分析患病与健康虾夷扇贝(Patinopecten yessoensis)闭壳肌菌群多样性[J].生态学杂志, 2016, 35(4): 179-185.
[21]洪坚平,谢英荷,孔令节,等. 矿山复垦区土壤微生物及其生化特性研究[J]. 生态学报, 2000, 20(4): 138-141.
[22]滕 应,黄昌勇,龙 健,等. 铅锌银尾矿污染区土壤微生物区系及主要生理类群研究[J]. 农业环境科学学报,2003,22(4):25-28.
[23]李小林,颜 森,张小平,等. 铅锌矿区重金属污染对微生物数量及放线菌群落结构的影响[J]. 农业环境科学学报, 2011,30(3): 66-73.
[24]聂 猛,李文涛,李 勇,等. 山东半岛典型海域大叶藻(Zosteramarina)附着大型藻类群落结构[J]. 生态学杂志, 2014,33(7): 1786-1794.
[25]丁巧蓓,晁元卿,王诗忠,等. 根际微生物群落多样性在重金属土壤修复中的研究[J]. 华南师范大学学报:自然科学版,2016, 48(2): 7-18.
[26]罗晓蔓,丁贵杰,翟帅帅,等. 褐环乳牛肝菌对马尾松幼苗根际土壤微环境的影响[J]. 中南林业科技大学学报, 2016,36(10): 66-70.
[27]邓 欢,李小方,黄益宗,等. 土壤微生物污染诱导群落耐性研究进展[J]. 生态毒理学报, 2008, 3(5): 14-23.
[28]Fernández-calviño D, Martín A, Arias-estévez M, et al. Microbial community structure of vineyard soils with different ph and copper content[J]. Applied Soil Ecology, 2010, 46(2): 276-282.
[29]Fernández-calviñoa D, Arias-estéveza M, Díaz-raviña M, et al.Bacterial pollution induced community tolerance(pict) to cu and interactions with ph in long-term polluted vineyard soils[J]. Soil Biology and Biochemistry, 2011, 43(11): 2324-2331.
[30]Bååth E, Díaz-raviña M, Bakken L R. Microbial biomass,community structure and metal tolerance of a naturally pbenriched forest soil[J]. Microbial Ecology, 2005, 50(4): 496-505.
[31]Singha A, Agrawal M, Marshall F M. The role of organic vs.inorganic fertilizers in reducing phytoavailability of heavy metals in a wastewater-irrigated area[J]. Ecological Engineering, 2010,36(12): 1733-1740.
[32]Kamitani T, Oba H, Kaneko N. Microbial biomass and tolerance of microbial community on an aged heavy metal polluted fl oodplain in japan[J]. Water Air & Soil Pollution, 2006, 172(1): 185-200.
Study of characteristics and diversity of rhizospheric micro fl ora from the lead-zinc tailing area of soil improved by organic fertilizer
LIU Xiangjun, FENG Chongling, WU Xiaofu, JI Zehua, ZHANG Shuang, LI Liugang
(College of Environmental Science and Engineering,Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
Orthogonal experiment was carried out to compare the differences in removal of lead and zinc by rhizospheric micro fl ora between pepper plant pots applied with and without a specifically prepared organic fertilizer. Combined with Illumina sequencing technique, the characteristics changes in bacterial community structure and diversity were also analyzed. The result showed that the organic fertilizer enhanced the capacity of culturable rhizospheric microflora to remove lead and zinc and the highest removal rate increment reached 40.2% and 12.7%, respectively. The optimum culture condition of lead removal was changed while the effect of leadzinc concentrations and medium types on lead removal rate increased to higher signi fi cant levels. In comparison, the positive effect of organic fertilizer on zinc removal was less signi fi cant. Medium type was found to be the main factor affecting lead and zinc removal.Prokaryotes were shown to be more preponderant in removal of lead and zinc than Eukaryotes in the rhizospheric micro fl ora. It was also found the organic fertilizer had an apparent impact on the original micro fl ora, the relative microorganism abundance was changed, the diversity of fl ora species was enriched, but Thiobacillus were still the dominant bacteria.
rhizospheric micro fl ora; organic fertilizer; orthogonal experiment; 16S rRNA; lead; zinc
S718.8
A
1673-923X(2017)06-0032-07
10.14067/j.cnki.1673-923x.2017.06.005
2017-01-17
国家“十二五”科技支撑计划项目(2012BAC09B03-4);国家“十二五”科技惠民计划项目(2012GS430203);湖南省环境科学与工程重点学科建设项目
刘相君,硕士研究生
冯冲凌,讲师,博士;E-mail:ddukepet@163.com
刘相君,冯冲凌,吴晓芙,等. 铅锌尾矿区土壤有机菌肥改良后植物根际菌群的特性及多样性研究[J].中南林业科技大学学报,2017, 37(6): 32-38.
[本文编校:吴 彬]

