NDV和A PMV-4的F和HN蛋白糖基化位点的差异分析比较*
袁小远,杨金兴,张玉霞,孟凯,李莉,王友令,艾武
(山东省农业科学院家禽研究所,山东 济南 250023)
NDV和A PMV-4的F和HN蛋白糖基化位点的差异分析比较*
袁小远,杨金兴,张玉霞,孟凯,李莉,王友令**,艾武**
(山东省农业科学院家禽研究所,山东 济南 250023)
本文就禽副黏病毒的两种不同血清型APMV-1(以NDV为代表)和APMV-4的F和HN蛋白糖基化位点进行分析比较。分析显示:F蛋白糖基化位点NDV强弱毒株毒株均有6处糖基化位点,而APMV-4毒株则只有4处潜在的糖基化位点,而且位置与APMV-1略有不同。同时,NDV强毒株GM的HN蛋白有5个潜在的糖基化位点,而La Sota弱毒株有6个潜在的糖基化位点,即538~540位为NKT;APMV-4毒株有7处潜在的糖基化位点,且位置与APMV-1完全不一致。
新城疫病毒;禽副黏病毒;F/HN蛋白;糖基化位点
禽副黏病毒病 (Avain Paramyxoviridae virus,APMV)是当今危害全球养禽业的重要疫病之一,其病原共有九个血清型(APMV 1~9)[1]。禽副粘病毒1型最常见的是新城疫病毒(NDV),ND是引起家禽等的一种急性、烈性传染性疾病,发病率和死亡率均很高,并且多种禽类等都可以感染。NDV是禽副黏病毒1型的代表,也是各型禽副黏病毒型中研究最为透彻的,而对禽副黏病毒APMV 2~9的分子特性和致病性知之甚少[2-4]。GenBank数据库关于APMV-4型的分离毒株信息只有数株,相关研究非常有限。对于APMV-4的研究现在已获悉:APMV-4可以从水禽中分离到,可导致病禽的肺炎、支气管炎等呼吸道症状,而且可以在鸡胚和 部分 细 胞上 增 殖[5,6]。
糖基化作为一种主要的翻译后修饰作用对蛋白质的功能有着重要影响;糖基化位点能够参与影响病毒蛋白的合成,进而影响其活性和功能。因此,通过分析比较APMV-1和APMV-4的F和HN蛋白糖基化位点的不同,为两者作用机理的研究提供科学的理论基础。
1 材料与方法
1.1 材料
1.1.1 毒株及背景资料 NDV的GM强毒株、疫苗株La Sota和APMV-4 QY毒株均由山东省SPF鸡研究中心分离鉴定保存。GM强毒株为鸡源基因VII型强毒株,La Sota为基因II型弱毒疫苗株,APMV-4的QY毒株为鸭源弱毒株。
1.1.2 试剂 PCR试剂盒、胶回收试剂盒、载体等均购自宝生物工程(大连)有限公司,Simple RNA kit购自博日生物有限公司。
1.2 方法
1.2.1 引物设计 参照GenBank中NDV和APMV4的全基因组序列 (No:KU342001和 KC439346)设计4对引物,分别用于扩增F和HN全长基因。引物由华大基因公司合成,PAGE plus级别纯化。
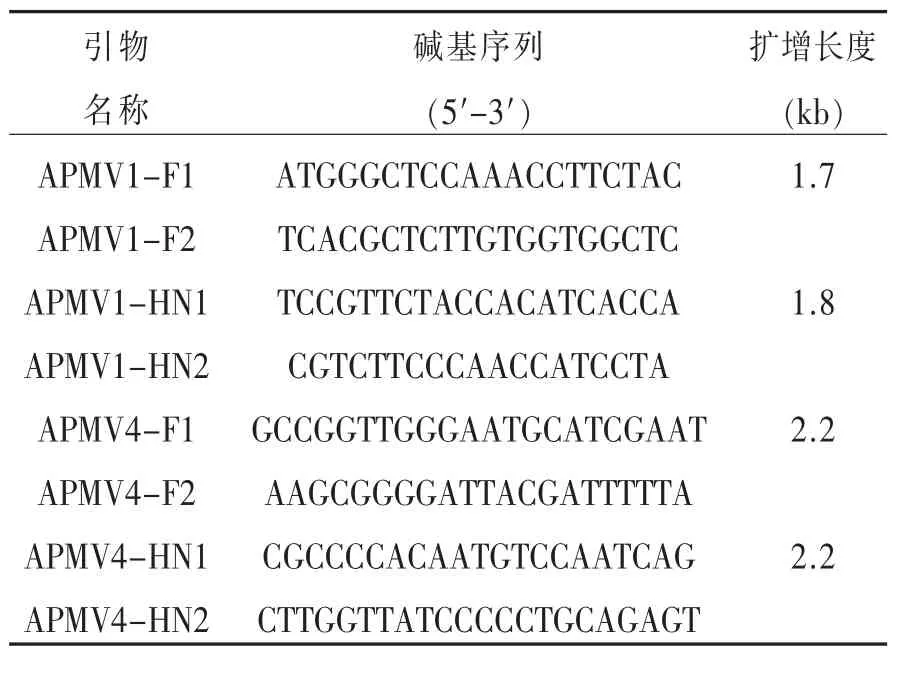
表1 F/HN基因扩增引物
1.2.2 RNA的提取和反转录 GM、La Sota、QY毒株的病毒RNA的提取按照Simple RNA试剂盒使用操作说明进行,最后用20μl DEPC水溶解RNA,立即进行RT操作。反转录RT按照文献[7]的操作进行,cDNA产物-20℃保存。
1.2.3 PCR扩增、连接和验证 APMV-1和APMV-4 的 cDNA 产物 5μl、2×pfu PCR Buffer(含Mg2+、dNTP plus)25μl、pfu DNA Polymerase(5U/μl)1μl、不同的 F 和 R primer(20pmol/μl)各 1μl,加水补至 50μl。PCR反应经摸索确定为:95℃预变性4min;第一步 94℃变性 60s、第二步 48~52℃退火60s、第三步 72℃延伸 90s,共进行 33个循环;72℃后延伸 4min;4℃保存。将扩增得到的 GM、La Sota、QY的F和HN产物纯化后与PMD-19T进行连接、转化、PCR反应验证后,阳性质粒送至华大基因测序。
1.2.4 糖基化位点的比较分析 各毒株F和HN序列进行拼接后利用DNAStar v6.13和Mega6.0进行分析,比较各个片段的糖基化位点的不同。
2 结果
2.1 F和HN基因序列测定和同源性分析 经序列测定,APMV-1的GM分离毒F和HN的ORF长度分别为 1662、1716bp;La Sota 为 1662bp 和1734bp,而APMV-4 F和HN的ORF长度分别为1701、1698bp。就 F基因而言,APMV-4的 QY与GM、La Sota的氨基酸同源性为 30%、31.6%;就HN基因而言,QY与GM、La Sota的氨基酸同源性为 33.2%、32.6%。综上,APMV-1和APMV-4的F和HN基因的同源性较低。
2.2 F蛋白糖基化位点分析 分析各毒株F蛋白的糖基化位点(即N-X-S/T)的不同之处,结果见表2。F蛋白糖基化位点La Sota和GM毒株均有6处糖基化位点,而APMV-4毒株则缺少2处位点,只有4处潜在的糖基化位点,而且位置与APMV-1略有不同。

表2 F蛋白糖基化位点的位置
2.3 HN蛋白糖基化位点分析 分析各毒株HN蛋白的糖基化位点不同之处,结果见表3。NDV强毒株GM HN蛋白有5个潜在的糖基化位点,而La Sota弱毒株有6个潜在的糖基化位点,即538~540位为NKT。APMV-4毒株完全与APMV-1不同,共有7处潜在的糖基化位点。从表3可以看出APMV-4与APMV-1的HN蛋白糖基化位点的数量与位置完全不一致。
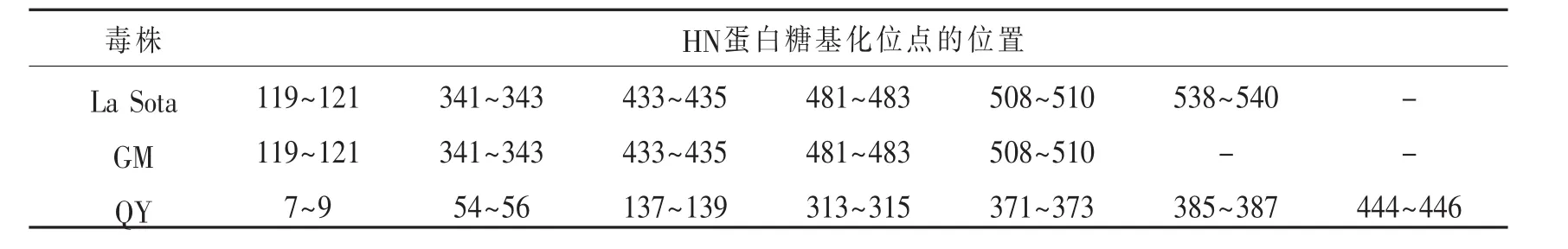
表3 HN蛋白糖基化位点的位置
3 讨论
APMV-1的HN、F蛋白是两大糖基化蛋白,也是宿主保护性抗原。F蛋白是病毒感染细胞的必需蛋白,以非活性前体F0的形式存在;经宿主细胞特异性的蛋白酶水解后F蛋白才能表现出融合活性,通过促进病毒穿入宿主细胞膜而发挥融合作用[8]。HN蛋白是NDV中较大的糖蛋白,在识别唾液酸受体、促进细胞融合等方面有重要作用[9,10]。HN蛋白在融合的过程能够识别并结合细胞受体。APMV-4毒株基因组全长是15054bp,与副黏病毒的“六规则”一致;基因组包含6个非重叠的基因,也是按NP/VMF-HN-L的顺序排列。每个基因的两侧是高度保守的转录起始和停止信号,并且有长度为9~42nt的间隔序列。
蛋白质的糖基化是指在糖基转移酶作用下将糖转移至蛋白质,随即和蛋白质上的氨基酸残基形成糖苷键的过程。糖基化作为一种主要的翻译后修饰作用对蛋白质功能有着重要修饰作用,例如它对于蛋白质的折叠、运输、定位以及调节蛋白质功能等方面起着重要作用[11,12]。因此,对于糖基化位点的研究意义重大。
本文在对APMV-1和APMV-4的HN、F基因进行全基因测序的基础上,对其潜在的糖基化位点进行分析。最终确定APMV-4毒株与APMV-1的强毒株和弱毒株F和HN蛋白糖基化位点存在差异,尤其是HN蛋白,糖基化位点的数量与位置完全不一致。以上研究数据为禽副黏病毒的不同血清型病毒感染和作用机制提供了科学的研究基础。
[1] Alexander D J.Avian Paramyxoviridae recent developments[J].VeterinaryMicrobiology,1990,23(1-4):103-114.
[2] Liu X F,Wan H Q,Ni X X,et al.Pathotypical and genotypical characterization of strains of Newcastle disease virus,isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001 [J].Archives ofVirology,2003,148(7):1387-1403.
[3] Wang KC,Chen GQ,Jiang WM,et al.Complete Genome Sequence ofa Hemagglutination-Negative Avian Paramyxovirus Type 4 Isolated from China [J].Genome Announcements,2013,1(2):e0004513.
[4] Molouki A,Peeters B.Rescue of recombinant Newcastledisease virus:a shorthistoryofhow it all started[J].Archives of Virology,2017,162(7):1-10.
[5] Khattar S K,Nayak B,Kim S H,et al.Evaluation of the Replication,Pathogenicity,and Immunogenicity of Avian Paramyxovirus(APMV)Serotypes 2,3,4,5,7,and 9 in Rhesus Macaques[J].Plos One,2013,8(10):e75456.
[6] Choi K S,Kim J Y,Kye S J,et al.Genetic diversity of avian paramyxovirus type 4 isolatesfrom wild ducks in Korea from 2006 to 2011[J].Virus Genes,2013,46(2):302-308.
[7] 袁小远,杨金兴,王友令,等.一株野禽新城疫强毒分离株的分子特性及其对不同宿主的致病性[J].农业生物技术学报,2014,22(3):273-279.
[8] Cardenas-Garcia S,Afonso C L.Reverse Genetics of NewcastleDiseaseVirus[J].Methodsin Molecular Biology,2017,1602:141.
[9] Liu J,Zhu J,Xu H,et al.Effects of the HN Antigenic Difference between the Vaccine Strain and the Challenge Strain ofNewcastle Disease Virus on VirusSheddingand Transmission[J].Viruses,2017,9(8):225-229.
[10] Chu F,Wen H,Zhang W,et al.'a'-Position Mutated and G4-Mutated Hemagglutinin Neuraminidase Proteins of Newcastle Disease Virus Impair Fusion and Hemagglutinin -Neuraminidase -Fusion Interaction by Different Mechanisms [J].Intervirology,2013,56:27-36.
[11] Panda A,Elankumaran S,Krishnamurthy S,et al.Loss of N ~Linked Glycosylation from the Hemagglutinin ~Neuraminidase Protein Alters Virulence ofNewcastle Disease Virus[J].J.Virol,2004,76:4965-4975.
[12] Pegg C L,Hoogland C,Gorman J J.Site-specific glycosylation of the Newcastle disease virus haemagglutinin -neuraminidase [J].Glycoconjugate Journal,2016:1-17.
S858.312.65+9.5
B
1673-1085(2017)12-0008-03
2017-11-17
山东省农业科学院青年基金项目(2014QNM15)、 山东省自然科学基金面上项目(ZR2015CM009);山东省农业科学院科技创新工程项目(CXGC2016A10)。
袁小远(1980.01-),女,汉,山东荣成人,博士,研究方向:禽病分子生物学与免疫学。E-mail:xyyuan1980@163.com。
**通讯作者:王友令(1974-),男,副研究员,研究方向:家禽疫病防控研究。E-mail:wangyouling71@163.com。
艾武(1964-),女,研究员,研究方向:家禽疫病诊断与防治。 E-mail:767068849@qq.com.cn。

