一株鸭源H9亚型禽流感病毒的分离鉴定及H A基因序列分析*
高月花,于可响,宋玲玲,宋敏训
(山东省农业科学院家禽研究所,山东 济南 250023)
●2017年《家禽科学》总目录…………… (60)
一株鸭源H9亚型禽流感病毒的分离鉴定及H A基因序列分析*
高月花,于可响,宋玲玲,宋敏训**
(山东省农业科学院家禽研究所,山东 济南 250023)
本研究从发生产蛋下降疫情的山东某种鸭场采集病料,分离得到一株病毒。经血凝(HA)试验、血凝抑制(HI)试验、测序分析,鉴定该毒株为H9亚型禽流感病毒。对分离株HA基因进行测序及序列分析,结果显示该分离株HA基因的裂解位点为333PARSSR↓GLF339,符合低致病性AIV的特征;与参考毒株的HA基因组序列进行比较发现,核苷酸的同源性为93.7%~99.3%,推导的氨基酸的同源性为96.4%~98.6%,与Shandong/YT5/2010(H9N2)株同源性最高。
H9亚型禽流感病毒;HA基因;序列分析
禽流感(Avian influenza,AI)是由正粘病毒科A型流感病毒(AIV)所引起的一种禽类传染病。根据禽流感病毒(AIV)致病力的不同可分为高致病性禽流感病毒(AIV)和低致病性禽流感病毒(AIV)[1]。H9亚型AIV属于低致病性AIV,虽然致病力低,不引起禽类死亡或死亡率低,但会引起禽类免疫抑制生长障碍、产蛋下降,或者不表现临床症状而成为AIV的隐性带毒者[2],成为AI的重要传染源,给养禽业造成巨大损失。H9亚型AIV感染谱很广,鸡感染后表现为呼吸道症状或不表现症状,而鸭等水禽表现为产蛋下降或隐性感染不表现任何症状。鸡与鸭感染H9亚型AIV后表现的症状不同已经引起越来越多的学者关注。
本研究从发生产蛋下降疫情的山东某种鸭场采集的病料,通过鸡胚接种分离到一株病毒,并通过血清中和试验、RT-PCR检测等方法对病毒进行了鉴定,最终确认该分离病毒为H9亚型禽流感病毒,并对其HA基因进行克隆、测序和进化分析及比较。
1 材料与方法
1.1 材料 SPF鸡胚由山东省农业科学院家禽研究所昊泰试验动物中心提供;禽流感病毒(AIV)H9亚型、H7亚型、H5亚型阳性血清购自哈尔滨维科生物技术开发公司。TRIzol购自invitrogen公司;RNasin、dNTP 购自 Promega 公司;Ex-Taq、pMD18-T载体试剂盒购自TaKaRa(大连)公司;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;DNA凝胶回收试剂盒和质粒小量抽提试剂盒购自AXYGEN公司。
1.2 方法
1.2.1 病毒分离及鉴定 采集发病鸭泄殖腔棉拭子,无菌处理后接种5枚10日龄SPF鸡胚,0.2ml/枚。弃去24h内死亡的鸡胚,收集24~96h的死、活鸡胚尿囊液,测定其血凝价。将该病毒盲传3代后,收集24~96h的死、活鸡胚尿囊液。
1.2.2 血清学鉴定 血凝(HA)试验:按常规方法,将收获的鸡胚尿囊液进行微量平板法HA试验,测定病毒的血凝效价。
血凝抑制(HI)试验:按常规方法,将HA试验中有血凝活性的尿囊液分别与NDV、EDSV阳性血清及 H5、H7、H9亚型 AIV标准阳性血清进行微量平板法凝集抑制试验,判定HI结果。
1.2.3 鸡胚半数感染量测定 将盲传3代收获的有血凝活性的尿囊液稀释成为10-6~10-9四个稀释度,每个稀释度接种5枚10日龄鸡胚,每胚0.2ml。37℃孵育至120h。收集接种后24~120h死亡鸡胚的尿囊液,未死的鸡胚于120h冻死并收集尿囊液,分别测定血凝效价。按照Reed-Muench法测定其EID50。
1.2.4 病毒HA基因序列测定
1.2.4.1 引物设计 根据GenBank中发表的H9亚型AIV的HA基因序列设计一对引物,用于扩增HA基因全长片段,片段预期大小为1703bp。引物由上海生工生物工程公司合成,上游引物P1序列为:5'TTCACAACCACTCAAGATGGA3' ,下游引物P2序列为:5'GCCAATTATATACAAATGTTGC3'。
1.2.4.2 RT-PCR 按照TRIzol试剂说明提取病毒 RNA,上、下游引物(20μM)各 1μl、2×one Step Mix 25μl、one Step Enzyme Mix 2μl、DEPC 水11μl和提取的病毒 RNA 10μl,体系共 50μl。反应程序为 50℃ 30min,95℃ 2min, 然后 95℃ 30s、50℃ 30s、72℃ 2min,30 个循环,72℃延伸 10min。取5μl反应产物在1%琼脂糖中电泳进行检验。
1.2.4.3 扩增产物克隆 PCR产物电泳后,切下目的片段,用回收试剂盒回收PCR产物,回收产物与pMD18-T载体进行连接,16℃连接 2~3h。将连接产物转化感受态DH5ɑ,均匀涂布于含50μg/ml氨苄青霉素的 LB固体培养基,37℃培养 18h后,挑取大小适中的白色菌落进行培养,用质粒小量抽提试剂盒提取质粒,并用PCR扩增进行鉴定。将阳性菌送上海生工生物工程公司测序。
1.2.5 HA基因序列分析 自GenBank下载国内H9亚型禽流感病毒参考株HA基因组序列,利用Lasergene和Meg6.0软件,比较分离株与参考毒株的HA基因核苷酸及推导的氨基酸同源性,绘制HA基因的分子遗传进化树,对HA蛋白氨基酸序列分析。
2 结果
2.1 血清学鉴定 ①HA试验:分离的病毒能凝集鸡的红细胞,病毒HA效价为8~10log2;②HI试验:分离的病毒凝集鸡红细胞的特性不能被NDV、EDSV阳性血清及H5、H7亚型AIV标准阳性血清所抑制,而能被H9亚型AIV标准阳性血清所抑制,初步确定分离毒株为H9亚型AIV。
2.2 病毒鸡胚半数感染量(EID50)测定 盲传3代后,病毒的鸡胚半数感染量(EID50)为10-7.18/0.1ml。
2.3 病毒HA基因扩增与序列分析
2.3.1 病毒HA基因扩增 以病毒RNA作为模板,扩增的HA基因片段大小约为1.7kb,与预期片段大小相符(图1);将扩增产物连接pMDl8-T克隆载体后进行测序鉴定,测序所得HA基因的开放阅读框由1703个核苷酸组成,与Genbank中公布的H9AIV核酸序列进行Blast比对,确定所得HA基因序列片段为H9亚型AIV HA基因序列。
图1 H9亚型AIV HA基因扩增电泳图
2.3.2 病毒HA基因分析
2.3.2.1 病毒HA基因核苷酸序列及推导的氨基酸序列同源性分析 从表1可以看出,分离株SDDJ同国内其他15株H9亚型AIV参考株的核苷酸的同源性为88.8%~99.3%,推导的氨基酸的同源性为 92.9%~98.6%,与 YT5株(A/chicken/Shandong/YT5/2010)同源性最高。
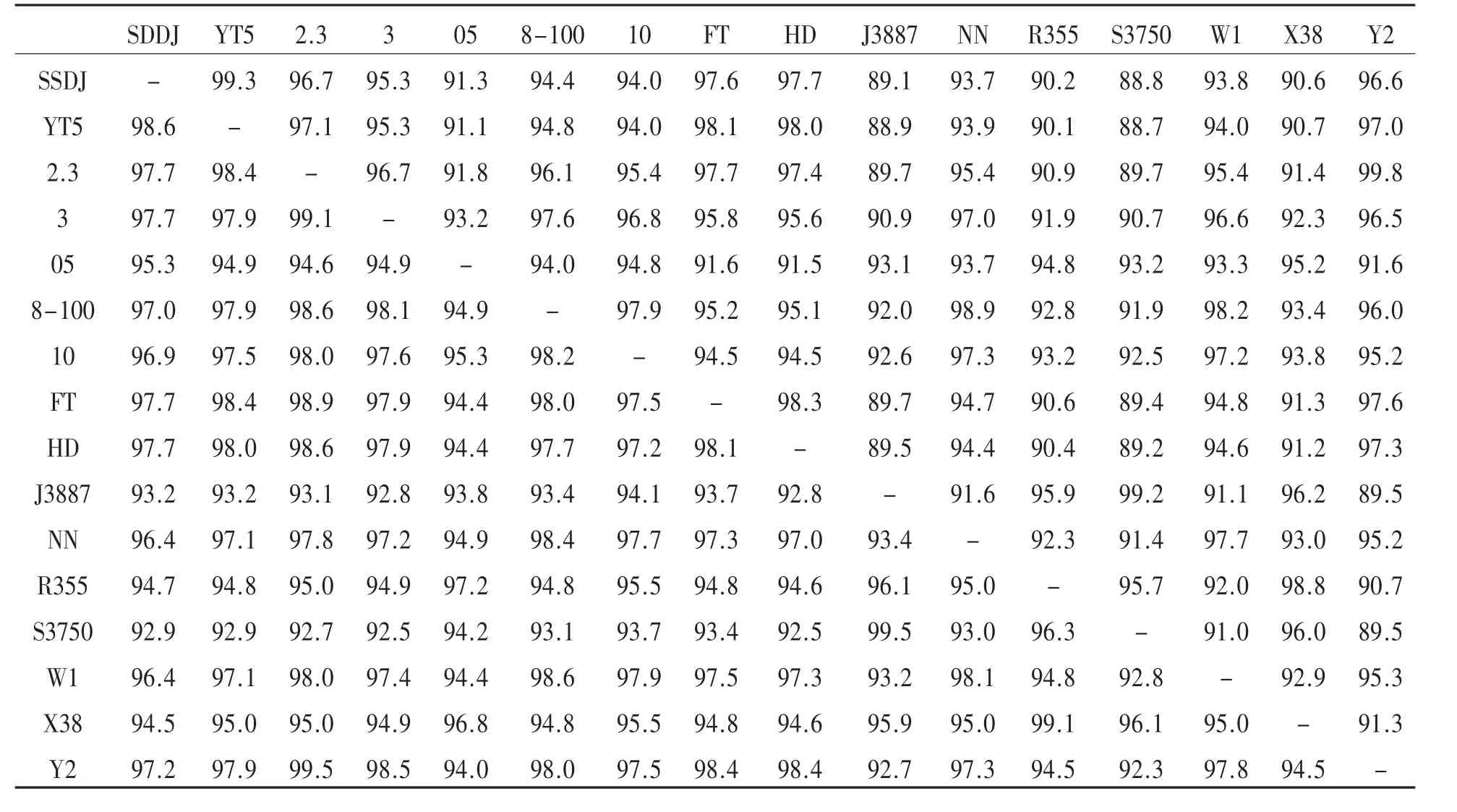
表1 HA基因核苷酸序列及推导的氨基酸序列同源性比较
2.3.2.2 病毒HA基因氨基酸位点分析 通过对HA基因氨基酸序列进行分析发现,该分离株HA蛋白裂解位点为333PARSSR↓GLF339,不含碱性氨基酸,符合低致病力毒株特征。
2.3.2.3 系统进化关系分析 将该分离株与28株国内H9N2参考毒株的HA基因氨基酸序列进行比对分析,并运用MEGA6.0软件绘制其HA基因的系统进化树(图2)。结果显示,该分离株与YT5株遗传距离最近。
3 讨论
本研究从发生产蛋下降的种鸭中分离到一株H9亚型AIV,其HA效价为8~10log2,鸡胚半数感染量为10-7.18/0.1ml。
HA蛋白在病毒吸附及穿膜过程中起关键作用,裂解为HAl和HA2是病毒感染细胞的先决条件[3]。AIV毒株毒力的强弱主要体现在HA基因裂解位点的变化上。通过对该分离毒株HA蛋白进行分析发现,其HA蛋白裂解位点(333~339位)的氨基酸序列为PARSSR↓GLF,不含碱性氨基酸,这从分子水平上证实分离株为低致病力毒株[4-5]。
该分离株同国内不同地区的其他15株H9亚型AIV参考株的核苷酸的同源性及推导的氨基酸的同源性都很高,分别为88.8%~99.3%、92.6%~98.6%, 与 YT5株(A/chicken/Shandong/YT5/2010)同源性最高。
H9亚型AIV的感染谱很广,大多数的禽类都可感染,以鸡、火鸡和某些野禽最易感,鸡感染后通常表现为呼吸道症状,而鸭等水禽感染后表现为产蛋下降,或隐性感染不表现任何症状。本实验将从产蛋下降的种鸭分离到的H9亚型AIV与国内不同宿主来源H9亚型AIV进行HA基因系统进化分析,结果发现,该鸭源分离株与国内其他鸭源分离株并没有更近的亲缘关系。

图2 H9亚型 AIV HA基因进化树
H9亚型禽流感是近几年影响中国养禽业的主要疾病之一,但由于H9亚型AIV属于低致病性AIV,它的低致死率和低发病率又往往引起人们的忽视,从1997年香港人感染禽流感事件被证明病毒H5N1的重组基因来自于H9N2亚型[6],到2013年H7N9亚型流感病毒的内部基因与H9N2亚型AIV的内部基因高度同源[7-8], 无一不证明了的H9亚型AIV的严重潜在危害。所以我们更应该加强对H9亚型禽流感的关注和防控,防止由病毒变异或基因重组造成的人畜共患疫病的发生。
[1] Munster V J,Fouchier MunR A M.Avian influenza virus:of virus and bird ecology[J].Vaccine,2009,27(45):6340-6344.
[2] 孟侯.禽流感[M].第 2版.北京:中国农业出版社,2002.
[3] 塞弗 Y M.禽病学[M].第十一版.苏敬良,高福,索勋,译.北京:中国农业出版社,2005:75-117.
[4] Rohm C,Horimoto T,Kawaoka Y,eta1.Do hemagglutinin genes of highly pathogenic avian influenza virus constitute unique phylogenetic 1ineages[J].Viro-logy,1995,209(2):664-670.
[5] Lin Y P,Shaw M,Gregory,et a1.Avian-to-human trans-miSSion of H9N2 subtype influenza a virus:Relation-ship between H9N2 and H5Nlhuman isolates [J].Proc Natl Acad Sci USA,2000,97:9654-9658.
[6]CLAAS E C,OSTERHAUS A D,VAN BEEK R,et a1.Human influenza A H5NIvirusrelated to a highly pathogenic avian influenza virus[J].Lancet,1998,351(9101):472-477.
[7] KAGEYAMA T,FUJlSAKI S,TAKASHITA E,et a1.Genetic analysis ofnovelavian A(H7N9)influenza viruses isolated from patients in China,February to April 2013[J].Euro Surveill,2013,18(15):20453.
[8] ONATAK ,JESSICAB ,CHRISTIANG ,etal.aAvian InfluenzaH7N9/13 and H7N7/13:a Comparative Virulence Study in Chickens,Pigeons,and Ferrets[J].JVirol,2014,88(16):9153-9165.
The isolation and identification of a H9subtype AIV from duck and sequence analysis of HA gene*
GAO Yue-hua,YU Ke-xiang,SONG Ling-ling,SONG Min-xun**
(Poultry institute,shandong academy of agricultural sciences,jinan shandong 250023,China)
Samples were collected from a breeding duck farm with egg-laying epidemic in shandong province,and one virus strain as isolated.The virus was identified as H9subtype AIV by HA,HI test and sequencing analysis of HA gene.The sequencing analysis showed that the isolate had a HA cleavage site of 333PARSSR↓GLF339,which was a characteristic structure of low pathogenic AIV. The nueleotide homology and amino acid homology between isolated strain and the reference strains were 93.7%~99.3%and 96.4%~98.6%respectively.The isolated strain was highest homology with Shandong/YT5/2010 H9N2subtype.
H9N2subtype AIV;HA gene;sequencing analysis
S858.314.4+3
B
1673-1085(2017)12-0003-05
2017-11-11
山东省农业科学院科技创新重点项目资助(项目编号:2014CXZ08)。
高月花(1974-),女,山东日照人,硕士,主要从事畜禽疾病防控研究,E-mail:cwh143@sina.com。
**通讯作者:宋敏训(1963-),男,山东招远人,博士,研究员,硕士生导师,主要从事禽病防控与生物制品研究。

