干热河谷牛角瓜顶芽枯死病 病原鉴定及其生物学特性研究
葛立傲,禹利芳,伍建榕,刘林妹,马焕成,王以静
( 1.西南林业大学林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224; 2.西南林业大学 国家林业局西南生物 多样性保育重点实验室,云南 昆明 650224; 3.云南省元江县林业局,云南 元江 653300)
干热河谷牛角瓜顶芽枯死病 病原鉴定及其生物学特性研究
葛立傲1,禹利芳1,伍建榕1,刘林妹1,马焕成2,王以静3
( 1.西南林业大学林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224; 2.西南林业大学 国家林业局西南生物 多样性保育重点实验室,云南 昆明 650224; 3.云南省元江县林业局,云南 元江 653300)
按分离—接种—再分离的柯赫法则对云南干热河谷人工栽培牛角瓜CalotropisgiganteanL.上的一种新的顶芽枯死病害进行病原菌分离、鉴定及其致病性测定,根据培养性状、形态特征及分子鉴定确定该病原菌为柱孢属Cylindrocarponpauciseptatum真菌。生物学特性研究表明:该菌生长的最佳C 源为葡萄糖,对N 源和维生素均不能很好地利用,在PDA 培养基上生长的适宜温度为15~25 ℃,最佳温度为20 ℃,最佳pH 值为6,分生孢子在相对湿度100%时萌发。可以通过控制温度和土壤pH值来降低牛角瓜顶芽枯死病的发病率,提高牛角瓜的产量。
牛角瓜;顶芽枯死病;Cylindrocarponpauciseptatum;病原鉴定;生物学特性;干热河谷
牛角瓜CalotropisgiganteanL.是萝藦科Asclepiadaceae牛角瓜属的一种常绿小灌木,整株富含乳汁,叶对生,倒卵状长圆形或者椭圆状长圆形,幼嫩的叶子背面被白色绒毛,老叶无绒毛。花淡紫色,聚伞花序,全年开花结果。
牛角瓜广泛分布在亚洲和非洲的热带、亚热带地区。在我国主要分布于四川、广西、广东、海南及云南干热河谷地区的元阳、元江、建水、东川等地。因牛角瓜的多用途,即具有药用、生物药剂、能源植物以及纺织原材料开发的价值,在干热河谷地区大规模集约化种植。国外由于树种、树龄结构单一,发生过大规模的流行病害[1-3],国内目前对于牛角瓜的病害研究处于空白阶段。2012年9月,在云南省元阳县赛刀村牛角瓜种植基地近20 hm2内调查,发病率100%,病情指数68。作者对云南干热河谷地区元阳及元江县牛角瓜顶芽枯死病调查,通过对病原菌形态学观察及病原菌核糖体DNA ITS序列分析,确定引起牛角瓜顶芽枯死病的病原是柱孢属Cylindrocarponpauciseptatum真菌,同时研究了病原菌生物学特性[4-6]。
1 材料与方法
1.1 研究材料 在云南省元阳县赛刀村随机采集牛角瓜50株,供试菌株 2014年4月分离自野外采集的具典型顶芽枯死症状的牛角瓜病组织。
PDA培养基:马铃薯(去皮)200 g,琼脂20 g,葡萄糖20 g,水1 000 mL。用于致病性测定及生物学特性研究。
1.2 病原菌分离与纯化 将采回的牛角瓜病部组织用自来水冲洗干净,在病健交界处切取5 mm×5 mm的组织块,放于75%的酒精中浸泡10~20 s,取出放入0.1%升汞溶液浸泡3~5 min,用蒸馏水清洗3~4次,除去残留的消毒剂(否则影响病菌生长),接种到PDA培养基平皿中,在25 ℃黑暗条件下培养。待长出菌落后,通过挑取菌丝尖端方法对分离的病原菌进行纯化,纯化后的病原菌保存在-4 ℃冰箱,备用[8-9]。
1.3 致病性测定 将2年生的健康牛角瓜嫩叶经75%酒精表面消毒,用病叶分离所得的菌株接种。对已产孢的真菌配制成一定浓度的孢子悬浮液(40×10倍20个孢子,并掺有一些菌丝),对未产孢的真菌取菌丝块( 直径约为0.5 cm)接种[10]。
接种采用烫伤和针刺两种方法,处理组30片嫩叶,对照组为15片。针刺法用接种针刺伤表面已消毒的牛角瓜顶尖嫩叶,然后用灭过菌的棉花蘸取菌块接种上去,塑料薄膜保湿培养;对照直接用蘸灭菌水的无菌棉花接种。烫伤接种只是接种在轻微烫伤的顶尖嫩叶上,其他均与针刺法相同[11-12]。
1.4 病原菌鉴定
1.4.1 病原菌形态学鉴定 选用症状明显的牛角瓜发病组织采用徒手切片法制作临时玻片,镜检观察病原菌形态特征、显微摄影和测量[7]。
1.4.2 病原菌分子鉴定
基因组 DNA 提取:将分离和接种确定的牛角瓜芽枯病病原菌菌丝接种到新的培养皿上,25 ℃条件下培养7 d,用OMEGA 公司产品Forensic DNA kit试剂盒按步骤提取DNA,试剂盒由昆明硕阳生物公司提供。
rDNA ITS区序列扩增:用真菌核糖体基因转录间隔区的通用引物ITS1(5‘TCCGTAGGTGAACCTGCGG3′)和ITS4 (5’TCCTCCGCTTATTGATATGC3’)扩增ITS区间和5.8S rDNA。反应体系以50 μL计算:模板DNA 2 μL,引物ITS1,ITS4各1.5 μL,Mix25 μL,ddH2O 20 μL。反应程序:94 ℃预变性3 min;进入循环,94 ℃变性30 s,56 ℃退火40 s,72 ℃延伸50 s,40个循环;最后72 ℃延伸10 min,4 ℃保存。取4 μL反应产物进行1%琼脂糖凝胶电泳检测,完成后,将胶板取出放入凝胶成像系统中,用GeneSnap软件进行拍照观察,用吸附柱式PCR产物回收试剂盒(上海博光生物科技有限公司)纯化剩余的PCR产物,提交云南硕阳生物公司测序,序列通过Genbank进行同源性比对。
测序及rDNA ITS序列分析:测序后的ITS1、ITS4 和5.8 S rDNA序列用Clustal X程序进行rDNA序列的联配(alignment)比较、编辑,然后提交GenBank。将序列与GenBank中的柱孢属的Cylindrocarponpauciseptatum的ITS1、ITS2 和5.8 S rDNA序列进行同源性比较。
1.5 生物学特性测定
(1)温度。采用平板法进行营养生长试验,采用载片法进行孢子萌发试验。温度设10,15,20,25,28,30,32,35,40 ℃共9个梯度,每个水平设5次重复,菌落测量时间为3 d,孢子萌发测定时间为12 h。
(2)湿度。采用载片法进行孢子萌发试验,湿度调节采用小容器法,调节溶液为浓硫酸,设50%,65%,70%,90%,100%共5个湿度梯度,每个梯度设5次重复。
(3)pH。采用平板法进行营养生长试验,采用载片法进行孢子萌发试验,调节pH溶液为磷酸缓冲液,pH设4,5,6,7,8,9,10共7个梯度,每个梯度设5个重复。
(4)光照。采用平板法进行促进产孢试验,设计光照时间为0,10,12,14,24 h,共5个梯度。每个梯度设5个重复,培养直至产孢为止。
(5)营养。营养生长采用平板法,用Czapek培养基分别以等碳当量的葡萄糖、乳糖、可溶性淀粉取代蔗糖,另设无碳培养基CK;氮源则以等氮当量的牛肉膏、硫酸铵取代硝酸钾,另设无氮培养基CK。孢子萌发采用载片法,共设置1%硝酸钾、1%葡萄糖、无菌水3种处理,每种处理设置5个重复。
1.6 数据分析 数据分析使用SPSS 13.0中的一元线性模型中的Univariated方法完成。
2 结果与分析
2.1 症状 发病初期顶芽基部出现褪绿并呈水渍状,逐渐发展为黄色至暗褐色病斑,不久,顶芽发黄、变褐,病芽不能展叶、开花,呈半枯死或枯死状,产生许多小黑点,后期,病害向下延伸,出现枯梢症状,在枯死部分的下方产生大量黑色霉点。病斑后期下陷,流胶,见图1。

图1 牛角瓜顶芽枯死病症状
2.2 病原菌鉴定
形态学鉴定:枯梢上的黑色霉点经徒手切片、显微观察,鉴定牛角瓜顶芽枯死病的病原菌为柱孢属Cylindrocarponpauciseptatum真菌,有性世代为赤壳属Nectriasp.。
分离培养病原菌形态特征:在PDA 上生长很快、无色或淡色,菌落呈柔软的绒毛状、毡状,以单梗或分生孢子座方式产孢。瓶梗圆柱形或针形,具有开放的顶孔和短的领状物,从中产生无色、壁光滑的粘质状分生孢子。大分生孢子,圆柱形,两端钝圆,直或弯曲,有1个或多个横隔膜。
分子鉴定:病原菌用ITS-PCR引物进行序列测定,获得660 bp的扩增片段序列。在GenBank上blast,发现病原菌株与序列柱孢属的Cylindrocarponpauciseptatum(GenBank登录号为JF735305)同源性极高,相似性达99%,进一步证实了分离于牛角瓜的顶芽枯死病病原菌是柱孢属Cylindrocarponpauciseptatum。
2.3 致病性测定 病原菌C.pauciseptatum经人工接种,9 d后在嫩叶上产生变色反应,15 d后发病症状与采集的人工林牛角瓜顶芽枯死病的症状基本一致,切片镜检发现,病部组织内有菌丝存在。同时将发病嫩叶进行病原分离,仅得到1种真菌,与Cylindrocarponpauciseptatum的培养性状相同,病原菌再经分子检测与前相同。
2.4 病原菌生物学特性
2.4.1 温度对病原菌菌丝生长的影响 由图2可见,牛角瓜顶芽枯死病病原菌C.pauciseptatum在5~35 ℃下均能生长,适温为15 ~ 25 ℃,最适为20 ℃;低于10 ℃或者高于35 ℃时,可以明显看到菌落直径急剧减小。
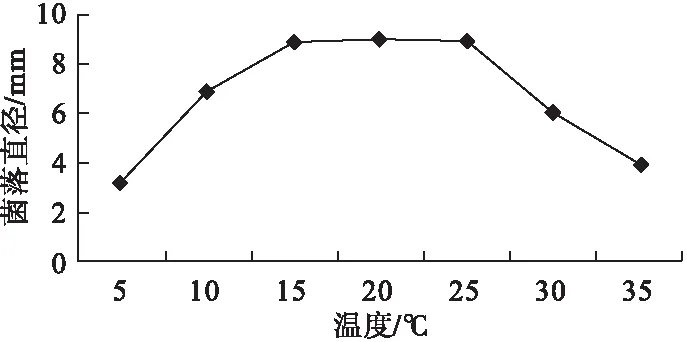
图2 不同温度对病原菌生长的影响
2.4.2 光照对病原菌菌丝生长的影响 在持续光照条件下菌落生长非常好,黑暗或间断性光照条件下,生长的菌落直径只是持续光照的三分之一,可见持续光照对该菌株生长有明显的促进作用(图3)。
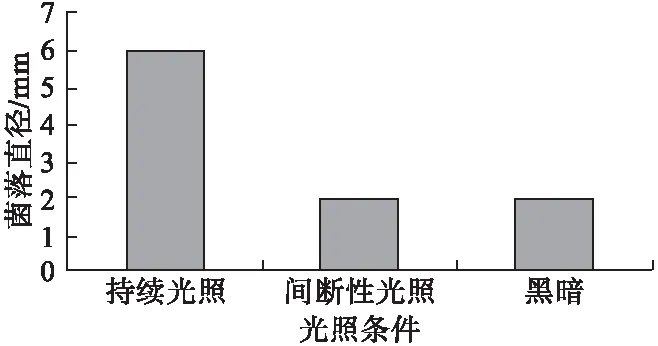
图3 光照对病原菌的影响
2.4.3 酸碱度对病原菌的影响 该病原菌生长的pH 值范围在3~10,适宜的pH 值为5~7,最适pH 值为6.2 左右;因此,病原菌适合在弱酸性环境中生长,强酸性或者强碱性的环境都不适合,甚至无法生长。在弱酸性和弱碱性的环境中可以生长,并且随着酸碱性的增加生长速度减弱,生长的菌落直径也减小(图4)。
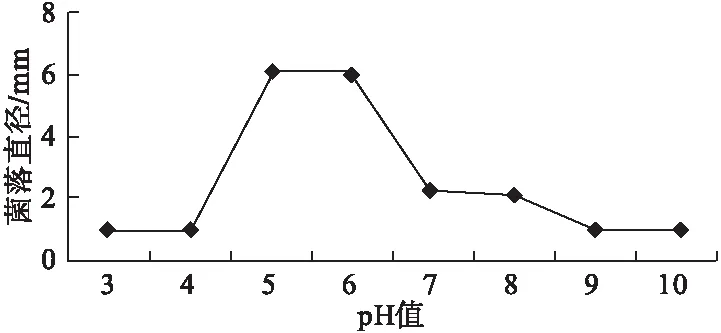
图4 不同酸碱度对病原菌的影响
2.4 不同碳源对病原菌的影响 病原菌菌株在不同碳源的几种培养基上都可以生长,并且生长良好,但相比之下,乳糖制成的培养基对该病原菌生长有较明显的抑制作用(图5)。

注:图中R,ZT,KR,M,G分别表示用乳糖、蔗糖、可溶性淀粉、麦芽
糖、甘露醇代替葡萄糖的Czapek培养基
图5不同碳源对病原菌的影响
3 结论与讨论
经过致病性测定、形态学和分子生物学鉴定,确定牛角瓜顶芽枯死病病原菌为柱孢属的Cylindrocarponpauciseptatum。
国外柱孢属真菌C.pauciseptatum的生物学特性方面的报道比较少,国内也不多。1985年刘梅娟 等[13]报道了锈腐病菌对不同碳源、氮源的利用情况,高书砚 等[14]报道了人参锈腐菌10 个方面的生物学特性的初步研究,还没见到该菌这方面的研究[13-14]。研究表明,该病原菌在持续光照条件下生长最好;适合的酸碱度在pH6左右,最适范围pH5~7;在 15~25℃都生长良好;不同碳源(除了乳糖)的培养基中生长均良好,葡萄糖的培养基生长最好,蔗糖次之;自然光照射下生长良好,连续黑暗或间断性光照不利于生长。
鉴于该病原菌的生物学特性,在牛角瓜顶芽枯死病防控过程中,尤其圃地,可以通过控制光照条件、土壤pH值来预防牛角瓜顶芽枯死病的发生。
[1] DEWAN S,SANGRUALA H,KUMAR V L.Preliminary studies on the analgesic activity of latex ofCalotroprisprocera[J].Journal of Ethnopharmacology,2000,73:307-311.
[2] ASU A,NAG CHAUDHARI A K.Preliminary studies on the anti-inflammatory and analgesic activities ofCalotroprisproceraroot extract[J].Journal of Ethnopharmacology,1991,31(3):319-324.
[3] GAL A,PATHAK A K.CNS activity ofCalotroprisgigantearoots[J].Journal of Ethnopharmacology,2006,106(1):142-145.
[4] 李克烈,罗联忠,陈伟,等.牛角瓜的组织培养[J].广东农业生物科学,2007,26(3):247-249.
[5] 戴好富,王茂源,等.牛角瓜属植物化学成分与药理活性研究进展[J].河海大学学报(医学版),2009,28(1):1-7.
[6] BOOTH C.The genusCylindrocarpon[J].Mycol,1966,104:1-56.
[7] 王春梅.草坪病虫害防治[M].延边:延边大学出版社,2002:1-244
[8] 陈润进,陈应龙.菌根学[M].北京:科学出版社,2007:1-447.
[9] 高柱,王晓玲,罗明灿.牛角瓜开发价值及栽培技术管理[J].北方园艺,2011(18):202-206.
[10]方忠达.植病研究法[M].北京:农业出版社,1982:1-427.
[11]LARCHER W.植物生理生态学[M].李博译.北京:科学出版社,1980:45-49.
[12]COOSEMANS J.Antagonistic activity of aCylindrocarponolidumisolate against nematodes[J].Mededelingen yande aculteit and ouwwetens chappen,1991,56(2):23-228.
[13]刘梅娟,杨利民.人参锈病菌的鉴定[J].植物保护:1985(3):27-31.
[14]高书砚,赫荣琳.人参锈腐病的筛选和鉴定[J].植物保护:1987(3):63-69.
ThepathogenidentificationanditsbiologicalcharacteristicsofapicalbudblightofCalotropisgiganteaninxerothermicvalleyareas/
Ge Li′ao.et al.
(Key Laboratory of Forest Disaster Warning and Control in Yunnan Higher Education Institutions,College of Forestry,Southwest Forestry University,Kunming 650224,China)
According to Koch′s postulates of isolation-inoculation-reisolation,isolation and pathogenicity identification on a new kind of disease cultivated inCalotropisgiganteanL.were carried out in the dry-hot valleys (DHV).According to cultivate character and morphological characteristics and molecular identification,column spore belongs toCylindrocarponpauciseptatum.The results showed that the best C source for the bacteria was glucose,the N source and vitamins couldn′t be utilized well,The proper temperature was 15 to 25 ℃ on PDA medium,optimum temperature was 20 ℃,optimal pH value was 6,conidium germinated only when the relative humidity was 100%.
CalotropisgiganteanL;bud blight;Cylindrocarponpauciseptatum;pathogen identification;biological characteristics;dry-hot valleys (DHV)
2016-04-15;
2016-06-07
国家林业公益行业专项“干热河谷牛角瓜人工林定向培育关键技术研究(201304810)”;国家自然科学基金项目(31260175);云南省高校干热河谷植被恢复创新团队;“云南省重点学科森林保护学”(XKZ200905),云南省高等学校森林病虫害综合治理教学团队
葛立傲(1991—)男,安徽芜湖人,在读硕士,主要从事园林植物保护学和资源微生物利用研究,E-mail:geliaogao@163.com
伍建榕,教授,主要从事森林病理学和资源微生物利用研究,E-mail:wujianrong63@aliyun.com。
S763.15
A
1671-0886(2017)03-0038-04
(责任编辑 杨静莉)

