樟子松赤枯病拮抗真菌的筛选
徐阳,赵贺新,宋义前,于庆帆,刘雪峰
(1.新疆生产建设兵团农四师农业科学研究所,新疆 伊宁市 835000; 2.东北林业大学,黑龙江 哈尔滨 150040)
樟子松赤枯病拮抗真菌的筛选
徐阳1,赵贺新1,宋义前1,于庆帆1,刘雪峰2
(1.新疆生产建设兵团农四师农业科学研究所,新疆 伊宁市 835000; 2.东北林业大学,黑龙江 哈尔滨 150040)
在健康的樟子松针叶上分离得到25种真菌,从中选出具有生防潜能的11种用于控制樟子松赤枯病的病原菌拮抗菌株的筛选。拮抗真菌与病原菌的平板对峙试验结果表明:长枝木霉Trichodermalongibrachiatum、血红毛壳Chaetomiumcruentum和印度毛壳C.indicum能有效抑制该病原菌,其中长枝木霉对病原菌菌丝的抑制效果最强,抑制率为72.81%,后2种的抑制率分别为49.16%和42.36%。
樟子松赤枯病;病原菌;拮抗真菌;抑制率
樟子松Pinussylvestrisvar.mongolica赤枯病在世界广泛分布,主要危害杉、柏苗木及多种松树的针叶,樟子松苗木和大树均可受害。何秉章[1]等人首次在黑龙江省帽儿山林场的樟子松上发现病害症状,经鉴定该病害由两种病原菌引起,即拟盘多毛孢属Pestalotiopsissp.和截盘孢Truncatellasp.真菌。近年来,随着樟子松栽植面积不断扩大,樟子松赤枯病的危害越来越严重,不仅引起针叶枯死,树势减弱,而且引起林产品品质下降,造成重大经济损失。据王桂珍[2]调查,辽宁省沈阳东陵铁路林场一年生樟子松苗发病率30% 以上,重者苗木枯死,对苗木生产威胁很大。目前该病害主要靠化学防治来控制,但因容易造成环境污染而受到限制,寻找科学的防治方法是亟待解决的新问题。近年来随着防治技术的迅速发展,森林植物病害的生物防治技术在生产上受到广泛重视。以细菌、放线菌和真菌为生物源的生物防治[3-5],对土传病害、叶部病害和枝干病害均取得了较好的防治效果。真菌病害生防制剂已经开发成商品并大面积推广应用的有木霉,线虫病害的生防菌有厚垣轮枝霉、淡紫拟青霉等。为寻找控制樟子松赤枯病具有开发价值的生防菌株,作者进行了从樟子松叶上分离并筛选拮抗菌株的研究。
1 材料与方法
1.1 供试材料 樟子松赤枯病病原菌柠檬拟盘多毛孢Pestalotiopsiscitrina(MeAipine)Nag Raj从哈尔滨帽儿山实习林场的樟子松病叶上分离得到,保存于东北林业大学林学院森林病理实验室。植物材料为帽儿山实习林场的樟子松1~3年生针叶。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1000 mL,pH自然,121 ℃高压灭菌30 min[6]。
1.2 叶栖真菌分离及纯化 将健康的1年生、2年生和3年生樟子松针叶剪成0.5 cm左右的小段,用纱布包起放入漂白粉(1∶14)消毒液中消毒30 s,取出用无菌水漂洗3次,用吸水纸吸干。接至PDA培养基上,每皿5段,放入25 ℃培养箱中避光培养。每个处理6次重复。
当接种材料周围生出明显的菌丝时,采用尖端菌丝挑取法和单孢分离法[6-7]挑取形态不同的菌落,接入PDA培养基内,20~25 ℃避光培养。最后转到PDA斜面保存,用以进一步鉴定及后续试验。
1.3 形态鉴定 将分离、纯化所得的真菌接种在PDA培养基上,25 ℃培养数日后,对已经产孢的真菌,直接挑取孢子,制成水载片;产生子实体的真菌做徒手切片,制成水载片;在显微镜下观察子实体、分生孢子梗、产孢细胞以及孢子的形态特征,结合其培养特性及菌落特征,参考相关真菌分类资料进行形态学鉴定[8-10]。
1.4 樟子松赤枯病病原菌的拮抗菌筛选 拮抗菌株初筛采用平板对峙法[11]。将培养8 d的病原菌、11种内生真菌,用7 mm打孔器切取等质量的菌饼,采用两点对峙法,分别接至PDA培养基的中心两侧,两点相距4 cm,一侧接入病原菌,另一侧接入待测的内生真菌菌株;以接7 mm的水琼脂的菌饼与病原菌的为对照;放入25 ℃培养箱中避光培养。每个处理重复5次。24 h后测量,每24 h测量1次。每日记录、观察11种待测菌株与病原菌的生长情况。并分别测量记录内生真菌菌株指向病原菌的半径、病原菌指向内生菌菌株的半径以及对照病原菌的半径,5 d 后开始计算内生菌菌株对病原菌的抑制率。若两菌落相交,要观察并记录内生真菌菌株对病原菌的抑制、包围,以及病原菌对拮抗菌株包围、侵占的反作用。抑菌率的计算公式如下:
相对抑菌率(%)=(病原菌对照菌落半径-病原菌菌落指向对峙菌的半径)÷病原菌对照菌落半径×100
被抑菌率(%)=(拮抗菌菌落半径-与病原菌对峙菌的趋向半径)÷拮抗菌菌落半径×100
根据参考文献[12]的拮抗系数、抑菌率和被覆盖程度筛选出适合的生防菌株。拮抗系数的分级标准见表1。
2 结果与分析
2.1 叶栖真菌群落组成 经形态学鉴定,从校园健康樟子松针叶上分离到的叶栖真菌共25种,其中,子囊菌3种为血红毛壳Chaetomiumcruentum、印度毛壳C.indicum和散囊菌Eurotiumsp.,接合菌1种为根霉Rhizopussp.,其余21种为半知菌,以Penicilliumsp.,Alternariasp.,Paecilomycessp.和Pestalitioposissp.为优势种,分离率依次为19.7%,15.2%,15.5%和10%,这些优势种在不同年龄的针叶上分离频率差异较大(表2)。
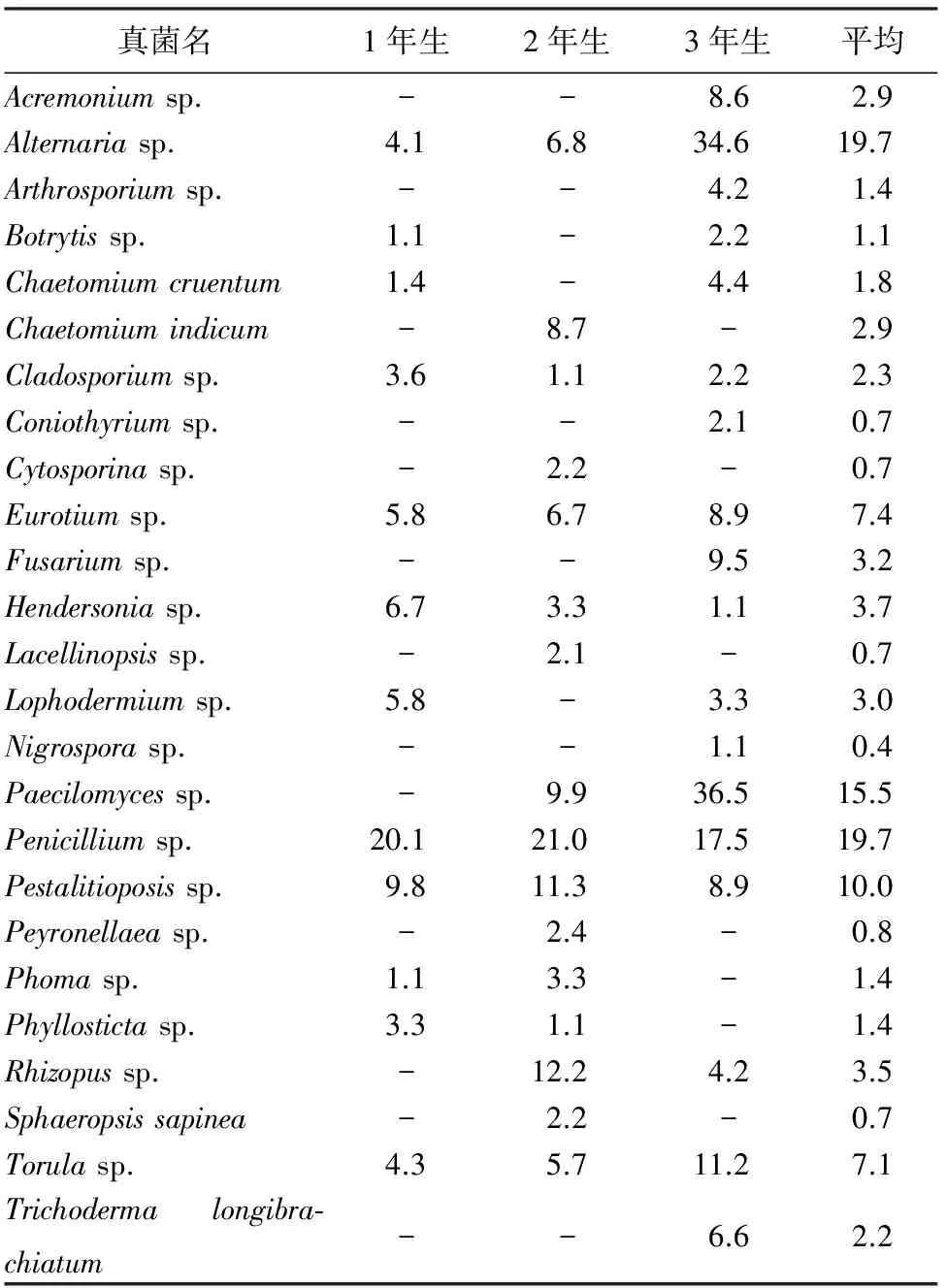
表2 樟子松叶栖真菌分离率 %
注:-表示没有分离到该菌株。
樟子松针叶真菌群落物种较丰富,1年生的针叶分离鉴定出真菌12种,2年生针叶上的真菌16种,3年生针叶上的真菌18种。不同年龄松针上真菌组成和分离频率差异也较大,随着针叶年龄增加真菌种类增多。在不同年龄针叶上,叶栖真菌共有6种,占总数的28%,为链格孢属、芽枝霉属、散囊壳属、青霉属、拟青霉属和色串孢属。共有属(种)链格孢属、散囊壳属和色串孢属真菌随针叶年龄增大分离率逐渐增大,共有属(种)青霉和拟盘多毛孢属的真菌随针叶年龄增大分离到的次数减少,共有属(种)芽枝霉属从针叶中分离到的次数由大到小依次为:1年生,3年生,2年生。1年、2年生的针叶青霉属真菌排第1位,3年生的针叶拟青霉属真菌排第1位。
2.2 拮抗真菌筛选 从分离、纯化的真菌中选出11种真菌与樟子松赤枯病病原菌柠檬拟盘多毛孢Pestalotiopsiscitrina对峙培养,结果见表3。这11种真菌对柠檬拟盘多毛孢菌丝体均有不同程度的抑制作用,其中长枝木霉TrichodermalongibrachiatumKM菌株3 d后将病原菌完全覆盖,完全占领了病原菌全部营养空间,拮抗系数和覆盖率都达到最高。血红毛壳和印度毛壳在4 d后对柠檬拟盘多毛孢的抑制作用逐渐增强,有明显的抑菌带,用抑菌率、拮抗系数和覆盖率3个指标来评价血红毛壳比印度毛壳的抑菌效果更明显。散囊菌属Eurotiumsp.和链格孢属Scytalidiumsp.不但对柠檬拟盘多毛孢产生拮抗作用较小,反而被柠檬拟盘多毛孢所抑制,说明这两种生防菌没有抑制病原菌的作用,反而能在一定程度上促进病原菌菌丝的生长。在柠檬拟盘多毛孢的自我对峙中,发现柠檬拟盘多毛孢并没有相互融合,而是自我抑制,出现明显的抑菌带,并且抑制效果也相对较为明显。而青霉Penicilliumsp.、拟盘多毛孢Pestalotiopsissp.、茎点霉Phomasp.、枝顶孢Acremoniumsp.、座壳孢Dichomerasp.和盾壳霉Coniothyriumsp.对柠檬拟盘多毛孢的抑制效果不明显,抑菌率较低。
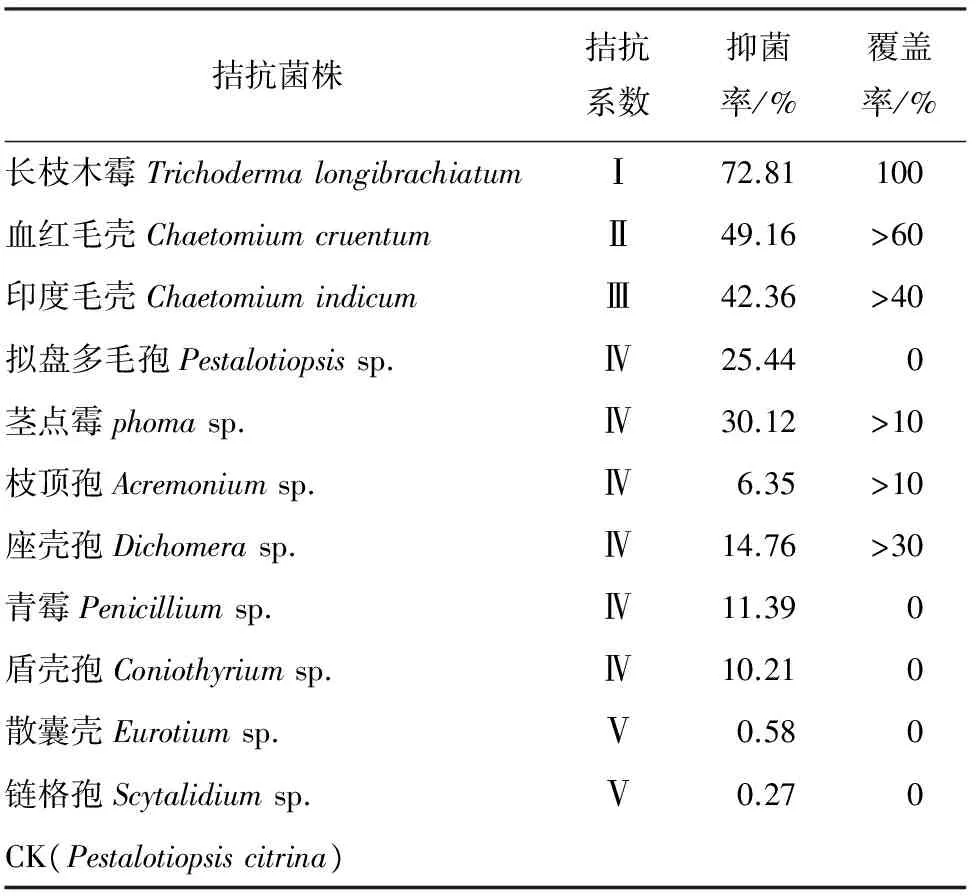
表3 拮抗菌株与樟子松赤枯病病原菌对峙培养8 d的抑菌率、覆盖程度
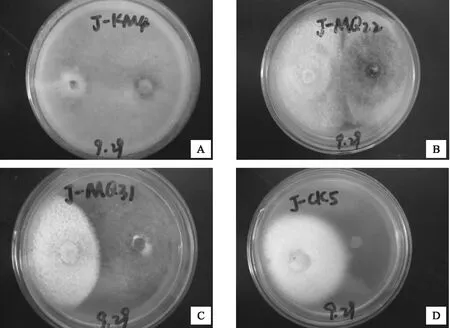
A.病原菌与长枝木霉对峙结果;B.病原菌与印度毛壳对峙结果;C.病原菌与血红毛壳对峙结果;D.对照图1 重要接抗菌与病原菌平板抑制图
综合上述结果,从11种生防菌与病原菌的平板对峙试验中选出3种能够有效抑制樟子松赤枯病病原菌的真菌:长枝木霉、血红毛壳和印度毛壳。其中长枝木霉对病原菌菌丝的抑制效果最强,抑制率为72.81%,其次为血红毛壳、印度毛壳,抑制率分别为49.16%和42.36%,这3种真菌对病原菌的抑制率均在40%以上。3种真菌形态特征见图2~4。
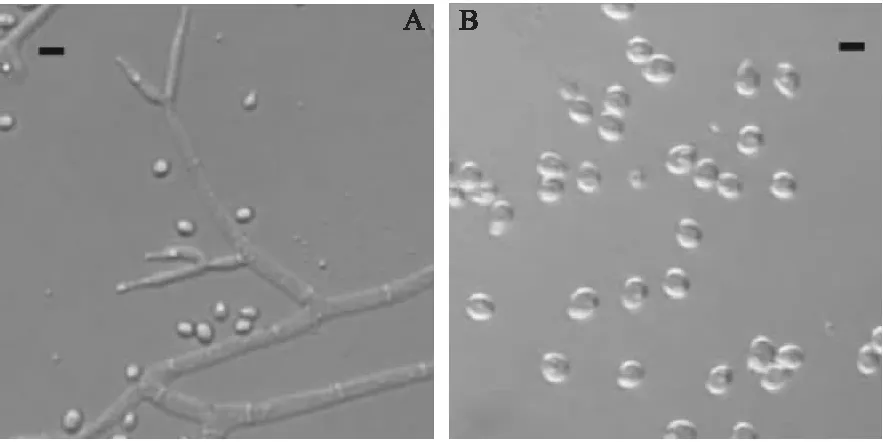
A.分生孢子梗和分生孢子;B.分生孢子;标尺=10μm图2 长枝木霉形态特征

A.子囊果和附属丝;B.子囊;C、D.子囊孢子;标尺=10μm图3 印度毛壳形态特征

A.子囊果上的附属丝;B.子囊;C.子囊孢子;标尺=10μm图4 血红毛壳形态特征
3 结论与讨论
从樟子松针叶上共分离出叶栖真菌25种,其中,半知菌21种,子囊菌3种,接合菌1种,优势种为Penicilliumsp.、Alternariasp.、Paecilomycessp.和Pestalitioposissp.。各年龄针叶共有6属(种),这6个属(种)呈现不同的变化规律。
从11种叶栖真菌与病原菌的对峙培养中,筛选出具有开发价值的优良生防菌株。根据生防菌对病原菌的抑菌率、拮抗系数和覆盖程度等指标进行综合评价,最终确定的可以有效抑制樟子松赤枯病病原菌的拮抗菌株为长枝木霉Trichodermalongibrachiatum、血红毛壳Chaetomiumcruentum和印度毛壳C.indicum。
本研究表明:木霉属T. sp.和毛壳属C. sp.真菌对樟子松赤枯病病原菌有明显的抑制作用,为后续研究该病的林间生物防治和抑菌活性物质的筛选奠定了基础。
[1] 何秉章,高玉海,姜俊清,等.樟子松主要病害和防治[M].哈尔滨:黑龙江朝鲜民族出版社,1993:97-98
[2] 王桂珍.樟子松苗木上的一种新病害——樟子松黑点枯针病[J].辽宁林业科技,1983(Z1):41-42.
[3] 李兴龙,李彦忠.土传病害生物防治研究进展[J].草业学报,2015,24(3):204—212.
[4] 朱玥妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2012,40(34):16635-16638.
[5] 童晓茹,王学翠,温学森,等.植物叶片真菌病害生物防治的研究进展[J].山东科学,2008,21(1):41-46.
[6] 方中达.植病研究方法[M].3版. 北京:中国农业出版社,1998:16.
[7] 李顺鹏.微生物学实验指导[M].北京:中国农业出版社,2003:12-13
[8] 巴尼特 亨特.半知菌属图解[M].北京:科学出版社,1977:90-91.
[9] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:566-570.
[10]KIFFER E,MORELRT M.The deuteromycetes.Mitosporic fungi:classification and generic keys [J].Deuteromycetes,1999.
[11]徐涛.苹果树皮内生真菌的分离及其对腐烂病的生防作用[D].保定:河北农业大学,2012.
[12]刘秀薇,刘雪峰,王鹏,等.利用三种梢栖真菌生物防治落叶松枯梢病的研究[J].林业科学研究,2012,25(6):685-690.
ScreeningofantagonisticfungiofPinussylvestrisvar.mongolicaredblight/
XU Yang,et al.
(Agricultural Research Institute of The Fourth Division of Xinjiang Production and Construction Corps,yining 835000,China)
Twenty-five species of fungi were isolated from healthy needles ofPinussylvestrisvar.mongolica,and of which 11 species with biocontrol potential were tested for screening the antagonistic against the pathogen of red blight inPinussylvestrisvar.mongolica.The result of confrontation test showed thatTrichodermalongibrachiatum,ChaetomiumcruentumandC.indicumcould effectively inhibite the growth of the pathogen,among them,T.longibrachiatumhad the highest antagonistic effect on the pathogen hypha,its inhibiting rate was 72.81%,followed byC.cruentumandC.indicum,which were 49.16% and 42.36% respectively.
Pinussylvestrisvar.mongolicared blight;pathogen;antagonistic fungi;restrained rate
2016-05-25;
2016-07-15
新疆兵团第四师科技项目(2016)“伊犁地区地下真菌的筛选与块菌(松露)的引种栽培”
徐阳(1988—),女,助理研究员,硕士,主要从事林果病虫害及森林病理学方面的研究,E-mail:31476214@qq.com
刘雪峰,研究员,主要从事森林病理学及真菌分类方面的研究,E-mail:liuxuefeng63@sina.com。
S763.15
A
1671-0886(2017)03-0001-04
(责任编辑 杨静莉)

