热应激初期肉兔血象指标及与耐热时间的相关性研究
李丛艳,李 娟,邝良德,梅秀丽,郭志强,雷 岷,谢晓红*
(1.四川省畜牧科学研究院,四川成都 610066;2.动物遗传育种四川省重点实验室,四川成都 610066;3.成都市农林科学院畜牧研究所,四川成都 611130)
热应激初期肉兔血象指标及与耐热时间的相关性研究
李丛艳1,2,李 娟3,邝良德1,2,梅秀丽1,2,郭志强1,2,雷 岷1,2,谢晓红1,2*
(1.四川省畜牧科学研究院,四川成都 610066;2.动物遗传育种四川省重点实验室,四川成都 610066;3.成都市农林科学院畜牧研究所,四川成都 611130)
试验旨在研究热应激初期肉兔血象指标与耐热时间的关系,为筛选肉兔耐热性候选评价指标提供参考。选取同期出生、体重相近的健康4月龄新西兰兔55只,随机分配在(21±1)℃适温和(38±1)℃高温环境中,记录每只兔的耐热时间,并在热应激起始(HS0)和8 h(HS8)时采集血液,测定血象指标及其变化(△HS)情况。结果表明:热应激极显著影响HS8的中性粒细胞百分比(NEUT%)、中性粒细胞/淋巴细胞(N/L)、淋巴细胞百分比(LYMPH%)(P<0.01),显著影响白细胞计数(WBC)、LYMPH%、N/L及平均红细胞血红蛋白浓度(MCHC)的△HS(P<0.05),极显著影响血小板(PLT)、NEUT%、淋巴细胞计数(LYMPH#)以及单核细胞计数(MONO#)的△HS(P<0.01);HS0时的嗜酸性粒细胞百分比(EO%)、嗜酸性粒细胞计数(EO#)及单核细胞百分比(MONO%)的△HS与耐热时间呈极显著正相关(P<0.01),MONO#的△HS与耐热时间呈显著正相关(P<0.05)。推测EO%、EO#以及MONO#可能是重要的耐热性评价候选指标。
热应激;血象指标;耐热时间;肉兔
肉兔全身被毛且几乎没有功能性汗腺,当夏季环境温度较高时难以消除体内多余的热量,非常容易出现热应激,导致代谢功能紊乱,采食量下降,饲料利用率降低,生长速度和机体抵抗力下降,公、母兔繁殖性能降低等[1],是炎热季节和地区肉兔生产的主要限制因素。前人研究表明,家兔对炎热的耐受力受遗传因素制约,可能是一个数量性状,使得通过培育耐热肉兔品系以提高兔自身耐热力、从根本上消除兔的热应激成为可能[2-3]。血液是机体运输营养物质和代谢产物的载体,是反映机体状况的重要指标。研究发现,血液红细胞钾、皮质酮、三碘甲状腺原氨酸、异嗜性粒细胞与淋巴细胞比值、T淋巴细胞亚群、球蛋白、碱性磷酸酶和超氧化物歧化酶等指标与牛[4]、羊[5-6]、鸡[7-10]、兔[11]等的耐热性有关。然而,尚未发现血象指标与畜禽耐热性关系的研究。本试验旨在研究热应激初期肉兔血象指标的变化及与耐热性的关系,为建立肉兔耐热性评价指标提供理论依据。
1 材料与方法
1.1 试验设计 选择同期出生、体重为(2 313±273)g的健康4月龄新西兰兔55只,随机分配在2个人工温控室内,并采用智能温湿度记录仪(APRESYS,179-TH)测定实时温湿度。其中适温组(N=25,公兔11只,母兔14只)采用空调降温,人工加湿,环境温度为(21±1)℃;热应激组(N=30,公母各半)采用暖风加热,自动控温,人工加湿,环境温度为(38±1)℃。预试期5 d,所有兔只均处于适温环境中,试验一直持续到热应激组所有兔只死亡。试验于2015年7月在四川省畜牧科学研究院种兔场温控室内进行,兔自由饮水和采食,饲养管理条件一致(日粮主要营养水平为粗蛋白16.0%,粗纤维14.0%,消化能10.50 MJ/kg)。
1.2 测定指标和方法
1.2.1 血样收集与处理 在热应激起始(HS0)和热应激8 h(HS8)时所有兔只均采集全血2 mL/只,EDTA抗凝,-20℃保存待测。
1.2.2 血象指标测定 血液样品在成都中医药大学第三附属医院检验科使用SYSMEX(西森美康)XS-500i全自动血球分析仪及其配套试剂进行测定,测定的血象指标:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白浓度(HGB)、血小板计数(PLT)、红细胞压积(HCT)、中性粒细胞百分比(NEUT%)、淋巴细胞百分比(LYMPH%)、中性粒细胞/淋巴细胞(N/L)、单核细胞百分比(MONO%)、嗜酸性粒细胞百分比(EO%)、嗜碱性粒细胞百分比(BASO%)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞体积分布宽度标准差(RDW-SD)、红细胞体积分布宽度变异系数(RDW-CV)、血小板压积(PCT)、血小板体积分布宽度(PDW)、平均血小板体积(MPV)、大血小板比率(P-LCR)、中性粒细胞计数(NEUT#)、淋巴细胞计数(LYMPH#)、单核细胞计数(MONO#)、嗜酸性粒细胞计数(EO#)、嗜碱性粒细胞计数(BASO#)等血象指标。
1.2.3 耐热时间测定 通过人工观察,准确记录热应激组中每只兔的死亡时间,以正式试验开始为起点计算出每只兔在高温环境下的存活时间,即兔的耐热时间。
1.3 统计分析 利用SPSS17.0软件中的一般线性模型(GLM)程序进行方差分析,模型中包括性别效应,结果用最小二乘均值±标准误表示。同时利用软件中简单相关分析模型(CORR)程序进行血象指标与耐热时间的相关性分析。
2 结 果
2.1 热应激初期肉兔血象指标的变化 由于HS8时热应激组已经有2只兔死亡,因此HS8时统计数据为28只。由表1可见,热应激8 h时大多数血象指标无显著变化(P<0.05)。与适温组相比,WBC、PLT、MCHC以 及 MONO#在 HS0和 HS8的组间差异均不显著,而其在热应激0~8 h的变化值(△HS)在组间的差异均达到显著(P<0.05)或极显著水平(P<0.01),表明热应激显著或极显著影响WBC、MCHC及MONO#的△HS;热应激组HS8的NEUT%及N/L极显著高于HS0时以及适温组在HS0和HS8时的值(P<0.01),其△HS的组间差异也达到显著(P<0.05)或极显著水平(P<0.01),表明热应激显著升高HS8的NEUT%及N/L;热应激组HS8时的LYMPH%及LYMPH#极显著低于HS0(P<0.01),且极显著低于HS0和HS8时适温组的值(P<0.01),其△HS的组间差异达到显著水平(P<0.05),表明热应激显著影响LYMPH%及LYMPH#。尽管RBC和RDW-CV的组间差异显著,但可以看出,HS0的热应激组和适温组间差异不显著(P>0.05),HS8时的热应激组和适温组间差异不显著(P>0.05),热应激组与适温组在HS0和HS8之间的差异均不显著(P>0.05),且其△HS无显著组间差异,表明热应激对RBC和RDW-CV无显著影响。
2.2 肉兔血象指标及其变化值与耐热时间的相关分析 由表2可知,HS0的EO%以及EO#与肉兔的耐热时间呈极显著正相关(P<0.01);MONO%在热应激0~8 h的△HS与耐热时间呈极显著正相关(P<0.01);MONO#在热应激0~8 h的△HS与耐热时间呈显著正相关(P<0.05);其余血象指标与肉兔耐时间无显著相关(P>0.05)。
3 讨 论
血象是指血液的一般检验(以往称为血常规检查)的结果,是对外周血中血液细胞数量和质量的化验检查,是用以评判机体状态、诊断病情的常用辅助检查手段之一。
红细胞、血红蛋白是血液运送氧气的最主要的媒介。本研究中,外周血RBC、HGB、HCT、MCV、MCH、RDW-SD、RDW-CV在热应激前后均无显著变化,仅MCHC在0~8 h的△HS显著高于适温组,但总体呈下降趋势,这与Khalil等[12]发现热应激1 h对新西兰公兔及布拉迪红公兔的RBC、Hb、HCT均无显著影响的结果一致,这可能是由于炎热条件下,机体的代谢产热降低,导致需氧量降低引起,而需氧量的降低在维持体热平衡中具有重要作用。但由于测定时间较短,血象指标尚未出现显著变化。Seley于1960年发现热应激会降低促肾上腺皮质激素(ACTH)水平,进而降低RBC、Hb以及PCV。本研究结果与Okab等[13]发现的夏季热应激引起成年新西兰公兔RBC、Hb、HCT、MCHC显著或极显著降低的结论不一致,但总体趋势相同。此外,Ondruska等[14]研究发现,持续1个月、每天12 h的(36±3)℃的热应激处理条件下新西兰成年公母兔在热应激后RBC与HCT均显著降低,生长公、母兔RBC与HCT在热应激前后无显著变化,但仍有下降趋势,与本试验结果相同或趋势一致。进一步的相关分析表明,RBC、HGB、HCT、MCV、MCH、RDW-SD、RDW-CV与肉兔的耐热时间均无显著相关,表明它们与肉兔的耐热性关系不大,不适宜作为肉兔耐热性评价指标。
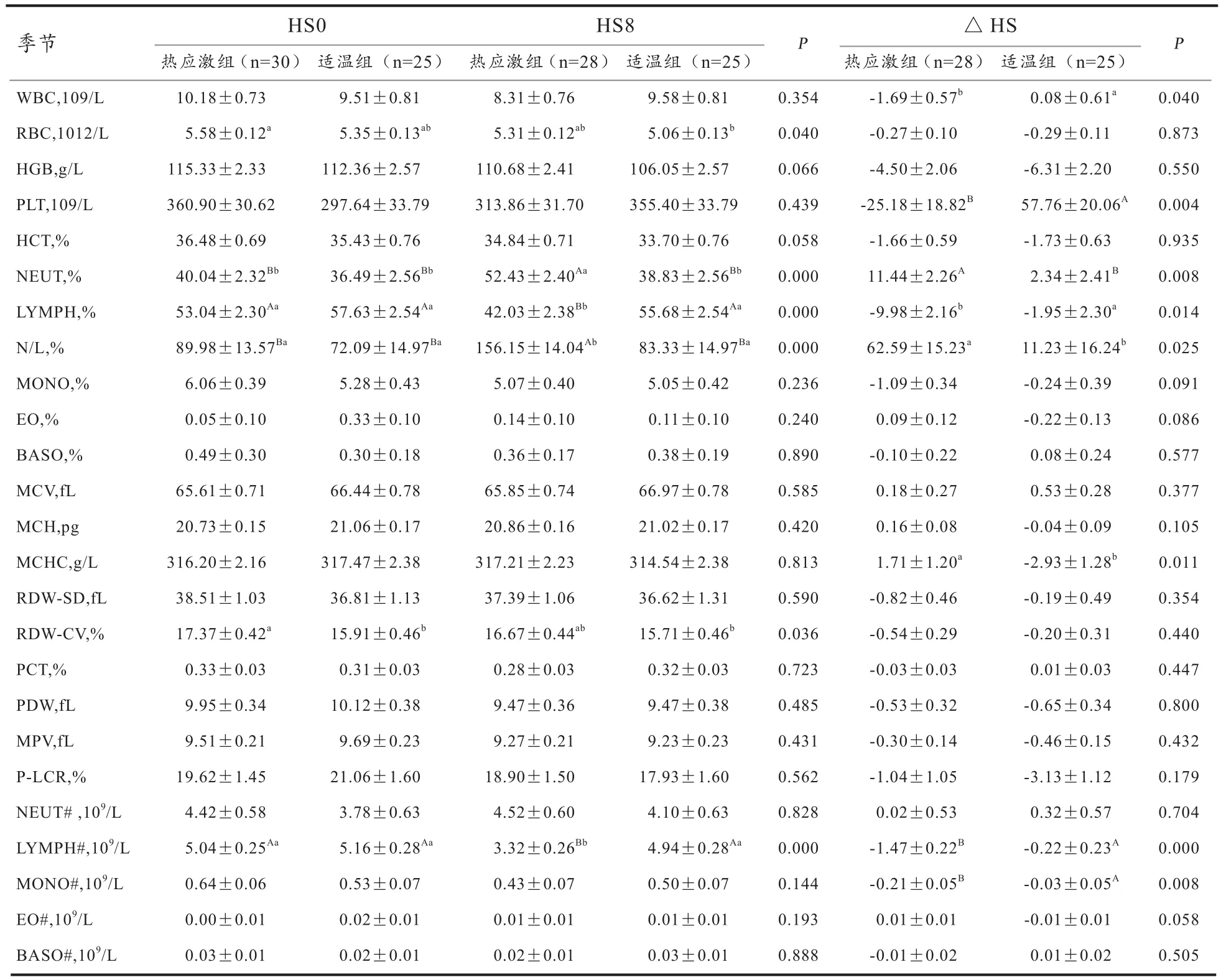
表1 热应激初期肉兔血象的变化
血小板是最小的血细胞,可以通过多种应激被激活从而发挥作用,MPV、PDW和P-LCR等参数可简单快捷地反映血小板的形态变化,显示其活化程度。本研究中热应激对PCT、PDW、MPV以及P-LCR均无显著影响,表明热应激不能显著激活血小板。热应激8 h的PLT与0 h以及适温组相比均无显著差异,但其0~8 h的△HS极显著低于适温组,这可能是由于热应激引起血小板凝集,从而降低外周血中血小板数量。Denise等[15]对人的研究结果表明,热应激(运动或被动加热引起)使得血小板数量上升,这一结果与本研究结果不同,可能是由于物种的差异引起。本试验中,相关分析表明PLT、PCT、PDW、MPV以及P-LCR与肉兔耐热时间均无显著相关,表明它们不能反映肉兔的耐热性能,不宜用作耐热性评价指标。
白细胞主要作用是吞噬细菌、防御疾病,一般以白细胞计数和白细胞分类计数表示。Redwine等[16]研究表明,应激或应激激素(儿茶酚胺类和糖皮质激素类)会引起血液中WBC以及相对含量的显著变化。本研究中发现,热应激极显著降低8h时的LYMPH%及LYMPH#,极显著升高8 h的NEUT%以及N/L,且热应激组WBC和LYMPH%以及LYMPH#和MONO#的△HS均显著或极显著低于适温组,而NEUT%以及N/L显著或极显著高于适温组。本研究结果与Dhabhar等[17]发现应激引起WBC降低,LYMPH%显著降低、NEUT%显著升高的结果一致,与Okab等[13]发现的新西兰公兔在夏季热应激季节的WBC值极显著高于春季的结果相反,而与Khalil等[12]及Ondruska等[13]的研究结果呈部分一致、部分相反的结论,推测这可能是由于家兔的品种、性别、年龄以及热应激方式(急性和慢性)的不同引起的。本试验中,进一步的相关分析表明,热应激0 h时的EO%(r=0.523)及EO#(r=0.521)与肉兔耐热时间呈极显著正相关,MONO%(r=0.482)及MONO#(r=0.441)在热应激0~8 h的△HS与肉兔耐热时间呈极显著或显著正相关。热应激期间机体维持体内生化指标的稳定是耐热的基础[18]。本研究的方差分析结果表明,热应激对EO%及EO#均无显著影响,说明EO%和EO#在热应激条件下较为稳定,可能是肉兔耐热性评价候选指标之一;热应激对MONO%及其△HS均无显著影响,其△HS与耐热时间的显著相关无实际意义,因此MONO%在热应激0~8 h的△HS不适宜作为耐热性候选指标;而热应激对MONO#在0~8 h的△HS有极显著影响,且其△HS与耐热时间呈显著相关,表明MONO#的△HS与耐热时间的相关意义较大,可以作为耐热性候选指标之一。
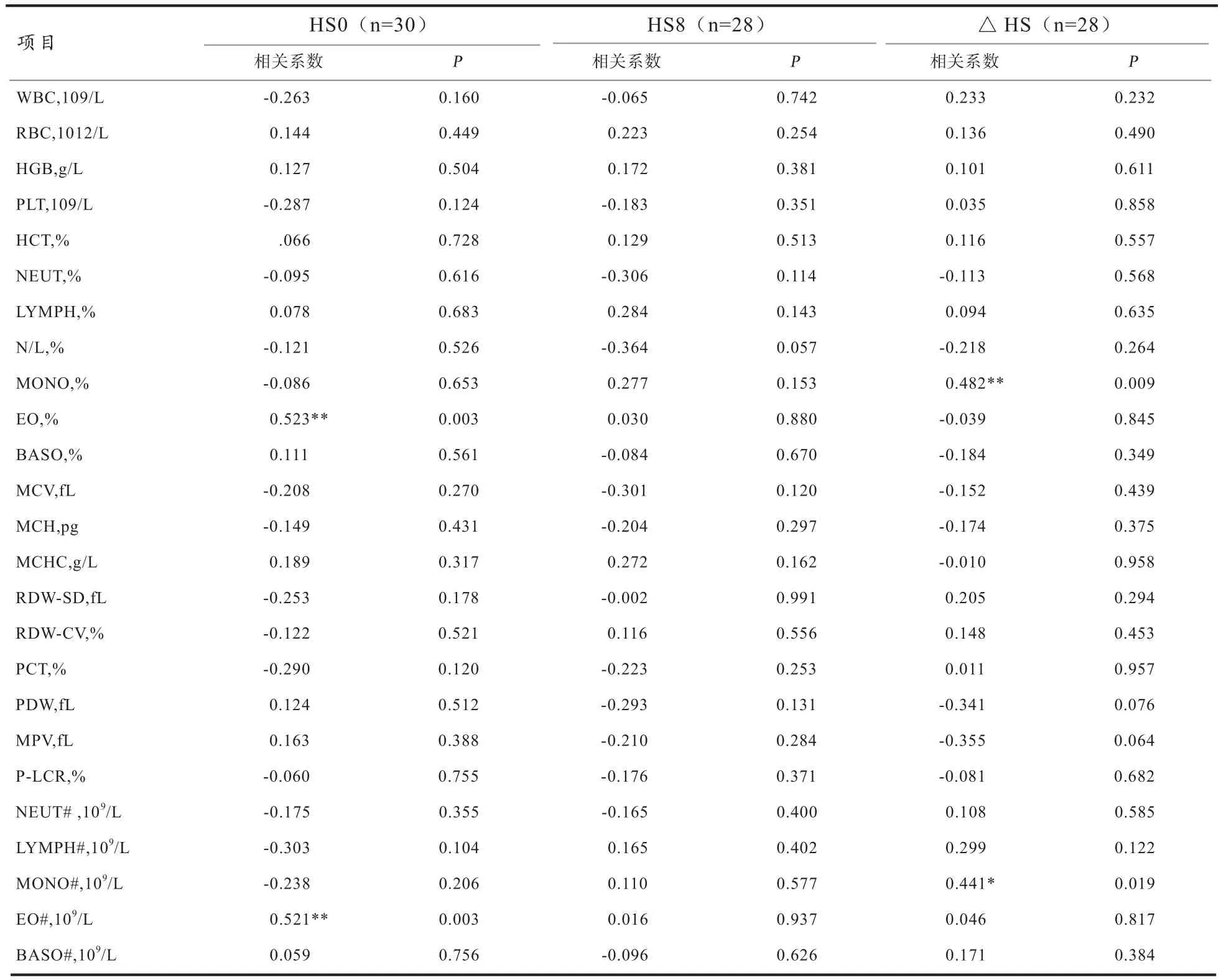
表2 肉兔血象指标与耐热时间的相关
4 结 论
通过对(38±1)℃条件下肉兔血象指标的变化分析结果表明,热应激极显著升高HS8时的NEUT%和N/L,极显著降低LYMPH%,显著或极显著影响 WBC、PLT、LYMPH%、LYMPH#、MONO#、NEUT%、N/L以及MCHC的△HS。相关分析结果发现,HS0的EO%、EO#以及MONO#的△HS与耐热时间的正相关具有实际意义,推测EO%、EO#以及MONO#可能是重要的耐热性评价候选指标。
[1]Marai I F M, Habeeb A A M, Gad A E. Rabbits'productive,reproductive and physiological performance traits as affected by heat stress: a review[J]. Livest Prod Sci, 2002,78(2): 71-90.
[2]McNitt J I, Lukefahr S D, Cheeke P R,et al. Rabbit Production[M]. Oxfordshire: CABI Publishing, 2009:59-60.
[3]Kasa W, Thwaites C J. The effects of elevated temperature and humidity on rectal temperature and respiration rate in the New Zealand white rabbit[J]. Int J Biometeorol, 1990,34(3): 157-160.
[4]Evans J. Adaptation to subtropical environments by Zebu and British breeds of cattle in relation to erythrocyte characters[J].Aust J Agr Res, 1963, 14(4): 559-571.
[5]Evans J V. Electrolyte concentrations in red blood cells of British breeds of sheep[J]. Nature, 1954, 174(4437): 931-932.
[6]Evans J V, Mounib M S. A survey of the potassium concentration in the red blood cells of British breeds of sheep[J]. J Agric Sci, 1957, 48(04): 433-437.
[7]Star L, Nieuwland M G, Kemp B,et al. Effect of single or combined climatic and hygienic stress on natural and specific humoral immune competence in four layer lines[J]. Poult Sci, 2007, 86(9): 1894-1903.
[8]Tao X, Zhang Z Y, Dong H,et al. Responses of thyroid hormones of market-size broilers to thermoneutral constant and warm cyclic temperatures[J]. Poult Sci, 2006, 85(9):1520-1528.
[9]Hammami M M, Bouchama A, Shail E,et al. Lymphocyte subsets and adhesion molecules expression in heatstroke and heat stress[J]. J Appl Physiol, 1998, 84(5): 1615-1621.
[10]Gross W B, Siegel H S. Evaluation of the Heterophil/Lymphocyte Ratio as a Measure of Stress in Chickens[J].Avian Diseases, 1983, 27(4): 972-979.
[11]李丛艳, 梅秀丽, 李娟, 等. 肉兔耐热性评价指标的初步研究[J]. 中国畜牧杂志, 2016, 52(23): 89-92.
[12]Khalil H A, Yaseen M A, Hamdy A M M. Behavioral activities, physiological body reactions, hematological parameters and hormonal profiles for bucks of new zealand white and baladi red rabbits exposed to short term of high temperature[J]. Asian J Poult Sci, 2015, 9(4): 191-202.
[13]Okab A B, El-Banna S G, Koriem A A. Influence of environmental temperatures on some physiological and biochemical parameters of New-Zealand rabbit males[J].Slovak J Anim Sci, 2008, 41: 12-19.
[14]Ondruska L, Rafay J, Okab A B,et al. Influence of elevated ambient temperature upon some physiological measurements of New Zealand White rabbits[J]. Vet Medczech, 2011, 56(4): 180-186.
[15]Denise L S, Pamela M B, Andrew M M,et al. Platelet Function and Coagulation During and Following Heat Stress[J]. FASEB J, 2007, 21(6): A1127.
[16]Redwine L, Snow S, Mills P,et al. Acute psychological stress: effects on chemotaxis and cellular adhesion molecule expression[J].Psychosom Med, 2003, 65(4): 598.
[17]Dhabhar F S, Miller A H, Mcewen B S,et al. Effects of stress on immune cell distribution. Dynamics and hormonal mechanisms[J]. J Immunol, 1995, 154(10):5511-5527.
[18]姜润深, 夏文涛, 陈兴勇, 等. 利用热应激初期血清生化指标的变化幅度评价鸡的耐热性能[J]. 中国农业大学学报, 2011, 16(2): 114-117.
S829.1
A
10.19556/j.0258-7033.2017-12-111
2017-07-26;
2017-09-12
四川省公益性科研院所基本科研业务费项目(SASA 2017A02);四川省“十三五”畜禽畜种攻关项目(2016NYZ00 46);国家兔产业技术体系(CARS-43-D-3);四川省财政运行专项(SASA2014CZYX005)
李丛艳(1983-),女,湖南邵阳人,硕士,助理研究员,主要从事家兔遗传育种研究,E-mail:licongyan0311@sina.com
*通讯作者:谢晓红(1964-),女,研究员,主要从事家兔育种与饲养管理研究,E-mail:xiexiaohongl@sina.com

