青苔和大叶藻对刺参生长性能及免疫指标的影响
路晶晶 郭 冉* 赵春龙 崔兆进 夏 辉 解 伟 王美雪 杨品贤
(1.河北农业大学海洋学院,秦皇岛 066000;2.河北省海洋与水产科学研究院,河北省海洋生物资源与环境重点实验室,秦皇岛 066000)
青苔和大叶藻对刺参生长性能及免疫指标的影响
路晶晶1郭 冉1*赵春龙2崔兆进2夏 辉1解 伟1王美雪1杨品贤1
(1.河北农业大学海洋学院,秦皇岛 066000;2.河北省海洋与水产科学研究院,河北省海洋生物资源与环境重点实验室,秦皇岛 066000)
本试验旨在研究青苔和大叶藻对刺参生长性能及免疫指标的影响。试验选取720头平均质量为0.35 g的刺参,随机分为3个组,每个组3个重复,每个重复80头刺参。以青苔、大叶藻和海带为主要藻类蛋白质源,分别制成3种不同配合饲料饲喂刺参,海带组为对照组,青苔组及大叶藻组为试验组。试验期8周。通过评估刺参的生长性能、体壁营养成分、消化酶活性及非特异性免疫指标评价青苔和大叶藻对刺参健康生长的影响。结果表明:青苔组和大叶藻组增重率较对照组分别增加了29.15%和24.13%,饲料系数较对照组降低了10.39%和15.58%,但各组间无显著差异(P>0.05);青苔组和大叶藻组刺参脏壁比、肠重比显著低于对照组(P<0.05),体壁水分含量显著高与对照组(P<0.05);大叶藻组体壁粗灰分含量显著高于青苔组和对照组(P<0.05);青苔组和大叶藻组刺参肠道淀粉酶活性显著低于对照组(P<0.05);青苔组体腔液谷胱甘肽过氧化物酶(GSH-Px)活性显著高于对照组和大叶藻组(P<0.05),过氧化物酶(POD)、超氧化物歧化酶(SOD)和酸性磷酸酶(ACP)活性均高于对照组和大叶藻组,但各组间无显著差异(P>0.05);大叶藻组体腔液碱性磷酸酶(ALP)活性显著低于对照组(P<0.05),与青苔组无显著差异(P>0.05)。由此可见,在本试验条件下,青苔和大叶藻作为饲料原料应用于刺参饲料中是可行的;以生长性能指标为基础,结合抗氧化及非特异性免疫指标,刺参生长效果为青苔组>大叶藻组>海带组。
刺参;青苔;大叶藻;生长性能;非特异性免疫
刺参(Apostichopusjaponicus)属于棘皮动物门(Echinodermata),海参纲(Holothurioider),是我国主要食用海参之一,具有较高的营养和药用价值,曾被誉为“海产八珍”之首。近年来,随着人们生活水平的提高和市场消费需求的增长,刺参需求量不断增加,极大刺激了海参养殖业的发展。海参养殖业的发展,促使海参饲料的研究广受业内人士关注。饲料的优劣直接影响了海参养殖生产的成败。目前海参饲料需求量在不断增加,但是人工配合饲料市场比较混杂,优质原料资源短缺,缺少配方合理、营养全面的优良饲料,这将成为制约海参养殖业发展的一大潜在因素。在刺参养殖中,作为刺参配合饲料的主要原料之一的海带、鼠尾藻、马尾藻等大型海藻需求量逐年攀升,但由于过度开采及水质污染一系列问题,这些优质的海藻资源已经出现供不应求的现象,寻找合适的海藻替代原料成为亟待解决的关键问题之一。青苔,又称青泥苔,是水绵、刚毛藻、双星藻、水网藻等几十种丝状绿藻的总称。池塘内大量的青苔会影响水体指标和水生动物的生长,因此青苔完全被当作池塘危害物对待,清除青苔的办法有人工清除法、化学清除法及生物清除法等[5-6]。但青苔中含有多种有益藻类,其中海青苔多以软红藻、浒苔和扁浒苔组成,干物质中蛋白质含量在7%~8%,营养物质相对稳定。目前海青苔在猪及部分鱼饲料中的应用已有研究并取得了一定效果,其能否作为刺参配合饲料的藻类蛋白质源还有待研究。近年来,大型海藻作为饲料原料广泛应用于水产养殖中,并取得了较不错的效果。大叶藻,学名马尾藻,具有极高的耐盐性,含有磷脂酸胆碱、磷脂酸乙醇胺等成分。大叶藻提取液水相对仿刺参腐皮综合征致病菌及病灶优势菌的研究发现,其有抑菌活性。唐薇等[10]研究发现,浒苔和大叶藻粉混合替代市售藻粉可作为更好的刺参饲料。本试验旨在根据刺参营养水平需要,用廉价的原料青苔、大叶藻替代刺参饲料中高价的原料,设计出经济实惠的饲料配方,以达到促进刺参生长,降低饲料成本的目的。
1 材料与方法
1.1 试验饲料
海带购买于秦皇岛天桥海鲜市场,青苔源自红鳍东方鲀养殖场海参养殖池(晾晒后粉碎),大叶藻购自昌黎县新开口鱼需物资商店。将海带、青苔、大叶藻等主要原料经粉碎机粉碎后,过60目筛,配制饲料,试验饲料组成及营养水平见表1。采用逐级混合法将各原料混合,再于搅拌机(HYJ-30,北京环亚天元机械技术有限公司)中充分混匀,并保存至-20 ℃冰箱中备用。
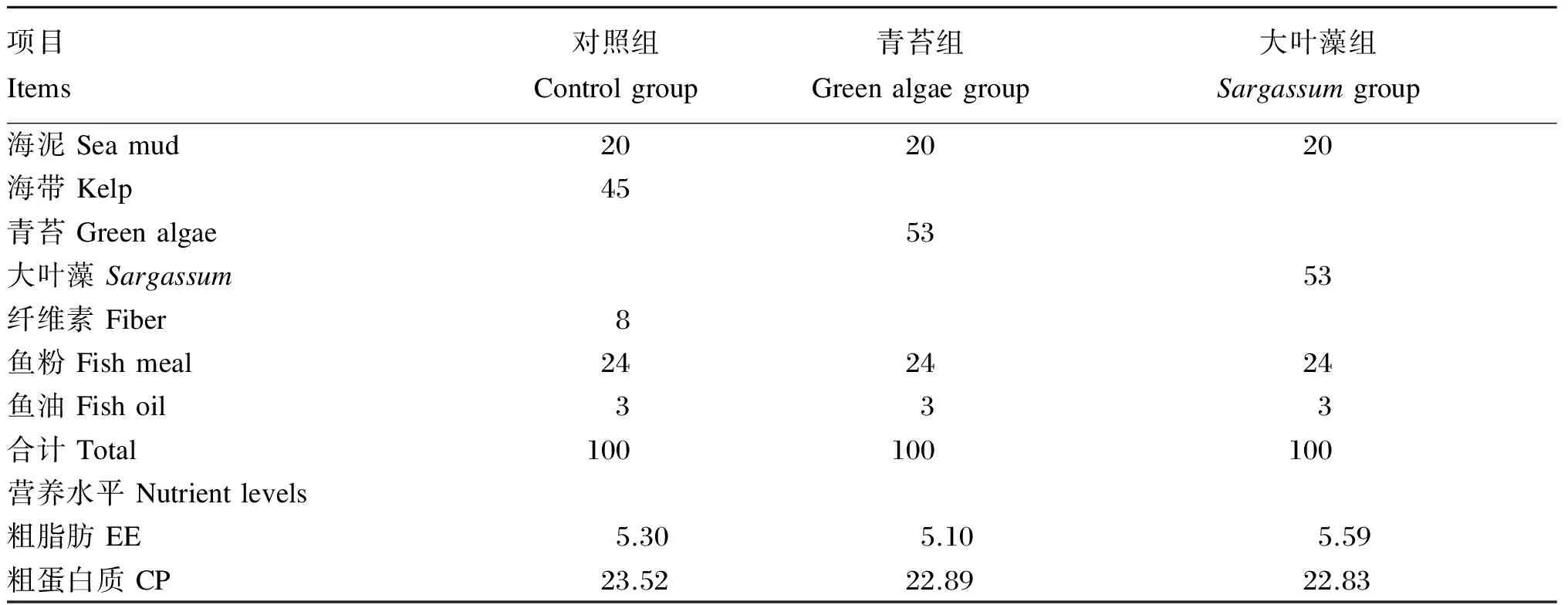
表1 试验饲料组成及营养水平(干物质基础)
1.2 试验设计及饲养管理
试验刺参购于山东省安源水产有限公司。试验前将刺参在水族玻璃缸中暂养2周,以适应养殖环境。随后,随机选取720头(平均质量为0.35 g)大小均匀,体色相近、健康无病的刺参苗进行试验,随机分为3个组,每个组3个重复,每个重复80头刺参,饲养在9个水族玻璃缸(0.4 m×0.5 m×0.6 m)中。试验期间采用避光养殖形式,于每天10:00,按刺参体重量的3%~5%进行投喂。采用经沉淀、过滤后的渤海湾秦皇岛港海域自然海水,水温(17±1) ℃,盐度在30.5~31.5,溶解氧含量保持在7 mg/L以上,pH 8.0±0.2。每天定时吸底换水,换水量为2/3~3/4。观察海参的摄食情况及死亡情况,作好记录。
1.3 样品采集
试验结束后对所有刺参禁食24 h,各组刺参进行计数和称重。每重复取11头刺参分别称重、测体长后,用2.5 mL针管于刺参腹部1/3出抽取体腔液,解剖刺参取出完整的肠道,测量肠道长度,并分别称量肠道和体壁的重量进行肠道指数和脏壁比的计算。刺参体腔液2 500×g离心,取上清液4 ℃保存用于免疫指标的测定;肠道和体壁在液氮中迅速冷冻,取出放于-80 ℃超低温冰箱中保存,用于刺参肠道消化酶活性和体壁营养成分的分析。
1.4 指标测定
刺参的生长性能指标根据以下公式计算:
增重率(weight gain rate,WGR,%)=[(Wt-Wo)/Wo]×100;特定生长率(specificgrowthrate,SGR,%/d) =[(lnWt-lnWo)/t]×100;
蛋白质效率(proteinefficiencyratio,PER,%)=
[(Wt-Wo)/(F×P)]×100;
饲料系数(feed coefficient,FC)=
F/(Wt-Wo);
脏壁比(viscera body wall ratio,%)=
(Wv/Wb)×100;
肠重比(ratio of intestine gut weight to body
weight)=Wv/Wt;
肠长比(ratio of intestine gut length to body
length)=Li/L。
式中:Wo为试验开始时刺参体质量(g);Wt为试验结束时刺参体质量(g);Wv为内脏质量(g);Wi为肠道质量(g);Wb为体壁质量(g);Li为刺参肠道长度(cm);L为刺参长度(cm);F为饲料摄食量(g);P为饲料中蛋白质含量(%);t为试验天数(d)。
刺参体壁营养成分分析:水分含量测定采用105 ℃烘干恒重法获取干物质;粗灰分含量测定采用马弗炉灼烧法(550 ℃);粗蛋白质含量测定采用凯氏定氮法;粗脂肪含量测定采用索氏抽提法。
刺参消化、免疫指标测定:淀粉酶(碘-淀粉比色法)、脂肪酶(比浊法)、胃蛋白酶(福林试剂比色法)、过氧化物酶(酚比色法)、谷胱甘肽过氧化物酶(二硫双硝基苯甲酸法)、总超氧化物歧化酶(黄嘌呤氧化酶法)和磷酸酶活性(铁氰化钾法)的测定均采用南京建成生物工程研究所生产的试剂盒检测。
1.5 数据统计
试验结果采用平均值±标准差(mean±SD)表示,数据统计使用SPSS 17.0分析软件进行单因素方差分析(one-way ANOVA),差异显著性水平为P<0.05。
2 结 果
2.1 不同饲料对刺参生长性能的影响
由表2可知,青苔组和大叶藻组的刺参增重率较对照组分别增加了29.15%和24.13%,但差异不显著(P>0.05);青苔组和大叶藻组的刺参特定生长率、摄食量、蛋白质效率也均高于对照组,但差异不显著(P>0.05);青苔组和大叶藻组的刺参饲料系数较对照组分别降低了10.39%和15.58%,但差异不显著(P>0.05);青苔组和大叶藻组的刺参脏壁比显著低于对照组(P<0.05)。
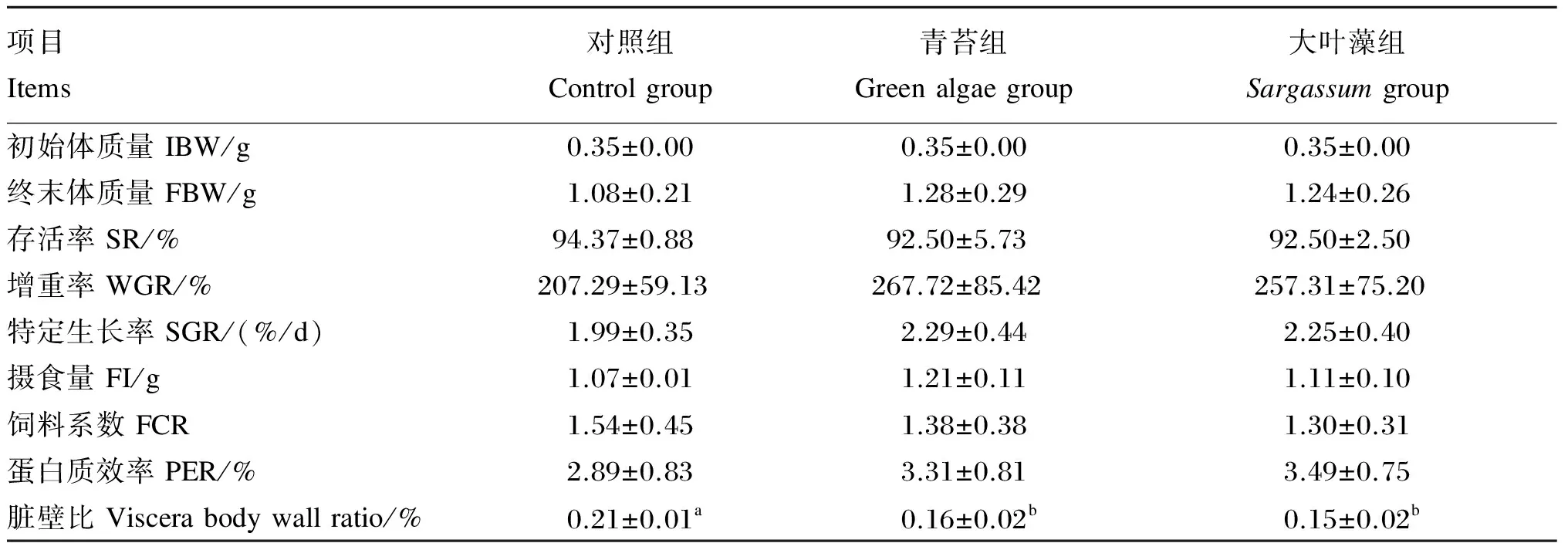
表2 不同饲料对刺参生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 不同饲料对刺参体壁营养成分的影响
由表3可知,青苔组和大叶藻组的体壁水分含量显著高于对照组(P<0.05);青苔组的体壁粗灰分含量与对照组无显著差异(P>0.05),大叶藻组的体壁粗灰分含量显著高于对照组和青苔组(P<0.05);各组间的体壁粗蛋白质和粗脂肪含量无显著差异(P>0.05)。

表3 不同饲料对刺参体壁营养成分的影响
2.3 不同饲料对刺参肠道指数的影响
由表4可知,青苔组和大叶藻组的肠重比显著低于对照组(P<0.05),但2组间无显著差异(P>0.05);各组间肠长比无显著差异(P>0.05)。

表4 不同饲料对刺参肠道指数的影响
2.4 不同饲料对刺参肠道消化酶活性的影响
由表5可知,各组间肠道脂肪酶和蛋白酶活性无显著差异(P>0.05);青苔组肠道淀粉酶活性显著低于对照组(P<0.05),大叶藻组肠道淀粉酶活性显著低于对照组和青苔组(P<0.05)。

表5 不同饲料对刺参肠道消化酶活性的影响
2.5 不同饲料对刺参抗氧化及非特异性免疫指标的影响
由表6可知,青苔组体腔液谷胱甘肽过氧化物酶活性显著高于对照组和大叶藻组(P<0.05);肠道过氧化物酶及体腔液过氧化物酶、总超氧化物歧化酶、酸性磷酸酶活性均高于对照组和大叶藻组,但差异不显著(P>0.05);大叶藻组体腔液碱性磷酸酶活性显著低于对照组(P<0.05),与青苔组无显著差异(P>0.05)。
3 讨 论
3.1 不同饲料对刺参生长性能的影响
饲料的营养成分、诱食性及适口性都是影响动物生长的关键因素[11-12]。朱伟等[13]研究表明,刺参的适宜蛋白质需要量为18.21%~24.18%,适宜脂肪需要量为5%。本试验以海带为对照,用青苔和大叶藻为主要原料设计蛋白质和脂肪水平在22%和5%左右的刺参试验饲料。试验结果表明,青苔组和大叶藻组的刺参不仅增重率和蛋白质效率均高于对照组,而且饲料系数略低于对照组,可证实分别以青苔和大叶藻为主要原料设计的刺参配方饲料是可行的;青苔组和大叶藻组刺参脏壁比显著低于对照组,也说明青苔和大叶藻2种饲料原料更利于刺参体壁的增长。

表6 不同饲料对刺参抗氧化及非特异性免疫指标的影响
3.2 不同饲料对刺参体壁营养成分的影响
天然刺参主要摄食沉积物,能量分配模式与其他水产动物不同,排粪能较高,生长能偏低[14-15]。刺参摄食获取能量,较高部分用于排粪能和其他活动,大部分用于各种生长的需求[16]。饲料中一定量的纤维可以促进胃和肠道的蠕动,有利于营养物质的吸收。本试验研究结果表明,青苔组刺参摄食量要高于对照组和大叶藻组,刺参体壁粗蛋白质含量略高于对照组,体壁粗脂肪含量略低于对照组,可能因为青苔和大叶藻作为刺参饲料原料纤维含量适宜,适口性较好,蛋白质易吸收,可提高蛋白质的沉积率有关;大叶藻组刺参体壁粗灰分含量显著高于对照组和青苔组,可能与大叶藻有促进机体矿物质沉积的作用有关,这还需进一步的试验来验证。
3.3 不同饲料对刺参肠道指数和消化酶活性的影响
肠重比可以检测动物机体的摄食情况,一般摄食活跃个体比饥饿个体的肠重比要高,生长发育后期肠重比要比初期低[17]。本试验结果表明,青苔组和大叶藻组刺参肠重比显著低于对照组,结合增重率和特定生长率指标分析,说明青苔和大叶藻较海带更有利于刺参生长发育。刺参的肠道是主要的消化场所,可分泌多种消化酶来促进营养物质的消化吸收[18]。Gangadhara等[19]认为饲料的种类和成分的改变会引起动物消化酶活性的变化。郭娜认为,刺参可以通过调节其肠道的生理功能和消化酶活性来适应不同来源的食物。本试验结果表明,各组刺参肠道蛋白酶和脂肪酶活性无显著差异,青苔组和大叶藻组肠道淀粉酶活性显著低于对照组,与李旭等[11]用不同饲料原料对刺参生长效果试验结果相似。
3.4 不同饲料对刺参非特异性免疫指标的影响
刺参属于高等无脊椎动物,一般认为缺乏特异性免疫应答系统,免疫反应主要通过体腔液细胞的吞睡作用、呼吸爆发及多种免疫因子等相互协同作用来实现[20-21]。谷胱甘肽过氧化物酶、过氧化物酶和超氧化物歧化酶是生物体内重要的抗氧化酶,可以分解过氧化物消除氧化氢、活性氧,清除自由基,起到抗氧化作用[22]。本试验结果表明,各组间刺参体腔液过氧化物酶、总超氧化物歧化酶活性无显著差异;但青苔组体腔液谷胱甘肽过氧化物酶活性显著高于对照组和大叶藻组,能更快地分解有毒的过氧化物为无毒的羟基化合物,提高自身免疫力。碱性磷酸酶和酸性磷酸酶是溶酶体标志性酶,是机体重要的免疫因子,除了可以促进体内钙磷代谢还可以间接反映动物体内组织损伤情况,评价动物体非特异性免疫的主要指标[23]。体腔液碱性磷酸酶活性的升高有生理和病理等方面原因,本试验中大叶藻组体腔液碱性磷酸酶活性显著低于对照组的原因尚不明确,各组体腔液酸性磷酸酶活性无显著差异。
4 结 论
在本试验条件下,青苔和大叶藻作为饲料原料应用于刺参饲料中是可行的;以生长性能指标为基础,结合抗氧化及非特异性免疫指标,刺参生长效果为青苔组>大叶藻组>海带组。
[1] 樊绘曾.海参:海中人参——关于海参及其成分保健医疗功能的研究与开发.中国海洋药物杂志,2001,20(4):37-44.
[2] 郭娜.不同饲料对刺参(Apostichopusjaponicus)生长、消化生理和能量收支的影响.硕士学位论文.青岛:国海洋大学,2011.
[3] 袁成玉.海参饲料研究的现状与发展方向.水产科学,2005,24(12):54-56.
[4] 彭刚,严维辉,刘国兴,等.3种药物对青苔生长的抑制效果研究.安徽农业科学,2013,41(12):5367-5369.
[5] 马爱兵.河蟹养殖池中青苔的防除技术.现代农业科技,2011(10):342.
[6] 王荣林.蟹池青苔生物生态综合防治技术.中国水产,2007(6):42.
[7] 常巧玲,孙建义.海藻饲料资源及其在水产养殖中的应用研究.饲料工业,2006,27(2):62-64.
[8] 郭栋.大叶藻增殖生态学的实验研究.硕士学位论文.青岛:中国海洋大学,2010.
[9] 刘阳.大叶藻(ZoteramarinaL.)提取活性物质对仿刺参(Apostichopusjaponicus)“腐皮综合症”病灶优势菌及白脊藤壶(BalanusalbicostatusPilsbry)幼体附着抑制研究.硕士学位论文.青岛:中国海洋大学,2009.
[10] 唐薇,王庆吉,张蕾,等.不同藻粉对刺参组织免疫性能和体壁成分的影响.资源开发与市场,2014,30(8):905-907,920.
[11] 李旭,章世元,陈四清,等.四种饲料原料对刺参生长、体成分及消化生理的影响.饲料工业,2013,34(8):36-40.
[12] 何舟,宋坚,常亚青,等.穗花狐尾藻(MyriophyllumspicatumL.)饲喂对刺参(Apostichopusjaponicus)幼参生长、体成分及消化酶的影响.渔业科学进展,2015,36(4):122-127.
[13] 朱伟,麦康森,张百刚,等.刺参稚参对蛋白质和脂肪需求量的初步研究.海洋科学,2005,29(3):54-58.
[14] TIAN X L,DONG S L.The effects of thermal amplitude on the growth of Chinese shrimp Fenneropenaeus chinensis.Aquaculture,2006,251(2/3/4):516-524.
[15] ZHENG Z H,DONG S L,TIAN X L.Effects of intermittent feeding of different diets on growth ofLitopenaeusvannamei.Journal of Crustacean Biology,2008,28(1):21-26.
[16] 殷旭旺,李文香,白海锋,等.不同海藻饲料对刺参幼参生长的影响.大连海洋大学学报,2015(3):276-280.
[17] KING P A,FIVES J M,MCGRATH D.Reproduction,growth,and feeding of the dragonetCallionymuslyra(Teleostei:Callionymidae),in galway bay,Ireland.Journal of the Marine Biological Association of the United Kingdom,1994,74(3):513-526
[18] 崔龙波,董志宁,陆瑶华.仿刺参消化系统的组织学和组织化学研究.动物学杂志,2000,35(6):2-4.
[19] GANGADHARA B,NANDEESHA M C,VARGHESE T J,et al.Effect of varying protein and lipid levels on the growth of Rohu,Labeorohita.Asian Fisheries Society,1997,10(2):139-147.
[20] COTEUR G,MELLROTH P,DE LEFORTERY C,et al.Peptidoglycan recognition proteins with amidase activity in early deuterostomes (Echinodermata).Developmental & Comparative Immunology,2007,31(8):790-804.
[21] DOLMATOVA L S,ELISEIKINA M G,ROMASHINA V V.Antioxidant enzymatic activity of coelomocytes of the far east sea cucumberEupentactafraudatrix.Journal of Evolutionary Biochemistry and Physiology,2004,40(2):126-135.
[22] 王方雨,杨红生,高菲,等.刺参体腔液几种免疫指标的周年变化.海洋科学,2009,33(7):75-80.
[23] 方晨,王霞,张小雪.嗜水气单胞菌对黄鳝内脏器官酸性磷酸酶和碱性磷酸酶活性的影响.科学养鱼,2015(9):54-55.
EffectsofGreenAlgaeandSargassumonGrowthPerformanceandImmuneIndicesofSeaCucumber(Apostichopusjaponicas)
LU Jingjing1GUO Ran1*ZHAO Chunlong2CUI Zhaojin2XIA Hui1XIE Wei1WANG Meixue1YANG Pinxian1
(1.OceanCollegeofHebeiAgriculturalUniversity,Qinhuangdao066000,China; 2.KeylaboratoryofMarineLivingResourcesandEnvironmentinHebeiProvince,OceanandFisheriesScienceResearchInstituteofHebeiProvince,Qinhuangdao066000,China)
This experiment was conducted to study the effects of green algae andSargassumon growth performance and immune indices of sea cucumber (Apostichopusjaponicas). A total of 720 sea cucumber with average body weight of 0.35 g were randomly divided into 3 groups with 3 replicates per group and 80 sea cucumber per replicate. Use green algae,Sargassumand kelp as the main source of algae protein, made three different compound diets to feed the sea cucumber, including the control group (kelp group) and experiment groups (green algae group andSargassumgroup). The experiment lasted for 8 weeks. The effects of green algae andSargassumon the healthy growth of sea cucumber were evaluated by assessing the growth performance, body wall nutrient composition, digestive enzymes activities and nonspecific immune indices. The results showed that compared with the control group, the weight gain rate of green algae group andSargassumgroup increased by 29.15% and 24.13%, while the feed conversion ratio decreased by 10.39% and 15.58%, and there were no significant difference among all groups (P>0.05). The ratio of intestine gut weight to body weight and the ratio of viscera to body wall of green algae group andSargassumgroup were significantly lower than those of control group (P<0.05), but the body wall moisture content of green algae group andSargassumgroup were significantly higher than that of control group (P<0.05). The body wall crude ash content ofSargassumgroup was significantly higher than that of control group and green algae group (P<0.05). The intestinal tract amylase activity of green algae group andSargassumgroup was significantly lower than that of control group (P<0.05). The activity of glutathione peroxidase (GSH-Px) in coelomic fluid of green algae group was significantly higher than that of control group andSargassumgroup (P<0.05), while the activities of peroxidase activity (POD), superoxide dismutase (SOD), acid phosphatase (ACP) of green algae group were significantly higher than those of control group andSargassumgroup (P>0.05). The activity of alkaline phosphatase (ALP) in coelomic fluid was significantly lower than that of control group (P<0.05), but had no significantly difference with green algae group (P>0.05). In conclusion, under the experimental condition, the application of green algae andSargassumin diets of sea cucumber is feasible; based on the growth performance and takes into account antioxidant and non-specific immune index, the growth effect for sea cucumber is green algae group >Sargassumgroup > kelp group.[ChineseJournalofAnimalNutrition,2017,29(12):4632-4638]
sea cucumber; green algae;Sargassum; growth perform; non-specific immunity
10.3969/j.issn.1006-267x.2017.12.046
S963.22+1
A
1006-267X(2017)12-4632-07
2017-06-14
河北省现代农业产业技术体系特种海产品创新团队
路晶晶(1992—),女,河北衡水人,硕士研究生,研究方向为动物营养与饲料。E-mail: lujingjing928@sina.com
*通信作者:郭 冉,副教授,硕士生导师,E-mail: toguoran@163.com
*Corresponding author, associate professor, E-mail: toguoran@163.com
(责任编辑 武海龙)

