饲粮碘含量对牦牛体外瘤胃发酵的影响
范小红 薛艳锋 郝力壮* 刘书杰* 柴沙驼 牛建章 张晓卫 王 迅
(1.省部共建三江源生态与高原农牧业国家重点实验室,青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁 810016;2.青海高原牦牛研究中心,西宁 810016;3.青海大学畜牧兽医科学院,西宁 810016)
饲粮碘含量对牦牛体外瘤胃发酵的影响
范小红1,2,3薛艳锋1,2,3郝力壮1,2,3*刘书杰1,2,3*柴沙驼1,2,3牛建章1,2,3张晓卫1,2,3王 迅1,2,3
(1.省部共建三江源生态与高原农牧业国家重点实验室,青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁 810016;2.青海高原牦牛研究中心,西宁 810016;3.青海大学畜牧兽医科学院,西宁 810016)
本试验旨在研究饲粮碘含量对牦牛体外瘤胃发酵的影响。以碘化钾作为添加形式,以牦牛饲粮为底物进行体外发酵,底物碘含量分别为0.1、0.3、0.5、0.7、0.9 mg/kg,共发酵48 h。发酵结束测定总产气量、瘤胃发酵特性指标及消化酶活力。结果表明:当底物碘含量为0.3 mg/kg时,发酵液微生物蛋白质(MCP)、乙酸(C2)、丙酸(C3)、丁酸(C4)、异戊酸(i-C5)、戊酸(C5)、总挥发性脂肪酸(TVFA)浓度以及淀粉酶(AMS)、脂肪酶(LPS)、胰蛋白酶(TYS)活力均达到最大值,分别为3.694 g/L、56.286 mmol/L、28.906 mmol/L、9.507 mmol/L、1.552 mmol/L、0.919 mmol/L、97.769 mmol/L、1.567 U/mL、0.453 U/mL、60.787 U/mL;当碘含量为0.5 mg/kg时,干物质消化率(DMD)达到最大值,为69.39%,显著高于其他处理(P<0.05);在碘含量为0.7 mg/kg时,发酵液纤维素酶(CLS)活力达到最大值,为79.956 U/mL,发酵液乙酸/丙酸最低,为1.636。综合各项指标得出,在体外条件下,在底物碘含量为0.3~0.7 mg/kg时,牦牛体外瘤胃发酵处较高水平。
牦牛;碘化钾;体外产气技术;挥发性脂肪酸;消化酶活力
牦牛是在海拔3 000 m以上区域繁衍的牛种,主要分布在远离沿海地带的青海、西藏的高原山地,及其毗邻的高山、亚高山地区,其对高寒草原寒冷、氧气缺乏、草料匮乏等恶劣生存环境的适应能力强,是高寒牧区不可替代的生产生活资料和支柱产业,同时牦牛作为高寒草地重要的生态组成部分,主要依赖于天然草场资源进行放牧饲养,但随着近年来超载放牧、草场退化和草畜矛盾加深的影响,造成了牦牛营养供给不平衡,尤其在冬季,牦牛会出现严重的掉膘情况,严重约束了牦牛产业的发展。且青海、西藏是碘缺乏较为严重的地区,藏区碘盐覆盖率长期维持较低水平,据膳食结构调查,藏族群众日常饮食以风干牦牛肉、牦牛乳及其制品为主,提示藏族人群可能通过碘盐外的其他途径摄入碘。因此,牦牛缺碘对牦牛产业自身发展及藏区人群的健康有极其深远的影响,所以,深入研究牦牛营养、制订出适合牦牛的饲养标准、合理补饲是目前急需解决的问题。有关牦牛营养和饲养方面的研究有一定的报道[4-5],但牦牛微量元素营养方面的研究还鲜少报道。
碘参与动物体内甲状腺素的合成,调节动物机体新陈代谢,影响动物生长发育,是动物保持良好繁殖性能的一种必需微量元素,缺碘会导致动物被毛皮肤干燥,毛发失去光泽,皮肤增厚甚至全身脱毛,周身被毛纤维化等[10]。碘添加过量会影响动物机体的生长发育及健康状况,但饲粮中碘往往处于缺乏状态。杨凤[11]指出碘在动物饲粮中处于临界缺乏状态,而实际生产中大多数以预混料的形式向动物饲粮中添加微量元素复合物来满足动物的需求,这样虽然起到了一定的积极作用,但却不能最大程度地发挥动物的生长性能。
郭洋等[12]指出一头体重600 kg的成年牛,每日需碘量为10 mg以合成甲状腺素;杨国忠等[13]研究指出在通常情况下牛对碘的需要量是0.5 mg/kg,耐受量是20 mg/kg;根据NRC(2007)标准的规定,每千克的饲粮干物质(DM)当中牛、羊碘添加量分别为0.25~0.50 mg/kg、0.10~0.80 mg/kg,耐受量都是50.00 mg/kg;根据我国的实际情况,每千克的饲粮DM当中牛、羊的碘适宜添加量都是0.5 mg/kg[14]。碘的理化性质极其不稳定,很容易散失或转化,因此很少合成螯合碘作为动物的含碘添加剂,而碘化钾中,碘的存在形式稳定,含量测定准确,不易发生变化。因此,本试验以碘化钾作为微量元素碘的添加形式,通过体外产气技术研究底物碘含量为0.1~0.9 mg/kg时对人工牦牛瘤胃发酵的影响,旨在探究微量元素碘在牦牛饲粮中的适宜含量,为完善牦牛饲养标准和科学补饲提供参考。
1 材料与方法
1.1 试验动物与饲养管理
试验选择3头健康、体况接近、装有永久性瘤胃瘘管的成年阉牦牛作为瘤胃液供体动物。试验饲粮包括精料(不添加任何微量元素)和粗料(燕麦青干草),精粗比6∶4,单头饲喂,每日2次(08:00、18:00),自由饮水,饲喂15 d之后,清晨空腹采集瘤胃液。
1.2 试验设计
参考我国《肉牛饲养标准》(NY/T 815—2004)及生长期牦牛能量和蛋白质需要[4,15],按照150 kg牦牛日增重500 g设计牦牛基础饲粮的精料配方,以燕麦青干草作为粗料,精粗比6∶4配制发酵底物。试验采用单因素试验设计,共5个处理,每个处理设3个重复。然后在5个处理的发酵底物中以碘化钾(长沙兴嘉生物工程有限公司提供,纯度77.28%)的形式添加,使底物碘含量分别为0.1、0.3、0.5、0.7、0.9 mg/kg。采用体外产气技术研究底物不同碘含量对牦牛体外瘤胃发酵的影响。
1.3 体外产气技术方法
牦牛饲喂15 d后,于晨饲前空腹采集3头牛的瘤胃液,采集结束后将所采瘤胃液混匀,并4层纱布过滤,人工瘤胃发酵液的配制参考Menke等[16]的方法,持续通入CO2达到厌氧状态,采用分液装置向每个装有200 mg底物的发酵培养管中注入发酵液30 mL,迅速转入恒温人工瘤胃培养箱[(39.0±0.5) ℃、40 r/min〗中进行培养,分别在培养2、4、6、8、12、16、20、24、30、36、48 h时快速读取发酵培养管(特种玻璃注射器,D·89173 Lonsee-Ettlenschie β型,德国,长度27 cm,内径3 cm,在100 mL范围内具有刻度显示,最小分度1 mL,在注射器前端的3.5 cm延伸管外套有硅橡胶软管,用特制聚氯乙烯止水夹将硅橡胶软管夹紧)活塞所处的刻度(mL)并记录,发酵48 h结束后,读取发酵培养管的刻度,收集发酵产生的气体,迅速将培养管转移到冰水浴中终止发酵。备份发酵液,冷冻保存。
1.4 测定指标与方法
1.4.1 碘含量
碘含量测定参考GB/T 13882—2010[17],使用硫氰酸钾-亚硝酸催化动力学法。本试验所做出的碘含量标准曲线拟和公式为:
Abs=-0.34Conc+0.475 6 (r=0.997 3,n=5)。
式中:Conc为碘含量(μg/mL);Abs为460 nm吸光度值。
1.4.2 总产气量、产气速率和干物质消化率(DMD)
根据各时间点记录的产气量计算总产气量、甲烷产量和产气速率。
总产气量(mL)=试验管总产气量-空白管总产气量;甲烷产量(mL)=总产气量×甲烷所占百分比;阶段产气速率(mL/h)=阶段产气量/时间间隔。
体外发酵结束后,收集发酵残渣,105 ℃烘干12~24 h,计算DMD,计算公式为:
DMD(%)=[(样本DM重-残渣DM重+空白管DM重)/样本DM重〗×100。
1.4.3 pH、氨态氮(NH3-N)和微生物蛋白质(MCP)浓度
pH采用HANNA HI221型台式酸度计测定。
NH3-N浓度采用冯宗慈等[18]改进的比色法测定。
MCP浓度测定采用南京建成生物工程研究所提供的试剂盒(货号:A045-1)进行测定,测定方法为双缩脲法。操作方法:准确吸取发酵液0.20 mL,加入0.80 mL的生理盐水,冰水浴条件下机械匀浆,制成20%的匀浆液,在646×g的条件下离心10 min;吸取离心后的上清液0.05 mL于测定管,后于空白管加0.05 mL超纯水,标准管加0.05 mL 56.3 g/L的蛋白质标准品,并于空白管、标准管、测定管分别加入双缩脲试剂(将试剂1中的粉剂加超纯水稀释到100 mL,试剂2中的粉剂加超纯水稀释到200 mL,然后将稀释后的试剂1、试剂2按照1∶2配成双缩脲试剂)2.50 mL,混匀,37 ℃水浴10 min,流水冷却。使用TU-1810紫外可见分光光度计(提前预热30 min)在波长540 nm处测定各管吸光度值,比色皿光径1 cm,超纯水调零。MCP浓度计算公式为:
MCP(g/L)=(Am-AK)/(As-Ak)×Ck×w。
式中:Am为测定管吸光度值;AK为空白管吸光度值;As为标准管吸光度值;Ck为蛋白质标准品浓度,为56.3 g/L;w为稀释倍数。
1.4.4 VFA浓度
VFA浓度测定参考文献[19-20]。对样品进行前处理:发酵液经4层纱布过滤后,取5 mL于干净的离心管中,930×g离心10 min,取上清液2 mL于离心管中,准确加入0.2 mL 25%的偏磷酸溶液,混匀之后,静置10 min充分反应后,在14 876×g、4 ℃的条件下离心10 min,转移上清到新的离心管中,-80 ℃冻存,备用。
VFA的测定方法:用岛津2014气相色谱仪分析。测定条件:火焰离子检测器(FID),色谱柱为毛细管柱(30.00 m×0.32 mm×0.50 μm);色谱柱升温程序,初始60 ℃,以10 ℃/min升温至120 ℃,保留2 min,以15 ℃/min升温至180 ℃,保留5 min;汽化温度250 ℃;检测温度250 ℃;进样量:1 μL,载气为高纯氮气(99.99%),压力0.7 MPa,检测器氢气压力0.4 MPa,空气压力0.4 MPa,毛细管柱压力0.6~0.8 MPa,分流比40∶1。
1.4.5 消化酶活力
淀粉酶(AMS)(货号:C016-1)、脂肪酶(LPS)(货号:A054)、胰蛋白酶(TYS)(货号:A080-2)、纤维素酶(CLS)(货号:A138)活力测定采用南京建成生物工程研究所提供的试剂盒进行测定。
单位定义:每毫升含酶溶液在37 ℃下与底物作用30 min,水解10 mg淀粉定义为1个AMS活力单位;每毫升含酶溶液在37 ℃下与底物作用1 min,每消耗1 μmol底物为1个LPS活力单位;每毫升含酶溶液在37 ℃、pH=8.0的条件下,每分钟使反应体系的吸光度值(253 nm)变化0.003即为1个TYS活力单位;每毫升含酶溶液每分钟催化产生1 μg葡萄糖定义为1个CLS活力单位。
1.5 统计分析
试验数据采用SAS 9.0软件的ANOVA程序进行单因素方差分析,Duncan氏法进行多重比较,P<0.05为差异显著,数据以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 总产气量、甲烷产量、pH和DMD
从表1中可以看出,随着底物碘含量的升高,总产气量、甲烷产量和DMD呈现先上升后下降的趋势,pH呈现先下降后上升的趋势。总产气量在碘含量为0.3 mg/kg时达到最大值,为69.0 mL,但各处理之间差异均不显著(P>0.05);甲烷产量在碘含量为0.7 mg/kg时达到最大值,为6.80 mL,各处理之间差异不显著(P>0.05);pH在碘含量为0.3 mg/kg时达到最小值,为7.08,各处理之间差异均不显著(P>0.05),各处理体外发酵后pH处于7.08~7.40;DMD在碘含量为0.5 mg/kg时达到最大值,为69.39%,显著高于碘含量为0.1 mg/kg时的DMD(P<0.05),但与碘含量为0.3、0.7、0.9 mg/kg时的DMD差异不显著(P>0.05)。
2.2 产气速率
从图1中可以看出,随着发酵时间的延长,5个处理的产气速率都出现先上升后下降的趋势。在培养开始阶段(0~3 h)产气速率变化较大,培养3 h时达最大,培养30 h后,产气速率不断下降。
2.3 NH3-N和MCP浓度
从表2中可以看出,随着底物碘含量的升高,体外发酵后的发酵液NH3-N浓度呈现先下降后上升的趋势,在碘含量为0.1 mg/kg时处于最高值10.168 mg/dL,显著高于碘含量为0.5 mg/kg时(P<0.05),但与其他各处理之间的差异不显著(P>0.05);发酵液MCP浓度在碘含量为0.3 mg/kg时达到最高值,为3.694 g/L,显著高于碘含量为0.9 mg/kg时(P<0.05),但与其他各处理之间的差异不显著(P>0.05)。

表1 底物碘含量对体外瘤胃发酵总产气量、甲烷产量、pH、DMD的影响
同行数据肩标不同字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different letter superscripts mean significant difference (P<0.05), while with no letter or the same letter superscripts mean no significant difference (P>0.05). The same as below.
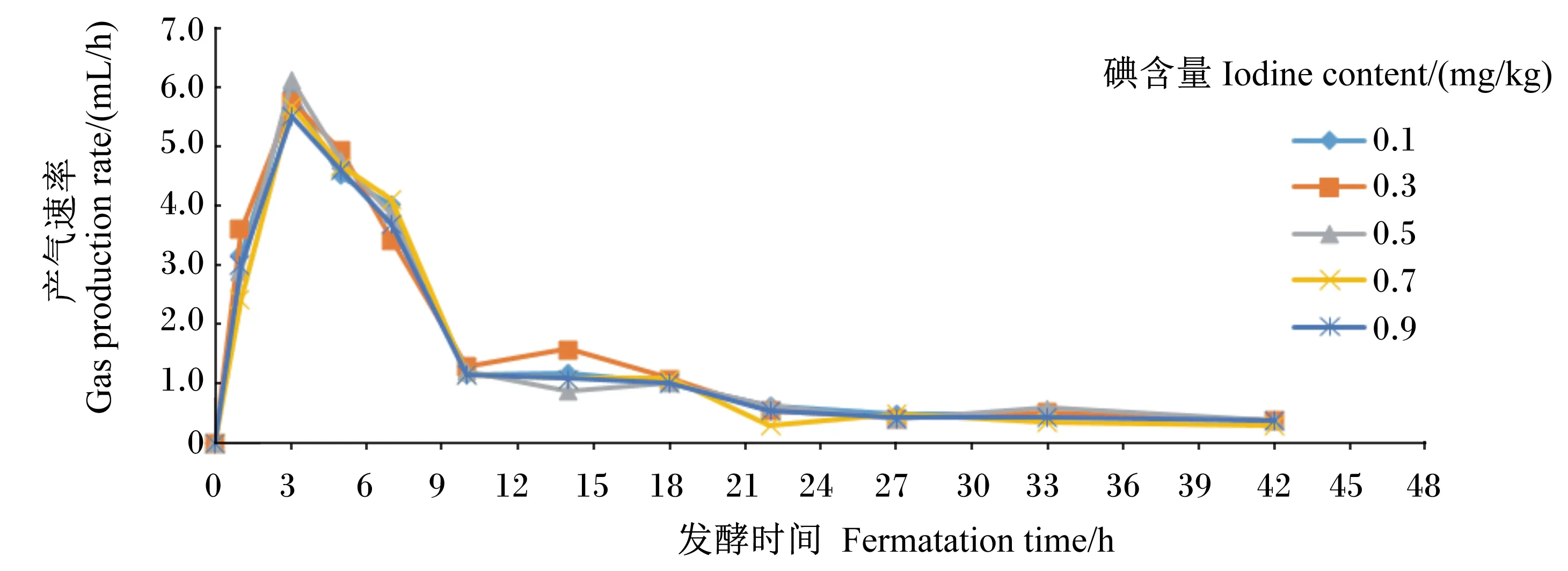
图1 底物碘含量对体外瘤胃发酵产气速率的影响

表2 底物碘含量对体外瘤胃发酵后NH3-N、MCP浓度
2.4 VFA浓度
从表3中可以看出,随着底物碘含量的升高,发酵液乙酸(C2)、丙酸(C3)、丁酸(C4)、异戊酸(i-C5)、戊酸(C5)、总挥发性脂肪酸(TVFA)浓度都呈现先上升后下降的趋势,异丁酸(i-C4)浓度没有明显规律。发酵液C2、C3、C4、i-C5、C5、TVFA浓度在碘含量为0.3 mg/kg时达到最大值,分别为56.286、28.906、9.507、1.552、0.919、97.769 mmol/L,但不同处理之间差异均不显著(P>0.05);发酵液乙酸/丙酸出现先上升后下降的趋势,在碘含量为0.7 mg/kg时达到最低值1.636,各处理之间差异均不显著(P>0.05)。

表3 碘含量对体外瘤胃发酵后VFA浓度的影响
2.5 消化酶活力
从表4中可以看出,随着底物碘含量的升高,发酵液AMS、LPS、TYS、CLS活力都呈现先上升后下降的趋势。发酵液AMS活力在碘含量为0.3 mg/kg时达到最大值1.567 U/mL,显著高于碘含量为0.1、0.7、0.9 mg/kg时(P<0.05),但与碘含量为0.5 mg/kg时差异不显著(P>0.05);发酵液LPS活力在碘含量为0.3 mg/kg时达到最大值,为0.453 U/mL,但各处理之间差异均不显著(P>0.05);发酵液TYS活力在碘含量为0.3 mg/kg时达到最大值,为60.787 U/mL,但各处理之间差异均不显著(P>0.05);发酵液CLS活力在碘含量为0.7 mg/kg时达到最大值,为79.956 U/mL,显著高于碘含量为0.1 mg/kg时(P<0.05),但与碘含量为0.3、0.5、0.9 mg/kg时差异不显著(P>0.05)。
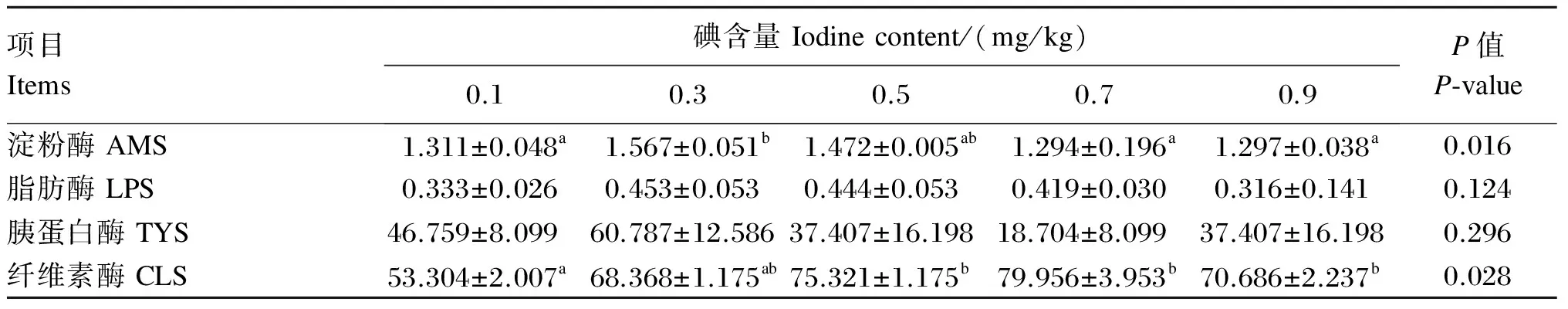
表4 碘含量对体外瘤胃发酵后消化酶活力的影响
3 讨 论
体外发酵产气量是反映反刍动物发酵底物可消化营养成分含量及瘤胃微生物代谢状况的重要指标之一,其与营养物质的消化率往往呈正相关性[15,21-22]。本试验中,以碘化钾作为添加剂时,瘤胃发酵总产气量、甲烷产量均随着碘含量的升高呈现先升高后降低的趋势,总产气量在底物碘含量为0.3 mg/kg时达到最大值,为69.0 mL;甲烷产量在底物碘含量为0.5~0.7 mg/kg时处于较高水平,在碘含量为0.7 mg/kg时达到最大值,为6.80 mL。这表明添加碘化钾可提高体外发酵总产气量,有利于瘤胃发酵,试验结果与王茂荣[23]研究结果一致。体外发酵产气速率呈现先上升后下降的单峰趋势,发酵初期迅速产生气体,这是由于发酵底物中的可溶性糖等成分在发酵初期易于被微生物所利用,随着发酵继续,产气速率随之慢慢降低,可能是由于发酵成分越来越少,随着时间的延长,最终产气速率趋近于零。pH受发酵底物类型、有机酸沉淀等各种因素影响,综合反映瘤胃发酵[24]。研究表明,pH对瘤胃微生物发酵的影响与pH的变化范围有关[25],只有当pH处于正常范围之内,机体瘤胃发酵、饲料降解才能保证正常进行。反刍动物在正常生理条件下的瘤胃液pH约在5.6~7.5,Kopecny等[26]提出,适合瘤胃微生物水解酶的pH在5.5~7.0。也有研究指出,瘤胃的理想pH呈弱酸性至中性,在6.4~6.8[27]。本试验不同碘化钾含量下体外发酵后的pH在7.08~7.40,属正常pH范围之内。
不同饲粮的DMD有一定的差异,其表示饲粮被瘤胃微生物降解状况。本试验中,DMD随着碘含量的升高呈现先上升后下降的趋势,并且在碘含量为0.5~0.7 mg/kg时处于较高水平,表明碘含量在0.5~0.7 mg/kg时,饲粮易被瘤胃微生物发酵降解利用。发酵液AMS、LPS和TYS 3种消化酶的活力都在碘含量为0.3 mg/kg的时候达到最大值,CLS的活力在碘含量为0.7 mg/kg的时候达到最大值,瘤胃消化酶活力变化基本与DMD一致。因此从DMD和瘤胃消化酶活力的角度看,当碘的含量在0.5~0.7 mg/kg的时候,适合微生物的附着与生长,最有利于饲粮的降解。本试验测定的牦牛瘤胃消化酶活力与张海涛等[28]测定的犊牛瘤胃内AMS活力0.29~1.74 U/mL,刘彩娟等[29]测定的奶牛瘤胃中CLS活力71.43~99.05 U/mL基本在同一水平;王杰[30]测定的羊瘤胃中TYS活力为18.09~24.56 U/mL,而本试验结果测定的TYS活力达到18.704~60.787 U/mL,这可能由于TYS活力与瘤胃中的pH、蛋白质的沉积速度和蛋白质含量有关。
瘤胃内的NH3-N是饲粮蛋白质降解及瘤胃微生物降解氮源生成氨、摄取利用氨速度的综合反映,NH3-N含量基本保持着动态平衡[31]。Murphy等[32]的研究显示微生物发酵的最佳NH3-N含量为6.3~27.5 mg/dL,Slyter[33]指出瘤胃液NH3-N浓度的范围为0.35~29.00 mg/dL。本试验5个处理的发酵液NH3-N含量为6.842~10.168 mg/dL,均处于正常范围,并随底物碘含量的升高呈现先下降后上升的趋势,且在碘添加量为0.1 mg/kg的时候NH3-N含量处于最大值,为10.168 mg/dL,则单从发酵液NH3-N含量来看,随着底物碘含量的升高,微生物分解饲料蛋白质的能力呈现先下降后上升的趋势。MCP反映瘤胃微生物的数量及活性且是反刍动物最主要的氮源供应者,可提供机体蛋白质需要量的40%~60%。本试验中发酵液MCP含量随着底物碘含量的提高呈现先上升后下降的趋势,在碘含量为0.3~0.7 mg/kg时处于较高水平。由此可见,底物碘含量在0.3~0.7 mg/kg时,瘤胃微生物数量及活性利于MCP的合成,底物碘含量低时,可能由于瘤胃中氨和能量不同步释放,导致可发酵底物利用率下降,MCP合成能力较弱,从而MCP含量较低。结合发酵液NH3-N和MCP含量而言,本试验中,随着底物碘含量的升高,发酵液NH3-N含量呈先下降后上升,但MCP呈先上升后下降趋势,可能是MCP合成需消耗大量NH3-N,从而MCP含量较高使NH3-N含量处于较低的水平。
VFA是反刍动物机体代谢所需的主要能量来源[19]。Gray等[34]指出VFA能为反刍动物提供60%~80%的消化能。本试验中,不同碘含量处理发酵液C2、C3、i-C4、C4、i-C5、C5、TVFA含量差异均不显著,但随着底物碘含量的升高基本都呈现先上升后下降的趋势,在碘含量为0.3~0.9 mg/kg时都处于较高水平;发酵液乙酸/丙酸在不同处理间差异不显著,但在碘含量为0.7 mg/kg时达到最低值,为1.636,反刍动物瘤胃发酵中碳水化合物发酵水平通过乙酸/丙酸反映,其数值越低,表明瘤胃能量发酵模式趋近于丙酸型发酵,有利于饲粮中能量的利用,本试验中发酵液乙酸/丙酸在碘含量为0.7 mg/kg的时候达到最低值。因此,从VFA浓度角度来看看,碘含量为0.3~0.9 mg/kg时,有利于瘤胃发酵能量物质的生成,对牦牛的生长有利。
4 结 论
体外条件下,对于生长期牦牛,若以碘化钾作为碘的添加形式,牦牛饲粮碘含量在0.3~0.7 mg/kg时,瘤胃发酵和饲粮降解处较高水平。
[1] 郭宪,阎萍,梁春年,等.中国牦牛业发展现状及对策分析.中国牛业科学,2009,35(2):55-57.
[2] 朱新书,阎萍,梁春年,等.从生态学观点论青藏高原地区牦牛产业的可持续发展.黑龙江畜牧兽医,2011(3):148-150.
[3] 孟献亚,李亚楠,张秀丽,等.牦牛肉和牦牛乳中碘含量及甲状腺激素检测结果分析.现代预防医学,2017,44(10):1774-1775,1779.
[4] 韩兴泰,胡令浩,谢敖云,等.粗饲条件下生长牦牛能量代谢的估测.青海畜牧兽医杂志,1992,22(2):21-22.
[5] 薛白,柴沙驼,刘书杰,等.生长期牦牛蛋白质需要量的研究.青海畜牧兽医杂志,1994,24(4):1-5.
[6] NUDDA A,BATTACONE G,DECANDIA M,et al.The effect of dietary iodine supplementation in dairy goats on milk production traits and milk iodine content.Journal of Dairy Science,2009,92(10):5133-5138.
[7] 孔祥瑞.必需微量元素的营养生理及临床意义.合肥:安徽科学技术出版社,1982:121.
[8] 孙全文.必需微量元素碘对家兔的营养作用.中国养兔,2009(5):34-39.
[9] SARGISON N D,WEST D M,CLARK R G.The effects of iodine deficiency on ewe fertility and perinatal lamb mortality.New Zealand Veterinary Journal,1998,46(2):72-75.
[10] 李西峰,杨全明.必需微量元素碘.中国饲料,1995(20):31.
[11] 杨凤.动物营养学.2版.北京:中国农业出版社,2003:116-117.
[12] 郭洋,杜绍范.碘对于反刍动物的毒性.现代畜牧兽医,2005(7):52-53.
[13] 杨国忠,王净,孙泰然,等.微量元素碘对动物的营养作用.今日畜牧兽医,2007(1):52-53.
[14] NRC.Nutrient requirements of small ruminants:sheep,goats,cervids,and New World camelids.Washington,D.C.:National Academies Press,2007.
[15] 柴沙驼,刘书杰,谢敖云,等.生长期牦牛对饲料中氮利用率的研究.草食家畜,1996(4):36-39,57.
[16] MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquorinvitro.The Journal of Agricultural Science,1979,93(1):217-222.
[17] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 13882-2010饲料中碘的测定硫氰酸铁-亚硝酸催化动力学法.北京:中国标准出版社,2011.
[18] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进.畜牧与饲料科学,2010,31(4):40-41.
[19] 曹庆云,周武艺,朱贵钊,等.气相色谱测定羊瘤胃液中挥发性脂肪酸方法研究.中国饲料,2006(24):26-28.
[20] 王加启.反刍动物营养学研究方法.北京:现代教育出版社,2012:139-141.
[21] MENKE K H.Estimation of the energetic feed value obtained from chemical analysis andinvitrogas production using rumen fluid.Animal Research and Development,1988,28:7-55.
[22] 哈斯花.体外发酵产气技术在饲料营养价值评定中的作用.当代畜禽养殖业,2013(1):15-19.
[23] 王茂荣.不同水平的铜、铁、碘、钼对RSI-Ⅱ人工瘤胃微生物发酵的影响.硕士学位论文.晋中:山西农业大学,2001.
[24] 高天爽,孙海霞,谢小来,等.日粮中高粱替代玉米对绵羊瘤胃发酵的影响.黑龙江畜牧兽医,2014(9):7-10.
[25] WALES W J,KOLVER E S,THORNE P L,et al.Diurnal variation in ruminal pH on the digestibility of highly digestible perennial ryegrass during continuous culture fermentation.Journal of Dairy Science,2004,87(6):1864-1871.
[26] KOPECNY J,WALLACE R J.Cellular location and some properties of proteolytic enzymes of rumen bacteria.Applied and Environmental Microbiology,1982,43(5):1026-1033.
[27] 陈光吉,严锦绣,郭春华,等.微生物发酵饲料对肉牛瘤胃液pH值和微生物数量的影响.黑龙江畜牧兽医,2015(7):104-107.
[28] 张海涛,王加启,卜登攀,等.纳豆枯草芽孢杆菌对犊牛断奶前后瘤胃发酵和酶活的影响.中国畜牧兽医,2009,36(12):5-11.
[29] 刘彩娟,孙满吉,孙金艳,等.饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响.动物营养学报,2011,23(5):821-827.
[30] 王杰.小尾寒羊、滩羊生长性能及其主要消化生理参数的比较.硕士学位论文.杨凌:西北农林科技大学,2008.
[31] LENG R A,NOLAN J V.Nitrogen metabolism in the rumen.Journal of Dairy Science,1984,67(5):1072-1089.
[32] MURPHY J J,KENELLY J J.Effect of protein concentration and protein source on the degradability of dry matter and proteininsitu.Journal of Dairy Science,1987,70(9):1841-1849.
[33] SLYTER L L.Monensin and dichloroacetamide influences on methane and volatile fatty acid production by rumen bacteriainvitro.Applied and Environmental Microbiology,1979,37(2):283-288.
[34] GRAY G M.Starch digestion and absorption in nonruminants.The Journal of Nutrition,1992,122(1):172-177.
EffectsofDietaryIodideContentonRumenFermentationofYaksinVitro
FAN Xiaohong1,2,3XUE Yanfeng1,2,3HAO Lizhuang1,2,3*LIU Shujie1,2,3*CHAI Shatuo1,2,3NIU Jianzhang1,2,3ZHANG Xiaowei1,2,3WANG Xun1,2,3
(1.StateKeyLaboratoryofPlateauEcologyandAgriculture,KeyLaboratoryofPlateauGrazingAnimalNutritionandFeedScienceofQinghaiProvince,Xining810016,China; 2.QinghaiPlateauYakResearchCenter,Xining810016,China; 3.AcademyofScienceandVeterinaryMedicineofQinghaiUniversity,Xining810016,China)
This study was conducted to investigate the effects of dietary iodide content on rumen fermentation of yaksinvitro. Potassium iodide was used as additive and diet for yaks was used as a substrate forinvitrorumen fermentation. Iodine content in substrate was designed as 0.1, 0.3, 0.5, 0.7 and 0.9 mg/kg, respectively. The fermentation lasted for 48 h. Gas production, rumen fermentation characteristic parameters and digestive enzyme activities were measured after fermentation. The results showed as follows: when the content of iodine in substrate was 0.3 mg/kg, the concentrations of microbial protein (MCP), acetic acid (C2), propionic acid (C3), butyric acid (C4), isovaleric acid (i-C5), valeric acid (C5) and total volatile fatty acid (TVFA), as well as the activities of amylase (AMS), lipase (LPS) and trypsin (TYS) in fermentation fluid reached the highest, which were 3.694 g/L, 56.286 mmol/L, 28.906 mmol/L, 9.507 mmol/L, 1.552 mmol/L, 0.919 mmol/L, 97.769 mmol/L, 1.567 U/mL, 0.453 U/mL, 60.787 U/mL, respectively; when the content of iodine in substrate was 0.5 mg/kg, dry matter digestibility (DMD) reached the highest, as 69.39%, which was significantly higher than other treatments (P<0.05); when the content of iodine in substrate was 0.7 mg/kg, cellulose (CLS) activity in fermentation fluid reached the highest, which was 79.956 U/mL, and C2/C3 in fermentation fluid reached the lowest, which was 1.636. Based on the various indexes, underinvitroconditions, when the content of iodine in substrate was 0.3 to 0.7 mg/kg,invitroruminal fermentation of yaks is at high level.[ChineseJournalofAnimalNutrition,2017,29(12):4613-4620]
yak; potassium iodide;invitrogas production technique; volatile fatty acid; digestive enzyme activity
10.3969/j.issn.1006-267x.2017.12.044
S823
A
1006-267X(2017)12-4613-08
2017-06-05
国家自然科学基金(31660673);国家重点研发计划(2016YFD0500504-4);国家国际科技合作专项项目(2015DFG31870);国家重点基础研究发展计划(973项目)(2012CB722906);青海省重大科技平台建设项目(2013-Z-Y03)
范小红(1992—),女,甘肃定西人,硕士研究生,研究方向为饲草料营养价值评价。E-mail: 1642246477@qq.com
*通信作者:郝力壮,副研究员,E-mail: lizhuanghao1122@foxmail.com;刘书杰,研究员,硕士生导师,E-mail: mkylshj@126.com
*Corresponding authors: HAO Lizhuang, associate professor, E-mail: lizhuanghao1122@foxmail.com; LIU Shujie, professor, E-mail: mkylshj@126.com
(责任编辑 王智航)

