生物质焦CO2高温气化反应动力学研究
袁聪聪, 王宇栋, 张丁川, 杨 斌, 戴永年
(1. 真空冶金国家工程实验室, 云南 昆明 650093; 2. 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093; 3. 昆明理工大学 冶金与能源工程学院, 云南 昆明 650093)
研究报告—生物质能源
生物质焦CO2高温气化反应动力学研究
袁聪聪1,2,3, 王宇栋1,2,3*, 张丁川1,2,3, 杨 斌1,2,3, 戴永年1,2,3
(1. 真空冶金国家工程实验室, 云南 昆明 650093; 2. 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093; 3. 昆明理工大学 冶金与能源工程学院, 云南 昆明 650093)
利用同步热分析仪,采用程序升温法研究了生物质焦CO2气化反应速率特性,主要考察了升温速率对生物质焦气化反应性的影响,并用Friedman-Reich-Levi法对其动力学参数进行了计算。结果表明:DTG曲线峰值温度和最大反应速率随着升温速率的增大而增大;以二氧化碳作保护气,改变升温速率,当升温速率为15 ℃/min时,热解得到的生物质焦的反应活性最好,即气化速率最快;升温速率越大,反应速率随着温度的变化越明显;生物质焦气化阶段的活化能在-4 984.41~1 408.39 kJ/mol之间变化,气化的反应过程复杂。
生物质颗粒;二氧化碳;程序升温法;气化;热分析动力学;Friedman-Reich-Levi法
生物质分布广泛,是一种清洁丰富的可再生能源[1],其利用问题日益得到重视。CO2在地球上贮量极为丰富[2],在大气中的体积分数约为0.03 %~0.04 %,总量约为2.75×1012t。生物质焦CO2气化是利用CO2作为气化剂,在高温下通过热化学反应将生物质焦的可燃部分转化为可燃气,不但利用生物质[3]而且实现二氧化碳的减排。生物质通过气化生成氢气和一氧化碳等合成气,这些合成气可以通过进一步转化产生汽油、柴油等化工产品[4]。对生物质气化的动力学进行分析具有重要意义,常用的动力学分析方法中,以Flynn-Wall-Ozawa(FWO)法[5-6],Kissinger-Akahira-Sunose(KAS)法[7-8]和Friedman法[9-10]为代表的多重扫描速率法,是指用不同加热速率下所测得的多条热分析曲线上同一转化率(α)处的数据,故又称等转化率法[5]。等转化率法能在不涉及动力学模式函数的前提下,获得较为可靠的活化能(Ea)值,可以用来对单个扫描速率法的结果进行验证,而且可以通过比较不同的α下的Ea值来核实反应机理在整个过程中的一致性[11]。董存珍等[12]在750~1 000 ℃对4种生物质进行了CO2等温气化实验。与等温法相比,程序升温法具有实验少、温度区域宽、给出的信息多等特点[13-15]。东北大学的于庆波等[16]以程序升温法来研究煤焦CO2气化反应,结果表明,相同时间内升温速率越大,煤焦的碳转化率越高。 但目前国内尚未出现采用程序升温法研究生物质焦二氧化碳气化。生物质焦的气化过程是决定气化炉速率的关键步骤,开展生物质焦气化动力学的研究可以为气化炉的合理设计、运行提供非常重要的信息[17]。因此,本研究采用综合热分析仪,模拟气化炉中生物质热解的真实情况,使生物质的热解和热解得到的生物质焦气化2个过程连续进行,主要考察了升温速率对生物质焦气化反应的影响,并探讨了生物质焦CO2高温气化的反应动力学。
1 实 验
1.1 材料、试剂与仪器
实验所用生物质颗粒由昆明某厂提供,是木屑和秸秆的压缩混合物,样品呈圆柱状,直径8 mm,长度在10 mm左右。对实验材料进行工业分析、元素分析和热值分析,材料的物性参数(以空气干燥基计)工业分析为:水分3.22 %、灰分4.79 %、挥发分75.41 %、固定碳16.58 %;元素分析:S 0.03 %、H 6.04 %、C 49.18 %、N 0 %、O 44.75 %;低位热值17.69 MJ/kg。
所用工业二氧化碳(体积分数99 %)、保护气高纯氩气(体积分数99.99 %),均为昆明梅塞尔公司生产。实验仪器为NETZSCH公司生产的STA449F3同步热分析仪。
1.2 热重实验
为消除系统误差,在测试样品之前先做一个与实验条件相同的基线进行校准。
称取8 mg样品置于热天平支架的刚玉坩埚内,升温范围设为20~1 100 ℃,动态二氧化碳流量为25 mL/min,保护气高纯氩气流量为20 mL/min,分别按升温速率10、15和20 ℃/min进行热重分析,得到热失重(TG)曲线和微分热失重(DTG)曲线。
2 结果与分析
2.1 热重实验结果
样品的TG和DTG曲线如图1所示。

图1 生物质颗粒在3种升温速率下的热失重和微分热失重曲线Fig. 1 The TG and DTG curves of biomass particles under three kinds of heating rate
由图1可见,3种升温速率下生物质的失重过程均可分为3个阶段:第一阶段在200 ℃之前,失重发生很小的变化,是原料脱除表面水、化学结合水和发生少量解聚反应导致的[18-19];第二阶段,200~400 ℃,为快速热解阶段,TG曲线快速下降,DTG出现一个明显的峰,是由部分半纤维素和大量纤维素热解析出挥发分所致[20];第三阶段,400 ℃至气化结束,曲线上的水平线起点表示气化结束,主要剩余物是灰分。生物质焦的气化主要发生在第三阶段,即第二阶段热解获得的生物质焦随着温度的进一步升高而气化。由图1可知,升温速率会影响第三阶段的失重和失重速率,达到最大失重速率时的温度会随着升温速率的增大而升高,失重和失重速率并不是严格地随着升温速率的增加而减小(见图1(a)中的第2条曲线)。这和于庆波等研究升温速率对煤焦气化反应的影响所得出的升温速率越大,煤焦的碳转化率越高的结论是不同的[16]。这是由不同升温速率制备得到的生物质焦的气化活性不同导致的,较高的升温速率下,生物质裂解生成更多的大分子碎片,这些大分子碎片在升温时发生二次反应的几率增大,而低升温速率更有利于生物质热解小分子气体的产生,使制备的生物质焦的碳微晶中可能含有更多的晶格缺陷,提高了反应活性,但升温速率太低,制备的生物质焦炭可能会存在沉积化趋势,而沉积炭能够抑制焦炭的气化反应,与乱层炭相比,沉积炭降低了焦炭表面的活性[21]。张瑜等[22]在氮气气氛下考察了不同升温速率(5、8、10、15、20、40、80 ℃/min)对制备的生物质半焦气化特性的影响,发现随着升温速率的增大,半焦的反应活性先增大后减小,当升温速率为15 ℃/min时,生物质焦的反应活性最好。本研究中当升温速率为15 ℃/min时,生物质焦的反应活性也最好,气化速率最快,与张瑜等的研究结果一致。
2.2 热重数据处理
根据实验得到的失重曲线,可计算出生物质焦CO2气化时的碳转化率(α)及气化反应速率(r)[12],计算方法如式(1)和式(2)所示。
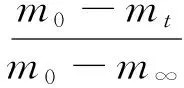
(1)

(2)
式中:α—t时刻碳的转化率;r—瞬时气化反应速率,%/min;m0—样品气化开始时刻生物质焦质量百分比,%;mt—气化过程中t时刻生物质焦的质量百分比,%;m∞—气化结束时的剩余质量百分比,%。式中涉及的质量百分比均相对于初始质量来计算。
依据式(1)和式(2),结合该段热失重数据进行计算,可得到生物质焦的碳转化率-温度关系图(见图2)和生物质焦的碳气化反应速率-温度关系图(见图3)。

由图2可知,400~736 ℃段,相对于15和20 ℃/min 的碳转化率-温度曲线,10 ℃/min升温速率时的碳转化率随着温度的增加变化相对缓慢,20 ℃/min的碳转化率随温度的增加与15 ℃/min下的基本相同;在736~860 ℃段,20 ℃/min下的碳转化率增加缓慢,逐渐低于10和15 ℃/min下的碳转化率,10 ℃/min下的碳转化率以较快速度增加,与15 ℃/min下的碳转化率越来越接近;860~1 100 ℃段,10 ℃/min下的碳转化率增速逐渐赶超了15 ℃/min下的碳转化率增速,并最先结束气化反应。由图3可知,随着温度的升高,不同升温速率下的气化反应速率变化趋势相近,但变化大小差别较大,升温速率越大,反应速率增加或减少越明显。
由此得出升温速率对生物质焦的转化率存在影响。吴一等[23]研究了升温速率对碳还原钛铁矿过程中合金密度的影响,罗健等[24]研究了升温速率对于钙基吸收剂脱碳性能的影响,参考上述文献推测,较低的升温速率使得二氧化碳分子以相对充分的时间进行固相扩散,有利于二氧化碳向低价转化的同时生物质焦向高价转化,最终生成气相CO。另一方面,较低的升温速率有助于CO的及时排放,促进了生物质焦内气孔的数量和体积的降低并抑制了还原反应。随着升温速率的不断提高,单位时间内反应的气体释放量加大,气体扩散受阻后在颗粒内部产生较大的气压,使得颗粒膨胀并冲击颗粒内部结构产生更多新的孔隙。除了孔隙导致的生物质焦内部结构的变化,颗粒内部存在温度梯度以及升温速率的提高导致传热时间减少和在同一温度段的反应时间减少也是造成生物质焦内部结构变化的因素。
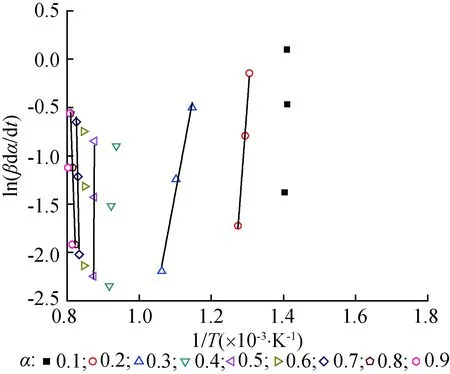
图4 3种升温速率下,基于Friedman-Reich-Levi法的等转化率分布Fig. 4 Distribution with Friedman-Reich-Levi method under different heating rate
2.3 多个升温速率组合法
求解表观活化能(Ea)和指前因子(A)采用 Friedman-Reich-Levi法[25-28], 该方法的优势在于可以避开反应结构函数f(α),不涉及任何假设与近似处理,使计算结果更接近真实情况。Friedman-Reich-Levi法的主要公式如式(3)。
(3)
式中:β—升温速率,K/min;A—指前因子,s-1;Ea—表观活化能,kJ·mol-1;R—摩尔气体常数,8.314 J·mol-1·K-1;T—温度,K。

表1不同失重率下生物质焦CO2气化阶段的活化能
Table1TheactivationenergyofbiocharCO2gasificationstageunderdifferentmassloss
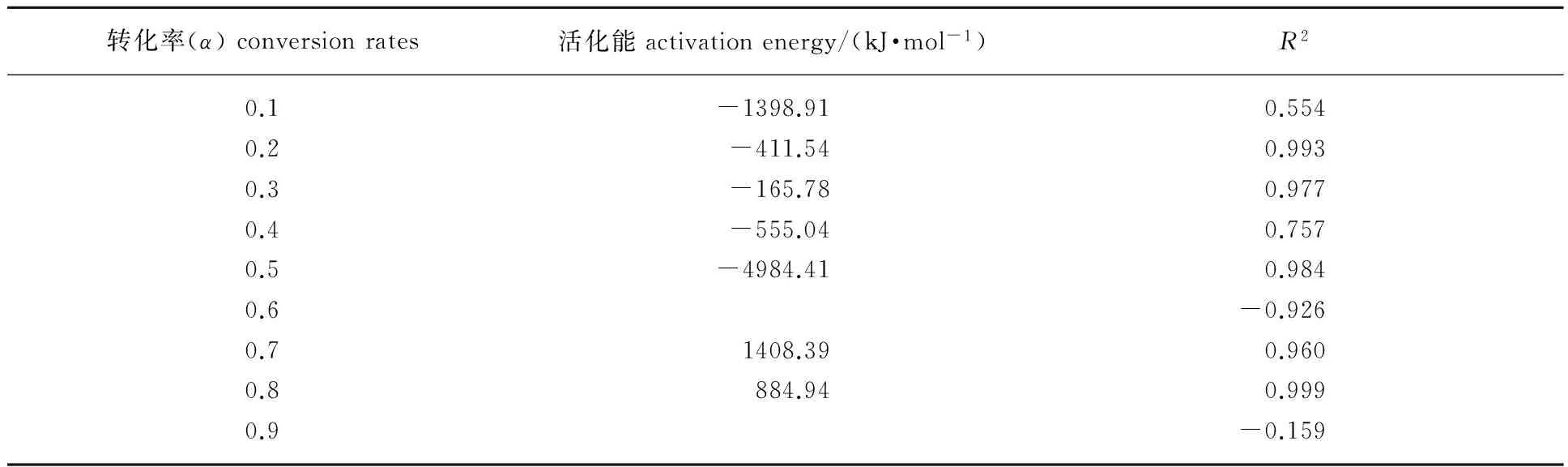
转化率(α)conversionrates活化能activationenergy/(kJ·mol-1)R20.1-1398.910.5540.2-411.540.9930.3-165.780.9770.4-555.040.7570.5-4984.410.9840.6-0.9260.71408.390.9600.8884.940.9990.9-0.159
由表1可见,生物质焦气化阶段,在转化率为0.1、0.4、0.6和0.9时线性拟合校正决定系数(R2)的大小出现负值或者正值距离1较远,因此认为这4个转化率下的数据拟合失败或线性差。失败原因可能是这几个转化率时刻的生物质焦的结构差异较大,加上不同的升温速率的影响,造成气化反应差别较大。生物质气化表观活化能变化快速,表明反应不断进行且复杂,多个升温速率下,表观活化能在-4 984.41~1 408.39 kJ/mol之间变化。
3 结 论
利用同步热分析仪,采用热失重技术和多升温速率法,研究了不同升温速率下,二氧化碳气氛下生物质焦的气化反应活性和表观活化能变化,研究结果表明升温速率为15 ℃/min时热解得到的生物质焦的反应活性最好,即气化速率最高;升温速率在不同温度段对生物质焦气化反应速率影响显著。升温速率越大,反应速率随着温度的变化越明显;生物质焦气化阶段的活化能在-4 984.41~1 408.39 kJ/mol间变化,生物质焦CO2气化的反应过程较为复杂。
[1]CAPUTO A C,PALUMBO M,PELAGAGGE P M,et al. Economics of biomass energy utilization in combustion and gasification plants: Effects of logistic variables[J]. Biomass and Bioenergy,2005,28(1):35-51.
[2]何琨,丁蕙,吴德荣,等. 芳烃抽提法优化乙烯联合装置的裂解原料[J]. 石油化工,2006,35(9):872-876.
[3]刘国喜,庄新姝,夏光喜. 生物质气化技术讲座:(一)生物质气化是生物质能高层次利用的良好途径[J]. 农村能源,1999,87(5):20-22.
[4]解庆龙,孔丝纺,刘阳生,等. 生物质气化制合成气技术研究进展[J]. 现代化工,2011(7):16-20.
[5]OZAWA T. A new method of analyzing thermogravimetric data[J]. Bulletin of the Chemical Society of Japan,1965,38(11):1881-1886.
[6]FLYMN J H,WALL A J. A quick direct method for the determination of activation energy from thermogravimetric data[J]. Journal of Polymer Science Part C: Polymer Letters,1966,4(5):323-328.
[7]KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry,1957,29(11):1702-1706.
[8]OZAWA T. Estimation of activation energy by isoconversion methods[J]. Thermochimica Acta,1992,203(1):159-165.
[9]FRIEDMAN H L. Kinetics of thermal degradation of char-forming plastics fromthermogravimetry: Application to a phenolic plastic[J]. Journal of Polymer Science Part C: Polymer Symposia,1964,6(1):183-195.
[10]OZAWA T J. Applicability of Friedman plot[J]. Thermochimica Acta,1986,31(3):547-551.
[11]胡荣祖,史启祯,高胜利,等. 热分析动力学[M]. 第二版.北京:科学出版社,2008:117.
[12]董存珍,汪小憨,曾小军,等. CO2气氛下生物焦气化反应动力学参数的实验研究:Ⅰ.活化能[J]. 燃料化学学报,2014,42(3):329-334.
[13]WHITE J E,CATALLO W J,LEGENDRE B L. Biomass pyrolysis kinetics: A comparative critical review with relevant agricultural residue studies[J]. Journal of Analytical and Applied Pyrolysis,2011,91(1):1-33.
[14]WANG W,ZHANG L,SHAO G,et al. Investigation of non-isothermal and isothermal gasification process of coal char using different kinetic model[J]. Journal of the Institute of Electronics and Information Engineers,2015(25):15-21.
[15]MENÉNDEZ C J,TAVANI E L,NOLASCO E J. Kinetic study of the isothermal and nonisothermal chlorination of a scheelite-wolframite concentrate with chlorineand sulphur dioxide[J]. Thermochimica Acta,1999(338):103-112.
[16]于庆波,李朋,秦勤,等. 煤焦-CO2高温气化反应特性的实验研究[J]. 东北大学学报:自然科学版,2009,30(12):1763-1766.
[17]KAJITANI S,SUZUKI N,ASHIZAWA M,et al. CO2gasification rate analysis of coal char in entrained flow coal gasifier[J]. Fuel,2006,85(2):163-169.
[18]刘荣厚,牛卫生,张大雷. 生物质热化学转化技术[M]. 北京:化学工业出版社,2005.
[19]刘仁庆. 纤维素化学基础[M]. 北京:科学出版社,1985.
[20]田红,廖正祝. 粤西地区生物质热解特性及其动力学[J]. 太阳能学报,2015,36(3):641-646.
[21]徐秀峰,崔洪,顾永达,等. 煤焦制备条件对其气化反应性的影响[J]. 燃料化学学报,1996,24(5):404-410.
[22]张瑜,邹志祥,闵凡飞,等. 生物质半焦CO2气化反应活性的实验研究[J]. 煤炭学报,2008,33(5):579-582.
[23]吴一,王鑫,邹正光. 升温速率对钛铁矿原位合成GT35 钢结硬质合金的影响[J]. 材料工程,2010(z2):106-109.
[24]罗健,禚玉群,冯武军,等. 煅烧升温速率对于钙基吸收剂脱碳性能的影响[J]. 化工学报,2009,60(8):2089-2094.
[25]YIP K,TIAN F J,HAYASHI J,et al. Effect of alkali and alkaline earth metallic species oil biochar reactivity and syngas compositions during steam gasification[J]. Energy Fuels,2009,24(1):173-181.
[26]ZHENG Y,CHI H,WANG W,et al. Application and comparison of equal conversion rate methods in the decomposition kinetics research[J]. Coal Conversion,2006,29(4):34-38.
[27]FRIEDMAN H L.Kinetics and gaseous products of thermal position of polymers[J]. Journal of Macromolecular Science: Part A-Chemistry,1967(41):57.
[28]REICH L,LEVI W. Dynamic thermogravimetric: Analysis in polymer degradation[J]. Journal of Polymer Science:Macromolacular Reviews,1967(1):173-275.
Kinetic Study on Biomass Char CO2Gasification at High Temperature
YUAN Congcong1,2,3, WANG Yudong1,2,3, ZHANG Dingchuan1,2,3,YANG Bin1,2,3, DAI Yongnian1,2,3
(1. National Engineering Laboratory for Vacuum Metallurgy, Kunming 650093, China; 2. State Key Laboratory of Complex Non-ferrous Metal Resources Clear Utilization, Kunming 650093, China; 3. Faculty of Metallurgical and Energy Engineering,Kunming University of Science and Technology, Kunming 650093, China)
The kinetics of biomass char CO2gasification reactivity at high temperature was investigated via the temperature-programmed thermogravimetry with thermal analyzer, the influence of heating rates on gasification reactivity was studied and the kinetic parameters were calculated by Friedman-Reich-Levi method. The results showed that along with the increase of heating rate, the peak temperature of DTG curves and the maximum reaction rates increased. With carbon dioxide as shielding gas, changing the heating rate to 15 ℃/min, pyrolysis biomass char owned the best reactivity. The higher the heating rate was, the more obvious the reaction rate changed with the temperature. The activation energies of biomass char gasification stage were -4 984.41-1 408.39 kJ/mol, which indicated biomass char CO2gasification reaction process was complicated.
biomass particles;carbon dioxide;temperature-programmed thermogravimetry;gasification;thermal analysis kinetics;Friedman-Reich-Levi method
TQ35;TK6
A
1673-5854(2017)06- 0038- 05
10.3969/j.issn.1673-5854.2017.06.007
2016-10-27
云南省院士自由探索基金(2015HA016,2016HA011)
袁聪聪(1988— ),女,江苏丰县人,硕士,主要从事生物质热解气化过程及其动力学的研究工作
*
王宇栋,讲师,博士,从事化工、冶金及材料领域研究;E-mail584772219@qq.com。

