基于多孔铂纳米球的白细胞介素-8超灵敏检测电化学免疫传感方法研究
(1.内蒙古科技大学包头医学院,内蒙古 014060;2.重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016;3.重庆医科大学附属大学城医院检验科,重庆 401331)
研究与讨论
基于多孔铂纳米球的白细胞介素-8超灵敏检测电化学免疫传感方法研究
李丽娜1蒲勤丽1何荣2李俊龙3谢国明2石继飞1
(1.内蒙古科技大学包头医学院,内蒙古 014060;2.重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016;3.重庆医科大学附属大学城医院检验科,重庆 401331)
超灵敏检测白细胞介素-8(IL-8)有助于口腔癌的早期诊断。本实验采用多孔铂取代天然的辣根过氧化物酶,催化双氧水(H2O2)实现信号转化与放大,构建了一种超灵敏的IL-8无酶电化学免疫传感器。采用透射电镜(TEM)和紫外可见吸收光谱(UV-Vis)对合成的多孔铂纳米酶进行形态和性能验证, 利用交流阻抗法(EIS)、循环伏安法(CV)和方波伏安法(SWV)进行电化学性能表征。在最优的条件下,该方法的检测范围是100~5000 fg/mL,检出限为85 fg/mL (S/N=3)。将IL-8标准加入唾液中进行检测仍得到很好的结果, 该方法对辅助口腔癌的早期诊断和治疗有潜在的应用价值。
白细胞介素-8 口腔癌 多孔铂纳米球 类过氧化物酶 电化学免疫传感器
1 引言
口腔癌是全世界最常见的恶性肿瘤之一,五年生存率在50%~60%之间,每年新发病例超过50万[1]。口腔癌早期检测率低,肿瘤病灶会很快的恶化并发生转移,导致后期患者治疗困难,极大影响了术后生存率[2]。现目前临床常用的口腔癌诊断金标准为活体组织检查,但活体组织检测存在明显的不足[3]:活检具有侵入性,检测程序复杂,且需要麻醉和外科辅助;通过组织活检微小癌变可能无法检测,造成漏诊或误诊;活检结果受人为主观判定影响较大。因此,亟需建立针对口腔癌无创、早期检测的新方法,实现对口腔癌的早期诊断、治疗,减少肿瘤患者的死亡率[4]。
口腔癌中鳞癌占的比例最高[5, 6],最近研究表明,唾液中的白细胞介素8(IL-8)作为口腔癌的肿瘤标志物有着很高的特异性,对口腔癌早期诊断、治疗以及预后都具有重要意义[7, 8]。唾液是一种无创性简便易得的体液,储存方便。因此,对唾液中IL-8检测能够为临床对口腔癌辅助诊断提供一种无创、快速、简单的方法。
近年来,随着纳米技术的不断进步,研究者将纳米材料引入到生物传感中,利用纳米材料的导电性、光学特性,以及物理学特性等,提高检测的准确性、灵敏度[9-12]。其中,纳米酶的研究是最成熟的纳米技术之一[13-15]。纳米酶与天然酶相比:催化性能更高,合成简单易操作,成本低廉,性能更稳定,不易受PH、温度等环境影响,实用性更强[13, 16, 17]。在众多纳米酶材料中,铂的催化性能尤为突出[18-20]。本研究对普通的铂纳米粒子与多孔铂纳米球(MPN)进行催化性能对比,由于独特的多孔物理结构,使得MPN具有更优的电化学催化性能、类过氧化物酶特性及生物兼容性[21]。将MPN与抗体整合,特异性识别目标物。运用电化学的方法,催化H2O2发生氧化还原反应,产生电化学信号,实现信号的转化与放大,大大提高了IL-8的检测灵敏度。
本实验采用具有类过氧化酶性质的MPN与ELISA双抗体夹心的方法整合构建了一种简单的电化学免疫传感器。如图1A所示,首先,合成MPN以及抗体功能化的MPN(MPN@Ab2),具体合成见补充文献。再构建检测IL-8的电化学免疫传感器,如图1B所示,将IL-8的抗体固定到处理好的金电极表面,用胎牛血清(BSA)封闭未修饰位点。当有目标物IL-8存在时,IL-8通过抗原抗体特异性识别的原理结合到电极表面。再加入IL-8抗体功能化的MPN,在电极表面形成双抗体夹心结构。当加入一定浓度的H2O2时,H2O2被MPN催化发生氧化还原反应,产生电流信号。因MPN与天然辣根过氧化物酶相比具有超高的催化效率,且性能稳定,大大提高分析检测的灵敏度。此外,由于MPN同时也具有极好的电催化性能,可进一步扩增电流信号。运用纳米材料对传统ELISA进行改进,结合电化学超灵敏信号转化,可实现对IL-8的超灵敏检测。见图1。
2 实验部分
2.1 试剂与仪器
氯铂酸钾(K2PtCl4),上海阿达玛斯试剂有限公司;多聚环氧乙烷-甲基丙烯酸甲酯嵌段共聚物(PEO(10500)-b-PMMA(18000)),西安瑞禧生物科技有限公司;四氢呋喃(THF)、胎牛血清(BSA),美国西格玛公司;白细胞介素-8(IL-8),IL-8抗体,北京博奥森生物技术有限公司;加样缓冲液,大连宝生物工程有限公司;硝酸(HNO3),重庆川东化工有限公司;维生素C(AA),上海生工生物工程有限公司。
电化学工作站:CHI660D,上海辰华仪器有限公司;紫外-可见分光光度计:NANO-DROP1000,美国赛默飞世尔科技公司;透射电子显微镜:Hitachi-7500,日本日立公司;超声仪:昆山禾创超声仪器有限公司;恒温孵箱:DZF-6020,上海博讯实业有限公司。
2.2 MPN与MPN@Ab2的制备
参考相关文献合成MPN及MPN@Ab2[21,22]:如图2所示,将4 mg PEO(10500)-b-PMMA(18000)加入到240μL无水THF中,超声1 min完全溶解。然后将0. 5 mL的HNO3(0.1 M),1 mL的AA(0.1 M)加入到混合溶液中,超声1 min混匀。再加入760 μL去离子水,使最终体积为3 mL。放室温下反应15 h,直至溶液完全变黑。将反应完的溶液14000 rpm离心20 min,去除上清液。再用THF和超纯水洗涤,14000 rpm离心20 min,连续3次,去除未反应完的PEO(10500)-b-PMMA(18000)。4 ℃避光保存。

图1 电化学免疫传感器构建原理图A:多孔铂纳米球制备及抗体修饰示意图;B: 电化学IL-8免疫传感器检测原。
将Ab2加入到前面制备好的MPN中, 溶液中Ab2的终浓度为100 μg/mL,充分混匀,在室温下搅拌反应24 h。将反应完全的MPN@Ab2用三次连续的洗涤离心纯化,4 ℃避光保存待用[23]。
2.3 传感器的制备和检测
首先,分别用0.3和0.05 μm直径的氧化铝粉末打磨金电极,直至金电极表面光滑成镜面。将打磨好的金电极分别在超纯水、无水乙醇、超纯水中超声10 min,氮气干燥。新鲜配置食人鱼溶液(98%的H2SO4与30%的H202体积比3∶1),加10 μL食人鱼溶液于金电极表面,放置10 min,用超纯水彻底清洗电极,氮气干燥[24]。向电极表面加入IL-8 抗体(10 μL,50 μg/mL,),盖上盖防止液体蒸发,避光、室温放置10 h,探针通过Au-NH2键固定在金电极上,用去离子水清洗。滴加BSA(10 μL, 10 mg/mL)溶液在探针修饰后的金电极上,室温1 h,封闭金电极上未结合的位点,用去离子水清洗去除未结合的多余BSA。然后将不同浓度的IL-8(10 μL)溶液继续滴加在探针修饰的电极上,37 ℃孵育30 min。IL-8通过抗原抗体的特异性识别作用结合到电极表面,用去离子水清洗去除未结合的IL-8。随后将MPN@Ab2(10 μL)滴加到电极上,37 ℃孵育1 h,用去离子水清洗。电化学工作站方波伏安法检测,参数为:初始电位,-0.50 V;终止电位,0.05 V;电位增量,0.004 V;振幅,0.05 V;频率,50 Hz;静置时间,2 s。
3 结果与讨论
3.1 MPN的表征
采用透射电镜(TEM)和紫外可见吸收光谱(UV-vis)对MPN进行形态学表征。如图2A所示,MPN的透射电镜结果呈均匀分布的球形结构,平均直径约100 nm,铂纳米球上可见随机分布的大小不一的孔,平均孔径约11 nm。此外,实验对材料酶催化性能进行验证,并与铂纳米粒子做了酶催化效率对比。取相同浓度的Pt纳米粒子(PtNPs)(管2)与MPN(管3),并做了阴性对照(管1)。由于MPN多孔结构,粒子比表面积大,使得催化性能明显高于普通的PtNPs。
采用紫外可见吸收光谱对MPN进行表征(图2B)。单纯的MPN无明显吸收峰;抗体在约280 nm处有特征吸收峰。当MPN与抗体功能化形成纳米复合物后,在280 nm处出现抗体的特征峰。证明抗体与MPN结合。

图2 纳米材料表征 A.MPN透射电子显微镜成像;插图:酶的性能验证;B.纳米材料紫外分光光度计表征。
3.2 生物传感器的电化学表征
在含有[Fe(CN)6]3-/4-(5 mM)和KCl(0.1 M)的PBS (pH 7.4)中,对传感器的不同修饰过程进行了循环伏安法(CV)测定。如图3A所示:[Fe(CN)6]3-/4-在电极表面发生氧化还原反应,裸金电极出现一对较大可逆的氧化还原峰(曲线1),在电极表面修饰上Ab1后,电极的氧化还原峰电流略有降低(曲线2),这是由于抗体修饰在电极上阻碍了电子传递。在Ab1/Au表面继续修饰BSA封闭后,氧化还原峰电流进一步降低(曲线3)。当在电极表面结合了目标物IL-8后,电极的氧化还原峰电流同样下降(曲线4)。最后加入MPN@Ab2,电流进一步下降(曲线5),电流信号的改变与电阻抗的改变结果相符,表明层层修饰成功。
电极表面生物膜的形成影响电极的绝缘性质,从而导致电阻的变化,因此可利用电化学阻抗谱(EIS)分析法进一步反映电极表面的修饰过程。图3B显示的是采用Randles模式进行等效电路拟合后的阻抗图谱。结果显示:裸金电极(曲线1)电阻较小。与裸金电极相比,修饰了Ab1的电极(曲线2)电阻明显增加,这是由于Ab1在电极表面有阻止电子传递的作用。在电极上进一步修饰封闭剂BSA(曲线3)后,阻抗值进一步增大,表明电极表面电子阻碍作用增大。在加入目标物IL-8后,电极(曲线4)阻抗继续增加,表明IL-8与Ab1特异性识别结合。当加入MPN@Ab2复合物后,在电极表面形成双抗体夹心结构,电极(曲线5)阻抗进一步增加。
3.3 实验条件优化
为了使该生物传感器达到最优分析能力,实验对Ab1固定的浓度、Ab2的浓度、目标物反应的时间及H2O2的浓度进行了优化。如图4A所示,随着Ab1浓度增加,电信号也随之增加,当Ab1浓度达到50 μg.mL-1时,信号值达到高峰。随后,继续增加Ab1的浓度对信号变化影响不明显,表明过高的Ab1表面密度可产生空间位阻效应,降低杂交效率。因而我们采用的Ab1浓度为50 μg/mL,并运用于后续实验。
Ab2浓度也是影响信号输出效率的关键因素,我们对与MPN反应的Ab2浓度进行了优化。如图4B所示,随着Ab2浓度增加,电信号也随着增加,当Ab2浓度达到100 μg/mL时,信号值达到高峰。随后,继续增加Ab2的浓度对信号不再增加,表明过高的Ab2表面密度可产生空间位阻效应,降低杂交效率。因而我们采用的Ab2浓度为100 μg/mL,并运用于后续实验。
目标物IL-8在电极表面反应的时间会影响传感的器的分析结果,时间太短会导致反应不充分。因此对目标物反应的时间进行了条件优化,如图4C所示,随着反应的时间增加,电信号也相应增加,当反应的时间为35 min时,信号值达到高峰。随后,继续增加反应的时间对信号变化影响不明显。因而我们采用反应的时间为35 min,并运用于后续实验。
H2O2的浓度决定最终氧化还原反应产生的电化学信号,因此必须对H2O2的浓度进行优化。如图4D所示,随着H2O2的浓度增加,电信号也相应增加,当H2O2的浓度达到0.5 mM时,信号值达到高峰。随后,继续增加H2O2的浓度对信号变化影响不明显。因而实验采用H2O2的浓度为0.5 mM,并运用于后续实验。
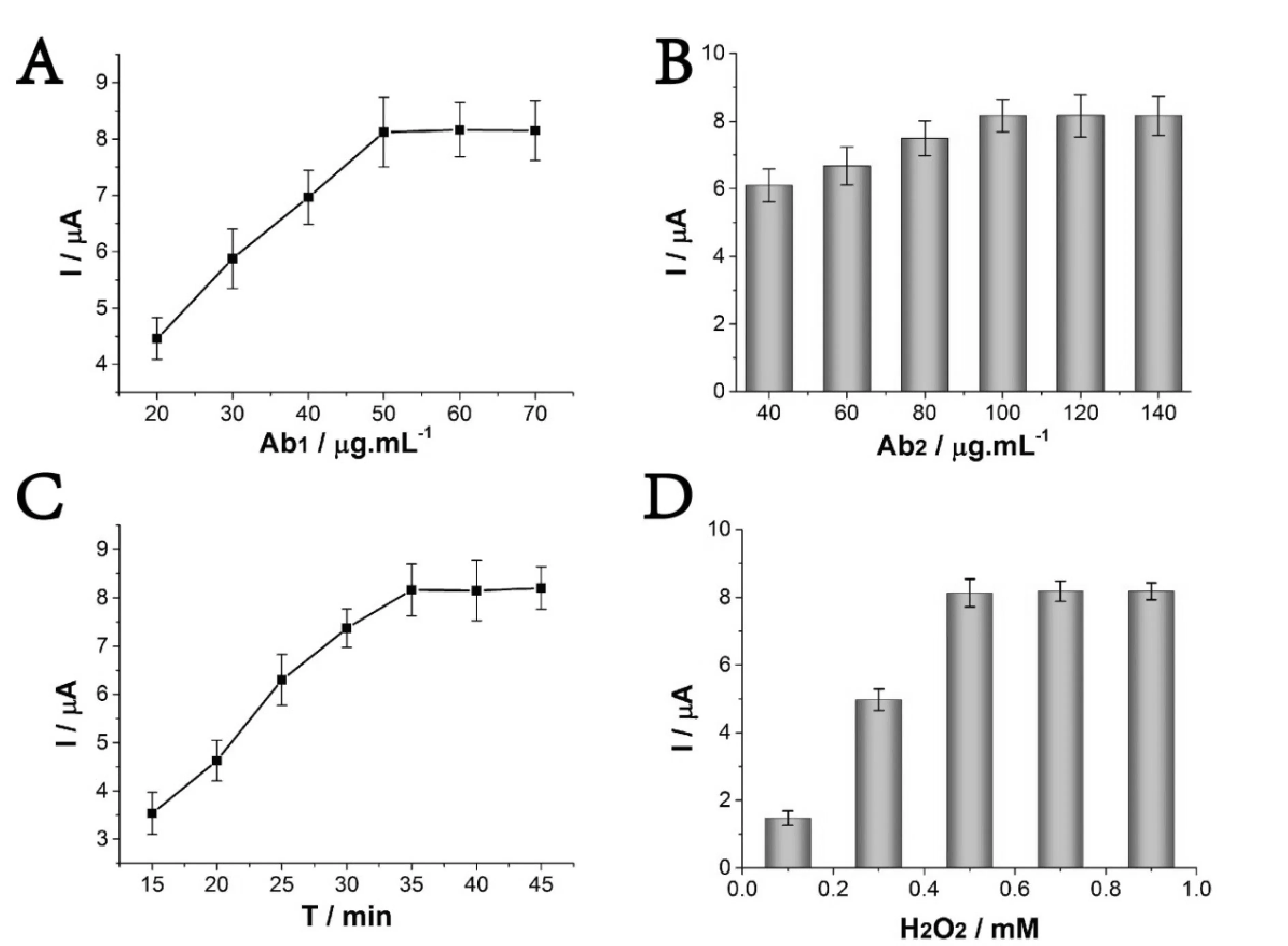
图4 实验条件优化条件优化:A.Ab1浓度响应;B. Ab2浓度响应;C.目标物在电极表面反应时间响应;D.H2O2浓度响应
3.4 生物传感器的分析性能
在最优化实验条件下,本方法的分析性能用示方波伏安法(SWV)进行评估。将0~500000 fg/mL不同浓度的目标物检测得到的结果显示在图5A。图5B说明随着目标物浓度增加,信号也随之增加。当目标物浓度在100~5000 fg/mL范围时,其回归方程为:I= 1.49 logC-1.99,相关系数R2=0.987,检出限为35 fg/mL (S/N=3),信号的增加与目标物浓度的对数有比较好的线性关系。
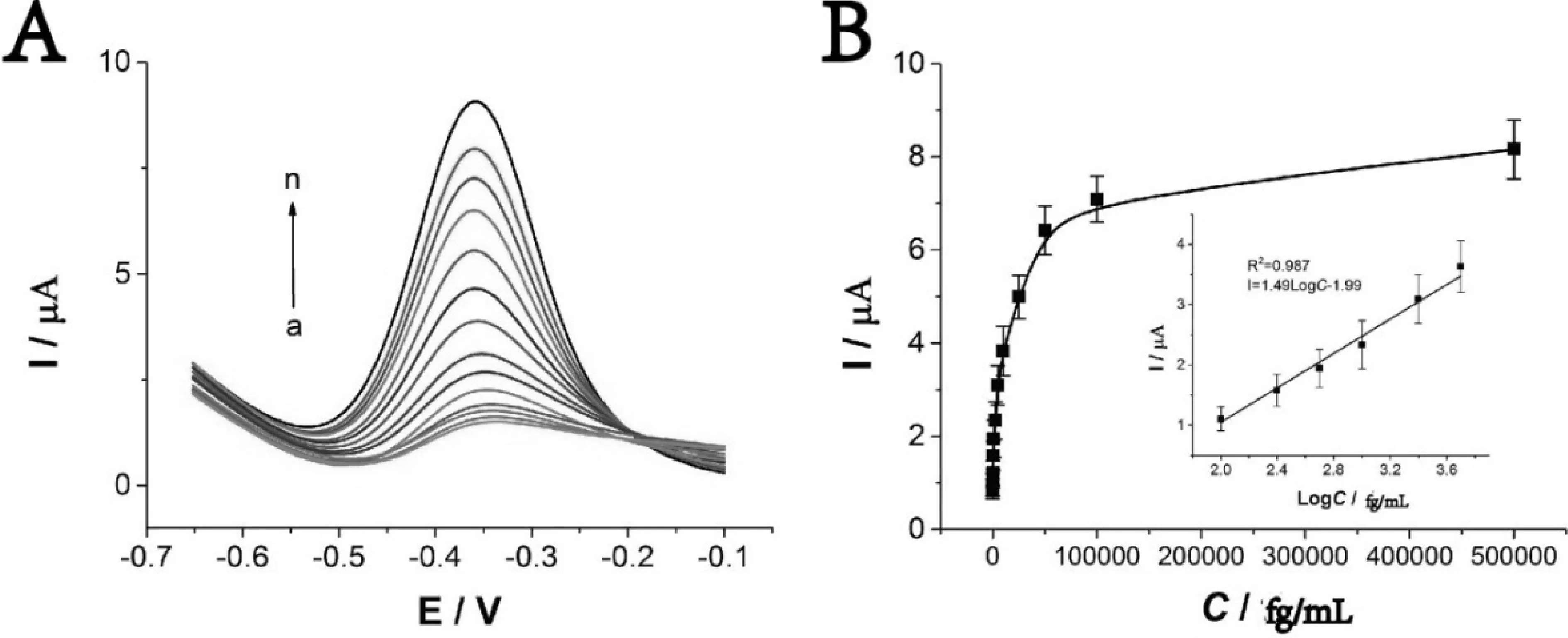
图5 免疫传感器检测线性分析A.生物传感器对不同浓度目标物的SWV电流响应图;(a-n:0 fg/mL, 10 fg/mL, 100 fg/mL, 250 fg/mL, 500 fg/mL, 1000 fg/mL, 2500 fg/mL, 5000 fg/mL, 10000 fg/mL, 25000 fg/mL, 50000 fg/mL, 100000 fg/mL, 500000 fg/mL);B.电流响应与IL-8浓度相关曲线;插图:电流响应与浓度对数关系曲线。误差线表示检测的标准差(n=3)。
3.5 特异性、重复性以及稳定性验证
对该检测方法的特异性、重复性及稳定性进行了验证。如图6A所示,选取IL-6、ATP作为IL-8检测的干扰蛋白,对检测特异性进行初步验证。结果显示在检测非目标物样本时信号有明显差异,混合样本对目标物检测也不会有干扰,表明该方法分析抗干扰能力好。如图6B所示,取低(150 fg/mL)、中(50000 fg/mL)、高(5000 fg/mL)三种浓度的目标物,分别用3根不同的电极用该方法进行检测,结果显示重复性良好。如图6C所示,将高浓度组电极存储于4 ℃冰箱,连续检测5天,结果显示该方法具有很好的稳定性。
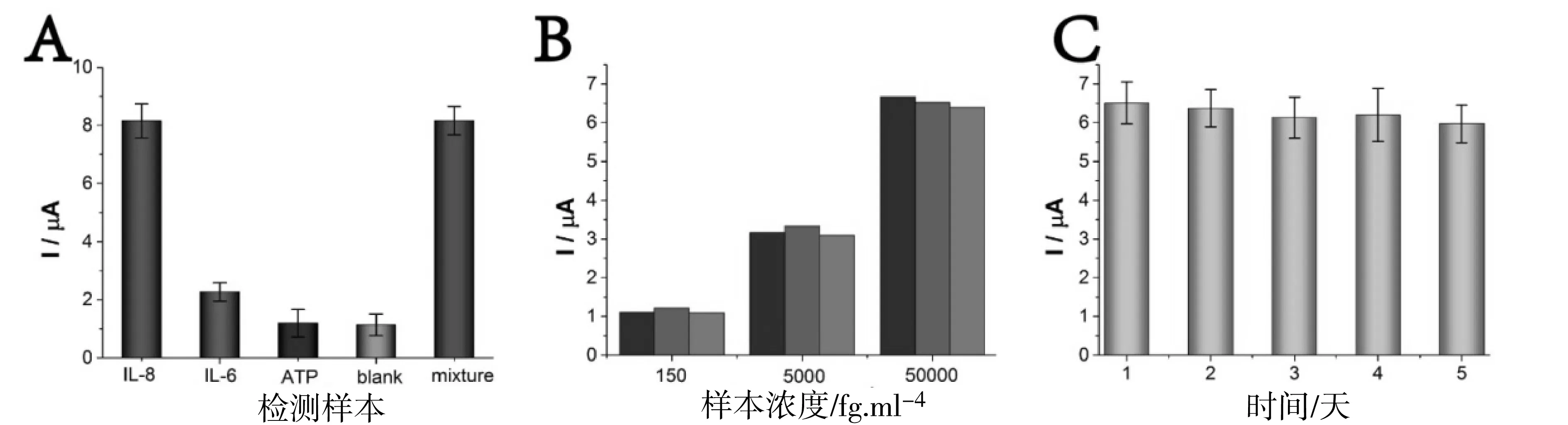
图6 电化学免疫传感器分析性能A.特异性实验;B.重复性实验;C.稳定性实验。
3.6 实际样本检测
为了验证本实验构建的电化学免疫传感器在唾液样本中的应用,将不同浓度的IL-8标准加入到健康人的唾液中,用本实验的方法进行检测,如表1所示,在唾液中的检测结果与标准加入的IL-8量大体一致。回收实验结果证明本实验构建的生物传感器准确性良好,可用于口腔癌的唾液样本的检测。

表1 将不同浓度的IL-8标准加入唾液中检测结果
4 结论
本实验建立了一种灵敏的电化学免疫传感器用于口腔癌标志物IL-8的检测。利用MPN类过氧化酶催化H2O2发生氧化还原反应实现信号扩大。本方法可实现无创、超灵敏检测,拥有低的检出限85 fg/mL和宽的检测范围100~5000 fg/mL。此外,本方法检测唾液标本也得到很好的效果。本传感器的构建为口腔癌的无创性筛查,早期诊断以及预后评估提供强有力的技术支持。
[1]温玉明, 华成舸, 王昌美, 等. 口腔癌的综合治疗. 中华口腔医学杂志, 2003, (1):页码.
[2]Herman M P, Dagan R, Amdur R J, et al. Postoperative radiotherapy for patients at high risk of recurrence of oral cavity squamous cell carcinoma. The Laryngoscope. 2015, 125 (3), 630-635.
[3]Herrero R, Castellsagué X, Pawlita M, et al. Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study. J Nati Cancer I, 2003, 95 (23), 1772-1783.
[4] Messadi D V. Diagnostic aids for detection of oral precancerous conditions. Int J Oral Sci. 2013, 5 (2), 59-65.
[5]Kaseb H O, Fohrer-Ting H, Lewis D W, et al. Identification, expansion and characterization of cancer cells with stem cellproperties from head and neck squamous cell carcinomas. Exp Cell Res. 2016, 348 (1), 75-86.
[6] Hasegawa T, Yanamoto S, Otsuru M, et al. Retrospective study of treatment outcomes after postoperative chemoradiotherapy in Japanese oral squamous cell carcinoma patients with risk factors of recurrence[J]. Oral surgery, oral medicine, Oral Patholog Oral Rad. 2017, 123(5): 524-530.
[7]Punyani S R, Sathawane R S. Salivary level of interleukin-8 in oral precancer and oral squamous cell carcinoma. Clin Oral Invest. 2013, 17(2): 517-524.
[8]Fujita Y, Okamoto M, Goda H, et al. Prognostic significance of interleukin-8 and CD163-positive cell-infiltration in tumor tissues in patients with oral squamous cell carcinoma. PloS one. 2014, 9(12): e110378.
[9]Pu Q, Li J, Qiu J, et al. Universal ratiometric electrochemical biosensing platform based on mesoporous platinum nanocomposite and nicking endonuclease assisted DNA walking strategy. Biosensors Bioelectron.2017, 94: 719-727.
[10]Liu K, Dong H, Deng Y. Recent Advances on Rapid Detection of Pesticides Based on Enzyme Biosensor of Nanomaterials. J Nanosci Nanotechn,2016,16(7): 6648-6656.
[11] Plesa C, Verschueren D, Pud S, et al. Direct observation of DNA knots using a solid-state nanopore. Nat Nanotechnol,2016, 11 (12): 1093-1097.
[12] Pelossof G, Tel-Vered R, Elbaz J, et al. Amplified biosensing using the horseradish peroxidase-mimicking DNAzyme as an electrocatalyst. Anal Chem,2010, 82(11): 4396-4402.
[13] Xia X, Zhang J, Lu N, et al. Pd-Ir core-shell nanocubes: a type of highly efficient and versatile peroxidase mimic. ACS Nano, 2015, 9(10): 9994-10004.
[14] Chang H, Zhang H, Lü J,et al. Pt NPs and DNAzyme functionalized polymer nanospheres as triple signal amplification strategy for highly sensitive electrochemical immunosensor of tumour marker. Biosensors Bioelectron,2016,86:156-163.
[15] Jia H, Yang D, Han X, et al. Peroxidase-like activity of the Co 3 O 4 nanoparticles used for biodetection and evaluation of antioxidant behavior. Nanoscale, 2016, 8(11): 5938-5945.
[16] Tao Y, Ju E, Ren J, et al. Bifunctionalized Mesoporous Silica-Supported Gold Nanoparticles: Intrinsic Oxidase and Peroxidase Catalytic Activities for Antibacterial Applications.Adv Mater,2015,27 (6):1097-1104.
[17] Fan J, Yin J J, Ning B, et al. Direct evidence for catalase and peroxidase activities of ferritin-platinum nanoparticles. Biomaterials,2011, 32(6): 1611-1618.
[18] Li W, Chen B, Zhang H, et al. BSA-stabilized Pt nanozyme for peroxidase mimetics and its application on colorimetric detection of mercury (II) ions. Biosensors Bioelectron,2015,66,251-258.
[19] Jin L, Meng Z, Zhang Y, et al. Ultrasmall Pt Nanoclusters as Robust Peroxidase Mimics for Colorimetric Detection of Glucose in Human Serum. ACS Applied Materials amp; Interfaces,2017,9 (11):10027-10033.
[20] Chen W, Fang X, Li H, et al. DNA-mediated inhibition of peroxidase-like activities on platinum nanoparticles for simple and rapid colorimetric detection of nucleic acids. Biosensors Bioelectron,2017,94,169-175.
[21] Jiang B, Li C, Malgras V, et al. Mesoporous Pt nanospheres with designed pore surface as highly active electrocatalyst. Chem Sc, 2016, 7(2): 1575-1581.
[22] Jiang B, Li C, Tang J, et al. Tunable-Sized Polymeric Micelles and Their Assembly for the Preparation of Large Mesoporous Platinum Nanoparticles. Angew Chem Internat Edit,2016,55(34):10037-10041.
[23] Yang J, Shen H, Zhang X, et al. A novel platform for high sensitivity determination of PbP2a based on gold nanoparticles composited graphitized mesoporous carbon and doxorubicin loaded hollow gold nanospheres. Biosensors Bioelectron,2016,77:1119-1125.
[24] Li J, Chen Z, Xiang Y, et al. An electrochemical biosensor for double-stranded Wnt7B gene detection based on enzymatic isothermal amplification. Biosensors Bioelectron, 2016, 86: 75-82.
2017-06-26
李丽娜,女,1974年出生,硕士,副教授,主要从事生物化学和分子生物学研究,E-mail:495847904@qq.com。
*
石继飞,男,1967年出生,主要从事医用物理学和生物学传感技术研究,E-mail:2568819350@qq.com,shijifei67@163.com。
信息简讯
长春光机所红外弱小目标处理研究获进展
随着红外成像相关产业的兴起,红外成像技术具有的隐蔽性好、探测范围广、定位精度高、穿透距离远,以及轻质小巧、低耗可靠等优点备受青睐,已成为当前智能化光电探测发展的主流方向。然而,红外弱小目标的图像细节特征少、信噪比低等特点成为红外图像应用的瓶颈,如何提高红外弱小目标成像效果成为目前的研究热点。
近日,中国科学院长春光学精密机械与物理研究所针对红外弱小目标超分辨率复原中出现的问题,对传统POCS超分辨率复原算法进行了优化,提出了改进算法,提高了复原算法的性能,同时使其达到实时或接近实时,进而可以在实际红外图像处理系统中应用。研究成果对于红外弱小目标识别与跟踪发展具有重要现实意义。
该项研究以“复原为本”为研究着眼点,利用超分辨率复原相关理论和技术,研究红外弱小目标超分辨率复原的方法和技术。
该项研究提出了四种改进的POCS算法和一种新的超分辨率复原评价方法,并分别通过基于红外动态场景仿真系统实验和基于红外图像采集及处理系统实验,验证了改进算法和评价方法的有效性。研究的主要工作及创新之处在于:
(1)针对传统POCS复原方法对噪声比较敏感的问题,将目前去噪效果较好的BM3D滤波方法和POCS复原方法相结合,对BM3D方法进行优化,提出了使用图像块的均值预筛选和限制分组图像块数目的方法,降低了BM3D方法的运算量。
(2)针对传统的超分辨率复原评价体系只关注图像某一方面统计特性的问题,提出了基于SSIM_NCCDFT的超分辨率复原评价方法。该评价方法结合了空间域的灰度均值、对比度以及频域自相关,能够同时评价超分辨率复原结果在空间域的复原效果和对频域信息的复原精度。
(3)针对POCS超分辨率复原算法迭代时间较长,无法满足光电探测系统实时性的问题,提出了基于梯度图的快速POCS超分辨率复原算法。该算法根据图像的梯度分布对图像中的像素点进行分类,采用不同的迭代系数进行计算。改进算法能够较好的保留边缘信息并抑制噪声,进而在保证超分辨率复原性能的基础上缩短了运算时间。同时,提出了另外一种改进算法:基于区域选择的快速POCS超分辨率复原算法。光电探测系统中我们关注的重点是目标区域,而这一区域通常只占很少的像素位置,因此通过阈值分割和合并找到所有目标区域并集,然后仅在这个目标区域并集上进行超分辨率复原。这样,去除了复原背景的巨大运算量,缩短了运算时间,使其达到实时或接近实时,进而可以在实际红外图像处理系统中应用。
相关研究成果发表在Scientific Reports上。研究工作得到了国家自然科学基金面上项目、光电对抗研究部创新基金等的支持。(长春光学精密机械与物理研究所)
Ultrasensitivedetectionofhumaninterleukin-8byelectrochemicalimmunosensorbasedonmesoporousplatinumnanospheres.
LiLina1,PuQinli1,HeRong2,LiJunlong3,XieGuoming2,ShiJifei1
(1.InstituteofMedicalTechnology,BaotouMedicalCollege,Baotou014060,China; 2.KeyLaboratoryofLaboratoryMedicalDiagnostics,MinistryofEducation,DepartmentofLaboratoryMedicine,ChongqingMedicalUniversity,Chongqing400016,China;3.ClinicalLaboratory,University-TownHospitalofChongqingMedicalUniversity,ChongqingMedicalUniversity,Chongqing401331,China)
We constructed a novel electrochemical human interleukin-8 (IL-8) immunosensor based on mesoporous platinum nanosphere (MPN) which is an non-enzymatic nanocatalyst. MPN plays an important role on the reduction of H2O2,and largely improves the sensitivity of the sensor. Transmission electron microscope (TEM) and UV-Vis absorption spectrometry were employed to characterize properties of nanomaterials. Electrochemical impedance spectroscopy (EIS), cyclic voltammetry (CV) and square wave voltammetry (SWV) were used to study the electrochemical properties of the sensor. Under optimum conditions, the amperometric signals increased linearly with the target IL-8 concentrations from 100 fg/mLto 5000 fg/mL, and the DNA sensor exhibited a detection limit as low as 85 fg/mL (S/N=3). It was also with a favorable signal response in saliva samples, which would become a simple and powerful tool to assist the early diagnosis and treatment of oral cancer.
human interleukin-8; oral carcinoma; mesoporous platinum nanosphere; mimetic peroxidase; electrochemical immunosensor
内蒙古自治区自然科学基金项目(2015MS0850);内蒙古自治区高等学校科学技术研究项目(NJZY211)。
10.3969/j.issn.1001-232x.2017.06.013

