边教边写的“好题”
江金华
广东
边教边写的“好题”
江金华

在教学中教着教着你就会有很多的想法,这些想法笔者觉得应该记录下来,编成试题,编写的这些试题是与学生互动产生的,题不是死的,而是活的,所以能与学生的心灵有交流,这才是好题。这种“好题”不但最适合学生,而且对编者能力也有很大的提升。笔者就常常在教学中写些题,记录自己课堂的内容。
例如,讲解人教版选修4化学反应原理第一章化学反应与能量时,笔者就有些想法,编写了一道有关化学反应与能量的“好题”。
【原题】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
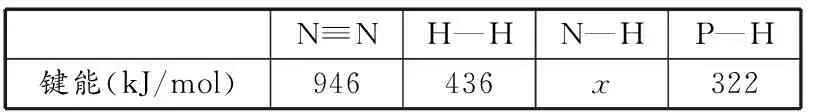
N≡NH—HN—HP—H键能(kJ/mol)946436x322
表中x=________。PH3是一种无色剧毒气体,其分子结构和NH3相似,但NH3比PH3稳定,原因是____________。
(2)工业上用NH3与镓在1 000℃高温下合成半导体材料氮化镓(GaN),同时生成氢气,每生成1 mol H2放出10.27 kJ热量。写出该反应的热化学方程式:____________。
(3)利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:




(4)1 mol NO2和1 mol CO反应生成CO2和NO过程中正反应的活化能E1=134 kJ/mol,逆反应的活化能E2=368 kJ/mol,完成图象,并标出E1、E2、ΔH,并写出NO2和CO反应的热化学方程式:____________。
【参考答案】
(1)391 PH3分子稳定性低于NH3分子,因为N—H键键能高于P—H键键能(或N的非金属比P的强)
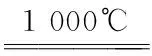
ΔH=-30.81 kJ/mol
(3)2a+2b+c
(4)



编写该题的思路:
收集生产生活与氮有关、与反应热有关的素材。首先想到的就是合成氨,收集化学键的数据,由键能与反应热关系求N—H键键能,键能与反应热的关系是化学反应与能量的章节的重点知识,作为同步练习这个内容是必考的问题;而后想到NH3与Ga反应生成半导体材料GaN,查数据,设计成热化学方程式的书写题,也有信息方程式书写的影子,适合学生练习信息方程式的书写与热化学方程式的书写;再又想到N与环境的关系,用氨水吸收污染气体考查盖斯定律的内容,盖斯定律是高考的热点;最后考查活化能与ΔH之间的关系,用绘图表示出来,对学生能力要求较高,但能让学生明白吸热反应、放热反应的宏观解释。
评价:
化学学科知识有四重表征:宏观、微观、符号与图象,这道题以学生熟悉的元素N及其化合物为载体,巧妙地把《考试大纲》中“化学反应中能量转化的原因”这一知识点的四重表征全部考查到。第一问从微观角度考查,实质上是对化学变化中能量变化本质的理解的考查,同时让解释NH3与PH3稳定性差异的原因,是键能的应用,体现引入键能物理量的价值所在,即让学生不仅能从非金属性角度解释NH3比PH3稳定,更要能从能量角度本质理解。第二问是书写热化学方程式,是从宏观与符号角度考查,使学生理解物质变化是能量变化的基础,同一个反应,参加反应(或生成)的物质多,放出的能量也多,是从不同角度考查对化学反应的认识。第三问考查盖斯定律,是新课标新引入的内容之一,体现化学物质、化学反应之间的关联性,考查学生的计算能力,且涉及4个化学反应,难度较大;第四问考查活化能与能量变化的内在原因,且用画图的形式考查,要求把E1、E2标出,必须完全理解才能准确画出图象,能力要求高。
试题标签如下:

小题号考点知识层次学习能力要求学科能力层级划分学科特色问题类型(1)化学键与反应热计算理解接受、吸收、整合化学信息的能力 A3:说明论证 化学定量计算,简答基础性问题;发展性问题 (2)热化学方程式书写 理解分析问题和解决(解答)化学问题的能力B1:分析解释 化学用语基础性问题 (3)盖斯定律理解分析问题和解决(解答)化学问题的能力B2:推理预测 化学定量计算 基础性问题 (4)总能量与反应热的关系及活化能 理解分析问题和解决(解答)化学问题的能力B3:方案设计(简单)作图发展性问题
又比如,讲解人教版选修4《化学反应原理》至第二章化学反应速率与化学平衡时,笔者也编写了一道关于化学平衡的同步练习的“好题”,原题如下:


甲
(1)下列能说明该反应已达到平衡状态的是___________。(填序号)
a.容器内HCl(g)、O2(g)、Cl2(g)、H2O(g)的浓度之比为4∶1∶2∶2
b.v正(HCl)=4v逆(O2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)如图甲所示该反应为ΔH___________(填“>”“<”或“=”)0。
(3)在300℃时经过8 min达到平衡,v(HCl)=___________,300℃该反应的平衡常数的值K=___________。


乙
【参考答案】
(1)bc (2)< (3)0.2 mol·L-1·min-1640 (4)a
【解析】(1)恒容密闭容器浓度之比等于系数之比,只是反应中的一种情况,可能是平衡状态,也可能不是,不能作为平衡状态判定的依据,a错误;“有正有逆大小按比例”,b正确;因为m+n≠p+q,压强可以作为判定平衡的标志,c正确;恒容密闭容器且全为气体,气体密度始终不变,则密度不能作为判定平衡的标志,d错误。故选bc。(2)由图可知温度升高平衡逆向移动,HCl的转化率下降,平衡向着吸热反应方向移动,则正反应方向放热,故ΔH<0。(3)利用三段法求算。

c起始(mol·L-1) 2 0.5 0 0
Δc(mol·L-1) 1.6 0.4 0.8 0.8
c平衡(mol·L-1) 0.4 0.1 0.8 0.8

(4)与第一个容器相比,第二个容器相当于减少了O2的用量,则平衡逆向移动HCl转化率下降,则应是a曲线符合。
编写该题的思路:

评价:
化学平衡是四大平衡之基础,是化学原理学习之基础。其重要考点是概念、化学平衡移动原理以及围绕化学平衡常数K的计算,本题几乎都有涉及。但从另一方面分析试题,第一问考查不同条件下化学反应是否处在平衡状态,实质上是考查对化学平衡状态的深刻理解,是概括关联性问题,属于基础性问题;第二问主要考查识图能力,获取信息能力;第三问解决的基础仍然是准确获取信息,所以,依然重点考查获取信息能力;第四问是判断选择,在深度理解的基础上做出选择判断,能力要求较高,是发展性问题。所以,从能力学习要求角度分析是道“好题”。

小题号考点知识层次学习能力要求学科能力层级划分学科特色问题类型(1)化学平衡判定理解问题解决能力 A2:概况关联 基础性问题 (2)反应热与ΔH关系理解获取信息能力、问题解决能力B1:分析解释 基础性问题 (3)反应速率与平衡常数计算 理解问题解决能力 C1:综合问题 定量计算发展性问题 (4)平衡移动应用获取信息能力、问题解决能力C3:创新思维 发展性问题

广东省肇庆市怀集县怀集中学)

