差量法在中学化学中的应用
内蒙古 王晓波
差量法在中学化学中的应用

差量法是根据在化学反应中反应物与生成物的差量和造成这种差量的实质及其关系,列出比例式求解的解题方法。一般说来, 化学反应前后凡有质量差、气体体积差、密度差、压强差等差量的问题均可运用差量法求解。解题的关键是做到明察秋毫,抓住造成差量的实质,即根据题意确定“理论差值”,再根据题目提供的“实际差量”,列出正确的比例式,求出答案。
1.质量差法
【例题1】在1 L 2mol/L的稀硝酸溶液中加入一定量的铜粉,充分反应后溶液的质量增加了13.2克,问:(1)加入的铜粉是多少克?(2)理论上可产生NO气体多少升?(标准状况)
解析:由铜与稀硝酸反应的方程式:

3 2 3×64-2×30=132
n(Cu)n(NO) 13.2
进而能求出对应的n(Cu)=0.3 mol,n(NO)=0.2 mol。
故加入的铜粉质量为0.3 mol×64 g/mol=19.2 g;理论上可产生NO气体体积为0.2 mol×22.4 L/mol=4.48 L。

解析:根据反应前后质量守恒原理,

2 30+46-44=32
n(NaNO2) 16
求得n(NaNO2)=1 mol,其质量为1 mol×69 g/mol=69 g,故生成工业盐的质量为69 g。
2.体积差法
【例题1】10 mL某气态烃在80ml氧气中完全燃烧后,恢复到原来状况(1.01×105Pa , 27℃)时,测得气体体积为70 mL,求此烃的分子式。
解析:设该气态烃的分子式为CxHy,其燃烧反应的化学方程式为:

1 (x+y/4)x1+(x+y/4)-x
10 10+80-70=20
根据比例关系得出y=4,从反应过程可以看出,符合题意的烃与其碳原子个数无关,所以烃的分子式可能是 ①CH4、②C2H4、③C3H4。
【例题2】标准状况下44.8 L CO2通入一定量的过氧化钠,充分反应后剩余的气体为33.6 L(标准状况下),则Na2O2的质量为多少?

2 2-1=1
n(Na2O2) 2-1.5=0.5 mol
根据对应关系求得n(Na2O2)=1 mol,m(Na2O2)=78 g。
3.物质的量差法


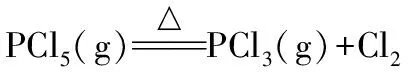
1 1
n(PCl5) 0.022 mol
根据对应关系求得n(PCl5)=0.022 mol。

【例题2】标准状况下,将4.48 L由NO和NO2组成的混合气体通入100 mL水中,气体体积缩小为2.24 L,假设溶液的体积不变,则原混合气体中NO和NO2的体积之比为________,反应过程中共转移的电子数目为________。

3 2



4.差量法的综合应用
(1)原混合物中Na2CO3和NaHCO3的质量。
(2)碱石灰中CaO和NaOH的质量。
解析:本题所涉及的化学反应有:



通过观察三个反应,①②两个反应不存在质量差,①③引起所加固体质量增加,增加的质量恰好是H2O的质量。即增加的质量20 g-9.5 g-9.6 g=0.9 g,由此得n(H2O)=0.05 mol,对应碳酸钠的物质的量为0.05 mol,其质量为0.05 mol×106 g/mol=5.3 g ,从而得出NaHCO3的质量为9.5 g-5.3 g=4.2 g。由Na2CO3和NaHCO3的质量,得出其对应的物质的量均为0.05 mol,带入②和③,求得Ca(OH)2的物质的量为0.1 mol 即n(CaO)=0.1 mol,CaO的质量为0.1 mol×56 g/mol=5.6 g,NaOH的质量为9.6 g-5.6 g=4.0 g 。
本题答案:(1)Na2CO3和NaHCO3的质量分别为5.3 g、4.2 g。
(2)碱石灰中CaO和NaOH的质量分别为 5.6 g、4.0 g。

内蒙古赤峰市林东一中)
勘误说明
《教学考试》高考化学3(适用于2017届高三复习)中,由于排版疏忽,导致第57页右栏关于恒温恒压下气体体积变化过程图出错,正确图示应为:
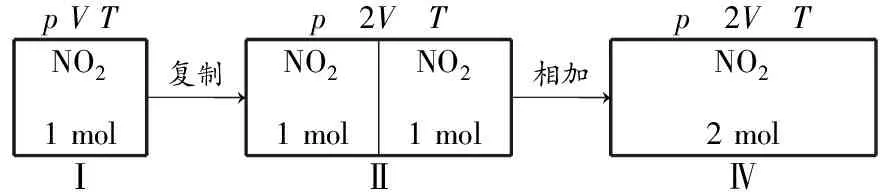
NO21molpVTⅠ复制→NO21molNO21molp 2V TⅡ相加→NO22molp 2V TⅣ
给各位读者带来不便,深表歉意。

