维药狭叶薰衣草抗炎活性部位筛选研究
新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004
维药狭叶薰衣草抗炎活性部位筛选研究
谭为张兰兰李晨阳孙玉华*
新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004
目的从薰衣草的不同提取部位中筛选出抗炎活性部位。方法采用二甲苯致小鼠耳肿胀模型和冰醋酸致小鼠腹腔毛细血管通透性模型进行抗炎活性筛选,再将活性好的部位采用细胞炎症模型进行相关分子机制的初步研究。结果XYC-3、XYC-5对二甲苯致小鼠耳肿胀实验有明显抑制作用(P<0.05);XYC-3对小鼠毛细血管通透性实验有显著抑制作用(P<0.05);XYC-3、XYC-5有明显抑制LPS诱导的NO产生,且NO水平抑制率随着提取物浓度成正比;还可抑制LPS刺激的RAW 264.7细胞中TNF-α,IL-6的产生,可有效抑制炎症因子的释放。结论XYC-3和XYC-5具有明显的抗炎作用,为薰衣草的抗炎活性部位。
薰衣草;抗炎;筛选;RAW264.7
维吾尔医常用药材薰衣草为唇形科植物狭叶薰衣草LavandulaaugustifoliaMill.的干燥地上部分,维语称薰衣草为“乌斯提胡都斯”。薰衣草作为维医常用药材已有很长历史,并被《中华人民共和国卫生部药品标准-维吾尔药分册》收载[1]。薰衣草性质为二级湿热,具有消散寒气、补胃理脑、燥湿止痛之功效,用于胸腹胀满、感冒咳喘、头晕头痛、心悸气短、关节骨痛等疾病的治疗[2]。
通过针对薰衣草的抗炎活性进行研究,首先采用二甲苯致小鼠耳肿胀模型和冰醋酸致小鼠腹腔毛细血管通透性模型对薰衣草挥发油和各极性部位进行抗炎活性筛选,再将筛选出的抗炎活性好的部位采用细胞炎症模型对其进行相关的抗炎分子机制的初步研究,以期为阐明薰衣草的抗炎药效物质基础和薰衣草的进一步开发与利用提供基础数据。
1 仪器与材料
1.1 材料 薰衣草药材(购自二道区市场,由新疆药物研究所何江副研究员鉴定为狭叶薰衣草LavandulaangustifoliaMill.);布洛芬片(西南药业股份有限公司,H20013193);RAW264.7细胞(小鼠单核巨噬细胞白血病细胞,ATCC,中国医学科学院药物研究所赠送)。1640培养基(批号8114242,美国Gibco公司);胎牛血清(批号1205331,美国Gibco公司); MTS(批号0000125533,美国Promega公司);双抗(批号J140027,美国Hyclone公司),Griess试剂盒(批号0000131725,美国Promega公司);LPS(批号:Sigma L-2880,美国Biosharp公司); TNF-αELISA试剂盒(批号E09479-1647,美国eBioscience公司);二甲苯(批号20060815,西安化学试剂厂);伊文思蓝(批号:20120917,上海化学试剂采购供应站分装厂);冰乙酸(批号:20120105,天津市福晨化学试剂厂);羧甲基纤维素钠(批号:20091224,上海山浦化工有限公司)。氯化钠注射液(新疆制药厂),食用油(中粮食品营销有限公司)。
1.2 仪器 BS124S电子天平(北京赛多利斯天平有限公司);CO2培养箱、BPN-CH(上海一恒科学仪器有限公司);TDZ5-WS多管架自动平衡离心机(上海卢湘仪离心机仪器有限公司);DSY2000X倒置荧光显微镜(重庆澳浦光电技术有限公司);RT-6100酶标仪(深圳雷杜生命科学仪器有限公司);SpectraMax M3型多功能酶标仪(美国Molecular Devices公司)。
1.3 实验动物 SPF级昆明种小鼠,雌雄各半,体重18~22 g,新疆实验动物研究中心提供,动物合格证号:No.65000200000677,许可证号:SCXK(新)2016-0001,雌雄分笼常规饲养。
2 实验方法
2.1 薰衣草提取物制备
2.1.1 水提物和挥发油制备 取薰衣草5 kg,粉碎,加水10倍量浸泡1h后回流提取2遍,收集挥发油备用。将水提液过滤,滤液减压浓缩成浸膏,将水提浸膏采用大孔树脂进行分离纯化得到不同的洗脱部位:水部分、30%乙醇部分、50%乙醇部分、70%乙醇部分、95%乙醇部分。
2.1.2 醇提物的制备 取薰衣草5 kg,粉碎,加入95%乙醇回流提取,醇提液过滤,浓缩成浸膏。将醇提浸膏加水混悬后,依次采用氯仿、石油醚、乙酸乙酯和饱和正丁醇依次萃取,得到石油醚部位、氯仿部位、乙酸乙酯部位、正丁醇部位和水部位。
2.2 薰衣草各部位的抗炎筛选试验
2.2.1 分组 取昆明种小鼠140只,按体重、性别随机分为2个空白对照组(CMC-Na组、食用油组)、11个给药组(XYC-1至XYC-11)、阳性药组(见表1),共14组,每组10只。
2.2.2 给药剂量 薰衣草提取物,参考《维药分册》,临床生药用量为3~9 g/人·d[1]。本实验取6 g生药作为临床用量,根据出膏率的不同将不同极性或萃取部位统一折算成小鼠等效用量。薰衣草精油部分,临用前加食用油稀释;其它极性部位或萃取部位,临用时加0.5%CMC-Na配成混悬液灌胃给药。具体给药剂量见表1。
2.2.3 对二甲苯致小鼠耳肿胀实验 按照“2.2.1”分组,各组按设定剂量灌胃给药,空白对照1组灌胃给予等量0.5%CMC-Na混悬液,空白对照2组灌胃给予等量的食用油,1次/d,给药3 d,末次给药后1 h,将二甲苯20 μL均匀涂抹于各组小鼠右耳廓两面致炎,以左耳作对照不做任何处理。30 min后处死小鼠,分别在左右耳对称部位用直径8 mm打孔器打下圆形耳片,精密称重,计算肿胀度和肿胀抑制率。每组小鼠耳廓肿胀度以每鼠左右耳重量之差的均值来表示。肿胀抑制率(%)=(对照组肿胀度均值-给药组肿胀度均值)/对照组肿胀度均值×100%
2.2.4 对冰醋酸致小鼠腹腔毛细血管通透性 实验按照“2.2.1”分组,各组按设定剂量灌胃给药,空白对照1组灌胃给予等量0.5%CMC-Na混悬液,空白对照2组灌胃给予等量的食用油,1d/1次,连续3d,末次给药后1 h,各组小鼠尾静脉注射0.5%伊文思蓝生理盐水溶液10 mL/kg,并立即腹腔注射0.6%冰醋酸生理盐水溶液0.2 mL/只。50 min后脱颈椎处死小鼠,用6 mL生理盐水注射洗涤腹腔,剪开腹部,吸出冲洗液,3000 r/min离心10 min,取上清液于波长590 nm处测定其吸光度(OD)值,计算药物对小鼠腹腔毛细血管通透性增高的抑制率。(抑制率(%)=(模型对照组OD590 -给药组OD590)/模型对照组OD590×100%)
2.3 薰衣草有效部位抗炎分子机制初步研究
2.3.1 细胞培养 RAW 264.7细胞于37 ℃、5% CO2及饱和湿度环境下培养于含10%胎牛血清1640培养基中,取对数生长期的细胞,于96孔培养板内以180 μL(3×104个/孔)接种孵育,孵育18~24 h后进行后续实验。
2.3.2 细胞分组与加药 将RAW 264.7细胞随机分组:正常对照组:以含10%胎牛血清的1640培养基继续培养,终体积补充至200 μL(补充液与样品溶液相同);LPS对照组:该对照组(1 μg/mL)加10 μL,终体积补充至200 μL;空白对照组:加无细胞的培养基200 μL;样品组:每孔加入薰衣草提取物10 μL,LPS 10 μL终体积达200 μL,设提取物浓度梯度为50 μg/mL,10 μg/mL,2 μg/mL样品与细胞共同孵育24 h进行相关检测。
2.3.3 RAW 264.7细胞活力和细胞释放NO的影响 孵育24 h后,分别在每孔中加入10 μL MTS混合液,继续培养4 h显色,于酶标仪490 nm波长处检测各孔的光吸收值。细胞存活率=(ODsample-OD blank)/( ODcontrol-OD blank) ×100%(OD sample:样品处理组吸光值;OD control:正常组吸光值;OD blank:培养板空白孔(无细胞)吸光值。)
采用试剂盒测NO含量,设定浓度梯度为100、50、25、2.5、6.25、3.13和1.56 μM制备标准曲线,每孔分别吸取细胞上清液100 μL于新的细胞培养板中,每孔依次分别放入50 μL磺胺溶液和50μL N-萘乙二胺盐酸,放置15 min后,于酶标仪540 nm波长处检测各孔的吸光度值。
2.3.4 ELISA法检测TNF-α含量 孵育24h后,每孔取细胞吸取上清液20 μL,稀释150倍,按ELISA试剂盒说明书进行操作,分别于酶标仪450nm波长处检测各孔的光吸收值。
2.3.5 薰衣草提取物IL-6的测定 孵育24 h后,每孔取细胞上清液50 μL,稀释10倍后按试剂盒说明书进行操作,于酶标仪450 nm波长处检测各孔吸光度值。
3 结果与分析
3.1 对二甲苯致小鼠耳肿胀的影响 薰衣草提取物XYC-1、XYC-3、XYC-4、XYC-5、XYC-6、XYC-7、XYC-8、XYC-9、XYC-11组对二甲苯致小鼠耳肿胀与空白对照组相比较有明显的抑制作用(P<0.05);XYC-3、XYC-5有及其明显抑制作用(P<0.01)。见表1。

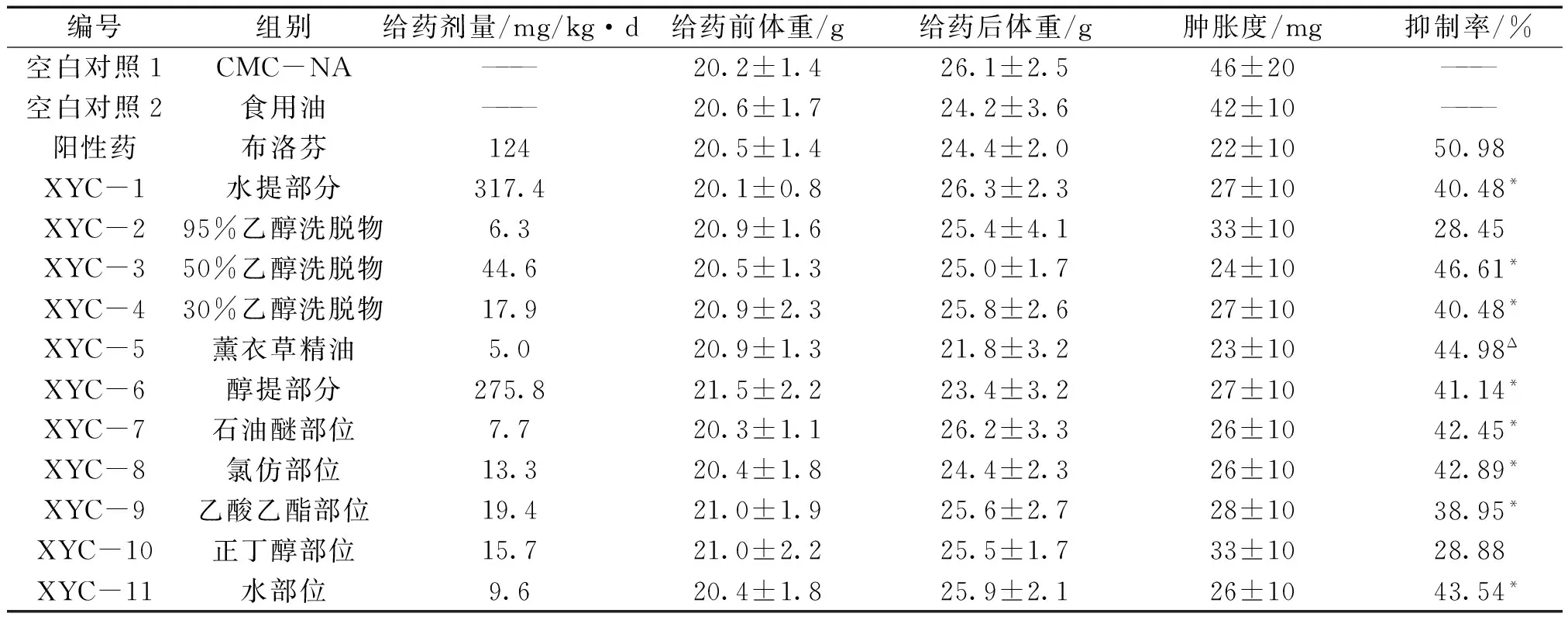
编号组别给药剂量/mg/kg·d给药前体重/g给药后体重/g肿胀度/mg抑制率/%空白对照1CMC-NA———20.2±1.426.1±2.546±20———空白对照2食用油———20.6±1.724.2±3.642±10———阳性药布洛芬12420.5±1.424.4±2.022±1050.98XYC-1水提部分317.420.1±0.826.3±2.327±1040.48*XYC-295%乙醇洗脱物6.320.9±1.625.4±4.133±1028.45XYC-350%乙醇洗脱物44.620.5±1.325.0±1.724±1046.61*XYC-430%乙醇洗脱物17.920.9±2.325.8±2.627±1040.48*XYC-5薰衣草精油5.020.9±1.321.8±3.223±1044.98ΔXYC-6醇提部分275.821.5±2.223.4±3.227±1041.14*XYC-7石油醚部位7.720.3±1.126.2±3.326±1042.45*XYC-8氯仿部位13.320.4±1.824.4±2.326±1042.89*XYC-9乙酸乙酯部位19.421.0±1.925.6±2.728±1038.95*XYC-10正丁醇部位15.721.0±2.225.5±1.733±1028.88XYC-11水部位9.620.4±1.825.9±2.126±1043.54*
注:XYC-5与空白对照2组比较,ΔP<0.05;其余与空白对照1组比较,*P<0.05。
3.2 对冰醋酸致小鼠腹腔毛细血管通透性增高的影响 薰衣草提取物XYC-1、XYC-3、XYC-4、XYC-9、XYC-10、XYC-11组与空白对照组相比较可以抑制冰醋酸致小鼠腹腔毛细血管通透性增加(P<0.05);其中XYC-3组有及其明显抑制作用(P<0.01)。

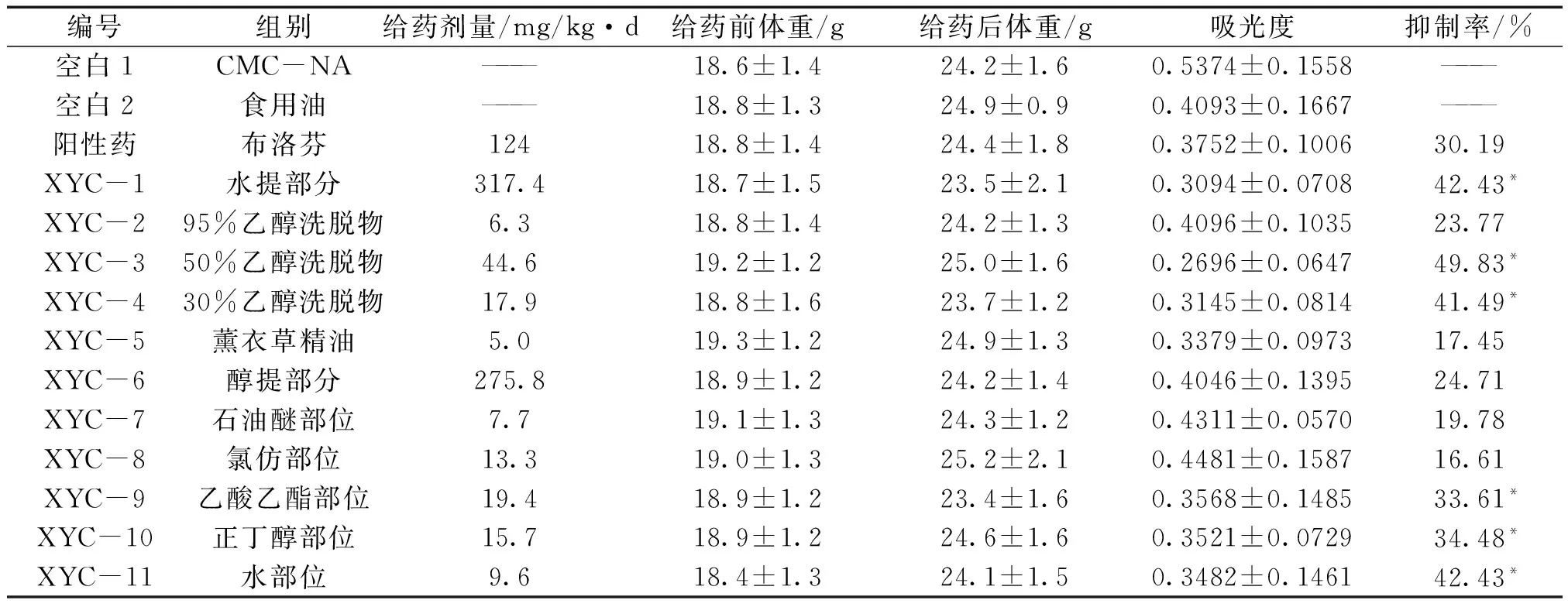
编号组别给药剂量/mg/kg·d给药前体重/g给药后体重/g吸光度抑制率/%空白1CMC-NA———18.6±1.424.2±1.60.5374±0.1558———空白2食用油———18.8±1.324.9±0.90.4093±0.1667———阳性药布洛芬12418.8±1.424.4±1.80.3752±0.100630.19XYC-1水提部分317.418.7±1.523.5±2.10.3094±0.070842.43*XYC-295%乙醇洗脱物6.318.8±1.424.2±1.30.4096±0.103523.77XYC-350%乙醇洗脱物44.619.2±1.225.0±1.60.2696±0.064749.83*XYC-430%乙醇洗脱物17.918.8±1.623.7±1.20.3145±0.081441.49*XYC-5薰衣草精油5.019.3±1.224.9±1.30.3379±0.097317.45XYC-6醇提部分275.818.9±1.224.2±1.40.4046±0.139524.71XYC-7石油醚部位7.719.1±1.324.3±1.20.4311±0.057019.78XYC-8氯仿部位13.319.0±1.325.2±2.10.4481±0.158716.61XYC-9乙酸乙酯部位19.418.9±1.223.4±1.60.3568±0.148533.61*XYC-10正丁醇部位15.718.9±1.224.6±1.60.3521±0.072934.48*XYC-11水部位9.618.4±1.324.1±1.50.3482±0.146142.43*
注:XYC-5与空白对照2组比较,ΔP<0.05;其余与空白对照1组比较,*P<0.05。
3.3 抗炎细胞实验 结果实验以LPS诱导的RAW 264.7炎症活化细胞为研究对象,评价薰衣草不同提取部位对细胞活力的影响,以及对NO和TNF-α、IL-6的抑制作用。
3.3.1 对RAW264.7细胞活力的影响 细胞的生长无抑制作用时薰衣草提取物梯度浓度为50 μg/mL,10 μg/mL,2 μg/mL,细胞活力均正常,细胞存活率趋近于100%。与模型组相比较,XYC-3、XYC-5具有不同程度抑制LPS诱导的RAW264.7细胞NO的释放,NO含量随着XYC-3、XYC-5浓度的增大而减小。见表3。

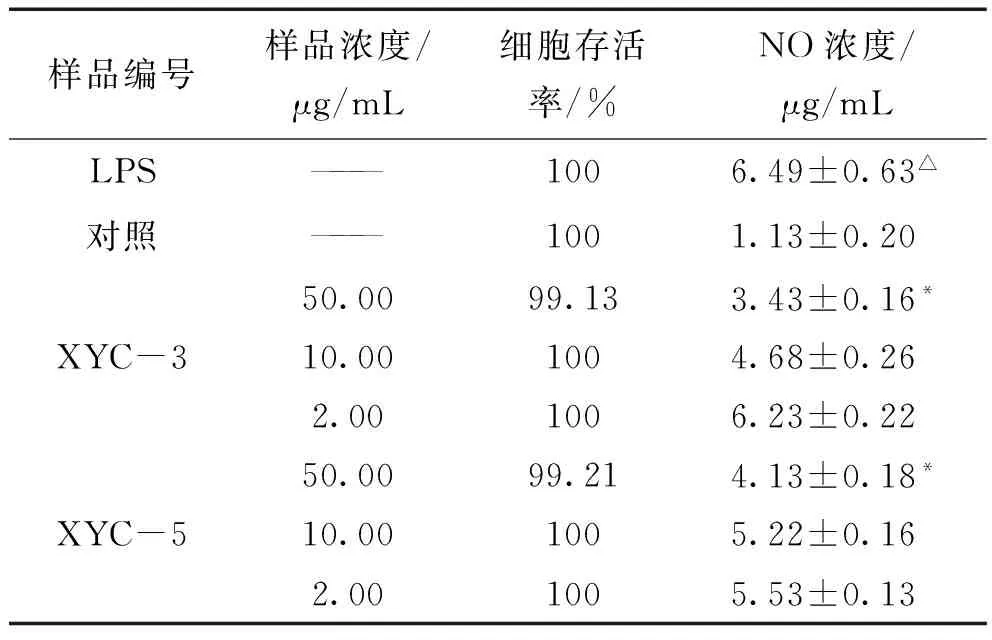
样品编号样品浓度/μg/mL细胞存活率/%NO浓度/μg/mLLPS———1006.49±0.63△对照———1001.13±0.20XYC-350.0099.133.43±0.16*10.001004.68±0.262.001006.23±0.22XYC-550.0099.214.13±0.18*10.001005.22±0.162.001005.53±0.13
注:与对照组比较比较,△P<0.05;与LPS组比较,*P<0.05。
3.3.2 TNF-α的测定 不同浓度的XYC-3和XYC-5作用于RAW264.7细胞后能够显著抑制LPS诱导的TNF-α的表达,并且具有浓度依赖性。
3.3.3 IL-6的测定 不同浓度的XYC-3和XYC-5作用于RAW264.7细胞后能够抑制LPS诱导的IL-6的表达,并且具有浓度依赖性。见表4。
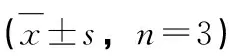
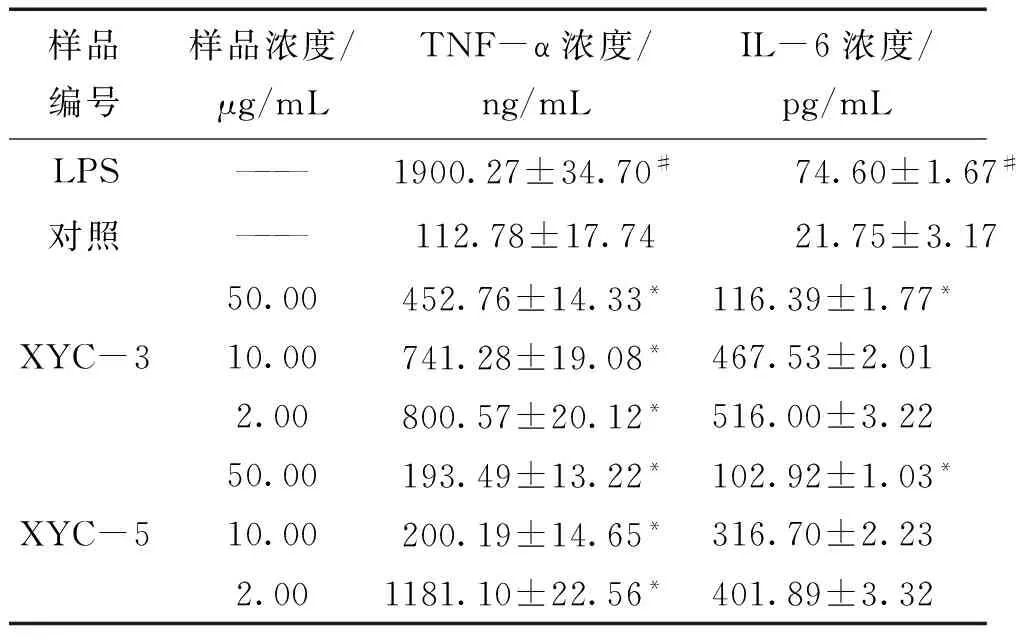
样品编号样品浓度/μg/mLTNF-α浓度/ng/mLIL-6浓度/pg/mLLPS———1900.27±34.70#74.60±1.67#对照———112.78±17.7421.75±3.17XYC-350.00452.76±14.33*116.39±1.77*10.00741.28±19.08*467.53±2.012.00800.57±20.12*516.00±3.22XYC-550.00193.49±13.22*102.92±1.03*10.00200.19±14.65*316.70±2.232.001181.10±22.56*401.89±3.32
注:与对照组比较比较,#P<0.05;与LPS组比较,*P<0.05。
4 讨论
薰衣草的抗炎作用从药效上分析并寻找薰衣草抗炎的物质基础,对薰衣草挥发性部位、薰衣草水提取物、以及用大孔树脂分离出不同的极性成分、薰衣草醇提取物、薰衣草各萃取部位使用二甲苯致小鼠耳肿胀实验和毛细血管通透性实验初步考察比较这些成分的抗炎作用。实验结果表明,XYC-3(50%乙醇洗脱部分)、XYC-5(薰衣草精油部分)有及其明显的抗炎作用。
实验以巨噬细胞RAW264.7为研究对象,通过MTS比色法检测薰衣草提取物体外抗炎活性。MTS是新一代四氮唑蓝盐化合物,采用比色法检测能够考察细胞的存活和生长。检测原理为:活细胞线粒体中的琥珀酸脱氢酶能使外源性MTS还原为有色的甲臜(Formazan)[31],该产物水溶性好、稳定性高、显色快,且颜色深浅与敏感细胞株的活细胞数在一定范围内呈高度相关。实验以酶联免疫检测仪在490 nm波长处测定吸光值,通过吸光值的变化反应薰衣草提取物对RAW 264.7存活和生长的影响。
通过Griess试剂对细胞上清中的NO进行检测,从而判断薰衣草提取物对炎症因子的抑制作用。NO在体内或水溶液中极易氧化成NO2,在酸性条件下,NO与重氮盐磺胺发生重氮反应,并生成重氮化合物,后者进一步与萘基乙烯基二胺发生耦合反应,该反应生成的产物浓度与NO浓度具有线性关系,在540nm处有极大吸收峰[32]。实验以酶联免疫检测仪在540 nm波长处测定吸光值,通过吸光值的变化反应NO释放量,来判断薰衣草提取物对炎症因子的抑制作用。
用ELISA法对细胞上清液中TNF-α,IL-6进行分析。由于TNF-α在炎症过程中是由多种免疫和非免疫细胞产生的细胞因子,有很强的炎症损伤作用,是主要的炎性介质之一,是巨噬细胞在炎症反应中产生的主要促炎因子,能够调节免疫应答,调节细胞的增值和分化,具有很重要的生物功能[33]。IL-6是促炎细胞因子,通常是在免疫激活后第一个产生的,可加重炎症疾病的病理过程,在先天性免疫和获得性免疫中扮演者重要的角色,可以调控T淋巴细胞,使其分化和激活,诱导辅助T细胞的活化,使调节性T淋巴细胞和辅助性T淋巴细胞之间保持平衡,并且在慢性炎症性疾病中发挥了重要的作用[34]。根据实验研究结果可知XYC-3(50%乙醇洗脱部分)、XYC-5(薰衣草精油部分)可抑制TNF-α和IL-6的分泌,从而达到抑制炎症介质的释放,减轻炎症反应的目的。
通过小鼠急性炎症实验、细胞实验反应了XYC-3(50%乙醇洗脱部分)、XYC-5(薰衣草精油部分),在动物水平和分子生物学水平均能够有效的抑制炎症因子的释放,说明薰衣草该有效部位对炎症疾病的治疗具有潜在的作用,为薰衣草的进一步开发与利用提供基础数据。
[1]国家药典委员会编.中华人民共和国卫生部药品标准(维吾尔药分册)[M].乌鲁木齐:新疆科技卫生出版社,1999:112.
[2]新疆维吾尔自治区卫生厅编.维吾尔药材标准(上册)[M].乌鲁木齐:新疆科技卫生出版社,1993:394.
[3]刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1992:905.
[4]张立军,李芸,杨志军,等.毒性中药高乌头炮制前后水煎液与三氯甲烷部分对小鼠的镇痛抗炎作用[J].中国临床药理学杂志,2017(7):624-627.
[5]奥斯曼江·麦提图尔荪,刘涛,赵军,等.砂地柏总黄酮抗炎镇痛作用实验研究[J].新疆医科大学学报,2017(4):512-515.
[6]黄显章,丁生晨,袁林,等.蜣螂乙醇提取物的抗炎作用研究[J].中华中医药学刊,2017(04):1002-1004.
[7]钟欣,朱华,贾智慧,等.赶黄草抗炎作用及其机理研究[J].西华师范大学学报(自然科学版),2017(1):48-51.
[8]刘莹,王振洲,李平亚,等.天然药物抗炎成分及作用机制的研究进展[J].特产研究,2017(01):69-76.
[9]刘海锋,黄山,玄光善,等.复方桔梗合剂止咳及抗炎活性的实验研究[J].中医药导报,2017(04):59-62.
[10]杨利红,赵费敏,张特,等.桑白皮抗炎活性成分的分离及抗炎机制研究[J].中华中医药学刊,2016(12):3008-3012.
[11]吴樟强.薰衣草精油应用研究进展[J].畜禽业,2016(10):26-28.
[12]吴凤荣,曾聪彦,戴卫波,等.宽筋藤水提液镇痛抗炎作用的实验研究[J].中华中医药学刊,2016(7):1775-1777.
[13]吴欢欢,周爱军,胡丽娟,等.加味小柴胡汤及其有效物质部位群抗炎实验研究[J].环球中医药,2016(6):664-667.
[14]王振苗,董丽荣,贾评,等.苦苣菜水提物抗急性炎症活性及其机制研究[J].中国医药导报,2017(10):1-3.
[15]杨莹,首弟武,唐丽.清热排毒合剂解热抑菌及抗炎作用的实验研究[J].湖南中医杂志,2016(5):180-181.
[16]杨华,徐风,万丹,等.甲基丁香酚镇痛抗炎作用及机制研究[J].中药新药与临床药理,2017(3):1-6.
[17]顾铭,李晨,张媞,等.生肌玉红胶原抗炎实验与机制研究[J].时珍国医国药,2016(3):529-531.
[18]任守忠,苏文琴,陈君,等.枫蓼提取物的抗炎作用及机制研究[J].中药药理与临床,2016(1):160-163.
[19]温先敏,杨缅南,胡田魁.地胆草水提物抗炎镇痛作用的动物实验研究[J].云南中医中药杂志,2015(12):71-72.
[20]余昕,朱烨,欧丽兰,等.鸭跖草抗炎活性部位筛选及抗炎机制[J].中成药,2015(8):1824-1827.
[21]张蓓蓓,陈岩,贲培玲,等.滁菊总黄酮的抗炎作用及部分机制研究[J].齐齐哈尔医学院学报,2015(17):2497-2499.
[22]刘保华,汪冬庚,周国梁.滁菊挥发油的抗炎实验研究[J].化学与生物工程,2015(2):57-59.
[23]童红,唐军.3种不同方法提取薰衣草挥发性成分的比较[J].中国实验方剂学杂志,2014(16):100-105.
[24]童红,唐军,张正方.薰衣草及其精油的研究进展[J].香料香精化妆品,2013(6):55-58.
[25]李紫薇,刘伟,张艺,等.薰衣草总黄酮的微波提取及其抗氧化性研究[J].食品工业科技,2013(5):255-258.
[26]李紫薇,欧阳艳,腊萍,等.大孔吸附树脂分离纯化薰衣草总黄酮[J].食品工业科技,2012(17):245-247,251.
[27]贾丽华,陈卫民.新疆薰衣草挥发油提取工艺及药理作用研究进展[J].中国误诊学杂志,2010(21):5057-5058.
[28]徐洁华,文首文.薰衣草挥发性有机物及其药理功效研究进展[J].时珍国医国药,2010(04):979-980.
[29]张群,扎灵丽.薰衣草的研究和应用[J].时珍国医国药,2008(06):1312-1314.
[30]王梦远,郭晓,刘晓婷,等.中药生物碱的提取及抗炎作用研究[J].动物医学进展,2017(4):80-83.
[31]石淙,万腊根.细胞增殖的检测方法[J].实验与检验医学,2012,30(02):153-155,168.
[32]张彩霞,刘阳云,刘庚勋,等.一氧化氮对鼻咽癌CNE-2细胞增殖与凋亡的影响[J].临床与病理杂志,2017,37(03):570-575.
[33]曹春琪,赵跃东,张旗,等.麦冬不同提取部位对LPS诱导的RAW 264.7细胞分泌炎症因子的影响[J].中药信息杂志,2016,33(2):11-15.
[34]李芬芬,黄丹菲,江乐明,等.大粒车前自多糖对脂多糖刺激RAW264.7巨噬细胞的免疫调节作用[J].食品科学,2014,35(23):249-252.
StudyontheAnti-inflammatoryActiveFractionofLavandulaaugustifoliaMill.
TAN Wei ZHANG Lanlan LI Chenyang SUN Yuhua*
Xinjiang Institute of Materia Medica,Urumqi 830004,China
ObjectiveTo search anti-inflammatory active fraction ofLavandulaaugustifoliaMill.MethodsThe inflammatory models of xylene-induced ear edema in mice and acetic acid-induced celiac capillary permeability increase were applied to evaluate their anti-inflammatory effect and the active sites were studied by the cell inflammatory model.ResultsThe XYC-3 and XYC-5 have evident inhibitory effects on swelling of auricle in mice(P<0.05); The XYC-3 have evident inhibitory effects on capillary permeability of mice(P<0.05);XYC-3 and XYC-5 have obvious inhibition of LPS induced NO production, and NO horizontal inhibition rate is proportional to the concentration of the extract. It can also inhibit the production of TNF-α and IL-6 in the RAW 264.7 cells of LPS stimulation, which can effectively inhibit the release of inflammatory factors.ConclusionTheLavandulaaugustifoliaMill. extraction sites as XYC-3 and XYC-5 have significant anti-inflammatory effects.
LavandulaaugustifoliaMill;Anti-inflammatory; Screen; RAW264.7
新疆维吾尔自治区卫生计生委青年科技人才专项科研项目(2015Y37)。
谭为(1983-),女,汉族,硕士研究生,副研究员,研究方向为民族医药研发。E-mail:tw21cn@163.com
孙玉华(1983-),女,汉族,硕士研究生,副研究员,研究方向为民族医药研发。E-mail:Applechi0505@163.com
R965.1
A
1007-8517(2017)22-0030-05
2017-10-13 编辑:梁志庆)

