pBabe-GLS1真核表达载体构建及其对结肠癌细胞增殖、谷氨酰胺摄取的影响
李雅莉,黄建玲,金鑫,张波
(西安交通大学医学院附属3201医院,陕西汉中723000)
pBabe-GLS1真核表达载体构建及其对结肠癌细胞增殖、谷氨酰胺摄取的影响
李雅莉,黄建玲,金鑫,张波
(西安交通大学医学院附属3201医院,陕西汉中723000)
目的构建pBabe-GLS1真核表达载体,观察谷氨酰胺酶1(GLS1)对结肠癌细胞增殖及谷氨酰胺摄取的影响。方法运用反转录PCR扩增GLS1基因片段,通过BamH Ⅰ和Sal Ⅰ双酶切目的片段并通过T4 DNA连接酶将GLSⅠ基因连接至pBabe真核表达载体中;经BamH Ⅰ和Sal Ⅰ双酶切法、PCR法测序鉴定重组DNA分子;转染组将构建的pBabe-GLS1真核表达载体瞬时转染结直肠癌HT29细胞,阴性对照组转染空质粒pBabe,采用Western blotting法检测GLS1蛋白表达,通过谷氨酰胺含量检测试验和蛋白定量实验检测其对结肠癌细胞的生物学影响。结果成功构建了pBabe-GLS1真核表达载体,且在HT29细胞中高表达GLS1蛋白;转染组HT29细胞增殖能力高于阴性对照组(Plt;0.05),对谷氨酰胺的摄取能力增加(Plt;0.05)。结论成功构建了pBabe-GLS1真核表达载体,构建的pBabe-GLS1真核表达载体能促进结肠癌细胞增殖及谷氨酰胺摄取。
结肠癌细胞;谷氨酰胺酶1;细胞增殖;谷氨酰胺
葡萄糖和谷氨酰胺是细胞赖以生存的营养物质,对肿瘤来说,其代谢方式的改变是判断其恶性程度的重要标志之一。在有氧条件下,肿瘤细胞仍大量摄取葡萄糖,且通过糖酵解方式产能,这种有氧糖酵解的代谢特征称为Warburg效应,亦是肿瘤特有的十大标志特征之一[1,2]。而谷氨酰胺是肿瘤除葡萄糖外的另一重要营养物质。谷氨酰胺酶1(GLS1)是调节谷氨酰胺代谢的关键酶之一,负责将谷氨酰胺转变为谷氨酸,生成的谷氨酸可进一步转变成α-酮戊二酸进入TCA循环或为谷胱甘肽提供还原当量[3]。2017年2~5月,我们构建了GLS1的过表达载体,并探讨其对结肠癌细胞增殖、谷氨酰胺摄取的影响。
1 材料与方法
1.1 材料 高糖DMEM、无酚红DMEM和PBS购自HyClone公司;人结肠癌细胞系HT29细胞购自中国科学院细胞库;大肠杆菌DH5α、限制性内切酶BamH Ⅰ和Sal Ⅰ购自Takara公司;pBabe-puro质粒购自Addgene公司;RT-PCR试剂购自Invitrogen公司;GLS1和β-actin一抗购自武汉博士德公司;人抗兔二抗购自CST公司。
1.2 GLS1目的片段的扩增 采用PCR法。从人结肠癌细胞HT29中提取mRNA,然后用 RT-PCR技术扩增GLS1片段。正向引物:3′-GGATCCATGATGCGGCTGCGAGGCT-5′;反向引物:3′-GTCGACTTACAACAATCCATCAAG-5′(下划线部分为酶切位点)。PCR反应体系:30 μL,变性温度95 ℃ 10 s,退火温度55 ℃ 10 s,延伸温度72 ℃ 30 s,反应30个循坏。将PCR产物通过琼脂糖凝胶电泳分离,在2 kb左右的位置观察到特异性条带,将其回收酶切,并经测序鉴定。
1.3 pBabe-GLS1过表达载体的构建 将上述2 kb左右的片段利用BamH Ⅰ和Sal Ⅰ进行酶切,酶切回收后,利用T4 DNA连接酶将目的片段连接至pBabe真核表达载体。将此连接产物转化至感受态DH5α,挑取阳性克隆,通过BamH Ⅰ和Sal Ⅰ双酶切鉴定。
1.4 pBabe-GLS1转染HT29细胞 将2×105个细胞接种于6孔板,待贴壁后长至60%密度时进行转染:pBabe-GLS1质粒2 μg、脂质体5 μL,将两者与无血清opti-MEM混匀后加至细胞培养液中,转染6 h后换成含10% FBS的DMEM培养48 h。
1.5 GLS1蛋白表达检测 采用Western blotting法。收集转染pBabe-GLS1的HT29细胞,加入RIPA蛋白裂解液,超声裂解,4 ℃离心取上清液,收集总蛋白。经10% SDS-PAGE胶分离后,电转(200 mA、2 h)至NC膜上。利用含5 %脱脂奶粉的TBST封闭NC膜;2 h后,用1∶1 000稀释的GLS1抗体4 ℃孵育过夜,次日加入二抗孵育1 h,通过ECL发光检测剂显示结果。
1.6 细胞活力检测 采用MTT法。将结肠癌细胞HT29分为转染组与阴性对照组,分别转染pBabe-GLS1、空质粒pBabe,24 h后,将各组细胞用含10%血清的培养液制成单个细胞悬液,以每孔104个细胞接种到96孔板;分别于培养0、1、2、3 d时进行MTT实验:每孔加入MTT溶液至终浓度为5 mg/mL,孵育4 h后通过DMSO溶解结晶物;酶联免疫检测仪于490 nm波长处测定各孔光密度(OD)值,并绘制细胞生长曲线。
1.7 谷氨酰胺检测 将结肠癌细胞HT29分为转染组与阴性对照组,分别转染pBabe-GLS1、空质粒pBabe,分别按照5×105细胞/孔接种于6孔板。待细胞贴壁后,弃培养基,更换为无血清无酚红DMEM,继续培养24 h。收集培养上清。用细胞刮收集细胞,溶于200 μL的PBS溶液,超声裂解后取细胞裂解产物。通过BCA法确定蛋白浓度。通过NH3来计算谷氨酰胺的量。根据试剂盒说明书,得到相应的数值,以无细胞对照孔培养液检测值为初始浓度,通过计算获得谷氨酰胺含量。即细胞摄取的谷氨酰胺=无酚红DMEM中谷氨酰胺初始浓度-培养上清中谷氨酰胺浓度。

2 结果
2.1 构建pBabe-GLS1真核表达载体的鉴定 成功得到GLS1基因片段,经琼脂糖凝胶电泳证实片段大小约为2 kb(图1)。回收该片段,并用BamH Ⅰ和Sal Ⅰ双酶切,发现1号和3号克隆可以切得一条2 kb大小的片段,说明其含有GLS1目的片段,经测序后鉴定正确。
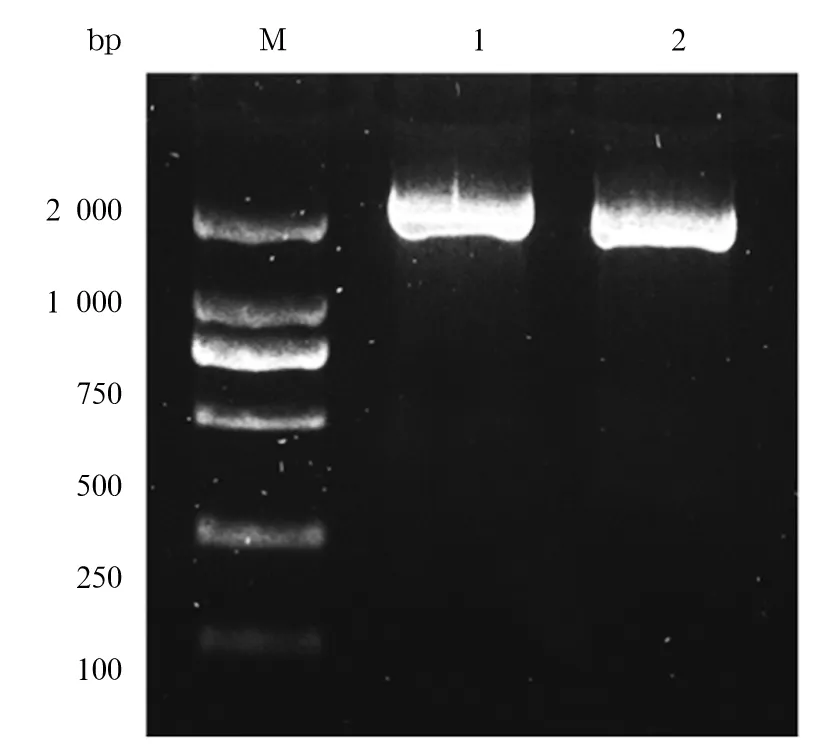
图1 GLS1片段10%琼脂糖凝胶电泳图
2.2 转染pBabe-GLS1表达的鉴定 Western blotting实验检测发现,阴性对照组HT29细胞中GLS1表达相对较低,而转染组GLS1蛋白呈高表达(图2),证实构建的重组质粒pBabe-GLS1能在真核细胞中正确表达。
2.3 GLS1的过表达对细胞增殖能力及对谷氨酰胺摄取的影响 描绘的细胞生长曲线见图3,转染组HT29细胞增殖能力增加,与阴性对照组相比,Plt;0.05;转染组、阴性对照组HT29细胞谷氨酰胺摄取量分别为6.902、4.139 mmol/g蛋白,两组相比,Plt;0.05。
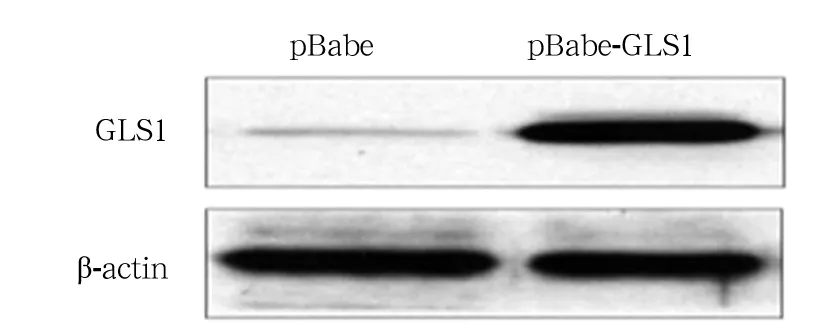
图2 Western blotting鉴定GLS1在HT29细胞中表达
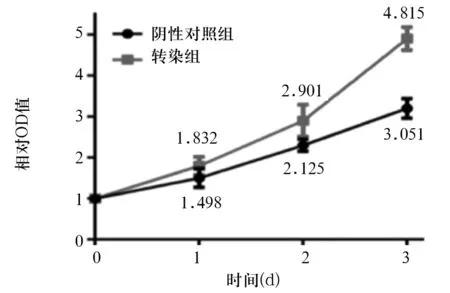
图3 MMT法描绘细胞生长曲线
3 讨论
谷氨酰胺是肿瘤细胞利用并依赖的重要能源物质,其作用包括:为细胞增殖提供足够的碳源、氮源和ATP[4]、为缺少葡萄糖来源的线粒体TCA循环的维持提供补给[5]、为细胞内抗氧化系统的运行提供谷胱甘肽等还原当量[6]。研究[7]发现,通过有氧酵解方式代谢的肿瘤细胞相对正常细胞更依赖谷氨酰胺的摄入。主要原因:一方面,高度恶性的肿瘤细胞多伴随重要癌基因的活化,如Myc、HIF-1α等,通过调节谷氨酰胺代谢的关键酶表达和活性,促进谷氨酰胺的摄入;另一方面,有氧酵解的肿瘤细胞增殖旺盛,通过利用谷氨酰胺分解产生的ATP、核酸、氨基酸等物质,满足其自身生长需要。此外,谷氨酰胺还能调节细胞内重要癌基因和信号通路,如PI3K/Akt、mTOR等,促进肿瘤的恶性演进过程[8]。
GLS主要有两种亚型,GLS1和GLS2。其中GLS1在调节谷氨酰胺代谢中扮演重要角色,通过将谷氨酰胺转变为谷氨酸,生成的谷氨酸可进一步转变成α-酮戊二酸进入TCA循环或为谷胱甘肽提供还原当量[3]。研究[9,10]发现,GLS1在多类肿瘤组织中呈高表达,如乳腺癌、前列腺癌、白血病等。基于代谢重编程与肿瘤恶性程度的相关性,以调节代谢的关键分子为靶点的肿瘤诊断和治疗工作一直是研究热点。PET-CT技术便是利用肿瘤细胞大量摄取葡萄糖的特点,通过18F等放射性核素标记葡萄糖分子进行显像,目前已广泛用于各类肿瘤的诊断和实验室研究工作中[11]。在治疗领域,诸多基于GLS1的抑制剂正处于实验室研究或临床试验阶段,如BPTES,CB-839等,并取得了令人满意的效果[12,13]。
本研究中,我们成功构建了pBabe-GLS1真核表达质粒,通过在结肠癌细胞HT29中验证其正确高表达后,利用谷氨酰胺检测实验证明GLS1的高表达可促进HT29细胞增殖及其对谷氨酰胺的摄取,为后续研究GLS1在肿瘤代谢中的作用及相关机制奠定了基础。
[1] Wu W, Zhao S. Metabolic changes in cancer: beyond the Warburg effect[J]. Acta Biochim Biophys Sin (Shanghai), 2013,45(1):18-26.
[2] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011,144(5):646-674.
[3] Jones NP, Schulze A. Targeting cancer metabolism--aiming at a tumour′s sweet-spot[J]. Drug Discov Today, 2012,17(5-6):232-241.
[4] Reitzer LJ, Wice BM, Kennell D. Evidence that glutamine, not sugar, is the major energy source for cultured HeLa cells[J]. J Biol Chem, 1979,254(8):2669-2676.
[5] Le A, Lane AN, Hamaker M, et al. Glucose-independent glutamine metabolism via TCA cycling for proliferation and survival in B cells[J]. Cell Metab, 2012,15(1):110-121.
[6] Curthoys NP, Watford M. Regulation of glutaminase activity and glutamine metabolism[J]. Annu Rev Nutr, 1995,15(1):133-159.
[7] Lu W, Pelicano H, Huang P. Cancer metabolism: is glutamine sweeter than glucose[J]. Cancer Cell, 2010,18(3):199-200.
[8] Hosios AM, Vander Heiden MG. Acetate metabolism in cancer cells[J]. Cancer Metab, 2014,2(1):27.
[9] Pan T, Gao L, Wu G, et al. Elevated expression of glutaminase confers glucose utilization via glutaminolysis in prostate cancer[J]. Biochem Biophys Res Commun, 2015,456(1):452-458.
[10] Qie S, Chu C, Li W, et al. ErbB2 activation upregulates glutaminase 1 expression which promotes breast cancer cell proliferation[J]. J Cell Biochem, 2014,115(3):498-509.
[11] Garcia Vicente AM, Soriano Castrejon A, Cruz Mora MA, et al. Dual time point 2-deoxy-2-[18F]fluoro-D-glucose PET/CT: nodal staging in locally advanced breast cancer[J]. Rev Esp Med Nucl Imagen Mol, 2014,33(1):1-5.
[12] Gross MI, Demo SD, Dennison JB, et al. Antitumor activity of the glutaminase inhibitor CB-839 in triple-negative breast cancer[J]. Mol Cancer Ther, 2014,13(4):890-901.
[13] Elgogary A, Xu Q, Poore B, et al. Combination therapy with BPTES nanoparticles and metformin targets the metabolic heterogeneity of pancreatic cancer[J]. Proc Natl Acad Sci U S A, 2016,113(36):E5328-E5336.
10.3969/j.issn.1002-266X.2017.41.010
R735.35
A
1002-266X(2017)41-0033-03
2017-03-14)

