外源激素在金雀花扦插生根进程中的调节机制
李千惠 ,范俊俊 ,赵明明,2,张往祥 ,2,王改萍 ,宋元超
(1.南方协同中心 南京林业大学林学院,江苏 南京 210037;2. 扬州小苹果园艺有限公司,江苏 扬州 225200)
外源激素在金雀花扦插生根进程中的调节机制
李千惠1,范俊俊1,赵明明1,2,张往祥1,2,王改萍1,宋元超1
(1.南方协同中心 南京林业大学林学院,江苏 南京 210037;2. 扬州小苹果园艺有限公司,江苏 扬州 225200)
以2年生金雀花实生苗为试验材料,采用IAA(900 mg/L)与清水(CK)处理插穗,分析了插穗生根过程中营养物质含量及抗氧化酶活性的动态变化,探讨了生根进程与内源物质之间节奏变化的关联性,旨在为揭示金雀花扦插生根机理、建立扦插繁殖技术体系提供理论依据。结果表明:外源激素处理对金雀花扦插生根时间及生根性状具有极显著影响,处理将不定根发生时间缩短了5 d,各生根性状(生根率79.97%,平均根数13,平均根长71.68 mm)提高为CK的1.5~3.2倍。可溶性蛋白、碳水化合物及各抗氧化酶活性的动态变化表明,各指标的峰值或谷值的出现时间与生根进程高度契合,这反映了生根形态与其生理代谢之间具有高度的协同性。在生根进程中,处理和CK的可溶性糖、淀粉及可溶性蛋白质的含量均分别呈“V”、“V”和“Λ”的变化趋势,但处理加速了可溶性糖与淀粉的消耗速度及可溶性蛋白质的积累速度(三指标含量的谷值或峰值到达时间均比CK提前了10 d,谷值或峰值大小分别比CK提高了6.2%、86.1%和11.2%);处理与CK的POD、PPO和SOD的活性均分别呈现“V”、“Λ”和“Λ”形变化趋势,然而处理显著提高了三种酶的活性(三指标活性的峰值或谷值到达时间均比CK提前了5 d,谷值或峰值大小分别比CK提高了8.7%、4.4%和7.8%)。综上所述,外源激素处理显著加快了营养物质代谢速度和抗氧化酶(POD、SOD和PPO)的合成进程,缩短了插穗生根周期,从而促进了不定根再生。
金雀花;扦插;生根;营养物质;抗氧化酶
金雀花Cytisus scoparius为豆科Leguminosae金雀儿属Cytisus植物[1],瓣端稍尖,旁分两瓣,势如飞雀,色金黄,故名“金雀花”,具有重要的观赏[2-3]、药用和食用价值等[4-5],根可补血、活血、祛风;花滋阴活血、健脾、祛风止咳。在云南、江西、安徽、 浙江等山区,居民采食其花作为特色山珍[6]。金雀花原产欧洲,具有中高度耐盐性,可种植于沿海或内陆盐碱地[7],在我国已经进行了引种推广[8],但其种子繁殖生长较为缓慢,无法满足与日俱增的市场需求。因此,开展扦插繁殖研究对金雀花的开发与利用具有重要意义。
一般认为,不定根的形成过程包括三个阶段:诱导期、形成初期和形成盛期[9]。外源激素是促进不定根形成的重要手段之一[10-11]。许多研究认为,外源激素处理可加速细胞的分裂,促进内源激素(生长素、细胞分裂素、赤霉素、水杨酸等)的合成和糖的积累,从而促进生根[12-15]。Zhang等(2016)等研究发现,可溶性糖、淀粉及可溶性蛋白的峰值或谷值与不定根的发生有一定的协同性,且外源激素可以显著提高三种营养物质的合成或代谢速度从而促进生根[16]。Rout(2006),Metaxas(2004)和Nag(2001)等研究发现,在不定根诱导期和形成初期,PPO酶活性持续上升,在延长期逐渐下降,而过氧化氢(H2O2)和IAAO酶活性变化呈相反趋势[17-19]。外源激素处理可影响这些生理物质的变化。然而,多数研究关注于根原基形成前的细胞学观测及生理生化规律,忽视了不定根突破皮层及不定根大量发生等关键临界点的重要性。本研究基于金雀花生根进程中的重要表观形态临界点,开展了外源激素对生根进程的影响及其生根进程与抗氧化酶(POD、PPO和SOD)之间的关联性研究,探讨了3种抗氧化酶的不同促进生根机理,旨在为揭示金雀花扦插生根机理、建立扦插繁殖技术体系提供理论依据。
1 材料与方法
1.1 试验地与试验材料
试验地位于江苏省南京市玄武区南京林业大学银杏园,试验材料为扬州市江都区苗圃基地金雀花2 a生健壮实生苗。于5月上旬上午7:30—9:00之间在金雀花2 a生实生苗中,选取生长健壮、无病虫害的苗木,选取中部茎干制作插穗。为防止金雀花被剪后快速氧化导致根基部变黑,选择就地取材,带回实验室再进行修剪枝条。插穗长度为10~12 cm,大小基本一致,下端剪成平滑斜口,制作好的插穗每30个一组捆扎后整齐地放入水盆中备用,保持直立。
1.2 试验方法
1.2.1 试验设计
采用900 mg·L-1吲哚乙酸(处理)浸泡金雀花插条基部1 h,并以清水处理作为CK。扦插株行距为5 cm×10 cm,扦插深度为插穗的2/3,上面留2~3个叶片。共设三组试验,组1用于生根过程中的形态特征观测,每处理样本数150株;组2用于试验终止后的扦插生根率和生根性状的统计分析,每处理样本数150株;组3用于生根机理研究,每处理样本数600株。
1.2.2 插后管理
插后水分管理采用全日照间歇式喷雾装置,每隔30 min喷水一次,持续时间15 s。每隔20 d喷一次0.3%的高锰酸钾消毒液,阳光强烈时,顶部用遮阴网进行荫蔽。
1.2.3 生根性状与指标测定
1.2.3.1 生根动态观测
在组1中,扦插后每隔2 d取样一次进行生根观测,每次随机选取5株。扦插起始日记为S0,不定根突破韧皮部即视为不定根开始发生日(记为S1),不定根数量≥3根且根长≥1 cm时视为不定根开始大量形成日(记为S2)。不定根诱导期记为P1(S0-S1),不定根形成初期记为P2(S1-S2),不定根形成盛期记为P3(S2以后时期)。
1.2.3.2 生根性状测定
在组2中,于扦插30 d后,对供试的2个处理进行生根情况统计,每处理随机选取3组(每组50株)插穗作为调查对象,统计生根率、平均根数和平均根长。
1.2.3.3 生理生化指标测定
在组3中,于扦插后的第5 d、10 d、15 d、20 d、25 d、30 d,对两种处理插穗中的可溶性蛋白质、可溶性碳水化合物及抗氧化酶活性进行测定,每处理每次随机选取3组,每组30株。可溶性蛋白及可溶性碳水化合物测定:分别称取插穗基部韧皮部组织0.2 g,用于可溶性蛋白、可溶性糖和淀粉含量测定,每指标测定均为3个重复。提取方法按照李合生[20]的方法进行,其中可溶性蛋白含量采用考马斯亮蓝法测定[21],可溶性糖和淀粉含量采用蒽酮比色法测定[22]。
酶活性测定:分别称取插穗基部韧皮部组织0.2 g,用于POD、PPO、SOD的活性测定。POD测定方法参照Tian等[23]进行测定,PPO测定方法参照Li等[24],SOD参照李合生法[20]。
1.3 数据处理
采用SAS 8.1进行数据统计分析,采用Origin Pro 9软件绘图。
2 结果与分析
2.1 外源激素处理对扦插生根节律的影响
从表1可以看出,外源IAA明显缩短了金雀花扦插生根的时间,处理插穗的不定根出现时间为10 d左右,然而,CK为15 d左右,处理将不定根出现时间缩短了5 d(33.3%)。

表1 金雀花生长节律统计表Table 1 Statistics on growth rhythm of stem cuttings of Cytisus
2.2 外源激素处理对扦插生根质量的影响
IAA处理显著提高了金雀花扦插生根质量(P<0.01)(表2)。IAA处理的插穗生根率达到了80.0%,平均根数与平均根长则分别达到了13根和71.7 cm,与CK相比,分别提高了52.6%、200.2%和216.0%。

表2 外源激素处理对金雀花扦插生根性状的影响Table 2 Effects of exogenous hormone treatments on rooting characteristics of Cytisus
2.3 金雀花扦插生根过程中营养物质含量变化
由图1可看出,在扦插生根过程中,处理的各指标与CK的变化趋势相同,其中可溶性糖和淀粉的含量均呈“V”的变化趋势,可溶性蛋白含量则呈现“Λ”的变化趋势。表3是从图1和图2中提取的可溶性蛋白、可溶性糖和淀粉含量的特征值(峰值、谷值和同期值)。从图1和表3可以看出,外源激素处理显著提高了可溶性蛋白的合成速度,其峰值出现时间比CK提前了5 d,且处理与CK的可溶性蛋白峰值之间差异显著(P<0.001),处理比CK的峰值提高了11.2%;当处理样本中的可溶性蛋白达到峰值时,其含量比CK的同期值提高了17.9%。从图1和表3还可以看出,外源激素处理显著提高了可溶性糖及淀粉的消耗速度,其谷值出现时间均比CK提前了10 d,且处理与CK的谷值之间差异显著(P=0.031,P<0.001),处理的谷值分别比CK提高了6.2%和86.1%。

图1 扦插过程中可溶性糖、淀粉和可溶性蛋白含量变化Fig.1 Changes of soluble sugar, starch and soluble protein content during the rooting process of Cytisus scoparius cuttings
由图2可看出,在扦插生根过程中,C/N比比值指标[淀粉/可溶性蛋白、可溶性糖/可溶性蛋白和(淀粉+可溶性糖/可溶蛋白)]皆呈“V”的变化趋势,且谷值出现时间均与不定根发生时间同步。然而,外源激素处理显著加速了各比值指标的变化,各指标谷值到达时间均比CK提前5 d(图2)。且与CK相比,外源激素处理提高了淀粉/可溶性蛋白、(淀粉+可溶性糖)/可溶性蛋白的含量(分别提高了52.9%和4.6%)。
2.4 金雀花扦插生根过程中酶活性变化
由图3可看出,在扦插生根过程中,插穗中的PPO和SOD活性皆呈“Λ”形变化趋势,而POD活性则呈现“V”的变化趋势。由图3和表4还可以看出,外源激素的处理显著提高了酶活性,PPO与SOD的峰值和POD的谷值均比CK提前了5 d。当处理的PPO与SOD活性达到峰值、POD活性达到谷值时时,其活性分别比CK的同期值提高了18.3%、10.1%和2.8%,比对照的峰值或谷值分别提高了4.4%、7.8%和8.7%。
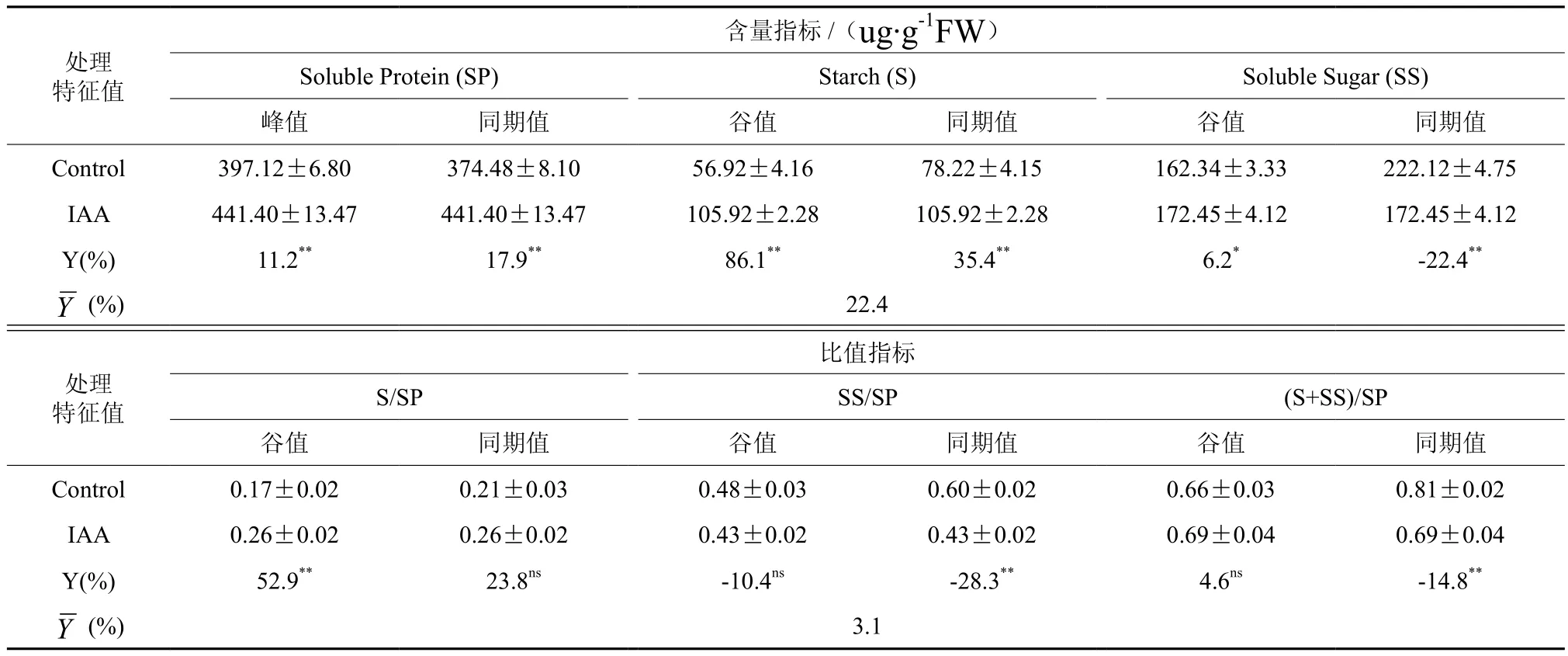
表3 外源激素处理对生根进程中插穗韧皮部中的可溶性蛋白、可溶性糖和淀粉含量特征值(峰值、谷值和同期值)的影响†Table 3 Effects of exogenous hormone treatments on characteristics of soluble protein, soluble sugar and starch content(peak value, valley value and synchronous value) in phloem of cuttings during rooting process

图2 扦插过程中C/N比值变化Fig.2 Changes of ratios of starch to soluble protein, soluble sugar to soluble protein, and carbohydrates (starch and soluble sugar) to soluble protein during the rooting process of Cytisus scoparius cuttings

图3 扦插过程中酶活性含量变化Fig.3 Changes of POD, PPO and SOD activity during the rooting process of Cytisus scoparius cuttings
3 结论与讨论
许多研究基于解剖学观察,将不定根的形成概括为诱导期、表达期和延长期三个阶段。本研究基于表观形态观察,将不定根形成进程划分为不定根发生前期、不定根发生初期和不定根发生盛期三个阶段。两种划分方法的主要区别在于后者的第一阶段将前者的诱导、起始和茎内生长等三个阶段进行了合并,前者的茎外生长阶段被细分为后者的第二和第三两个阶段。为了阐明不定根的形成过程及其机理,前者主要基于细胞和组织等微观观测,两个关键临界点分别是根原基初始细胞的形成和根原基的形成,被多数研究关注[17-19]。而后者主要是基于根系表观形态观测,两个关键临界点分别是不定根突破皮层和不定根大量发生,通常被多数研究者忽视。然而,不定根突破皮层对扦插成活率具有重要影响。因为不定根突破皮层,标志着根系吸收功能的开始恢复,这是评判扦插成活率的重要指标。本研究发现,处理插穗的不定根形成前期比CK缩短了5 d,生根率提高了52.6%,不定根出现越早,生根率越高。这与在芍药P. albiflora、楸子M. prunifolia、湖北海棠M.hupehensis等树种研究结论一致[25-26,16]。
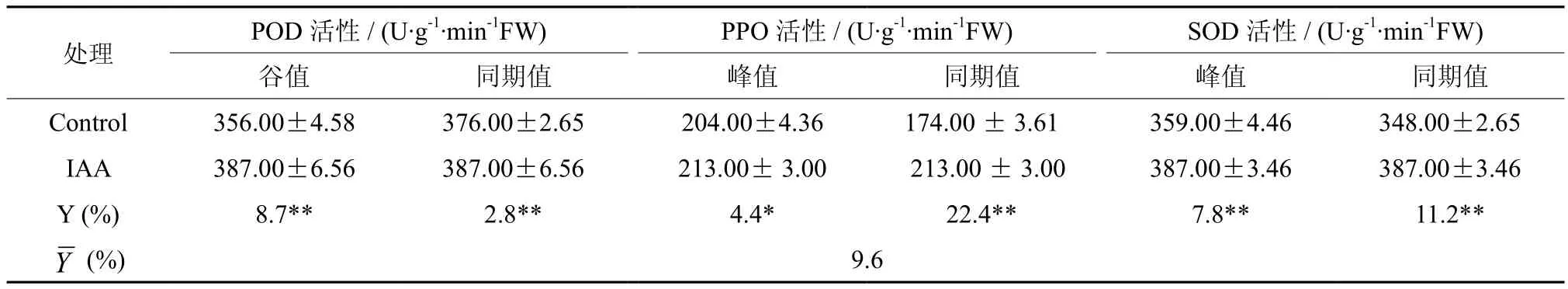
表4 外源激素处理对生根进程中插穗中的POD、PPO和SOD活性的特征值(峰值、谷值和同期值)的影响Table 4 Effects of exogenous hormone treatments on the characteristics of POD, PPO and SOD activity(peak value, valley value and synchronous value) in cuttings during rooting
与代谢相关的酶蛋白等大都为可溶性蛋白,可溶性蛋白含量的提高意味着和代谢有关的酶蛋白的合成增多,其含量的增加有利于根的形态建成。Basak(1995)在红树扦插研究中发现外源激素提高插穗合成蛋白质的能力是提高插穗生根能力的一个重要因素[27]。Goldsmith(1968),Gurumurti & Nanda(1974),Rout(1996) 等 研究也发现在不定根形成前,可溶性蛋白含量不断增加,生根完成以后含量开始下降[28-30]。插穗生根过程中,代谢活性明显升高,需要消耗更多的能量。碳水化合物是插穗基部愈合和不定根生长所需的直接能源[31-32],而可溶性糖是启动不定根形成所需能量的主要来源[33]。本研究发现,各营养物质指标的激素处理与CK的含量变化趋势相似,但外源激素处理显著提高了可溶性蛋白的合成速度(峰值比CK提前了10 d,可溶性蛋白含量比CK同期值提高了17.9%),加快了可溶性糖和淀粉的消耗速度(谷值比CK提前了10 d,处理的谷值分别比CK提高了6.2%和86.1%)。
许多研究结果认为,C/N比值与不定根发生之间存在明显的关联性,母树插穗体内C/N比值与插穗扦插生根率之间存在正相关关系[34-35],C/N比率高,则生根率高[36-37],在插穗不定根开始发生前,C/N比值越低说明插穗代谢越旺盛。本研究结果表明,在不定根生根诱导过程中,碳水化合物(淀粉和可溶性糖)与可溶性蛋白之间呈现出明显的负相关关系,这一结果与曾炳山等的研究结果一致[38]。各比值指标(淀粉/可溶性蛋白、可溶性糖/可溶性蛋白和(淀粉+可溶性糖)/可溶性蛋白)与含量指标(淀粉、可溶性糖和可溶性蛋白)的峰值或谷值出现时间基本契合,且与生根进程基本一致。
插穗离开母体,养分与水分的供给途径被切断,不定根再生之前,插穗始终处于逆境状态。提高抗逆性、缩短生根周期是扦插成活的关键。POD、PPO和SOD等抗氧化酶系不仅在植物体抗氧化防御中起重要作用[39-41],而且在植物扦插生根过程中也与不定根的形成和生长关系密切[42-44]。本研究发现,PPO与SOD的合成进程相似,均呈“Λ”的变化趋势,且峰值出现时间与不定根发生时间同步,而POD活性则呈“V”的变化趋势,在生根前5 d持续上升,并在第5 d达到峰值后开始下降,随后处理与CK分别在第15和第20 d达到谷值。形成这种差异的原因可能是各个酶系在生根过程中的作用机理不同有关。
POD是在植物体内多种生理生化过程中发挥重要作用的酶, 可以使得阻碍插穗生的抑制剂受到破坏[44],且POD作用的某些产物可能是不定根发生所必须的辅助因子[45];还有些研究认为,POD活性增强有助于细胞壁中木质素、木栓层的生物合成和富含羟脯氨酸的糖蛋白(伸展蛋白)中异二酪氨酸的产生[17,46-47]。与木质素、伸展蛋白合成有关的POD酶类活性的适当降低,有利于降低细胞壁的强度,从而促进细胞分裂、膨大和植株生长,反之有助于增强细胞的抗性[19,48-49]。在插条生根过程中,PPO可催化酚类物质与IAA形成一种“IAA-酚酸复合物”[50],这种复合物是一种生根辅助因子,具有促进不定根形成的活性[51];SOD是生物进化过程中,细胞形成的防御氧毒害的最重要的保护酶系统.其水平高低直接反映鲜活组织的抵抗能力和对逆境的适应能力。它们是衡量植物抗性的重要指标[46]。本研究发现,在扦插生根前期,POD活性持续上升,在第5 d即达到峰值,这可能是由于早期酶活性升高,有助于清除H2O2,增加细胞壁强度,从而提高抗逆性,此后下降有助于促进细胞膨大和生长。在扦插生根过程中,处理与CK样本中PPO与SOD的活性均呈“Λ”的变化趋势,其峰值出现时间均与不定根发生时间同步,这说明PPO酶的持续上升对不定根诱导与生长的整个过程发挥了促进作用,SOD酶活性的持续提升主要发而SOD酶活性的持续提升,有利于提升插穗的抗逆能力,直至根系形成后,插穗吸收功能开始恢复,逆境胁迫解除,SOD酶活性开始下降。另外,经外源激素处理后的插穗,其POD及SOD活性在整个生根过程中始终高于CK,且峰值出现时间均比CK提前了5 d,说明外源激素的处理提高了各个酶的合成进度,并进一步提高了插穗的生根率。
综上所述,本研究基于金雀花生根进程中的重要表观形态临界点,开展了外源激素对生根进程的影响及其生根进程与营养物质及抗氧化酶(POD、PPO和SOD)之间的关联性研究,探讨了3种抗氧化酶的不同促进生根机理,发现相对于CK,外源激素处理显著加快了营养物质代谢速度和抗氧化酶(POD、SOD和PPO)的合成进程,缩短了插穗生根周期(5 d),从而促进了不定根再生。有关外源激素如何间接通过提高酶活性使其作用的产物促进生根,有待更深一步的探究。
[1]崔鸿宾. 中国植物志.第42卷.第2分册[M]. 北京: 科学出版社, 1998.
[2]兑宝峰. 三种“金雀儿”[J]. 中国花卉园艺, 2010(18): 38.
[3]田英翠, 杨柳青, 袁雄强. 地被植物及其在园林中的应用[J].安徽农业科学, 2006, 34(5): 894-895.
[4]Sundararajan R, Haja N A, Venkatesan K,et al.Cytisus scoparius link-A natural antioxidant[J]. BMC complementary and alternative medicine, 2006, 6(1): 8.
[5]Nirmal J, Babu C S, Harisudhan T,et al. Evaluation of behavioural and antioxidant activity ofCytisus scopariusLink in rats exposed to chronic unpredictable mild stress[J]. BMC complementary and alternative medicine, 2008, 8(1): 15.
[6]陈家龙, 朱建军, 吴秀水, 等. 金雀花组织培养与快繁[J]. 浙江农林大学学报, 2013, 30(40): 611-614.
[7]张华新, 刘正祥, 刘秋芳. 盐胁迫下树种幼苗生长及其耐盐性[J]. 生态学报, 2009, 29(5): 2263-2271.
[8]王济成, 吕晓雪, 张志成, 等. 4种国外彩叶树种引种育苗试验[J]. 江苏林业科技, 2005, 32(3): 6-8.
[9]Guan L, Murphy A S, Peer W A,et al.Physiological and Molecular Regulation of Adventitious Root Formation[J]. Critical Reviews in Plant Sciences, 2015, 34 (5): 506-521.
[10] Graves W R. IBA, Juvenility, and Position on Ortets Influence Propagation of Carolina Buckthorn from Softwood Cuttings[J].Journal of Environmental Horticuture, 2002, 20(1): 57-61.
[11] Keeley K, Preece J E, Taylor B H,et al.Effects of High Auxin Concentrations, Cold storage, and Cane Position on Improved Rooting of Vitis Aestivalis Michx. Norton cuttings.[J]. American Journal of Enology & Viticulture, 2004, 55(3): 265-268.
[12] Negishi N, Nakahama K, Urata N,et al.Hormone Level Analysis on Adventitious Root Formation in Eucalyptus Globulus[J]. New Forests, 2014, 45(4): 577-587.
[13] Steffens B, Wang J, Sauter M. Interactions Between Ethylene,Gibberellin and Abscisic Acid Regulate Emergence and Growth Rate of Adventitious Roots in Deepwater Rice[J]. Planta, 2006,223(3): 604-612.
[14] Agullóantón M Á, Ferrándezayela A, Fernándezgarcía N,et al.Early Steps of Adventitious Rooting: Morphology, Hormonal Profiling and Carbohydrate Turnover in Carnation Stem Cuttings[J]. Physiologia Plantarum, 2014, 150(3): 446-462.
[15] Agulló-Antón M Á, Sánchez-Bravo J, Acosta M,et al.Auxins or Sugars: What Makes The Difference in The Adventitious Rooting of Stored Carnation Cuttings?[J]. Journal of Plant Growth Regulation, 2011, 30(1): 100-113.
[16] Zhang W, Fan J, Tan Q,et al. Mechanisms Underlying The Regulation of Root Formation in Malus hupehensis, Stem Cuttings by Using Exogenous Hormones[J]. Journal of Plant Growth Regulation, 2017, 36(1): 174-185.
[17] Rout G R. Effect of Auxins on Adventitious Root Development from Single Node Cuttings ofCamellia sinensis, (L.) Kuntze and Associated Biochemical Changes[J]. Plant Growth Regulation,2006, 48(2): 111-117.
[18]Metaxas D J, Syros T D, Yupsanis T,et al.Peroxidases During Adventitious Rooting in Cuttings of Arbutus Unedo, and Taxus Baccata, as Affected By Plant Genotype and Growth Regulator Treatment[J]. Plant Growth Regulation, 2004, 44(3): 257-266.
[19] Nag S, Saha K, Choudhuri M A. Role of Auxin and Polyamines in Adventitious Root Formation in Relation to Changes in Compounds Involved in Rooting[J]. Journal of Plant Growth Regulation, 2001, 20(2): 182-194.
[20] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[21] Bradford M M. A Rapid and Sensitive Method For The Quantitation of Microgram Quantities of Protein Utilizing The Principle of Protein-dye Binding[J]. Analytical biochemistry,1976, 72(1): 248-254.
[22] Laurentin A, Edwards C A. A Microtiter Modification of The Anthrone-sulfuric Acid Colorimetric Assay for Glucose-based Carbohydrates[J]. Analytical biochemistry, 2003,315(1):143-145.
[23] Tian M, Gu Q, Zhu M. The Involvement of Hydrogen Peroxide and Antioxidant Enzymes in The Process of Shoot Organogenesis of Strawberry Callus[J]. Plant Science, 2003, 165(4): 701-707.
[24] Li Z, Peng Y, Ma X. Different Response on Drought Tolerance and Post-drought Recovery Between The Small-leafed and The Large-leafed White Clover (Trifolium repens, L.) Associated with Antioxidative Enzyme Protection and Lignin Metabolism[J].Acta Physiologiae Plantarum, 2013, 35(1): 213-222.
[25] 付喜玲, 郭先锋, 康晓飞, 等. IBA对芍药扦插生根的影响及生根过程中相关酶活性的变化[J]. 园艺学报, 2009, 36(6): 849-854.
[26] 许晓岗, 丁俊刚, 童丽丽. 激素对楸子插穗内源激素含量和可溶性蛋白组成的影响[J]. 南京林业大学学报(自然科学版),2009, 33(2): 60-64.
[27] Basak U C, Das A B, Das P. Metabolic changes during rooting in stem cuttings of five mangrove species[J]. Plant Growth Regulation, 1995, 17(2): 141-148.
[28] Goldsmith M H M. The transport of auxin[J]. Annual Review of Plant Physiology, 1968, 19(1): 347-360.
[29] Gurumurti K, Nanda K K. Changes in peroxidase isoenzymes ofPhaseolusmungo hypocotyl cuttings during rooting[J].Phytochemistry, 1974, 13(7): 1089-1093.
[30] Rout G R, Samantaray S, Rout M C,et al.Metabolic changes during rooting in stem cuttings ofCasuarina equisetifoliaL.:effects of auxin, The sex and The type of cutting on rooting[J].Plant Growth Regulation, 1996, 19(1): 35-43.
[31] Druege U, Zerche S, Kadner R. Nitrogen-and storage-affected carbohydrate partitioning in high-light-adaptedPelargoniumcuttings in relation to survival and adventitious root formation under low light[J]. Annals of Botany, 2004, 94(6): 831-842.
[32] Rapaka V K, Bessler B, Schreiner M,et al.Interplay between initial carbohydrate availability, current photosynthesis, and adventitious root formation inPelargoniumcuttings[J]. Plant Science, 2005, 168(6): 1547-1560.
[33] 张 悦, 周 琳, 张会慧,等. 低温胁迫对蓝莓枝条呼吸作用及生理生化指标的影响[J]. 经济林研究, 2016, 34(2):12-18.
[34] 王小玲, 赵 忠, 高 柱. 插壤温度对四倍体刺槐硬枝插条生根过程中生理生化的影响[J]. 植物生理学报, 2012, 48(7): 699-704.
[35] 郭素娟, 凌宏勤, 李凤兰. 白皮松插穗生根的生理生化基础研究[J]. 北京林业大学学报, 2004, 26(2): 43-47.
[36] 王 立. 茶树扦插生根的理论与实践[J]. 中国茶叶, 1993(5):2-4.
[37] Kim J W, Kim T S. Rooting promotion in cutting propagation of tea[J]. Korean Journal of Medicinal Crop Science, 1995, 3(3):195-199.
[38] 曾炳山, 黄永芳, 杨懋勋, 等. 柚木嫩枝扦插生根过程中营养物质的研究[J]. 中南林业科技大学学报, 2013, 33(2): 1-4.
[39] Almeselmani M, Deshmukh P S, Sairam R K,et al.Protective Role of Antioxidant Enzymes Under High Temperature Stress[J].Plant Science An International Journal of Experimental Plant Biology, 2006, 171(3): 382-388.
[40] Mayer A M. Polyphenol Oxidases in Plants and Fungi: Going Places? A Review[J]. Phytochemistry, 2006, 67(21): 2318-2331.
[41] 杨谷良, 范媛媛, 邓先珍. 热激处理对甜柿外植体总酚含量和PAL、PPO、POD活性的影响[J]. 经济林研究, 2015, 33(1):115-118.
[42] Geiss G, Gutierrez L, Bellini C,et al.Adventitious Root Formation: New Insights and Perspectives[M]. Annual Plant Reviews Volume 37: Root Development. 2010: 127-156.
[43] Sato Y, Sugiyama M, Górecki R J,et al.Interrelationship Between Lignin Deposition and The Activities of Peroxidase Isoenzymes in Differentiating Tracheary Elements of Zinnia[J].Planta, 1993, 189(4): 584-589.
[44] Garspar T, Kevers C, Hausman J F,et al. Total Practical Uses of Peroxidase Activitys a Predictive Maker of Rooting Performance of Micropropagation[J]. Agronomic, 1992, 12: 757-765.
[45] Gebhardt K. Activation of Indole-3-acetic Acid Oxidase from Horseradish and Prunus by phenols and H2O2[J]. Plant Growth Regulation, 1982, 1(2): 73- 84.
[46] 刘林丽, 颜 霞, 赵亚兰. 水杨酸对脱毒马铃薯扦插苗的生理影响[J]. 西北农业学报, 2003, 12(2): 48-50.
[47] Passardi F, Cosio C, Penel C,et al.Peroxidases have more functions than a Swiss army knife[J]. Plant Cell Reports, 2005,24(5): 255-265.
[48] Jackson P A, Galinha C I, Pereira C S,et al.Rapid Deposition of Extensin During The Elicitation of Grapevine Callus Cultures is Specifically Catalyzed by A 40-kilodalton Peroxidase[J]. Plant Physiology, 2001, 127(3): 1065-1076.
[49] Syros T, Yupsanis T, Zafiriadis H,et al.Activity and Isoforms of Peroxidases, Lignin and Anatomy, During Adventitious Rooting in Cuttings ofEbenus cretica, L[J]. Journal of Plant Physiology,2004, 161(1): 69.
[50] Haissig B E. Influence of Auxins and Auxin Synergists on Adventitious Root Primordia Initiation and Development[J]. New Zealand Journal of Forestry Science, 1974, 4(2): 311-323.
[51] Bassuk N L, Hunter L D, Howard B H. The Apparent of Polyphenoloxidase and Phloridzin in The Production of Apple Rooting Cofactors[J]. Journal of Horticultural Science, 1981,56(4): 313-322.
[本文编校:吴 彬]
Mechanism of exogenous hormones in rooting process ofCytisus scoparius
LI Qianhui1, FAN Junjun1, ZHAO Mingming1,2, ZHANG Wangxiang1,2, WANG Gaiping1, SONG Yuanchao1
(1. Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry, Nanjing Forestry University, Nanjing 210037, Jiangsu, China; 2.Yangzhou Crabapple Horticulture Limited Company, Yangzhou 225200, Jiangsu, China)
In the present study, we treated the stem cuttings ofCytisus scopariuswith one exogenous hormones, indole acetic acid (IAA)(900 mg/L) and control group to discuss the process of rooting relationship between the endogenous substance and pace of change to investigate the mechanisms underlying root formation in stem cuttings and to optimize stem cutting propagation techniques. The results showed that the exogenous hormone treatment had a significant effect on the rooting time and rooting traits of the cuttings, which reduced the time to adventitious root formation by 5 days. The rooting characters (rooting percentage 79.97%, main root number 13,main root length 71.68 mm) were 1.5-3.2 times of CK. In addition, the levels of soluble sugar, starch, soluble proteins and antioxidases dynamically changed, with the time to peak value or time to valley value of each parameter synchronized well with the initiation of adventitious roots. The contents of soluble sugar, starch and soluble protein in treatment and control group were in the trend of “V”, “V”and “Λ” in the process of rooting. However, exogenous hormone treatment accelerated the consumption of soluble sugars and starch and enhanced the accumulation of soluble protein (reduced the time to the valley or peak value by 10 days as compared to that of the control group and the valley or peak value of treatment were significantly higher than control group, which increased by 6.2%, 86.1% and 11.2%). The activities of POD in treatment and control group were in the trend of “V”, and the activities of PPO and SOD all showed a “Λ”shape. However, exogenous hormone treatment significantly increased the activity of the three enzymes (reduced the time to the valley or peak value by 5 days as compared to that of the control group and the valley or peak value of treatment were significantly higher than control group, which increased by 8.7%, 4.4% and 7.8%). In conclusion, exogenous hormone treatment significantly accelerated the rate of nutrient metabolism and the synthesis of antioxidant enzymes (POD, SOD and PPO) and shortened the rooting cycle of cuttings, thus promoting the regeneration of adventitious roots.
Cytisus scoparius; cutting; rooting mechanism; nutrients; antioxidase
S723.1 文献标志码:A 文章编号:1673-923X(2017)10-0054-07
10.14067/j.cnki.1673-923x.2017.10.009
http: //qks.csuft.edu.cn
2017-01-14
国家科技支撑计划项目“高抗稳定耐水湿植物种质优选技术与示范”(2015BAD07B0104)
李千惠,硕士研究生 通讯作者:张往祥,博士,副教授,硕士研究生导师;E-mail:zhang2004@njfu.edu.cn
李千惠,范俊俊,赵明明,等. 外源激素在金雀花扦插生根进程中的调节机制[J].中南林业科技大学学报,2017, 37(10):54-60.

