“中国红”红枫植株再生技术研究
王晓立+王婷+张颖+韩浩章
摘 要:“中国红”红枫是红枫变种,其枝干多姿、优美,叶色艳丽而持久,具有极高的观赏价值,从而成为了园林绿化应用树种的新宠。为了建立“中国红”红枫的愈伤组织途径繁殖体系,该文以红枫的叶片、幼嫩茎段、叶柄作为外植体,采用75%乙醇(20s)、2%NaClO(10~15min)消毒,接种于愈伤诱导培养基上诱导培养,然后进行继代条件探讨,愈伤组织诱导芽研究。结果表明:“中国红”幼嫩茎段作为外植体可以启动愈伤组织的形成,而且优于叶片与叶柄对愈伤组织的诱导;在MS诱导培养基中,BA浓度为3mg/L,NAA浓度0.2mg/L的条件下,愈诱导率最高。在光照条件下出愈率较高。而由愈伤组织诱导芽分化则相对较难,分化芽后生根率较高。
关键词:“中国红”红枫;愈伤组织;诱导;植株再生
中图分类号 S79 文献标识码 A 文章编号 1007-7731(2017)22-0088-02
Abstract:"Chinese red" red maple is a variety of red maple.Its branches are colorful, graceful and gorgeous with long leaves.They are of high ornamental value and become the new darling of landscaping trees.In order to establish a propagation system of Chinese red maple from callus, we used 75% alcohol (20s), 2% NaClO (10 ~ 15min) as the explants, Disinfected, inoculated on callus induction medium for induction culture, and then subculture conditions, callus induction bud study.The results showed that young stem segments of "Chinese Red" could initiate callus formation as explants, and were superior to leaf and petiole on callus induction.In MS induction medium, BA concentration was 3 mg/L, NAA concentration of 0.2mg/L under the conditions, the highest induction rate.In the light of the conditions out of a higher cure rate.However, it is relatively difficult to induce bud differentiation by callus, and the rate of rooting after differentiation buds is higher.
Key words:Acer rubrum;Callus;Induction;Plant regeneration
“中國红”红枫是红枫(Acer rubrum)的变种,其枝干姿态优美,叶色保持时间长且不易褪色,具有极高的观赏价值,并且具有生态适应性广泛[1]、与其他变种植株相比生长速度快[2]等优点,从而成为了园林绿化应用树种的新宠。目前,红枫现主要通过种子繁殖和嫁接等技术进行繁殖,具有时间周期长,成活率不高等不足[3]。为开发“中国红”红枫新的繁殖技术,本试验通过在外源激素种类与浓度配比的MS培养基上,对“中国红”红枫幼嫩茎段等外植体进行一系列的愈伤组织诱导、继代培养、催芽、成苗的探讨,建立“中国红”红枫组织培养无性繁殖体系。
1 材料与方法
1.1 材料 取自宿迁新梦想园林绿化有限公司。以“中国红”红枫叶片、幼嫩茎段、叶柄作为外植体。
1.2 培养基配方 采用诱导培养基见表1。
1.3 方法 将外植体用自来水冲洗干净,吸水纸吸干水分后放于超净工作台上,采用75%乙醇20s、2%NaClO(10~15min)消毒,取出,用无菌水冲洗3次后备用。在超净工作台上外植体接种于愈伤组织诱导培养基中。培养条件:温度(25±1)℃、光照长度14h/d。
1.4 愈伤组织继代与成苗 选择质地均匀疏松度好的愈伤组织接种于光照和黑暗不同条件的培养基中进行培养。将诱导出的再生芽转入生根培养基MS+IBA0.25 mg/L中。
1.5 指标统计 计算公式如下:
愈伤组织诱导率(%)=(形成愈伤组织外植体数/接种外植体数)×100;愈伤组织污染率(%)=(污染外植体数/接种外植体数)×100。
2 结果与分析
2.1 不同激素浓度配比对外植体愈伤组织诱导的影响
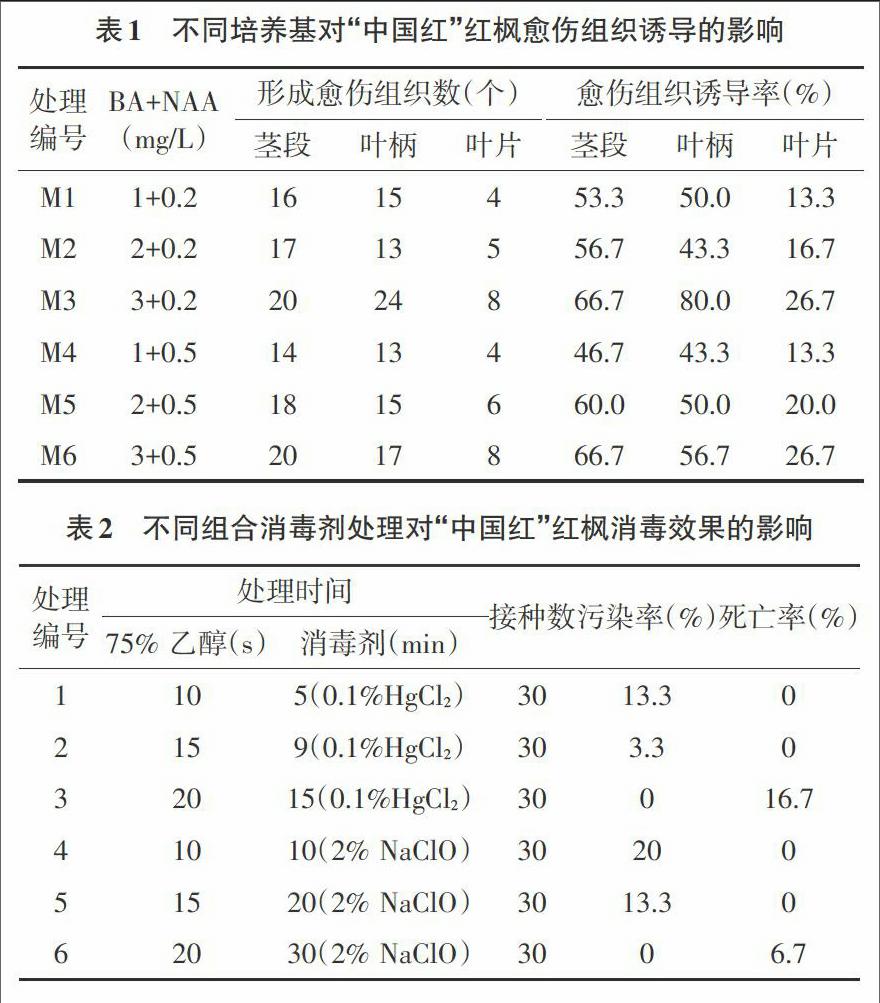
将“中国红”红枫叶片、茎段、叶柄等接种到添加植物激素不同组合浓度的MS培养基上,进行愈伤组织的诱导,接种外植体均为30,结果如表1所示。由表1可知,BA+NAA的组合均可以不同程度地诱导愈伤组织形成,BA3mg/L+NAA0.2mg/L组合对“中国红”红枫的诱导效果最好,最高诱导率达80%以上。茎段切口处产生的愈伤组织较疏松,颜色浅;另外,BA浓度的升高也会相应提高愈伤组织的诱导率。从外植体上来看,茎段和叶柄的诱导率均强于叶片,茎段诱导率整体上优于叶柄。
2.2 不同消毒处理对污染的影响 通过应用不同消毒剂处理外植体试验后发现(表2):接种7d后,以75%乙醇处理10s后,用2% NaClO 10min处理的材料污染情况很严重,以75%乙醇消毒15s和0.1% HgCl2消毒9min时,材料污染较小。HgCl2消毒剂消毒效果优于NaClO。随着消毒时间延长时,污染率均显著下降。但随着杀毒时间的延长,材料的死亡率大幅提高。综合考虑以上因素,同时考虑到HgCl2的污染性,认为75%乙醇消毒15s和2% NaClO消毒20min为较理想的消毒处理时间。endprint
2.3 愈伤组织继代培养与诱导芽分化 愈伤组织继代培养条件对“中国红”红枫愈伤组织的生长分化十分重要。以“中国红”红枫为外植体,接种于继代培养基中,一部分置于光照下(14h/d光照),另一部分放在黑暗条件下培养,接种30d后观察。发现光照条件对“中国红”红枫愈伤组织生长有很大的促进作用,光照下愈伤组织生长快,颜色浅,愈伤疏松;暗培养下外植体黄化严重,愈伤组织生长速度慢。继代培养后可得到均匀、疏松、状态稳定的愈伤组织转入MS BA2mg/L+NAA0.5mg/L培养基中诱导丛生芽。
2.4 生根培养 剪切1cm以上的分化芽转入MS+IBA0.25mg/L生根培养基中生根培养。
3 讨论与结论
3.1 讨论 愈伤组织的诱导技术中,植物部位的选择是关键因素之一[4]。在红枫愈伤诱导上,以选择硬的枝条居多[5]。新生枝条对消毒剂敏感,易死亡等缺点。但本试验选择新生枝条做为材料,可以成功诱导愈伤组织。文献在灭菌上,大体采用30s 75%乙醇,0.1%升汞组合处理[6]。本试验通过缩短75%乙醇处理时间,次氯酸钠处理时间相对延长,取得了良好效果。激素配比(生长素和细胞分裂素)对于植物愈伤组织的诱导十分重要。我们的试验结果,基本同King S M[7]试验结果相同。
3.2 结论 “中国红”红枫愈伤组织诱导以幼嫩茎段最好。在光照条件下,培养基BA3mg/L+NAA0.2mg/L下成功诱导愈伤组织。而由愈伤组织诱导芽分化则相对较难。该试验研究为进一步建立“中国红”红枫快速繁殖体系提供试验依据。
参考文献
[1]李莹,罗晓芳,蒋湘宁.美国红枫外植体选择及启动培养研究[J].黑龙江农业科学,2010(8):6-9.
[2]宗树斌,周春玲,牛立军,等.美国红枫的组织培养研究[J].山东林业科技,2006(1):1-3.
[3]桂勇武,郭成宝,高年春.4种引进彩叶树种的播种育苗技术研究[J].江苏农业科学,2006(6):271-272.
[4]于传.美国红枫(Acerrubrum)的组织培养技术体系研究[D].重庆:西南大学,2013.
[5]龚峥,王洪峰,张卫华,等.枫香组织培养快繁育苗技术研究[J].林业与环境科学,2012,28(5):45-50.
[6]曹受金,劉辉华,田英翠.美国红枫组织培养与快繁技术的研究[J].湖北农业科学,2010,49(11):2643-2645.
[7]King S M, Morehart A L.Effect of BA, NAA, and 2,4-D on red maple callus growth[J].Plant cell, tissue and organ culture, 1987,10(1): 57-63.
(责编:张宏民)endprint

