贝壳粉对Cd(Ⅱ)的吸附性能研究
罗文文 ,徐应明 ,王 农 ,蔡彦明 ,孙约兵 *
贝壳粉对Cd(Ⅱ)的吸附性能研究
罗文文1,2,徐应明1,2,王 农1,蔡彦明1,孙约兵1,2*
(1.农业部环境保护科研监测所 农业部产地环境污染防控重点实验室,天津 300191;2.农业部环境保护科研监测所 天津市农业环境与农产品安全重点实验室,天津 300191)
为了研究贝壳粉对Cd2+的吸附性能及最佳吸附条件,采用静态吸附实验研究了Cd2+初始浓度、吸附剂用量、温度、pH、吸附时间以及离子强度对贝壳粉吸附Cd2+性能的影响。结果表明:在不同Cd2+初始浓度下,随着吸附剂用量的增加,贝壳粉对Cd2+的吸附量呈现出先强烈吸附后逐渐缓和的趋势,符合准一级动力学模型和准二级动力学方程。Temkin和Langmuir模型均能较好地描述贝壳粉对Cd2+的等温吸附过程,约30 min达到平衡,为自发的吸热反应,最大饱和吸附量为161.75 mg·g-1。随着溶液pH值增加,贝壳粉对Cd2+的吸附性能也随之增大,当pH≥5时趋于稳定。随着Ca2+和Mg2+浓度增大,贝壳粉对Cd2+的吸附性能逐渐减弱,最大降幅分别达到15.19%和14.44%。
贝壳粉;镉;吸附量;影响因素
镉(Cd)是一种极具生物毒性的重金属,主要来源于金属冶炼、矿石开采、纺织印染、电镀等行业[1-3]。由于其具有在环境中不被降解,易在生物体骨骼、肝脏、肾脏中积累并导致系统紊乱等特征[3-4],对生态环境及人类健康造成极大的威胁。目前,处理重金属污染废水的方法主要有化学沉淀法、氧化还原法、离子交换法、膜分离法、电化学法、吸附法等[3]。吸附法因其具有高效、简便、选择性好等优点而被广泛应用于重金属污染废水的处理。特别是针对低浓度、强污染性,其他方法难以有效处理的重金属污染废水,吸附法具有独特的应用价值[5-6]。近年来,天然矿物、生物质及其改性材料作为吸附剂被用于重金属污染废水的处理,如沸石、黏土、泥煤、壳聚糖、木质素等[7-9]。在众多的天然矿物中,碳酸盐矿物由于高效廉价及操作简单等特点,得到了广泛的关注。自然界中的碳酸盐矿物可分为矿物来源碳酸盐和生物来源碳酸盐。陈淼等[10]的研究表明,方解石和白云石这两种碳酸盐矿物对Cd2+的饱和吸附量分别为 7.71 mg·g-1和 10.55 mg·g-1。祝凌燕等[11]的研究表明,方解石对初始浓度为200 mg·L-1的Pb2+初始固定率为99.93%,用 0.01 mol·L-1的CaCl2-NaCl电解液和微量矿物质盐MMS溶液解析后的Pb2+固定率分别为99.63%和99.83%。王吉中等[12]的研究表明,水体中的文石和方解石表面的Ca2+可与Cd2+、Mn2+、Pb2+发生离子交换反应,分别生成碳酸镉、碳酸锰和碳酸铅沉淀。吴宏海等[13]研究表明,重金属离子与方解石的表面反应为离子交换、表面配位吸附以及表面沉淀等多模式并存。Cu2+、Zn2+、Cd2+、Ni2+在低浓度(<10-6mol·L-1)时为交换吸附,在较高浓度(10-6~10-5mol·L-1)时为离子交换和表面配位吸附模式并存,在高浓度(>10-5mol·L-1)时则为表面沉淀。目前,碳酸盐矿物对重金属的吸附研究多集中于矿物来源碳酸盐,而生物来源的碳酸盐对重金属的吸附研究较少。贝壳粉作为生物碳酸盐的主要来源,除了极少部分被应用于畜禽饲料、涂料及化妆品行业外,大部分被随意丢弃,在浪费资源的同时造成了环境污染[14]。陈立新等[15]的研究发现,贝壳粉对污水中 20 g·L-1Zn2+、Cd2+、Cu2+的吸附率均达到 90%。贝壳粉对重金属污染有一定的修复作用,添加10%剂量贝壳粉后,土壤Pb和Zn浸出量可分别降低11%~91%和16%~65%[16]。因此,本文以贝壳粉为吸附材料,研究其对Cd2+的吸附动力学及热力学特征,并探讨了不同酸碱条件、离子强度等因素对贝壳粉吸附Cd2+的影响。
1 材料与方法
1.1 实验材料
实验用贝壳粉购于天津某公司,采用万能粉碎机粉碎后过200目筛,备用。
1.2 吸附实验
吸附动力学实验:将1 g贝壳粉置于1 L Cd2+初始浓度为 50 mg·L-1的 Cd(NO3)2溶液中,在 25 ℃、700 r·min-1条件下,使用磁力搅拌器搅拌24 h。分别于 1、2、5、10、15、20、30、40、60、120、180、240、300、360、480、600、720 min 和 1440 min 时取样,过 0.45 μm 水系滤膜,利用原子吸收分光光度计(ZEEnit 700P)测定滤液中Cd2+浓度。
吸附等温线实验:将0.050 g贝壳粉置于50 mL初始 Cd2+浓度为 50 mg·L-1的 Cd(NO3)2溶液中,分别在 10、25、40 ℃,180 r·min-1条件下,恒温培养振荡器振荡2 h,高速离心后测定上清液Cd2+浓度。
吸附影响因素实验:(1)贝壳粉投加量对Cd2+吸附性能影响。分别将 0.005、0.010、0.025、0.050、0.100 g贝壳粉置于50 mL初始Cd2+浓度为50 mg·L-1的Cd(NO3)2溶液中,在 25 ℃、180 r·min-1条件下,使用恒温培养振荡器振荡2 h,高速离心后测定上清液Cd2+浓度。(2)pH对贝壳粉吸附性能影响。将0.050 g贝壳粉置于 50 mL 初始 Cd2+浓度为 50、80、100 mg·L-1中,pH 分别设置为 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和 10.0,在 25 ℃、180 r·min-1条件下,使用恒温培养振荡器振荡2 h,高速离心后测定上清液Cd2+浓度。(3)共存离子对贝壳粉吸附性能影响。将0.050 g贝壳粉置于 50 mL 初始 Cd2+浓度为 50 mg·L-1,Ca2+、Mg2+离子浓度分别设置为 20、50、100、150 mg·L-1和200 mg·L-1,在 25 ℃、180 r·min-1条件下,使用恒温培养振荡器振荡2 h,高速离心后测定上清液Cd2+浓度。
1.3 数据处理
贝壳粉对水溶液中Cd2+的吸附量用下式计算:

式中:C0和Ct分别代表溶液中Cd2+的初始浓度及吸附时间 t(min)时溶液中 Cd2+的浓度,mg·L-1;V代表溶液的体积,L;m代表吸附剂的质量,g。
所有检测的数据都重复3次,所有处理均独立重复3次,以其平均值作为测定结果,用Microsoft Excel 2010进行平均值的运算,Origin 8.0作图。
2 结果与讨论
2.1 贝壳粉对Cd2+的吸附动力学特征
由图1可知,贝壳粉对Cd2+的吸附经历了2个较为明显的阶段,即快速的线性分配阶段和慢速的吸附阶段。在初始的1~30 min内,贝壳粉对Cd2+的吸附量随着时间的延长而不断增大。当吸附时间为30 min时,贝壳粉对初始浓度为50 mg·L-1Cd2+溶液中Cd2+吸附量达到43.12 mg·g-1,而将吸附时间延长至24 h,贝壳粉对Cd2+的吸附量并没有明显增加。这是由于在吸附的初始阶段,贝壳粉表面存在大量的吸附位点,且Cd2+初始浓度高,吸附传质动力大,所以对Cd2+的吸附速率迅速增加。随着吸附的进行,贝壳粉表面的吸附位点越来越少,且Cd2+浓度降低,吸附传质动力逐渐减小[17]。贝壳粉对Cd2+的吸附于30 min时达到饱和,吸附速率趋于稳定,吸附量上升不明显。因此,贝壳粉去除水环境中Cd2+的最佳吸附时间为30 min。研究表明,纳米羟基磷灰石[18]、膨润土[19]、改性白果壳[20]对Cd2+的吸附分别在120、120、60 min后达到吸附平衡。与之相比,贝壳粉的最佳吸附时间短,能更快达到吸附平衡,具有更高的处理效率。
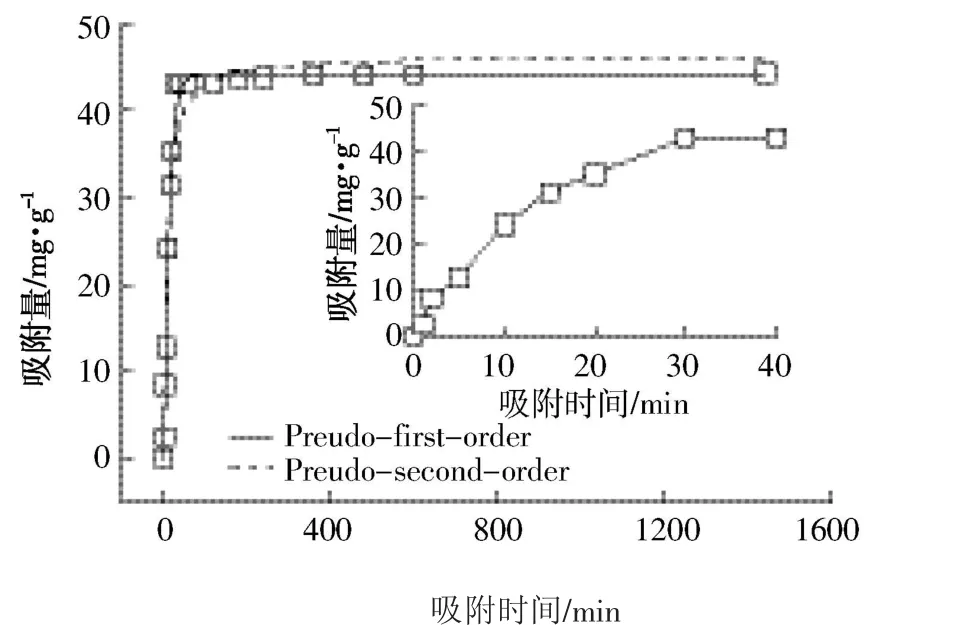
图1 贝壳粉对Cd2+的吸附动力学方程拟合Figure 1 Fitting of kinetic data of Cd2+on shell power
为了研究贝壳粉去除水环境中Cd2+的动力学特征,本实验在吸附关系曲线(吸附量-吸附时间)的基础上,采用准一级动力学方程及准二级动力学方程对实验数据进行拟合(图1),拟合过程中两种动力学模型的相关参数见表1。
准一级动力学模型(Pseudo-first-order):

准二级动力学模型(Pseudo-second-order):

式中:qt为t时刻单位质量贝壳粉吸附Cd2+的量,mg·g-1;qe为吸附平衡时单位质量贝壳粉吸附Cd2+的量,mg·g-1;t为吸附时间,min;k1为准一级反应速率常数,min-1;k2为准二级反应速率常数,g·mg-1·min-1。
结果表明,实验所得数据与准一级动力学和准二级动力学模型均较好拟合,R2分别达到0.995 0和0.969 5。准一级动力学模型的拟合度系数R2较准二级动力学模型高,说明实验数据与准一级动力学模型符合良好,偏离程度较小。当初始浓度为50 mg·L-1的Cd2+溶液,拟合所得的 qe,cal比实验测得的 qe,exp偏大,分别为2.27%和7.56%。准一级动力学方程描述的是吸附质在吸附剂外部的扩散过程,即吸附质分子从液相中扩散到固体表面的过程。该模型基于假定吸附受扩散过程控制,吸附速率正比于平衡吸附量与t时刻吸附量的差值[21],即吸附速率与未结合吸附位点的数量成正比。本研究实验数据与该模型拟合良好,说明贝壳粉对Cd2+的吸附过程由扩散过程所控制,外部传质阻力是该过程的限制因素。
2.2 贝壳粉对Cd2+热力学特征
本实验中不同温度下的吸附等温线分别采用Langmuir、Freundlich和Temkin等温式进行拟合:
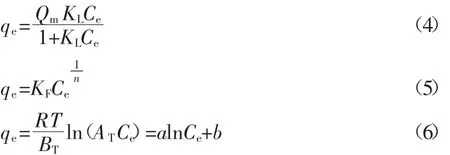
式中:qe代表平衡吸附量,mg·g-1;Qm代表饱和吸附量,mg·g-1;Ce代表平衡浓度,mg·L-1;KL代表吸附参数,L·mg-1;KF代表吸附容量,mg·g-1(L·mg-1)1/n;R 代表气体常数,J·mol-1·K-1;T 代表绝对温度,K;AT代表吸附参数,dm3·mmol-1;BT为常数。

表1 贝壳粉对Cd2+吸附动力学相关参数Table 1 Kinetic parameters of Cd2+sorption
本研究对Cd2+溶液分别在10、25、40℃的条件下进行吸附实验,并运用上述3种等温线模型对所得实验数据进行拟合,结果如图2所示。拟合过程中3种等温线模型的相关参数见表2。
对于Langmuir等温式,吸附是否有利可通过RL(Langmuir等温吸附模型的基本特征指数)来判断:

式中:KL代表吸附参数,L·mg-1;C0代表重金属初始浓度,mg·L-1。
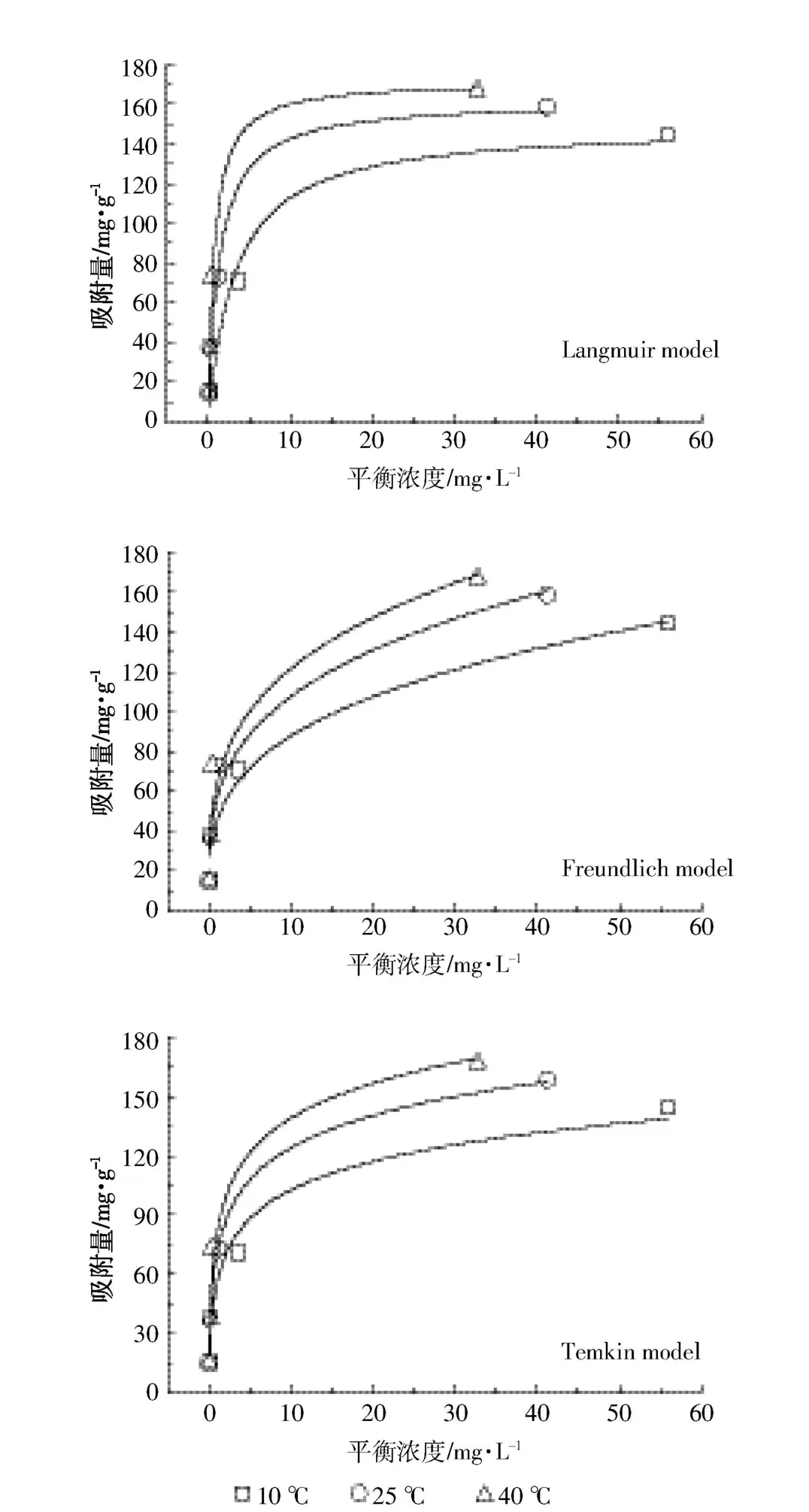
图2 贝壳粉对Cd2+的吸附等温线Figure 2 Isotherm fitting of Cd2+on shell power
由表3可知,本研究中0
吸附热指的是吸附过程中的热效应,吸附热的大小可反映吸附的强弱。一般通过吸附过程的吉布斯自由能变化(ΔG)、熵变(ΔS)和焓变(ΔH)对吸附过程进行热力学分析。


表2 Langmuir,Freundlich,Temkin吸附等温线相关参数,Langmuir吸附等温线分离系数Table 2 Parameters of Langmuir,Freundlich,and Temkin isotherm fitting for Cd2+,separation factor of Langmuir isotherm fitting for Cd2+
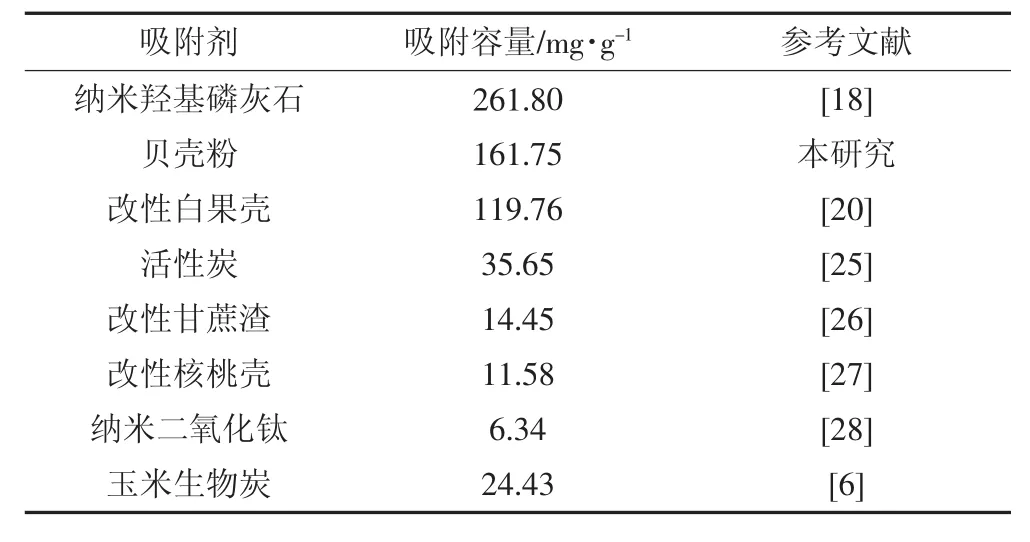
表3 不同吸附剂对Cd2+的吸附容量Table 3 Comparison of adsorption capacities of various adsorbents for Cd2+

式中:R 为气体常数,取值 8.314 J·mol-1·K-1;T 为开氏温度,K;K 为分配系数,mL·g-1,本研究采用 Langmuir模型所得KL代替[29]。
根据式(9),以 lnK 对 1/T作图(图 3),进行线性回归分析后通过斜率和截距可分别得到ΔH和ΔS的值;ΔG的值可通过式(8)直接求出。相关热力学参数见表4。
由表4可知ΔG<0,说明贝壳粉对Cd2+的吸附过程是自发反应。有研究表明,当吸附反应的ΔG绝对值小于20 kJ·mol-1时,吸附过程以物理吸附为主[30]。本研究中三个温度下的ΔG均小于20 kJ·mol-1,因此可判断该反应以物理吸附为主,而且该判断与动力学分析所得结论相符。本研究中ΔS>0,说明随着反应的进行,整个系统的无序度增大;ΔH>0,说明该反应为吸热反应,吸附量随温度的升高而增加。该判断与吸附等温线的拟合结果相符。

图3 不同温度对平衡吸附系数的影响Figure 3 Effect of temperature on coefficients

表4 贝壳粉对Cd2+吸附热力学相关参数Table 4 Thermodynamic parameters of Cd2+sorption
2.3 贝壳粉对Cd2+吸附性能的影响因素分析
2.3.1 贝壳粉投加量对Cd2+吸附性能影响
图4显示的是贝壳粉投加量对Cd2+吸附性能的影响。随着贝壳粉投加量的增加,贝壳粉对不同浓度的Cd2+的吸附量均呈现先逐渐增加、后逐渐减少的趋势。当贝壳粉用量为0.2 g·L-1时,在50 mg·L-1及100 mg·L-1的Cd2+溶液中吸附量均达到最大值,分别为75.09、138.32 mg·g-1。当吸附剂用量为 0.5 g·L-1时,吸附剂对80 mg·L-1的Cd2+溶液的吸附量达到最大值,其值为80.23 mg·g-1。这是由于随着吸附剂用量的增加,贝壳粉的比表面积及吸附位点增加,贝壳粉吸附Cd2+的绝对量增加。而当吸附剂用量继续增加时,单位吸附量下降。这是由于Cd2+的浓度下降且吸附剂量增加,吸附剂的一些吸附位点没有达到吸附饱和[14]。
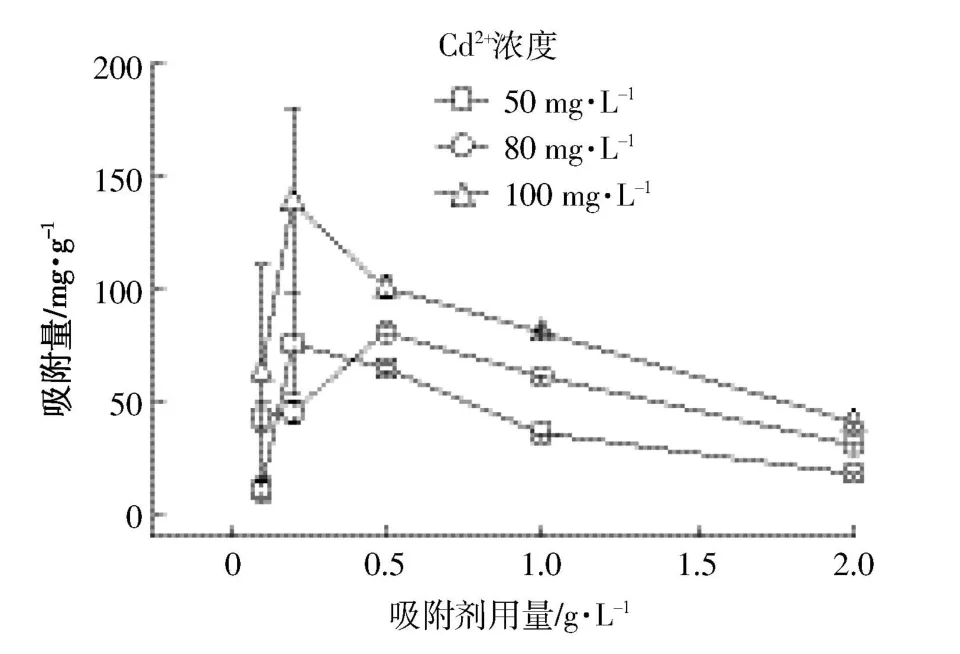
图4 不同剂量下贝壳粉对Cd2+吸附Figure 4 Effect of shell power contents on Cd2+sorption
2.3.2 pH对贝壳粉吸附性能影响分析
在Cd2+初始浓度为50 mg·L-1时,当溶液pH由2增加到4时,贝壳粉对Cd2+吸附量随着pH值的增大而迅速增加,Cd2+吸附量由17.28 mg·g-1增加到38.49 mg·g-1(图5a)。当pH值由4增加至10时,Cd2+吸附量总体处于稳定,说明该吸附反应适应pH范围较宽。这是由于不同pH条件下,Cd2+的赋存状态不同。石和彬等[18]的研究表明,当pH<9时,镉离子以Cd2+及少量CdNO+3的形态存在,当pH值逐渐增加时,Cd2+与羟基复合,则以多重碱式离子的形态存在,且溶液的初始pH可以影响重金属和吸附剂表面之间的络合反应、静电作用和表面沉淀等物理化学吸附机制[31-32]。本实验中,在pH值较低时,溶液中存在大量的H+,这些H+与Cd2+竞争由贝壳粉表面释放的CO2-3,从而阻止Cd2+在吸附剂表面生成碳酸盐沉淀[33]。随着pH值上升,溶液中H+浓度降低,Cd2+获得更多的CO2-3而生成碳酸盐沉淀,致使Cd2+吸附容量增加。同时,吸附剂表面负电荷也会随着pH升高而增加,使得吸附剂表面与Cd2+的静电斥力减弱,有助于Cd2+吸附容量的增加。另外,随着pH值的增大,Cd2+逐渐转化成较易被吸附的水合离子结构[17]。在本研究中,在pH值达到4时,Cd2+的平衡吸附量达到饱和,即使pH值继续增加,贝壳粉对Cd2+的吸附去除效率几乎无变化。

图5 pH和离子浓度对贝壳粉吸附Cd2+的性能影响Figure 5 Effects of pH and concentration of Ca2+,Mg2+on Cd2+sorption on shell power
2.3.3 共存离子对贝壳粉吸附性能影响
由图5b可知,未加入Ca2+、Mg2+时,贝壳粉对Cd2+的吸附量为 35.524 mg·g-1,不同浓度的 Ca2+、Mg2+对贝壳粉的吸附性能均产生抑制作用。当Ca2+浓度在20~100 mg·L-1范围内,随着Ca2+浓度的增加,其对贝壳粉吸附性能的抑制作用略有减弱,但不明显;当Ca2+浓度高于100 mg·L-1时,随着Ca2+浓度的增加,其对贝壳粉吸附性能的抑制作用急剧增强。当Mg2+浓度在20~150 mg·L-1范围内,随着Mg2+浓度的增加,其对贝壳粉吸附性能的抑制作用急剧增强;而当Mg2+浓度高于150 mg·L-1时,随着Mg2+浓度的增加,其对贝壳粉吸附性能的抑制作用有所减弱。同浓度的Ca2+、Mg2+相比,Mg2+的抑制作用更强。这是因为金属离子的竞争吸附能力与其离子电荷和水合离子半径有关[34-35]。当离子所带电荷数相同时,水合离子半径越小的离子,越容易被吸附剂吸附。因而,同价态二价阳离子的Mg2+比Ca2+更容易被贝壳粉吸附,其竞争吸附能力强于Ca2+,对贝壳粉吸附Cd2+的影响较大[6]。
3 结论
(1)贝壳粉对Cd2+的吸附在30 min后逐渐平衡,达到最大吸附量;随着吸附剂用量的增加,贝壳粉对不同浓度的Cd2+的吸附量均呈现出先剧烈增加,后逐渐减少的趋势。
(2)该吸附过程符合准一级动力学模型;等温吸附过程可用Temkin和Langmuir等温线较好地拟合,且其饱和吸附量可达161.75 mg·g-1。
(3)贝壳粉对Cd2+吸附过程以物理吸附为主。ΔH>0,说明该反应为吸热反应,吸附量随温度的升高而增加;ΔS>0,说明随着反应的进行,整个系统的无序度增大。
(4)贝壳粉对水溶液中Cd2+的吸附性能在pH为4~10的范围内比较稳定。不同浓度的Ca2+、Mg2+对贝壳粉的吸附性能均产生抑制作用。随着Ca2+浓度的升高,其对贝壳粉吸附性能的抑制作用呈现出先略微减弱后急剧增强的趋势;随着Mg2+浓度的升高,抑制作用呈现出先急剧增强后有所减弱的现象。
[1]Sun Y,Zhou Q,Diao C.Effects of cadmium and arsenic on growth and metal accumulation of Cd-hyperaccumulator Solanum nigrum L.[J].Bioresource Technology,2008,99(5):1103-1110.
[2]Sun Y,Xu Y,Xu Y,et al.Reliability and stability of immobilization remediation of Cd polluted soils using sepiolite under pot and field trials[J].Environmental Pollution,2016,20:739-746.
[3]周启星,宋玉芳,等著.污染土壤修复原理与方法[M].北京:科学出版社,2004.
ZHOU Qi-xing,SONG Yu-fang,et al.Remediaion of contaminated soils:Principles and methods[M].Beijing:Science Press,2004.
[4]丁 洋,靖德兵,周连碧,等.板栗内皮对水溶液中镉的吸附研究[J].环境科学学报,2011,31(9):1933-1941.
DING Yang,JING De-bing,ZHOU Lian-bi,et al.Study on the adsorption of aquatic cadmium(Ⅱ)by chestnut inner shell[J].Acta Scientiae Circumstantiae,2011,31(9):1933-1941.
[5]邹照华,何素芳,韩彩芸,等.重金属废水处理技术研究进展[J].工业水处理,2010,36(5):17-21.
ZOU Zhao-hua,HE Su-fang,HAN Cai-yun,et al.Research progress in heavy metal wastewater treatment techniques[J].Industrial Water Treatment,2010,36(5):17-21.
[6]徐楠楠,林大松,徐应明,等.生物炭在土壤改良和重金属污染治理中的应用[J].农业环境与发展,2013,30(4):29-34.
XU Nan-nan,LIN Da-song,XU Ying-ming,et al.Application of biochar on soil improvement and heavy metal pollution abatement[J].A-gro-Environment&Development,2013,30(4):29-34.
[7]Bailey S E,Olin T J,Bricka R M,et al.A review of potentially low-cost sorbentsforheavymetals[J].WaterResearch,1999,33(11):2469-2479.
[8]Basta N T,Gradwohl R,Snethen K L,et al.Chemical immobilization of lead,zinc,and cadmium in smelter-contaminated soils using biosolids and rock phosphate[J].Journal of Environmental Quality,2001,30(4):1222-1230.
[9]孙约兵,徐应明,史 新,等.污灌区镉污染土壤钝化修复及其生态效应研究[J].中国环境科学,2012,32(8):1467-1473.
SUN Yue-bing,XU Ying-ming,SHI xin,et al.The immobilization remediation of Cd contaminated soils in wastewater irrigation region and itsecologicaleffects[J].ChinaEnvironmentalScience,2012,32(8):1467-1473.
[10]陈 淼,吴永贵.两种天然碳酸盐矿物对废水中Cd2+的吸附及解吸试验[J].桂林理工大学学报,2014,34(1):94-98.
CHEN Miao,WU Yong-gui.Adsorption and desorption of Cd2+in wastewater onto two kinds of natural carbonate minerals[J].Journal of Guilin University of Technology,2014,34(1):94-98.
[11]祝凌燕,林加华,张子种.5种天然矿物修复铅污染沉积物的实验研究[J].环境科学与技术,2010,33(4):1-5.
ZHU Ling-yan,LIN Jia-hua,ZHANG Zi-zhong.Experimental study on in situ remediation of Pb-contaminated sediments by active capping with five natural minerals[J].Environmental Science&Technology,2010,33(4):1-5.
[12]王吉中,李胜荣,刘宝林,等.国内矿物治理重金属废水研究进展与展望[J].矿物岩石地球化学通报,2005,24(2):159-164.
WANG Ji-zhong,LI Sheng-rong,LIU Bao-lin,et al.Progress and prospect of the research on the treatment of heavy metal-bearing wastewater by using minerals in China[J].Bulletin of Mineralogy,Petrology and Geochemistry,2005,24(2):159-164.
[13]吴宏海,吴大清,彭金莲.重金属离子与方解石表面反应的实验研究[J].岩石矿物学杂志,1999,18(4):301-308.
WU Hong-hai,WU Da-qing,PENG Jin-lian.Experimental study on the surface reactions of heavy metal ion with calcite[J].Acte Petrologica Et Mineralogica,1999,18(4):301-308.
[14]杜 洋.贝壳粉去除水体中重金属的机理研究[D].天津:南开大学,2011.
DU Yang.Research on mechanism of removal of heavy metal in water onto shell power[D].Tianjin:Nankai University,2011.
[15]陈立新,王业松,周 原.贝壳粉处理重金属离子废水的研究[J].湖南工程学院学报,2012,22(4):43-46.CHEN Li-xin,WANG Ye-song,ZHOU Yuan.Study on the treatment of heavy metal wastewater with shell powder[J].Journal of Hunan Institution of Engineering,2012,22(4):43-46.
[16]张 琢,王 梅,任 杰,等.贝壳粉对污染土壤中Pb、Zn、Cd的稳定化作用[J].环境污染与防治,2016,38(1):14-18.
ZHANG Zhuo,WANG Mei,REN Jie,et al.Effects of sea shell powder on the stabilization of Pb,Zn and Cd in contaminated soil[J].Environmental Pollution&Control,2016,38(1):14-18.
[17]张 越,林珈羽,刘 沅,等.改性生物炭对镉离子吸附性能研究[J].武汉科技大学学报,2016,39(1):48-52.
ZHANG Yue,LIN Jia-yu,LIU Yuan,et al.Adsorption of cadmium ions by chemically modified biochar[J].Journal of Wuhan University of Science and Technology,2016,39(1):48-52.
[18]石和彬,钟 宏,刘 羽,等.纳米羟基磷灰石的镉离子吸附性能[J].武汉工程大学学报,2012,34(5):35-41.
SHI He-bin,ZHONG Hong,LIU Yu,et al.Properties of nano hydroxyapatite for sorption of aqueous cadmium ion[J].Journal of Wuhan Institute of Technology,2012,34(5):35-41.
[19]仇 欢,王风贺,李 卉,等.不同膨润土对含镉废水的吸附性能[J].环境工程学报,2016,10(11):6513-6518.
QIU Huan,WANG Feng-he,Li Hui,et al.Adsorption characteristics of Cd2+-containing wastewater onto different bentonites[J].Chinese Journal of Environmental Engineering,2016,10(11):6513-6518.
[20]苏 鹃,伍 钧,杨 刚,等.改性白果壳对水溶液中重金属镉的吸附研究[J].农业环境科学学报,2014,33(6):1218-1225.
SU Juan,WU Jun,YANG Gang,et al.Adsorption of Cd2+from solution by modified ginkgo shell powder[J].Journal of Agro-Environment Science,2014,33(6):1218-1225.
[21]林春香,詹怀宇,刘明华,等.球形纤维素吸附剂对Cu2+的吸附动力学与热力学研究[J].离子交换与吸附,2010,26(3):226-238.
LIN Chun-xiang,ZHAN Huai-yu,LIU Ming-hua,et al.Theemodynamics and kinetics of adsorption of Cu(Ⅱ)from aqueous solutions onto a spherical cellulose adsorption[J].Ion Exchange and Adsorption,2010,26(3):226-238.
[22]Chen H,Zhao J.Adsorption study for removal of Congo red anionic dye using organo-attapulgite[J].Adsorption,2009,15(4):381-389.
[23]Mall I D,Srivastava V C,Agarwal N K,et al.Removal of Congo red from aqueous solution by bagasse fly ash and activated carbon:Kinetic study and equilibrium isotherm analyses[J].Chemosphere,2005,61(4):492-501.
[24]Kavitha D,Namasivayam C.Experimental and kinetic studies on methylene blue adsorption by coir pith carbon[J].Bioresour Technol,2007,98(1):14-21.
[25]张淑琴,童仕唐.活性炭对重金属离子铅镉铜的吸附研究[J].环境科学与管理,2008,33(4):91-94.
ZHANG Shu-qin,TONG Shi-tang.The adsorption studies of activated carbon for heavy metal ions of lead,cadmium and copper[J].Environmental Science and Management,2008,33(4):91-94.
[26]陈智超,张超兰,李传章,等.改性蔗渣对水溶液中Cd2+的吸附研究[J].广西大学学报(自然科学版),2015(5):1314-1322.
CHEN Zhi-chao,ZHANG Chao-lan,LI Chuan-zhang,et al.Adsorp-tion of cadmium(Ⅱ)from aqueous solutions by modified bagasse[J].Journal of Guangxi University(Natural Science Edition),2015(5):1314-1322.
[27]Ali Almasi,Mehdi Omidi,Mehdi Khodadadian,et al.Lead(Ⅱ)and cadmium(Ⅱ)removal from aqueous solution using processed walnut shell:Kinetic and equilibrium study[J].Toxicological&Environmental Chemistry,2012,94(4):660-671.
[28]杨丽君.纳米二氧化钛对环境样品中镉的吸附性能研究[D].沈阳:辽宁大学,2011.
YANG Li-jun.Characterization of cadmium by selective adsorption nanoparticles in environmental samples[D].Shenyang:Liaoning University,2011.
[29]DENG Lin,SHI Zhou,LUO Lu,et al.Adsorption of hexavalent chromium onto kaolin clay based adsorbent[J].Journal of Central South University,2014,21(10):3918-3926.
[30]景 明.生物炭对土壤中六价铬和莠去津的吸附锁定作用研究[D].北京:中国地质大学,2015.
JING Ming.A study on sorption and locking effect of Cr(Ⅵ)and atrazine in biochar-amended soil[D].Beijing:China University of Geosciences,2015.
[31]李程峰,刘云国,曾光明,等.pH值影响Cd在红壤中吸附行为的实验研究[J].农业环境科学学报,2005,24(1):84-88.
LI Cheng-feng,LIU Yun-guo,ZENG Guang-ming,et al.A effect of pH on cadmium adsorption behavior in red soils[J].Journal of Agro-Environment Science,2005,24(1):84-88.
[32]Abollino O,Aceto M,Malandrino M,et al.Adsorption of heavy metals on Na-montmorillonite:Effect of pH and organic substances[J].Water Research,2003,37(7):1619-1627.
[33]Pokrovsky O S,Schott J.Surface chemistry and dissolution kinetics of divalent metal carbonates[J].Environmental Science&Technology,2002,36(3):426-432.
[34]Nada A A M A,Hassan M L.Phosphorylated cation-exchangers from cotton stalks and their constituents[J].Journal of Applied Polymer Science,2010,89(11):2950-2956.
[35]Celis R,Hermosin M C,Cornejo J.Heavy metal adsorption by functionalized clays[J].Environmental Science&Technology,2010,34:4593-4599.
Adsorption performance of cadmium onto shell powder
LUO Wen-wen1,2,XU Ying-ming1,2,WANG Nong1,CAI Yan-ming1,SUN Yue-bing1,2*
(1.Key Laboratory of Original Agro-Environmental Pollution Prevention and Control,Ministry of Agricultural,Agro-Environmental Protection Institute,Ministry of Agriculture,Tianjin 300191,China;2.Tianjin Key Laboratory of Agro-Environment and Agro-Product,Agro-Environmental Protection Institute,Ministry of Agriculture,Tianjin 300191,China)
To study the adsorption mechanisms and the optimum adsorption conditions of Cd2+onto shell powder,batch experiments were conducted to investigate the effects of initial Cd2+concentration,adsorbent dose,pH,temperature,time,and ionic strength on Cd2+adsorption onto the shell powder.The results showed that the adsorption of Cd2+onto the shell powder rapidly increased and then decreased gradually with the increase of sorption agent under different initial Cd2+concentration,and the adsorption fitted well to pseudo-first-order and pseudo-second-order kinetics.The isothermal adsorption was well described by the Temkin isotherm and the Langmuir isotherm.The adsorption process of Cd2+was a spontaneous and endothermic reaction that achieved adsorption equilibrium in only 30 min,and the maximum equilibrium adsorption capacity was 161.75 mg·g-1.The adsorption of Cd2+onto the shell powder increased with increasing pH,and then stabilized when the pH was≥5.With increasing concentrations of Ca2+and Mg2+,the adsorption properties of the shell powder gradually decreased,with maximum reductions of 15.19%and 14.44%,respectively,compared with the control group.
shell powder:cadmium;adsorption capacity;influence factor
X52
A
1672-2043(2017)11-2240-08
10.11654/jaes.2017-0583
罗文文,徐应明,王 农,等.贝壳粉对Cd(Ⅱ)的吸附性能研究[J].农业环境科学学报,2017,36(11):2240-2247.
LUO Wen-wen,XU Ying-ming,WANG Nong,et al.Adsorption performance of cadmium onto shell powder[J].Journal of Agro-Environment Science,2017,36(11):2240-2247.
2017-04-20 录用日期:2017-07-05
罗文文(1992—),女,甘肃天水人,硕士研究生,从事重金属污染修复技术研究。E-mail:1737415873@qq.com
*通信作者:孙约兵 E-mail:sunyuebing@aepi.org.cn
国家重点研发计划课题(2017YFD0801402);天津市自然科学基金重点项目(17JCZDJC34200);中国农科院基本科研业务费专项院级统筹项目(2017-syb-1)
Project supported:The National Key Research and Development Program of China(2017YFD0801402);The Key Program of Natural Science of Tianjin(17JCZDJC34200);The Basic Funds for Research and Development of Chinese Academy of Agriculture Sciences(2017-syb-1)

