人参皂苷Rg3温敏纳米粒制备及对肝癌细胞抑制作用研究
张味娜,徐 逸,俞 敏*
·论著·
人参皂苷Rg3温敏纳米粒制备及对肝癌细胞抑制作用研究
张味娜1,徐 逸2,俞 敏1*
目的制备人参皂苷Rg3温敏纳米粒,对其体外释药特性和对肝癌细胞的抑制作用进行研究。方法两亲性温敏聚合物作为药物载体,滴制法制备载药温敏纳米粒。采用正交试验设计,以包封率为主要评价指标,温敏聚合物浓度、人参皂苷Rg3浓度和搅拌时间为考察因素,筛选纳米粒处方和工艺。体外释放曲线法研究37 ℃和42 ℃时温敏纳米粒的体外释放特征。MTT法(四氮唑盐微量酶反应比色法)考察温敏纳米粒对HepG2肝癌细胞增生的抑制作用。结果优选处方及制备工艺为温敏聚合物,浓度为0.20 mg/mL,人参皂苷Rg3浓度为0.03 mg/mL,搅拌时间为2 h;温敏纳米粒呈类球形,包封率为78.43%±1.76%,平均粒径为(147.0±2.3)nm,平均Zeta电位为-14.6 mV(n=3)。体外释放结果表明,37 ℃时,3 h药物累积释放度为36.1%,24 h累积释放度为44.6%;42 ℃时,3 h累积释放度达54.1%,24 h累积释放率为83.0%。体外抑制结果显示,随着温敏纳米粒浓度从20 μg/mL增加至180 μg/mL,HepG2肝癌细胞成活率由69.8%下降至37.7%。结论人参皂苷Rg3温敏纳米粒处方和工艺合理可行,能达到随温度变化对药物释放起调释作用,对HepG2肝癌细胞具有较好的体外抑制作用。
人参皂苷Rg3;温敏纳米粒;正交设计;体外释放
0 引言
原发性肝癌是高发的恶性肿瘤之一,病死率高,预后差[1-2]。射频消融是局部热疗的一种方式,近年成为治疗原发性肝癌的主要方法之一,但是射频消融对肝癌的治疗存在局部复发和转移的问题[3-4]。如果能通过化疗方法联合射频消融进一步杀死残存的癌细胞,便可降低局部复发和转移,提高患者的生存率和生活质量。
人参皂苷Rg3 是从人参中分离的一种四环三萜皂苷,能抑制肿瘤细胞浸润和转移,具有显著的抗肿瘤作用,对肺癌、黑色素瘤和肝癌细胞等有明显抑制作用[5-6]。人参皂苷Rg3水溶性较差,口服后血浆浓度很低,口服3.2 mg/kg后测得最大血药浓度仅为(16±6)μg/L[7-8],故亟需采用制剂手段提高其生物利用度。纳米制剂可提高难溶性药物的溶解度,促进药物在体内的吸收,提高其生物利用度,减少对正常组织的毒副作用[9-11]。其中,温敏纳米粒作为一种主动靶向肿瘤治疗的新策略,目前也被广泛应用于各种肿瘤疾病的治疗研究和实践中;温敏纳米粒一旦被靶部位温度变化诱导或刺激,能在肿瘤部位聚集或在靶位点释放有效载荷,进而减少对正常组织的损伤,提高肿瘤治疗的精准性和有效性[12]。
临床治疗实践中,射频消融技术在肿瘤部位产生局部热效应,使温度高于温敏纳米粒最低临界溶解温度,从而使肿瘤部位药物释放增加,且不引起药物在其他部位的释放。本试验通过制备人参皂苷Rg3温敏纳米粒,达到化学治疗联合射频消融的目的,以期更有效地治疗肝癌患者。
1 材料
1.1 仪器 JB-3型定时磁力搅拌器(上海智光仪器仪表有限公司);RE-5205旋转蒸发仪(上海亚荣生化仪器厂);KQ-100超声波清洗器(昆山市超声仪器有限公司);LGJ-10冷冻干燥机(长沙湘仪离心机仪器有限公司);Agilent 1260高效液相色谱仪(安捷伦科技有限公司);Nano-ZS90型激光粒度分析仪(英国马尔文仪器设备有限公司);5810R冷冻高速离心机(德国艾本德科技有限公司,离心半径9.5 cm);JEM1400透射电子显微镜(日本电子株式会社);Multiskan Ascent酶标仪(美国赛默飞世尔科技有限公司);THZ-82型水浴恒温振荡器(江苏省金坛市宏华仪器厂)。
1.2 药品与试剂 HepG2细胞(中国科学院上海细胞库);DMEM培养基(赛默飞世尔生物化学制品);人参皂苷Rg3(纯度>98%,上海同田生物技术股份有限公司,批号:14090136);P(NIPAM-co-DMAAM)-b-PCL(两亲性温敏聚N-异丙基丙烯酰胺类嵌段共聚物,最低临界溶解温度为41.5 ℃,温州医科大学药学院提供);透析袋(分子量:3 500,北京鼎国生物技术有限公司)。其他试剂均为分析纯或化学纯。
2 方法与结果
2.1 人参皂苷Rg3含量测定方法[13]
2.1.1 色谱条件 色谱柱:Kromasiol ODS-C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(50∶50),体积流量:1 mL/min,检测波长:203 nm,进样量:20 μL,柱温:30 ℃。此色谱条件下,人参皂苷Rg3的相对保留时间约为9.0 min,且载体色谱峰与人参皂苷Rg3色谱峰能很好地达到基线分离,空白辅料无干扰,表明此方法专属性强。色谱图见图1。
2.1.2 标准曲线的制备 精密称取干燥至恒重的人参皂苷Rg3对照品10 mg,置于10 mL量瓶中,加甲醇超声溶解并稀释至刻度,摇匀,即得1 mg/mL的储备液。分别精密量取0.1、0.2、0.4、0.6、0.8、1.0 mL储备液置于10 mL量瓶中并稀释至刻度,摇匀,分别吸取20 μL进行测定。以峰面积(A)对质量浓度(C)作线性回归,得回归方程:A=8.856 5 C+2.802 1,r=0.999 9,线性范围:10~100 μg/mL,以信噪比为3时测得检测限为0.05 μg/mL,以信噪比为10时测得定量限为0.1 μg/mL。
2.1.3 方法精密度试验 制备高、中、低(100、50、10 μg/mL)3个质量浓度的人参皂苷Rg3标准液,分别放置0、2、4、8、12、24 h,用HPLC测定,考察日内精密度;每日测定1次,连续测定5 d,考察日间精密度。结果表明,高、中、低质量浓度人参皂苷Rg3标准液日内RSD分别为0.97%、1.12%、0.86%(n=6),日间RSD分别为0.74%、0.92%、1.07%(n=5),方法精密度符合分析试验要求。
2.1.4 提取回收率试验 按“2.2”项下方法制备空白纳米粒,精密移取1.0 mL空白纳米粒混悬液9份并分别置于10 mL容量瓶中,分别加入1 mg/mL人参皂苷Rg3标准储备液0.1、0.5、1.0 mL,各3份,甲醇稀释并定容至刻度,制得低、中、高3个质量浓度为10、50、100 μg/mL的人参皂苷Rg3供试品溶液。按“2.1.1”项下方法测定,代入随行标准曲线计算人参皂苷Rg3实际质量浓度,与已知质量浓度相比计算回收率。平均回收率为98.64%,RSD为1.03%(n=9),回收率符合要求。
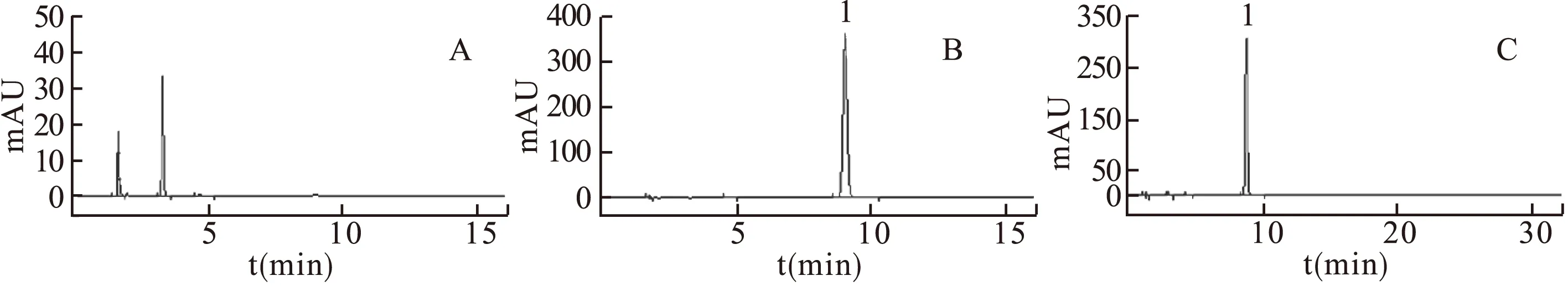
图1 高效液相色谱图注:A.空白辅料,B.对照品,C.样品;1.人参皂苷Rg3
2.1.5 仪器精密度试验 取人参皂苷Rg3对照品溶液(50 μg/mL)适量,按“2.1.1”项下色谱条件连续重复进样6次,记录色谱图。结果显示,人参皂苷Rg3峰面积的RSD为0.61%(n=6),表明仪器精密度良好。
2.2 人参皂苷Rg3温敏纳米粒的制备 精密称取一定量温敏两亲嵌段共聚物P(NIPAM-co-DMAAM)-b-PCL(参考文献[14]制备)分散到5 mL四氢呋喃溶液中,超声至完全溶解,用注射器(4号针头)吸取聚合物的四氢呋喃溶液滴加到100 mL的人参皂苷Rg3甲醇溶液中,边滴加边搅拌(1.0 mL/min,搅拌速度200 r/min)。全部加入后,继续搅拌一定时间后过滤,即得人参皂苷Rg3温敏纳米粒的混悬液。将混悬液转移至透析袋中(分子量:3 500),用PBS缓冲液和蒸馏水分别透析12 h(3次,1 000 mL/次)除去未包封的药物和四氢呋喃。透析之后冷冻干燥,即得载药纳米粒粉末。密封后4 ℃冰箱储存。
2.2.1 人参皂苷Rg3温敏纳米粒的制备工艺优化 以包封率为评价指标,通过单因素试验,对不同滴加速度、不同温敏聚合物浓度、不同人参皂苷Rg3浓度、不同搅拌转速和不同搅拌时间范围进行考察。基于单因素试验结果,对影响包封率的3个主要因素:温敏聚合物浓度(mg/mL)、人参皂苷Rg3浓度(mg/mL)和搅拌时间(h)进行正交设计。每个因素3个水平,采用正交表L9(3)4,以包封率为主要评价指标进行处方优化。因素水平和正交试验结果见表1、表2。

表1 正交设计因素水平表

表2 人参皂苷Rg3温敏纳米粒L9(3)4正交试验安排和试验结果
注:K1、K2、K3分别为3个水平的平均值;R为极差
正交试验数据直观分析表明,极差R反映各因素对指标的影响程度。R越大,影响程度越大。试验中3个因素R值排列顺序为A>B>C,即温敏聚合物的浓度对包封率影响最大,较高的浓度能显著提高药物的包封率。其中各因素水平分析结果为A:3>2>1;B:2>1>3;C:2>3>1,最佳处方为A3B2C2,即温敏聚合物的浓度为0.20 mg/mL,人参皂苷Rg3的浓度为0.03 mg/mL,搅拌时间为2 h。正交试验的方差分析结果表明,方差分析显示数据和直观分析数据结果一致,表明此次正交试验数据可信。见表3。

表3 处方筛选方差分析
2.2.2 人参皂苷Rg3温敏纳米粒制备的工艺验证 按“2.2.1”项下方法及选定的工艺条件制备人参皂苷Rg3温敏纳米粒3批,按照“2.3”、“2.4”、“2.5”项中测定方法测定其包封率、载药量和粒径分布。与之前的正交设计结果对比,验证工艺的稳定性。结果表明,三次验证试验结果均符合要求,表明优化处方组成合理,制备工艺稳定。见表4。

表4 验证试验结果
2.3 人参皂苷Rg3温敏纳米粒包封率的测定 取一定量的人参皂苷Rg3温敏纳米混悬液,于高速冷冻离心机内离心30 min(15 000 r/min),取上清液按“2.1”项下含量测定方法进行测定。按照公式:包封率=(总药量-未包封药量)/总药量×100%计算包封率。
2.4 人参皂苷Rg3温敏纳米粒载药量的测定 精密称取一定量干燥人参皂苷Rg3温敏纳米粒粉末,溶解在一定体积的四氢呋喃溶液中,超声10 min使之完全溶解,使其最终浓度为1 mg/mL。真空干燥箱中干燥(30 ℃),使四氢呋喃挥发完全。再用PBS(0.1 mol/L,pH=7.4)溶液10 mL复溶,微孔滤膜(0.45 μm)过滤后,按“2.1”项下方法进行测定。按公式:载药量=包载药物量/干燥载药纳米粒量×100%计算载药量。
2.5 人参皂苷Rg3温敏纳米粒的粒径及Zeta电位的测定 按“2.2”项下方法及工艺条件制备人参皂苷Rg3温敏纳米粒混悬液3批。取适量混悬液,用水溶液稀释到合适的浓度,用激光粒度分析仪及Zeta电位仪测定其粒径和Zeta电位。见图2、图3。

图2 人参皂苷Rg3温敏纳米粒粒径分布图

图3 人参皂苷Rg3温敏纳米粒Zeta电位图
由图2可知,人参皂苷Rg3温敏纳米粒粒径分布集中,平均粒径为(147.0±2.3)nm,不易被网状内皮系统清除。分散指数PDI为0.132(<0.3),表明纳米粒有较窄的粒径分布。由图3可以看出,温敏纳米粒平均Zeta电位为-14.6 mV,负电荷使纳米粒不易被细胞膜所吸附,此Zeta电位为纳米粒的体内稳定性奠定了基础。
2.6 温敏纳米粒的形态学观察 按“2.2”项下方法和工艺条件制备人参皂苷Rg3温敏纳米粒混悬液,将混悬液稀释到合适的浓度,用少量2%磷钨酸负染后滴加到专用铜网上,自然挥干,使粒子浓缩沉积,置于透射电镜下观察载药纳米粒的形态特征。见图4。

图4 人参皂苷Rg3温敏纳米粒透射电镜图
由图4可看出,温敏纳米粒外观圆整,呈球形或类球形,表明温敏两亲嵌段共聚物在水溶液中确实发生了自组装行为。
2.7 人参皂苷Rg3温敏纳米粒体外释放行为研究 精密称取5 mg人参皂苷Rg3温敏纳米粒干燥粉末,分散在5 mL PBS(0.1 mol/L,pH=7.4),置于透析袋(分子量:3 500)中并浸入装有30 mL PBS(0.1 mol/L,pH=7.4)的烧杯中,于恒温水浴振荡器中不断震荡,振荡频率为60 r/min,在37、42 ℃条件下测试药物释放。分别于0.25、0.5、1、3、5、7、9、12、24 h定时取样1 mL,并即时补加同体积、同温度的释放介质。按“2.1”项下的测定条件和方法检测药物的释放并绘制累计释放曲线。人参皂苷Rg3温敏纳米粒体外释放曲线见图5。

图5 人参皂苷Rg3温敏纳米粒在不同温度下体外累计释放曲线
由图5可以看出,两个温度下温敏纳米粒的释放均表现初期的快速释放和后期缓慢可控的释放。37 ℃时,3 h的药物累计释放度为36.1%,24 h的累计释放度为44.6%;42 ℃时,3 h的累计释放度高达54.1%,24 h的累计释放率为83.0%。在相同时间内,温敏纳米粒在42 ℃的释放速度和释放量明显高于37 ℃。结果表明,药物载体随着温度的变化对药物的释放起到了调释作用。
2.8 人参皂苷Rg3温敏纳米粒的细胞毒性试验 用复苏后的肝癌细胞(HepG2)进行传代培养。培养基为含10%胎牛血清的DMEM培养基。取对数生长期的细胞接种于96孔板中,密度是1×104个/孔,贴壁培养24 h。更换培养液后,分别加入浓度(以人参皂苷Rg3计)为10、20、60、100、140、180 μg/mL的人参皂苷Rg3温敏纳米粒和人参皂苷Rg3溶液(培养基稀释为稀释液),正常培养液组作为阴性对照。将96孔板移至培养箱中,37 ℃、饱和湿度95%和5% CO2保护下继续培养48 h。之后加入20 μL MTT(5 mg/mL),孵育4 h后终止培养。除去培养液,每孔加入150 μL二甲基亚砜(DMSO),震荡10 min以溶解结晶紫。选择波长450 nm,在酶标仪上测定各孔光密度值(OD),然后计算细胞成活率OD值。计算公式:成活率=OD治疗/OD空白×100%。人参皂苷Rg3温敏纳米粒和人参皂苷Rg3溶液对肝癌细胞HepG2的抑制结果见图6。

图6 不同浓度的人参皂苷Rg3温敏纳米粒和溶液对肝癌细胞的抑制作用
图6结果表明,随着人参皂苷Rg3温敏纳米粒和人参皂苷Rg3溶液浓度的增加,肝癌细胞HepG2的成活率随之降低,二者均表现出较好的抑制作用。分析数据可知,随着人参皂苷Rg3溶液和温敏纳米粒浓度从20 μg/mL增加至180 μg/mL,HepG2肝癌细胞成活率分别由71.4%和69.8%下降至41.0%和37.7%,二者对肝癌细胞HepG2的抑制作用无明显差异。但是根据温敏纳米粒体外溶出特性可知,42 ℃时人参皂苷Rg3温敏纳米粒的体外释放度有所提高,故抑制作用随温度的升高而增加。
3 讨论
本文利用两亲性温敏嵌段共聚物P(NIPAM-co-DMAAM)-b-PCL自组装的特性,滴制法制备了人参皂苷Rg3温敏纳米粒,制备的人参皂苷Rg3温敏纳米粒外观、包封率、载药量和粒径均满足纳米制剂的要求。体外释放试验结果表明,随着外部温度的改变,温敏纳米粒达到了调节药物释放的目的,是一种很有潜力的温敏控释载体。MTT法结果表明,人参皂苷Rg3温敏纳米粒对HepG2肝癌细胞具有良好的抑制作用。本文所制备的人参皂苷Rg3温敏纳米粒为下一步进行化疗联合射频消融治疗原发性肝癌试验研究奠定了基础。
[1] Yim HJ,Suh SJ,Um SH.Current management of hepatocellular carcinoma:an Eastern perspective[J].World J Gastroenterol,2015,21(13):3826-3842.
[2] 商红叶.原发性肝癌治疗进展[J].黑龙江医学,2015,39(3):225-227.
[3] 张耀军,陈敏山.射频消融治疗肝癌的指征和应用[J].肝胆外科杂志,2010,18(1):9-10.
[4] 刘丽莉.高危部位肝癌射频消融治疗的进展[J].临床肿瘤学杂志,2012,17(5):475-478.
[5] 黎阳,张铁军,刘素香,等.人参化学成分和药理研究进展[J].中草药,2009,40(1):164-附2.
[6] 尹天翔,王燕燕.人参皂苷Rg3对人肝癌细胞增殖、迁移、黏附和凋亡的影响及其作用机制[J].基础医学与临床,2015,35(3):303-307.
[7] 石楸鸣.人参皂苷的药理作用研究进展[J].中国药房,2010,21(31):2967-2969.
[8] 韩冬,张铁军,唐铖,等.人参皂苷的药动学研究进展[J].中草药,2009,40(2):附1-附3.
[9] Cooper DL,Conder CM,Harirforoosh S.Nanoparticles in drug delivery:mechanism of action,formulation and clinical application towards reduction in drug-associated nephrotoxicity [J].Expert Opin Drug Deliv,2014,11(10):1661-1680.
[10]Kumar S,Shen J,Burgess DJ.Nano-amorphous spray dried powder to improve oral bioavailability of itraconazole[J].J Control Release,2014,192:95-102.
[11]管庆霞,华晓丹,李伟男,等.载中药肝靶向纳米给药系统研究进展[J].中国药房,2015,26(7):1002-1005.
[12]Wang Y,Xu H,Ma L,et al.Recent advances of thermally responsive nanogels for cancer therapy [J].Ther Deliv,2015,6(10):1157-1169.
[13]翁砚,王晓非,刘同帅,等.HPLC法测定人参皂苷Rg3、Rh1的含量[J].长春中医药大学学报,2016,32(2):256-258.
[14]Cai Q,Zhang L,Yang J,et al.Core-crosslinked poly(N-isopropylacrylamide-co-N,N-dimethylacrylamide)-b-poly(ε-caprolactone) micelles for paclitaxel thermo-sensitive controlled release behaviors[J].Chin J Tissue Eng Res,2010,14(29):5505-5510.
PreparationofginsenosideRg3thermo-sensitivenanoparticlesandtheirinhibitoryeffectonhepatomacells
ZHANG Wei-na1,XU Yi2,YU Min1*
(1.Department of Pharmacy,Zhejiang Ninghai First Hospital,Ningbo 315600,China;2.Wenzhou Medical College Pharmacy School,Wenzhou 325000,China)
ObjectiveTo prepare ginsenoside Rg3 thermo-sensitive nanoparticles and to investigate the drug release behavior and the inhibiting effect on the hepatoma cellsinvitro.MethodsThermo-sensitive nanoparticles were prepared using the solvent injective method with amphiphilic block copolymer.The encapsulation efficiency was used to evaluate the influence of different formulation and preparation factors;the formulation was optimized by orthogonal design,with mixing time,mass concentration of amphiphilic block copolymer and ginsenoside Rg3 as factors.The drug release properties were measured at 37 ℃ and 42 ℃invitro.MTT assay was used to determine the inhibiting effect of ginsenosides Rg3 thermo-sensitive nanoparticles on HepG2 cells.ResultsThe mass concentration of amphiphilic block copolymer was 0.20 mg/mL,the mass concentration of ginsenosides Rg3 was 0.03 mg/mL and the mixing time was 2 h in the optimized formula and preparation process;the optimized nanoparticles had a spherical shape,the average diameter was (147.0±2.3) nm (n=3),the average Zeta potential was -14.6 mV (n=3) and the encapsulation efficiency was 78.43%±1.76% (n=3).The index of release showed that the accumulative release rates of the thermo-sensitive nanoparticles at the temperature of 37 ℃ and 42 ℃ were 36.1% and 54.1% within 3 h,and 44.6% and 83.0% within 24 h,respectively.The test of inhibition showed the survival rate of HepG2 cells was decreased from 69.8% to 37.7% with the increase of the concentration of thermo-sensitive nanoparticles from 20 μg/mL to 180 μg/mL.ConclusionThe results show that both formulation and preparation of ginsenoside Rg3 thermo-sensitive nanoparticles are feasible and reasonable.The thermo-sensitive nanoparticles can well respond to the environmental temperature change and has a good inhibitory effect on HepG2 cellsinvitro.
Ginsenoside Rg3;Thermo-sensitive nanoparticles;Orghogonal experimental design;Invitrodissolution
2017-04-05
1.浙江省宁海县第一医院药剂科,宁波 315600;2.温州医科大学药学院,温州 325000
*
10.14053/j.cnki.ppcr.201711001

