急性心肌梗死合并非甲状腺病态综合征的相关研究
段光臣, 任 颖, 黄高忠, 陆志刚, 魏 盟
(上海交通大学附属第六人民医院, 1. 特需医疗科; 2. 心内科, 上海, 200233)
急性心肌梗死合并非甲状腺病态综合征的相关研究
段光臣1, 任 颖1, 黄高忠1, 陆志刚2, 魏 盟2
(上海交通大学附属第六人民医院, 1. 特需医疗科; 2. 心内科, 上海, 200233)
目的探讨急性心肌梗死(AMI)患者合并非甲状腺病态综合征(NTIS)时FT3水平对患者远期死亡率的影响。方法共纳入1 809例AMI患者,按甲状腺功能检查分为NTIS组和甲功正常组,随访1~8.5年,采用多因素COX回归分析方法,研究FT3水平对AMI患者远期全因死亡、心血管死亡的影响。结果AMI患者中NTIS的发生率为21.7%。与甲功正常组相比,NTIS组住院死亡率、远期全因死亡率和远期心血管死亡率均升高(14.3% vs. 1.8%, 23.1% vs. 14.5%, 14.0% vs. 7.6%,P<0.05)。FT3水平(HR=0.304, 95%CI: 0.134~0.693,P=0.005)与AMI患者远期全因死亡的独立相关, FT3水平(HR=0.241, 95%CI: 0.093~0.622,P=0.003)也是AMI患者远期心血管死亡的独立危险因素。结论AMI患者中常见NTIS, FT3水平是AMI患者远期全因死亡和心血管死亡的独立危险因素。
急性心肌梗死; 非甲状腺病态综合征; 死亡率
非甲状腺病态综合征(NTIS)又称低T3综合征,是指在无明显的下丘脑-垂体-甲状腺轴(HPT轴)的改变下,表现为游离三碘甲腺原氨酸(FT3)水平降低,反三碘甲腺原氨酸(rT3)升高,伴或不伴游离甲状腺激素(FT4)、促甲状腺激素(TSH)水平降低[1], 并存在于多种重症疾病中,且与其疾病预后相关[2]。甲状腺激素水平和心血管疾病有密切关系[3]。既往研究[4]报道,甲状腺功能亢进和甲状腺功能减退都与冠心病的患病风险增加相关。本研究探讨AMI患者合并NTIS时对其近期死亡率、远期全因、心血管原因死亡率的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取上海市第六人民医院2005年6月—2015年1月心内科住院的初发AMI病例共2 079例,经筛选后共入选1 809例。NTIS诊断标准[5]: FT3水平低于正常, FT4水平和TSH水平正常或低于正常(FT3的正常参考值3.10~6.80 pmol/L, FT4的正常参考值12.00~22.00 pmol/L, TSH的正常参考值0.27~4.20 mIU/L)。AMI的诊断标准[6]: 至少具备以下3条标准的2条: ① 缺血性胸痛的临床病史; ② 心电图动态演变; ③ 血清心肌坏死标志物浓度的动态改变。排除标准: 陈旧心肌梗死,恶性肿瘤或结核等慢性消耗性疾病,严重肝脏、肾脏疾病,脑卒中,严重感染、呼吸衰竭患者(共134例); 接受血管活性药物(盐酸胺碘酮片、肾上腺素)或类固醇类等影响甲状腺功能测定的药物治疗的患者(共55例); 既往有原发性甲状腺疾病以及正在服用抗甲状腺药物或甲状腺激素的患者(共81例)。
1.2 方法
收集并记录患者一般临床资料和实验室检查指标,包括基本信息(年龄、性别)、既往史和个人史(糖尿病史、高血压病史、心肌梗死病史、吸烟史、饮酒史等)、体质量指数、入院冠状动脉介入治疗史,入院后24 h内测定的各化验指标,记录患者超声心动图检查中左室射血分数。采用简化肾脏病膳食改善方程(改良MDRD)公式[7]估算肾小球滤过率(eGFR), eGFR[mL/(min·1.73 m2)]=186.3×(肌酐)-1.154×(年龄)-0.203×(0.742女性),肌酐的单位为mg/dL, 以eGFR<60 mL/(min·1.73 m2)作为肾功能减退指标,即为低eGFR水平。严重充血性心力衰竭为AMI患者按Killip分级方法, Killip分级Ⅲ/Ⅳ级的患者。按NTIS组和甲功正常组分为2组,采用多因素COX回归分析,探讨影响AMI患者远期全因死亡率和心血管死亡率的因素。随访1~8.5年,记录患者心血管死亡和全因死亡情况。心血管死亡原因包括急性心肌梗死、心力衰竭、严重心律失常、心源性休克,电话随访结合入院记录明确死亡原因。
1.3 统计学处理
应用SPSS 16.0统计学软件处理数据。计量资料统一采用均数±标准差表示,对计量资料采用Kolmogorov-Smirnov方法做正态分布检验,正态分布变量采用独立样本t检验,非正态分布变量采用Wilcoxon秩和检验。计数资料采用百分率表示,组间率比较采用χ2检验。采用一般线性模型对因变量为计量资料时进行各因素校正及相关性分析,采用Binary logistic回归对因变量为计数资料时进行各因素校正。采用Spearman秩进行单因素相关性分析。采用Log-Rank检验进行组间生存率比较,采用多因素Cox比例风险模型进行预后分析,P<0.05为差异有统计学。
2 结 果
2.1 急性心肌梗死患者临床特征
1 809例AMI患者中,甲状腺功能正常者有1 293例(71.5%), 发生NTIS共392例(21.7%), 其中FT3降低、FT4正常、TSH正常285例(72.7%), FT3降低、FT4正常、TSH降低37例(9.5%), FT3降低、FT4降低、TSH正常53例(13.5%), FT3降低、FT4降低、TSH降低11例(2.8%), 其中发现FT3降低、FT4升高, TSH正常6例(1.5%)。1 809例AMI患者年龄在24~97岁,中位数年龄为69岁,其中男1 265例,占69.9%。和甲功正常组相比, NTIS组在年龄、性别、BMI、糖尿病病史、吸烟史、饮酒史、PCI治疗史、WBC、Hb、Alb、CRP、TG、FPG、FT3、FT4、SCr上差异有统计学意义,其中在高血压病史、TC、HDL-C、LDL-C、2 hPG、TSH上2组差异无统计学意义。校正年龄、性别因素后,在性别、BMI、糖尿病病史、吸烟史、饮酒史、PCI治疗史、血脂(TG、TC、HDL-C、LDL-C)、TSH、2 hPG等因素上,2组差异无统计学意义,其中2组在年龄、WBC、Hb、Alb、CRP、FPG、FT3、FT4、SCr差异有统计学意义,见表1。
2.2 2组患者心功能和肾功能比较
1 809例AMI患者中, LVEF<40%占18.3%, 发生严重充血性心力衰竭患者占17.5%。校正性别、年龄因素后, NTIS组和甲功正常组相比, LVEF[(51±10) % vs. (55±9) %,P<0.01]显著下降。2组充血性心力衰竭发生率相比(26.8% vs. 15.6%), NTIS组较甲功正常组显著升高(P=0.003)。NTIS组NT-ProBNP中位数645.20 ng/L, 四分位数间距为94.80~2 801.00, 甲功正常组NT-ProBNP中位数362.35 ng/L, 四分位数间距为76.10~1 450.00, NTIS组NT-ProBNP显著升高(P<0.001)。1 809例AMI患者中,低eGFR水平者占29.7%, NTIS组和甲功正常组相比,前者肾功能显著下降(46.1% vs. 24.8%,P<0.001)。在校正年龄、性别因素差异后,再比较2组肾功能差异仍有统计学意义(P<0.01)。

表1 1 809例急性心肌梗死患者的临床基本资料[n(%)]
表示校正年龄、性别后
2.3 FT3水平和其他因素相关性分析
对FT3水平和其他因素相关性分析发现, Hb(r=0.329,P<0.01)、Cr(r=0.329,P<0.01)、Alb(r=0.226,P<0.01)、LVEF(r=0.175,P<0.01)、eGFR(r=0.178,P<0.01)与FT3水平呈正相关, CRP(r=-0.259,P<0.01)与FT3水平呈负相关。在FT3水平和患者心功能及肾功能相关性分析发现,校正性别、年龄、糖尿病史、高血压病史、吸烟史、饮酒史后, FT3水平和患者LVEF及eGFR仍呈正相关(B=1.265、4.618,P<0.05), 进一步校正其他因素, FT3水平和患者LVEF及eGFR仍有相关性(B=2.342、3.548,P<0.05), 见表2。
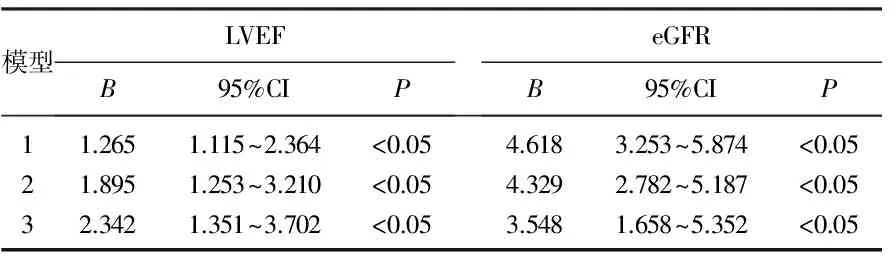
表2 FT3水平和患者心功能及肾功能相关性分析
模型1: 校正性别、年龄、高血压病史、糖尿病史、吸烟史、饮酒史、用药史; 模型2: 模型1+校正BMI; 模型3: 模型2+校正WBC、Hb、Alb、CRP、TG、TC、HDL-C、LDL-C、FPG、2 hPG、FT4、TSH。
2.4 生存分析
研究随访1~8.5年,中位数随访时间为4.6年,失访255例,失访率14.1%。住院期间死亡99例,其中NTIS组56例,与甲功正常组相比,NTIS组住院死亡率升高(14.3% vs. 1.8%,P<0.01)。远期全因死亡为267例,其中NTIS组78例(23.1% vs. 14.5%,P<0.01)。远期心血管死亡为147例,其中NTIS组46例(14.0% vs. 7.6%,P<0.01), 在远期全因死亡和远期心血管死亡方面, NTIS组均有增高趋势。
对AMI患者远期全因死亡率和远期心血管死亡率进行多因素COX回归分析显示, LVEF、年龄、FT3水平、低eGFR水平是AMI患者远期全因死亡的独立危险因素。LVEF、年龄、FT3水平、低eGFR水平是AMI患者远期心血管死亡的独立危险因素。见表3。
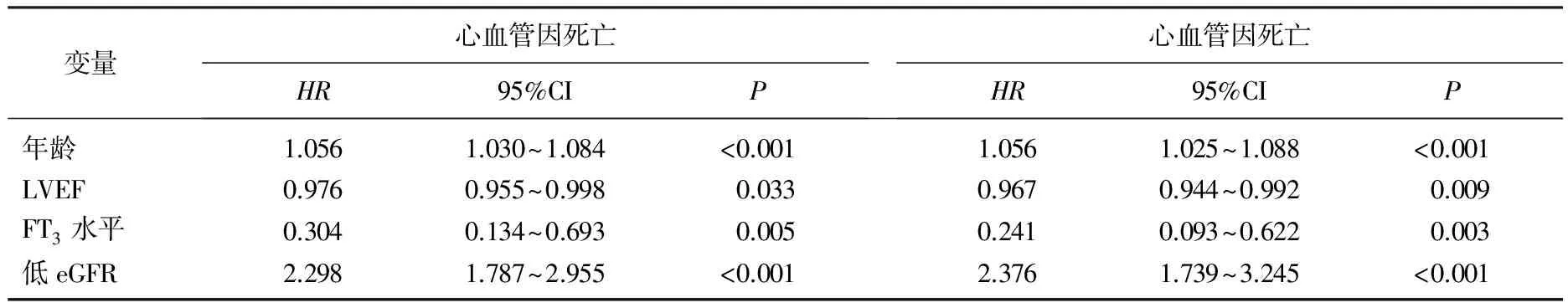
表3 COX回归对远期死亡的风险分析
校正因素: 性别、年龄、高血压病史、糖尿病史、吸烟史、饮酒史、用药史、BMI、WBC、Hb、Alb、CRP、TG、TC、HDL-C、LDL-C、FPG、2 hPG、FT4、TSH。
3 讨 论
甲状腺激素通过直接和间接的机制对心血管系统产生重要影响[8]。虽然AMI和甲状腺功能紊乱并不直接相关,但是动脉粥样硬化和甲状腺功能减退的关系以及心律失常和甲状腺功能亢进的关系是众所周知的[4, 9]。
本研究1 809例AMI患者NTIS发生率为21.7%, Lazzeri等[10]在641例ST抬高型心肌梗死患者的临床研究中发现NTIS的发生率为18.6%。Anavekar NS等[11]研究报道AMI患者中低eGFR水平发生率为33.5%。本研究AMI患者中的低eGFR水平者占29.7%, 在AMI患者中低eGFR水平和NTIS的发生率方面,本研究和既往研究结果基本一致。
甲状腺激素除了对心脏收缩力和心律的“经典”作用外,还调节了与应激和心脏重构反应有关的各种细胞内信号通路,它通过限制再灌注损伤影响心脏重塑,并且在后来的状态下,通过以时间依赖的方式诱导心室几何形状的明显变化[12-13]。肾功能减退可以引起左心室肥大,水钠潴留,心脏容量负荷增加,致心室扩张[14]。本研究结果发现,NTIS组患者LVEF、NT-proBNP明显下降,且严重充血性心力衰竭发生率也明显升高。校正多因素分析后发现NTIS组患者低eGFR发生率更高,表明AMI患者NTIS的出现,或可能参与其肾功能和心功能下降过程,其机制仍需进一步研究。
NTIS和低eGFR水平与AMI患者死亡率升高有关[10, 14-15]。本研究发现NTIS组住院死亡率为14.3%,明显高于甲功正常组。Lazzeri等[10]在641例ST抬高型心肌梗死患者的临床研究中发现,病态甲状腺组的住院死亡率也较高,与本研究结果一致。本研究结果显示, NTIS增加AMI患者死亡率, FT3水平和低eGFR水平是AMI 患者远期全因、心血管死亡的独立危险因素。NTIS可促使血管抵抗、炎症负荷、心输出量增加,心率及心肌收缩力降低,最终导致心衰患者全因死亡、心血管因死亡率升高[9, 16-17]。评估eGFR降低,表示肾功能减退,低eGFR水平与血脂紊乱、动脉钙化出现、动脉粥样硬化形成、心功能不全有关[18-20]。
综上所述, NTIS在AMI患者中常见, FT3水平是AMI患者近期和远期预后不良的强大预测因子。因此对AMI患者测定甲状腺功能,有助于全面评估患者病情及预后。
[1] Meuwese C L, Dekkers O M, Stenvinkel P, et al. Nonthyroidal illness and the cardiorenal syndrome[J]. Nat Rev Nephrol, 2013, 9(10): 599-609.
[2] Van den Berghe G. Non-thyroidal illness in the ICU: a syndrome with different faces[J]. Thyroid, 2014, 24(10): 1456-1465.
[3] Cini G, Carpi A, Mechanick J, et al. Thyroid hormones and the cardiovascular system: pathophysiology and interventions[J]. Biomed Pharmacother, 2009, 63(10): 742-753.
[4] Asvold B O, Bjoro T, Platou C, et al. Thyroid function and the risk of coronary heart disease: 12-year follow-up of the HUNT study in Norway[J]. Clin Endocrinol (Oxf), 2012, 77(6): 911-917.
[5] McIver B, Gorman C A. Euthyroid sick syndrome: an overview[J]. Thyroid, 1997, 7(1): 125-132.
[6] 高润霖. 急性心肌梗死诊断和治疗指南[J]. 中华心血管病杂志, 2001, (12): 9-24.
[7] National Kidney F. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification[J]. Am J Kidney Dis, 2002, 39(2 Suppl 1): S1-266.
[8] Iervasi G, Nicolini G. Thyroid hormone and cardiovascular system: from basic concepts to clinical application[J]. Intern Emerg Med, 2013, 8(Suppl 1): S71-74.
[9] Fraczek M M, Lacka K. Thyroid hormone and the cardiovascular system[J]. Pol Merkur Lekarski, 2014, 37(219): 170-174.
[10] Lazzeri C, Sori A, Picariello C, et al. Nonthyroidal illness syndrome in ST-elevation myocardial infarction treated with mechanical revascularization[J]. Int J Cardiol, 2012, 158(1): 103-104.
[11] Anavekar N S, McMurray J J, Velazquez E J, et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction[J]. N Engl J Med, 2004, 351(13): 1285-1295.
[12] Pantos C, Mourouzis I, Cokkinos D V. Thyroid hormone and cardiac repair/regeneration: from Prometheus myth to reality[J]. Can J Physiol Pharmacol, 2012, 90(8): 977-987.
[13] Pantos C, Mourouzis I, Cokkinos D V. New insights into the role of thyroid hormone in cardiac remodeling: time to reconsider[J]. Heart Fail Rev, 2011, 16(1): 79-96.
[14] Friberg L, Drvota V, Bjelak A H, et al. Association between increased levels of reverse triiodothyronine and mortality after acute myocardial infarction[J]. Am J Med, 2001, 111(9): 699-703.
[15] Damman K, Valente M A, Voors A A, et al. Renal impairment, worsening renal function, and outcome in patients with heart failure: an updated meta-analysis[J]. Eur Heart J, 2014, 35(7): 455-469.
[16] Gerdes A M, Iervasi G. Thyroid replacement therapy and heart failure[J]. Circulation, 2010, 122(4): 385-393.
[17] Zhang Y, Dedkov E I, Lee B, 3rd, et al. Thyroid hormone replacement therapy attenuates atrial remodeling and reduces atrial fibrillation inducibility in a rat myocardial infarction-heart failure model[J]. J Card Fail, 2014, 20(12): 1012-1019.
[18] Hillege H L, Girbes A R, de Kam P J, et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure[J]. Circulation, 2000, 102(2): 203-210.
[19] Braam B, Joles J A, Danishwar A H, et al. Cardiorenal syndrome--current understanding and future perspectives[J]. Nat Rev Nephrol, 2014, 10(1): 48-55.
[20] Tatar E, Kircelli F, Ok E. The contribution of thyroid dysfunction on cardiovascular disease in patients with chronic kidney disease[J]. Atherosclerosis, 2013, 227(1): 26-31.
Relatedstudyonacutemyocardialinfarctioncomplicatedwithnon-thyroidalillnesssyndrome
DUANGuangchen1,RENYing1,HHUANGGaozhong1,LUZhigang2,WEIMeng2
(1.DepartmentofSpecialMedicine; 2.DepartmentofCardiovascularMedicine,TheSixthPeople′sHospitalAffiliatedtoShanghaiJiaotongUniversity,Shanghai, 200233)
ObjectiveTo investigate the effect of FT3on the long-term mortality of patients with acute myocardial infarction(AMI) complicated with non-thyroidal illness syndrome (NTIS).MethodsA total of 1 809 patients with AMI were divided into NTIS group and normal group. The patients were followed up for 1 to 8.5 years. The multivariate COX regression analysis was used to study the effect of FT3on long-term all-cause mortality and cardiovascular mortality in AMI patients.ResultsThe incidence rate of NTIS in AMI patients was 21.7%. Compared with the normal control group, the in-hospital mortality, long-term all-cause mortality and long-term cardiovascular mortality in the NTIS group were significantly higher (14.3% versus 1.8%, 23.1% versus 14.5%, 14% versus 7.6%,P< 0.05). The level of FT3(HR=0.304, 95%CI: 0.134~0.693,P=0.005) was correlated with long-term all-cause mortality in patients with AMI, and FT3 level (HR=0.241, 95%CI: 0.093-0.622,P=0.003) is an independent risk factor for long-term cardiovascular death in patients with AMI.ConclusionNTIS exists in AMI commonly. FT3level is an independent risk factor for long-term all-cause death and cardiovascular death in patients with AMI.
acute myocardial infarction; non-thyroidal illness syndrome; mortality
R 542.2
A
1672-2353(2017)21-025-04
10.7619/jcmp.201721007
2017-07-20
上海市第六人民医院基金资助项目(LYZY-0105)
任颖

