红树林淡紫拟青霉胞外多糖对小鼠DCs吞噬功能的影响*
胡海岩,王华民,林英姿,杨 文,王永霞△
(海南医学院:1.临床学院;2.热带医学与检验学院,海口 571109)
·论著·
红树林淡紫拟青霉胞外多糖对小鼠DCs吞噬功能的影响*
胡海岩1,王华民2,林英姿2,杨 文2,王永霞2△
(海南医学院:1.临床学院;2.热带医学与检验学院,海口 571109)
胞外多糖;淡紫拟青霉;树突细胞;成熟;免疫功能
树突细胞(DCs)作为体内最重要的抗原提呈细胞,不仅是介导固有免疫和适应性免疫的桥梁,也是唯一能活化初始T细胞的抗原提呈细胞[1-3]。未成熟DCs由于高表达Toll样受体(TLR)等[4],获取抗原的能力较强,但刺激T细胞活化的能力弱;病原体等抗原刺激可活化DCs,促使其分化成熟,成熟DCs识别抗原能力减弱,但由于高表达主要组合相容性复合体(MHC Ⅱ)类分子、CD86、CD80等分子,提呈抗原的能力及活化T细胞的能力增强[5-6]。因此,通过调控体内DCs的成熟状态,可调节机体的免疫功能,达到预防或治疗疾病的目的。
课题组前期从海南沿海红树林中分离获得一株真菌,鉴定为淡紫拟青霉,体外试验证实其产生的胞外多糖有较好的免疫调节作用,可促进小鼠吞噬细胞的吞噬功能并刺激T淋巴细胞分泌细胞因子[7]。本实验将进一步探讨该多糖对小鼠骨髓源性DCs成熟及功能的影响。
1 材料与方法
1.1动物 由本校实验动物中心提供6~8周龄BALB/c小鼠,雄性。
1.2试剂及药物 胞外多糖用ddH2O配成20 g/L母液,0.22 μm微孔滤膜过滤后分装,-20 ℃冻存。APC标记的抗小鼠CD11c单克隆抗体、PE标记的抗小鼠MHC Ⅱ单克隆抗体、PE标记的抗小鼠CD80单克隆抗体、FITC标记的抗小鼠CD86单克隆抗体及FITC-dextran购自美国Ebioscience公司。Trizol试剂、反转录试剂盒、RPMI-1640培养基购自美国Hyclone公司,胎牛血清购自杭州四季青公司。
1.3仪器 流式细胞仪(美国BD公司),TC-512型PCR仪(英国Techne公司),DYY-12C型稳压稳流电泳仪(北京六一生物科技有限公司),凝胶图像分析仪(英国Syngene公司),生物安全柜(SG403A-HE,美国),CO2培养箱(NU-4750E,美国),倒置显微镜(深圳拓天仪器设备有限公司),电子分析天平(赛多利斯科学仪器有限公司),低速台式离心机(上海安亭科学仪器厂),细胞培养板(美国Corning公司)等。
1.4方法
1.4.1小鼠骨髓源性DCs诱导 取6~8周龄雄性BALB/c小鼠40只,SPF级,颈椎脱臼处死, 浸泡于75%乙醇中,10 min后无菌手术取股骨和胫骨,磷酸盐缓冲液(PBS)反复冲洗骨髓腔以获取骨髓细胞,细胞悬液离心后重悬细胞,红细胞裂解液裂解红细胞,PBS洗3次,用含10%胎牛血清的RPMI-1640完全培养液(含10 ng/mL rmGM-CSF和10 ng/mL rmIL-4)调整细胞浓度至2×106/mL,加入6孔板,每孔3 mL,置37 ℃、5% CO2培养箱吸附3 h后除掉未贴壁细胞,加入新的培养液,隔日半量换液,培养至第6天收集诱导的未成熟DCs进行后续实验。
1.4.2多糖对DCs表面分子表达的影响 将获得的小鼠骨髓细胞用RPMI-1640维持液稀释成1×106/mL,接种于12孔板,每孔2 mL。用5个不同浓度梯度的多糖干预,即用终浓度分别为50、100、200、300、400 μg/mL的多糖处理细胞,每一浓度设8个复孔,阴性对照孔加等量的RPMI-1640维持液,隔天观察细胞形态,48 h后收获细胞,PBS洗涤3次,其中每一浓度中4复孔细胞用于TLR2 mRNA 和TLR4 mRNA表达的检测,其余细胞调整浓度为1×106/mL,于细胞悬液中分别加入PE-CD80、FITC-CD86和 APC-CD11c、PE-MHC Ⅱ,4 ℃染色标记 30 min,洗涤3次,流式细胞术检测细胞表型,实验重复3次。
1.4.3多糖对未成熟DCs吞噬功能的影响 将小鼠骨髓细胞配制成1×106/mL,加入12孔板中,每孔2 mL,分别加入不同浓度多糖,使终浓度分别为50、100、200、300、400 μg/mL,每一浓度设4个复孔,37 ℃、5% CO2培养箱培养48 h,收集各孔细胞置37 ℃孵育30 min,加入终浓度为1 mg/mL的葡聚糖(FITC-dextran),置37 ℃孵育4 h,再于4 ℃作用1 h后流式检测结果,实验重复3次。
1.4.4淡紫拟青霉胞外多糖对DCs TLR2 mRNA和TLR4 mRNA表达的影响 总RNA抽提及cDNA制备:取1.2.2中收获的细胞,按Trizol试剂说明书提取细胞总RNA。反转录-聚合酶链反应(RT-PCR)获得cDNA,-20 ℃保存备用。
常规PCR:按下表配制PCR反应体系并进行PCR扩增,TLR2、TLR4和β-action反应体系均为(引物序列见表1,由上海Sangon公司合成):10×buffer 2.5 μL,dNTP 0.5 μL,上、下游引物各1 μL,cDNA 2 μL,2.5 U/μL TaqDNA聚合酶 0.3 μL,ddH2O 12.6 μL;反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后72 ℃延伸8 min,PCR产物进行1.5%琼脂糖凝胶电泳,紫外凝胶成像系统检测各条带光密度值,分析目的基因条带与内参条带光密度值的比值。

表1 TLR2、TLR4和β-action引物序列

2 结 果
2.1小鼠骨髓源性DCs诱导 小鼠贴壁的骨髓细胞经rmGM-CSF和rmIL-4诱导24 h 后,可见圆形、大小均匀的悬浮细胞。培养至第3天,可见疏松黏附与贴壁的细胞集落产生,细胞形态不规则。培养至第5天,部分细胞呈不规则状,见图1。
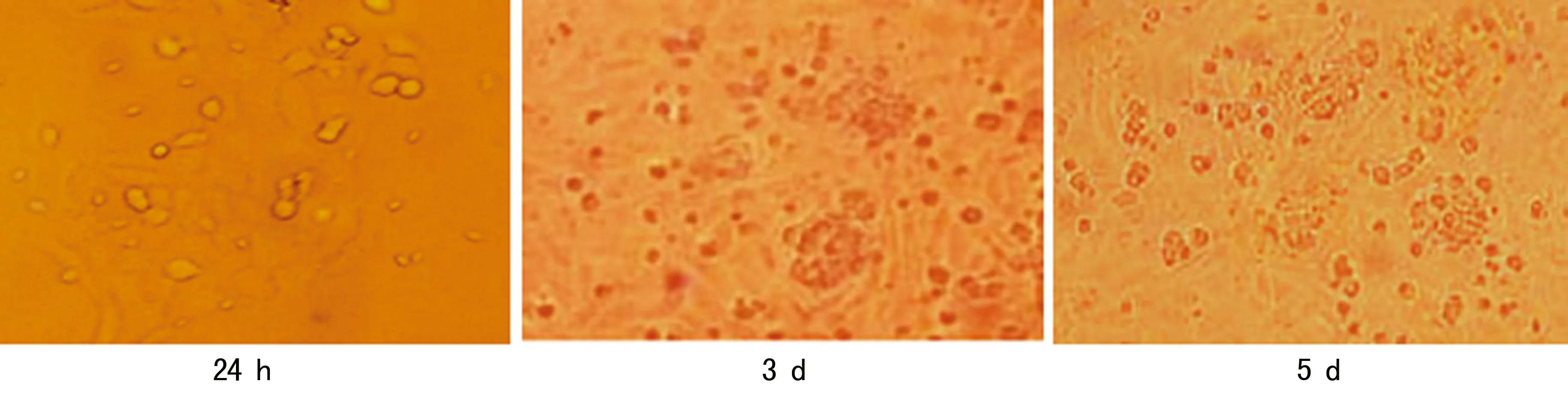
图1 倒置显微镜下不同时间DCs形态变化
2.2多糖对DCs表面分子表达的影响 未成熟DCs经不同浓度多糖干预48 h后,经流式细胞仪检测发现所用浓度多糖均可刺激DCs 对CD11c、MHC-Ⅱ类分子、CD80和CD86的表达,且刺激效果呈剂量依赖性。经终浓度为50、100、200 μg/mL的多糖刺激后,CD11c、MHC Ⅱ双阳性细胞百分率分别为(27.5±1.0)%、(29.7±1.1)%、(35.9±2.1)%,与空白对照组(25.5±0.9)%相比无明显差异(P>0.05),当多糖终浓度达300、400 μg/mL时CD11c、MHC Ⅱ双阳性细胞百分率达(45.8±1.6)%和(54.4±1.3)%,明显高于空白对照组(P<0.01);该多糖亦可刺激DCs CD80和CD86的表达,糖终浓度为50、100、200、300、400 μg/mL时CD80、CD86双阳性细胞百分率分别为(29.6±1.2)%、(33.1±1.7)%、(42.3±1.5)%、(53.6±1.4)%、(60.8±0.5)%,其中50、100 μg/mL终浓度多糖作用下CD80、CD86双阳性细胞百分率与空白对照组[(25.9±1.2)%]差异无统计学意义(P>0.05);200 μg/mL多糖作用下CD80、CD86双阳性细胞百分率与空白对照组相比差异有统计学意义(P<0.05),300、400 μg/mL多糖作用下CD80、CD86双阳性细胞百分率与空白对照组相比差异有统计学意义(P<0.05)。说明终浓度为200、300、400 μg/mL多糖对DCs分化成熟的刺激作用较好,结果见图2。

#:P>0.05,*:P<0.05,△:P<0.01,与空白对照组比较
图2淡紫拟青霉胞外多糖对DCs表达CD11c、 MHC-Ⅱ、CD80和CD86分子的影响
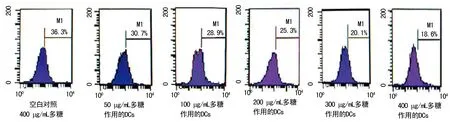
图3 淡紫拟青霉胞外多糖对DCs吞噬能力影响的部分流式图
2.3多糖对未成熟DCs吞噬功能的影响 小鼠骨髓细胞经不同浓度多糖处理48 h后,吞噬FITC-dextran的能力逐渐下降, 50、100、200 μg/mL糖浓度时阳性吞噬细胞百分率分别为(31.5±1.3)%、(28.9±1.4)%和(26.0±1.4)%,与空白对照组[(34.6±1.1)%]相比差异无统计学意义(P>0.05);当糖浓度达300、400 μg/mL时阳性吞噬细胞百分率明显降低,分别为(20.6±1.0)%、(17.8±1.5)%,与空白对照组相比,差异有统计学意义(P<0.05),说明终浓度300 μg/mL和400 μg/mL的多糖对DCs成熟的刺激作用较强,结果见图3。

*:P>0.05;#:P<0.05,与空白对照组比较
图4淡紫拟青霉胞外多糖对DCs吞噬能力的影响
2.4淡紫拟青霉胞外多糖对DCs TLR2 mRNA和TLR4 mRNA表达的影响 将不同浓度多糖作用于未成熟DCs 48 h后RT-PCR检测TLR2和TLR4 mRNA表达情况,结果发现经终浓度为50~400 μg/mL多糖作用的DCs TLR2、TLR4 mRNA表达逐渐降低,50 μg/mL多糖作用下DCs TLR2、TLR4 mRNA相对表达量分别为0.818±0.112、0.644±0.083,与空白对照组相比(0.864±0.071、0.685±0.002),差异无统计学意义(P>0.05),100、200、300、400 μg/mL多糖作用下TLR2、TLR4 mRNA相对表达量分别为0.757±0.062、0.533±0.096,0.663±0.053、0.508±0.023,0.425±0.081、0.482±0.041、0.386±0.121、0.425±0.078,与空白对照组相比,差异有统计学意义(P<0.05),见图5、6。

#:P>0.05;*:P<0.05,与空白对照组比较
图5淡紫拟青霉胞外多糖对DCs TLR2 mRNA和TLR4 mRNA表达的影响

泳道1:空白对照组,泳道2~6:50、100、200、300、400 μg/mL多糖处理组
图6 DCs TLR2 mRNA和TLR4 mRNA RT-PCR电泳图
3 讨 论
多糖类化合物含有丰富的生物信息,被认为是除肽链、核苷酸链之外具有重大意义的第3链,几乎参与了细胞所有生命活动。作为红树林生态系统中的第二大微生物资源,红树林真菌长期生活在强酸、寡营养、高盐的海洋环境中,必然有其独特的分子适应机制,具备产生不同于陆生微生物的独特新颖代谢产物的潜能,成为活性多糖的新来源[8-10]。本研究用红树林来源的淡紫拟青霉胞外多糖刺激小鼠骨髓源性DCs,观察其对DCs成熟的诱导作用,发现多糖在所用浓度范围内均可刺激DCs 分化成熟,具体表现为促进DCs 表面分子CD11c、MHC Ⅱ类分子及协同刺激分子CD80、CD86的表达,终浓度300 μg/mL和400 μg/mL的多糖刺激作用最强,CD11c、MHC Ⅱ双阳性细胞和CD80、CD86双阳性细胞百分率与空白对照组相比,差异有统计学意义(P<0.05),CD11c 为DCs特征性标志,MHC Ⅱ类分子参与抗原肽的提呈并诱导T细胞免疫应答的发生,CD80、CD86作为协同刺激分子,是T细胞活化的第二信号,DCs成熟时显著上调MHC Ⅱ类分子、CD80、CD86等表面分子的表达,说明多糖对DCs的成熟具有刺激作用[11-12]。随着DCs成熟其吞噬异物的能力大大降低,本研究发现经该多糖处理的DCs吞噬FITC-dextran的能力降低,尤其经300、400 μg/mL多糖作用的DCs阳性吞噬细胞百分率与空白对照组相比差异有统计学意义(P<0.05),说明300、400 μg/mL的多糖可显著促进DCs成熟。该多糖还可下调DCs TLR2 mRNA和TLR4 mRNA的表达,尤其100~400 μg/mL多糖作用效果明显,与空白对照组相比差异有统计学意义(P<0.05),而TLR2和TLR4作为TLRs家族的成员,为重要的模式识别受体,部分多糖刺激的非特异性免疫反应可能通过TLR2和/或TLR4介导[13-14]。另外,课题组还发现该多糖可刺激IL-12分泌,IL-12可诱导Th0分化为Th1,参与Th1反应[15],进一步说明该多糖能刺激DCs成熟。
总之,本研究初步发现红树林淡紫拟青霉胞外多糖具有刺激小鼠骨髓源性DCs分化成熟的作用,不仅可刺激DCs 表面分子CD11c 、MHC Ⅱ类分子的表达,还可刺激协同刺激分子CD80和CD86分子的表达,抑制其对异物的吞噬作用,下调TLR2 mRNA和TLR4 mRNA的表达,但作用机制不明,仍需进一步研究。
[1]Jacoues B,Ralph M.Dendritic cell and the control of immunity[J].Nature,1998,392(19):252-254.
[2]Nicoletti C,Regoli M,Bertelli E.Dendritic cells in the gut:to sample and to exclude?[J].Mucosal Immunol,2009,2(5):462.
[3]Klechevsky E,Kato H,Sponaas AM.Dendritic cells star in Vancouver[J].J Exp Med,2005,202(1):5-10.
[4]Yoon YD,Han SB,Kang JS,et al.Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix of Platycodon grandiflorum[J].Int Immunopharmacol,2003,3(13/14):1873-1882.
[5]Sandor F,Buc M.Toll-like receptors.I.Structure,function and their ligands[J].Folia Biol,2005,51(5):148-157.
[6]Gianotti L,Sargenti M,Galbiati F,et al.Phenotype and function of dendritic cells and T-lymphocyte polarization in the human colonic mucosa and adenocarcinoma[J].Eur J Surg Oncol,2008,34(8):883-889.
[7]饶朗毓,陈政良,林英姿,等.一株具免疫增强活性红树林真菌的筛选及鉴定[J].中国热带医学,2011,11(6):683-685.
[8]Chen YL,Mao WJ,Tao HW,et al.Preparation and characterization of a novel extracellular polysaccharide with antioxidant activity,from the mangrove-assocated fungus Fusarium oxysporum[J].Mar Biotechnol,2015,17(2):219-228.
[9]Chi ZM,Fang Y.Exopolysaccharides from Marine bacteria[J].J Ocean Univ Chin,2005,4(1):67-74.
[10]Alsayed HA,Ghanem EH,Saleh KM.Bacterial community and some physico-chemical characteristics in a subtropical mangrove environment in Bahrain[J].Mar Pollut Bull,2005,50(2):147-155.
[11]Kumaran S,Ramaprasanna D,Murugaiyan K.Production and characterization of exopolysaccharides(EPS)from mangrove filamentous fungus,Syncephalastrum sp[J].Afr J Microbiol Res,2014,8(21):2155-2161.
[12]Yan M,Mao W,Chen C,et al.Structural elucidation of the exopolysaccharide produced by the mangrove fungus Penicillium solitum[J].Carbohydr Polym,2014,111(1):485-491.
[13]Beutle B,Hoebe K,Du X,et al.How we detect microbes and respond to them:the Toll-like receptors and their transducers[J].J Leukoc Biol,2003,74(4):479-485.
[14]Visintin A,Mazzoni A,Spitzer JH.Regulation of toll-Like receptors in humanmon ocytes and dendritic cells[J].J Immunol,2001,166 (1):249-255.
[15]Giermasz AS,Urban JA,Nakamura Y,et al.Type-1 polarized dendritic cells primed for high IL-12 production show enhanced activity as cancer vaccines[J].Cancer Immunol Immunother,2009,58(8):1329-1336.
EffectsofextracellularpolysaccharidesfromPaecilomycesLilacinusononphagocytosisfunctionofmousebonemarrow-deriveddendriticcells*
HuHaiyan1,WangHuamin2,LinYingzi2,YangWen2,WangYongxia2△
(1.ClinicalMedicalCollege;2.SchoolofTropicalMedicineandLaboratoryMedicine,HainanMedicalUniversity,Haikou,Hainan571109,China)
extracellular polysaccharides;Paecilomyces Lilacinuson;murine dendritic cells;maturation;immunologic function
目的探讨红树林来源的淡紫拟青霉胞外多糖对小鼠骨髓源性树突细胞(DCs)功能成熟的影响。方法从小鼠骨髓腔中分离获得骨髓细胞,加入重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)、重组小鼠白细胞介素-4(rmIL-4)诱导分化为未成熟DCs,用不同浓度淡紫拟青霉胞外多糖干预,流式细胞术检测DCs的表面标志CD11c、主要组合相容性复合体(MHCⅡ) 类分子、CD80、CD86的表达情况及吞噬葡聚糖(FITC-dextran)的能力,反转录-聚合酶链反应(RT-PCR)检测该多糖对DCs Toll样受体(TLR)2 mRNA和TLR4 mRNA表达的影响。结果经300、400 μg/mL多糖作用48 h后DCs 表面分子CD11c、MHC Ⅱ类分子、CD80、CD86的表达较空白对照组显著上调(P<0.01);经多糖作用的DCs吞噬FITC-dextran能力下降,尤其是300、400 μg/mL的多糖与空白对照组相比作用效果明显(P<0.05);另外,该多糖还可下调DCs TLR2 mRNA和TLR4 mRNA的表达,尤其经100~400 μg/mL多糖处理的DCs下调作用显著,与空白对照组相比差异有统计学意义(P<0.05)。结论淡紫拟青霉胞外多糖可上调小鼠骨髓源性未成熟DCs表面 CD11c、MHC Ⅱ类分子、CD80和CD86的表达,降低其吞噬能力,下调TLR2 mRNA和TLR4 mRNA的表达,初步表明该多糖可刺激DCs分化成熟。
R392.9
A
1671-8348(2017)31-4321-04
10.3969/j.issn.1671-8348.2017.31.001
国家自然科学基金资助项目(31260225);海南省自然科学基金资助项目(813248);海南医学院科研培育基金资助项目(HY2014-015)。
胡海岩(1979-),讲师,本科,主要从事感染免疫及免疫调节研究。△
,E-mai:492608405@qq.com。
ObjectiveTo investigate the effects of Paecilomyces Lilacinuson extracellular polysaccharides on the phenotypic and function maturity of mouse dendritic cells.MethodsMononuclear cells were isolated from the mouse bone marrow cavity and added with cytokines for obtaining the recombinant mouse granulocyte-macrophagocyte colony stimulating factor(rmGM-CSF),recombinant mouse interleukin 4(rmIL-4) was induced to differentiated to immature DCs.Then different concentrations of extracellular polysaccharides were used to conduct the intervention.The mature DCs surface marker CD11c,major histocompatibility complex Ⅱ(MHCⅡ),CD80,CD86 molecular expression and phagocytosing FITC-dextran ability was detected by the flow cytometry.The effect of the polysaccharides on DCs Toll-like receptor(TLR)2 mRNA and TLR4 mRNA expression was detected by RT-PCR.ResultsAfter 400 μg/mL polysaccharides action for 48 h, the expression of DCs surface molecules such as CD11c,MHCⅡ,CD80 and CD86 was significantly up-regulated compared with the blank control group (P<0.05);after the polysaccharides action,the ability of DCs phagocytosing FITC-dextran was decreased,especially the effects of 300,400 μg/mL of polysaccharides were more significant compared with the control group (P<0.05).In addition, the polysaccharides could down-regulate the expression of TLR2 mRNA and TLR4 mRNA in DCs, the DCs down-regulation effect after 100-400 μg/mL polysaccharides treatment, the difference compared with the blank control group was statistically significant(P<0.05).ConclusionThe extracellular polysaccharides can up-regulate the expression of DCs surface CD11c,MHCⅡ,CD80 and CD 86 molecules,decreases the phagocytosis ability and down-regulates the expression of TLR2 mRNA and TLR4 mRNA,which preliminarily indicates that the polysaccharides could stimulate the differentiation and maturation of murine DCs.
2017-03-18
2017-06-06)

