大兴安岭笃斯越橘内生真菌及矿质养分特性分析*
白永超 陈 露 卫旭芳 蒋润迪 李彬彬 宫中志 侯智霞
(北京林业大学 省部共建森林培育与保护教育部重点实验室 蓝莓研究发展中心 北京 100083)
大兴安岭笃斯越橘内生真菌及矿质养分特性分析*
白永超 陈 露 卫旭芳 蒋润迪 李彬彬 宫中志 侯智霞
(北京林业大学 省部共建森林培育与保护教育部重点实验室 蓝莓研究发展中心 北京 100083)
【目的】 分析笃斯越橘根系内生真菌的多样性、侵染率、侵染结构及宿主矿质元素含量,明确内生真菌侵染对笃斯越橘矿质元素的影响。【方法】 以大兴安岭山地、水湿地冻土、水湿地有土壤3种立地类型的笃斯越橘为研究对象,应用现代生物学高通量测序技术(ITS)分析笃斯越橘根系内生真菌多样性,使用多元统计分析法,研究内生真菌侵染率与宿主矿质元素间的相互关系。【结果】 1) 大兴安岭地区笃斯越橘根系内生真菌多样性(H′=3.58~4.36)及侵染结构(根外菌丝、胞间有隔菌丝、胞间无隔菌丝、胞内菌丝团、表皮细胞缺失)较丰富,侵染率较高(54.98%~68.09%); 笃斯越橘根系内生真菌具有立地类型特异性,其中水湿地有土壤类型和山地类型以Phialocephala为优势菌属,而水湿地冻土类型的优势菌属为Meliniomyces。2) 3种立地类型中,笃斯越橘根系内生真菌多样性、侵染率均以水湿地冻土类型最高,山地类型次之,水湿地有土壤类型最低,笃斯越橘N、K、Ca、Fe元素的丰度与根系内生真菌多样性及侵染率呈现相同的趋势。3) 根系内生真菌侵染率与宿主植物N、P、K、Ca、Fe元素呈显著或极显著正相关,而与Zn元素呈极显著负相关(r=-0.944**)。【结论】 内生真菌对笃斯越橘矿质养分的积累有显著的促进或抑制作用,推测内生真菌侵染是影响笃斯越橘矿质元素含量的重要因子,环境条件是影响笃斯越橘根系内生真菌多样性和丰度的重要因素。
笃斯越橘; 内生真菌; 多样性; 侵染状况; 矿质养分
笃斯越橘(Vacciniumuliginosum)为杜鹃花科(Ericaceae)越橘属(Vaccinium)多年生落叶小灌木,集中分布于我国大、小兴安岭及长白山地区,抗寒性极强,营养价值极高,是极具开发价值的天然寒地浆果资源(伏鸿峰, 2013)。在大兴安岭的林间空地、针叶、阔叶及混交林中有大面积的笃斯越橘分布,丰产期果实年产量每公顷可达数十万吨,具有“越橘之乡”之美誉(刘金江, 2013)。近年来,由于气候变暖、林火频发以及人们对笃斯越橘高营养价值的青睐引起的破坏性采摘等原因,使得笃斯越橘分布面积和产量大幅下降,种质多样性逐渐减少,极大的限制了我国笃斯越橘的资源保护、开发利用和产业化发展(王贺新等, 2012)。
杜鹃花科植物根系在自然生境中可与土壤真菌形成一种特殊类型的互惠共生体,即杜鹃花类菌根(ericoid mycorrhizal, ERM),对宿主植物不但没有损伤作用(Koronetal., 2000; Carrilloetal., 2015),还可激发宿主植物对生物和非生物胁迫的防御机制(Brundrett, 2002; Scagel, 2005; Pignaetal., 2013)。为探讨ERM真菌在笃斯越橘栽培及繁育中的积极作用,Powall等(1984)用锤舌菌属(Hymenoscyphus)的H.ericae菌株接种高丛越橘(Vacciniumcorymbosum)后,宿主生长量及果实产量明显增加; Korno等(2000)用树粉孢属(Oidiodendron)的O.rhodogenum和O.griseum接种1年生越橘(Vacciniumcorymbosum)后,宿主叶面积和干质量较对照明显增加。上述研究为了解ERM真菌对笃斯越橘的回接效应提供了参考,但对于特殊立地类型的笃斯越橘根系内生真菌多样性尚不清楚,况且内生真菌为专性共生菌,必须依靠与宿主植物建立共生关系并从中获取宿主光合产物以维持正常生长和发挥其功能(Burggraafetal., 1989),研究内生真菌侵染对笃斯越橘矿质元素的影响是明确内生真菌与宿主植物共生的关键因素。对于笃斯越橘根系内生真菌多样性分析,以往多采用的传统分离培养法存在自身局限性,一方面是部分真菌目前尚不能人工分离培养 (袁继鑫, 2013),其次是分离过程中不同消毒时间分离得到的真菌数量差异显著(何映霞等, 2008),现代生物学高通量测序技术(ITS)为全面准确地了解特殊立地环境中的微生物多样性提供了便利(Hultmanetal., 2015)。因此,本研究在分子生物学鉴定和侵染特性分析相结合的基础上,进一步探究笃斯越橘根系内生真菌侵染率与宿主矿质元素的相关性,旨在为研究内生真菌与宿主植物共生的生态学意义及合理开发利用笃斯越橘内生真菌资源提供理论依据。
1 材料与方法
1.1试验区域概况及样品采集
2015年8月,选取大兴安岭地区笃斯越橘集中分布的3种立地类型进行调查分析,每种立地类型布设3个20 m×20 m的样地,每个样地选取1 m×1 m的标准样方进行调查并采样,同时记录各样地的采集信息(表1),参照尹德洁等(2011)的分类标准,将3种立地类型分为水湿地有土壤类型、水湿地无土类型、山地类型,由于本研究区域水湿地无土类型中永冻层距离地表较近,除大多根系分布于苔藓层外,部分根系直接与永冻层接触,因此在尹德洁等(2011)分类标准的基础上,根据实地环境特点将其命名为水湿地冻土类型。其中,水湿地有土壤类型根系层主要为腐殖质和沼泽土,主要伴生植物为兴安落叶松(Larixgmelinii)、白桦(Betulaplatyphylla)、红豆越橘(Vacciniumvitis-idaea)、杜香(Ledumpalustre)、忍冬(Loniceracaerulea)、柴桦(Betulafruticosa); 水湿地冻土类型根系层主要为苔藓,主要伴生植物为落叶松、红豆越橘、杜香、柴桦、杜鹃(Rhododendronsimsii); 山地类型根系层为少许腐殖质和含有石块的棕壤土,该立地类型中森林资源较丰富,主要伴生植物除水湿地有土壤类型的6种外,其伴生植物还有杜鹃。
在每个样方内随机采集5株长势良好的笃斯越橘及根系分布层土壤,剪取部分直径为0.5~1 mm的笃斯越橘根系洗净混匀后,一部分固定于多聚甲醛固定液中,用于内生真菌的侵染率计算及侵染结构观察; 一部分保鲜盒冷藏,带回实验室储存于-80 ℃冰箱,用于内生真菌多样性分析; 剩余根系及植株地上部全部带回实验室,用于植株矿质元素含量测定; 土壤样品拣出杂质后带回实验室自然晾干,用于土壤矿质养分测定。
1.2笃斯越橘根系内生真菌多样性分析
1.2.1 根系样品总DNA提取 取-80 ℃冰箱保存的根系,使用PowerSoil DNA Isolation Kit(Mibio,美国)试剂盒并参照说明书进行样品根系总DNA提取,-20 ℃保存备用。
1.2.2 PCR扩增 真菌ITS1区的扩增采用引物ITS1-F(5′- CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-TGCGTTCTTCATCGATGC-3′)。扩增体系(50 μL): 模板DNA30 ng; 正反向引物(10 μM)各2 μL; 4 μL dNTPs(2.5 mmol·L-1); 5 μL 10×Pyrobest Buffer; 0.3 μL Pyrobest DNA Polymerase(2.5 U·μL-1, Takapa D Code: DR0055A); 无菌ddH2O补足至50 μL。扩增程序: 95 ℃ 5min; 95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,25个循环; 72 ℃ 10 min; 4 ℃恒温保存。PCR产物经2%琼脂糖凝胶电泳检测(电压: 150 V; 电泳时间: 30 min),-20 ℃保存备用。
1.2.3 单个样品复杂性分析 基于OTUs(operational taxonomic units)的分析结果,试验对单个样品进行alpha 多样性分析。真菌多样性可用alpha 多样性来表示,其alpha多样性包括Shannon index(H′),Phylogenetic diversity(PD, whole tree)和Observed number of species。其中,Observed number of species是用来表示实际观测到的OTUs数目; Shannon index是用来评估反应内生真菌的物种数量及其分布的均匀度; Shannon index指数越大,物种越丰富。
1.3测定指标及方法
多聚甲醛固定液中固定的根系顺序经10% KOH脱水透明、1% HCl酸化处理后,使用0.02%台盘蓝染色,在光学显微镜下观察内生真菌侵染结构和计算真菌侵染率(Chapman, 1992)。
将自然风干的土壤样品除尽杂质后过筛分级备用,用于测定土壤全N(凯式定氮法),碱解N(碱解扩散法),全P(NaOH熔融-钼锑抗比色法),有效P(NaHCO3浸提-钼锑抗比色法),全K、速效K(原子吸收火焰法)。笃斯越橘植株(地上部、地下部)在105 ℃杀青后恒温至80 ℃烘干,经粉碎、过筛后用于测定全氮(N)(凯式定氮法),全磷(P)(NaOH熔融-钼锑抗比色法),全钾(K)、钠(Na)、钙(Ca)、镁(Mg)、铁(Fe)、锰(Mn)、锌(Zn)、铜(Cu)(原子吸收火焰法)(鲍士旦, 2005)。采用Excel 2003处理原始数据,采用SAS 9.2软件对试验数据进行整理统计分析,对真菌侵染率与宿主矿质养分的关系进行相关性分析。
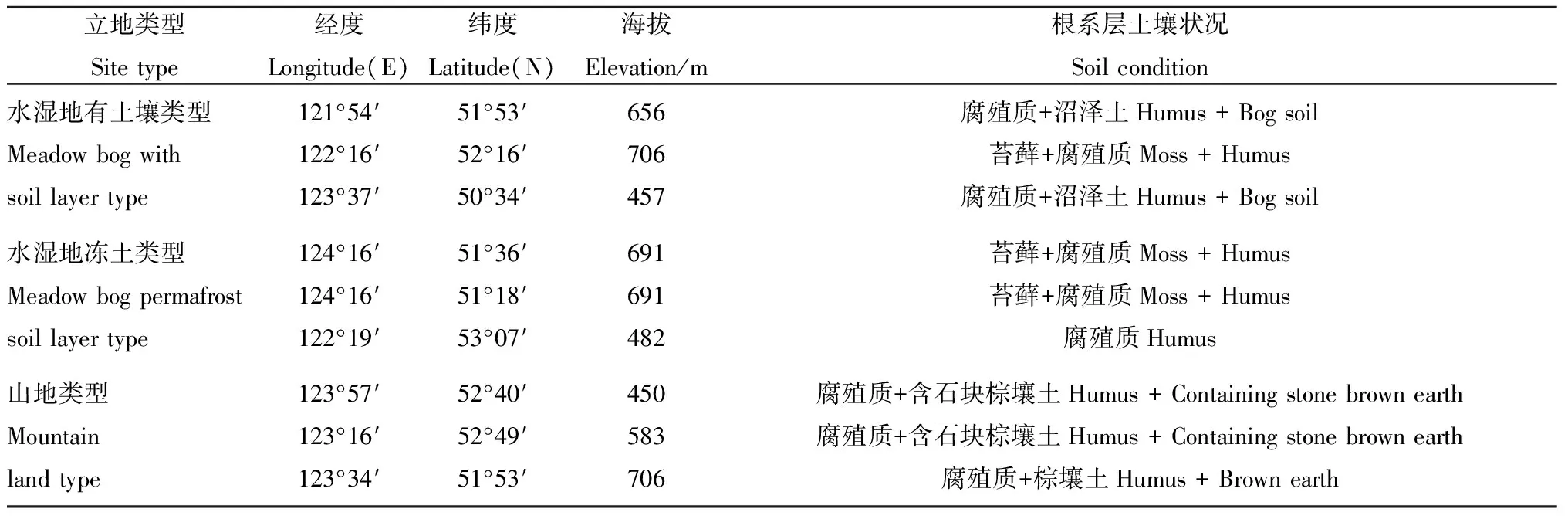
表1 大兴安岭3种立地类型中笃斯越橘分布状况Tab.1 The V. uliginosum distribution conditions of three site types in the Greater Xing’an Mountains
2 结果与分析
2.13种立地类型中笃斯越橘根系内生真菌多样性比较
笃斯越橘根系内生真菌多样性如图1、2所示。Alpha多样性分析表明,3种立地类型中笃斯越橘根系内生真菌OTUs在468~789之间(图1A),以水湿地冻土类型最高,山地类型次之,水湿地有土壤类型最低; 3种立地类型中的shannon index为H′=3.58~4.36(图1B),其中水湿地冻土类型H′=4.36,水湿地有土壤类型H′=3.58,说明水湿地冻土类型内生真菌最丰富。如图2所示,3种立地类型中鉴定出Phialocephala、Meliniomyces、Rhizoscyphus、Tomentella、Archaeorhizomyces、Cistella、Parmella、Oidiodendron、Clavaria9属真菌,同一菌属在不同立地类型中所占比例各异,其中山地类型和水湿地有土壤类型以Phialocephala为优势真菌,所占比例分别为40.1%、51.2%,水湿地冻土类型以Meliniomyces为优势真菌,所占比例为49.2%,以上两类优势菌均属于子囊菌(Hambletonetal., 2005; 邓勋等, 2015),说明笃斯越橘根系内生真菌以子囊菌为优势菌。同时,由图2还可以看出,部分内生真菌表现出了明显的立地类型特异性,如Cistella真菌仅分布于山地类型,占比2.53%,Tomentella真菌仅分布于水湿地冻土类型,而山地类型中未检测出Meliniomyces真菌,为水湿地冻土类型中的优势菌属(49.2%),水湿地有土壤类型中未检测出Oidiodendron真菌。
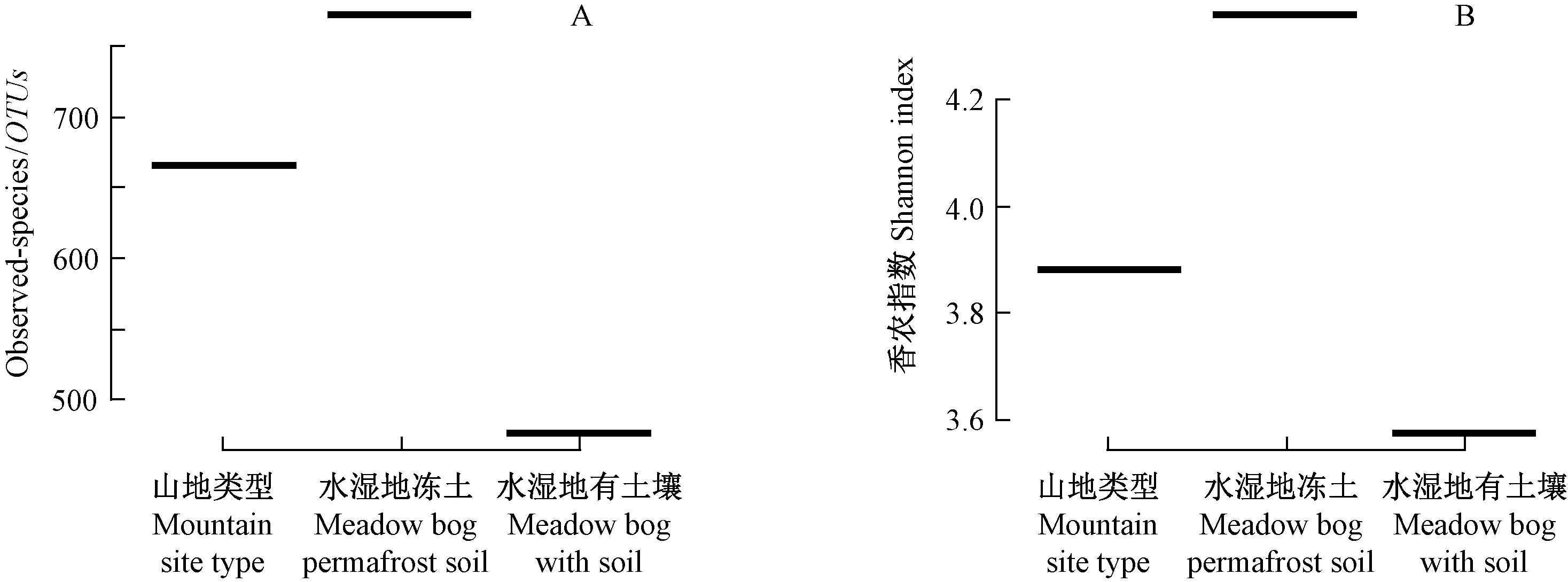
图1 3种立地类型中笃斯越橘内生真菌Alpha多样性(n=3)Fig.1 Alpha diversity of endophytic fungi in V. uliginosum of three site types (n=3)A: Observed number of species; B: Shannon index
2.2笃斯越橘根系内生真菌侵染特性
3种立地类型中笃斯越橘根系内生真菌侵染率差异显著(Plt; 0.05)(图3),以水湿地冻土类型最高(68.09%), 山地类型次之(62.33%—— 水湿地有土壤类型最低(54.98%),这可能是因为水湿地冻土类型中笃斯越橘根系内生真菌多样性最丰富(图1C),推测不同菌株间的相互作用可能对宿主植物的侵染具有促进作用。显微观察发现,3种立地类型中均有根外菌丝(图4A)、胞间有隔菌丝(图4B)、胞内菌丝团(图4D)、表皮细胞缺失现象(图4E),而水湿地有土壤类型和山地类型中还出现胞间无隔菌丝的侵染结构(图4C),5种侵染结构中根外菌丝在3种立地类型中出现的频次均最高。胞内菌丝团作为杜鹃花类菌根的典型侵染结构(Peterson, 1980),说明本研究区域的3种立地类型中笃斯越橘根系存在典型的菌根真菌侵染体; 而表皮细胞缺失现象可能是菌丝侵染宿主根系细胞一段时间后,根系中细胞原生质膜破裂,细胞内含物分解导致细胞缺失。
2.3笃斯越橘矿质营养及根系分布层土壤养分状况
2.3.1 笃斯越橘常量元素含量 3种立地类型中笃斯越橘地上部、地下部常量元素含量分析结果(图5)显示,除Na和地上部P元素外,不同立地类型中笃斯越橘地上部、地下部矿质元素含量均存在显著差异(Plt; 0.05),其中,地上部N、Ca元素含量高且差异较大,均以水湿地冻土类型含量最高,水湿地有土壤类型含量最低,而地上部及地下部Mg元素含量却以水湿地有土壤类型最高,地上部以水湿地冻土类型最低(0.09%),地下部以山地类型最低(0.07%)。由图5可知,水湿地冻土类型的笃斯越橘地上部、地下部N、P、K、Ca元素含量显著高于其余2种立地类型,而水湿地有土壤类型中地上部N、K、Ca,地下部N、P元素含量均最低,总体而言,水湿地冻土类型的植株矿质元素含量较其余2种类型高,水湿地有土壤类型总体较低,说明立地类型对笃斯越橘吸收矿质元素的影响较大。
2.3.2 笃斯越橘微量元素含量 由图6可知,水湿地有土壤、水湿地冻土及山地3种立地类型中笃斯越橘地上部和地下部Mn元素含量均较高,但差异不显著,其含量在742.88~776.81 mg·kg-1之间。除Mn和地下部Cu元素外,其余3种微量元素(Fe、Zn、Cu)含量在不同立地类型中差异显著(Plt; 0.05),其中水湿地冻土类型中地上部及地下部Fe元素含量均最高(地上部397.98 mg·kg-1,地下部593.31 mg·kg-1),而Zn元素含量则最低; 水湿地有土壤类型中地上部及地下部Fe、Cu元素含量均最低,而Zn元素含量则最高,由此可知,笃斯越橘吸收微量元素具有地域间差异。
2.3.3 根系分布层土壤养分含量 由图7可知,3种立地类型的笃斯越橘根系分布层土壤中,水湿地冻土类型的全N、全P、碱解N、有效P含量均最高,
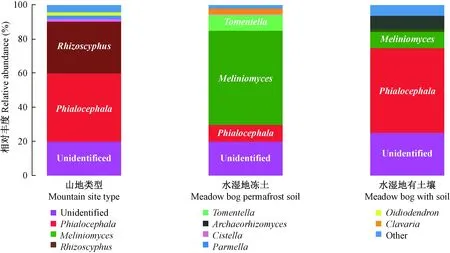
图2 3种立地类型中笃斯越橘根系内生真菌相对丰度Fig.2 Relative abundance of endophytic fungi species in V. uliginosum of three different types
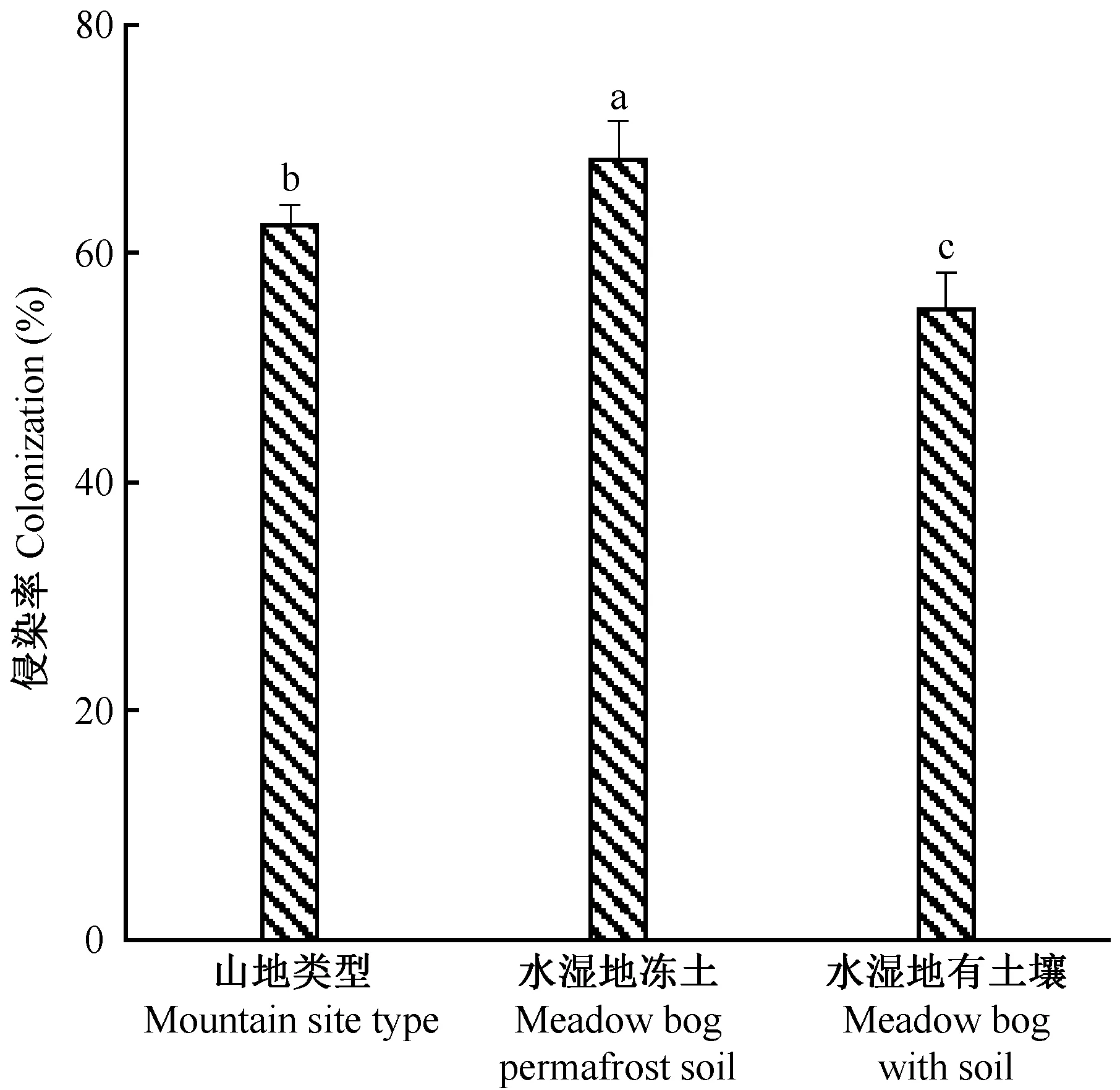
图3 3种立地类型中笃斯越橘根系内生真菌侵染率Fig.3 The colonization rate of endophytic fungi in V. uliginosum of three site types不同小写字母表示在0.05水平差异显著(P lt; 0.05),下同。 The different small letters show significant at 0.05 level. The same below.

图4 3种立地类型中笃斯越橘根系内生真菌侵染结构Fig.4 The infection structure of endophytic fungi in V. uliginosum of three site typesA: 根外菌丝 Exogenous mycelium; B: 胞间有隔菌丝 Intracellular hyphae with partition; C: 胞间无隔菌丝 Intracellular nonseptate hyphae group; D: 胞内菌丝团 Intracellular hyphae; E: 表皮细胞缺失 Missing of the epidermal cells
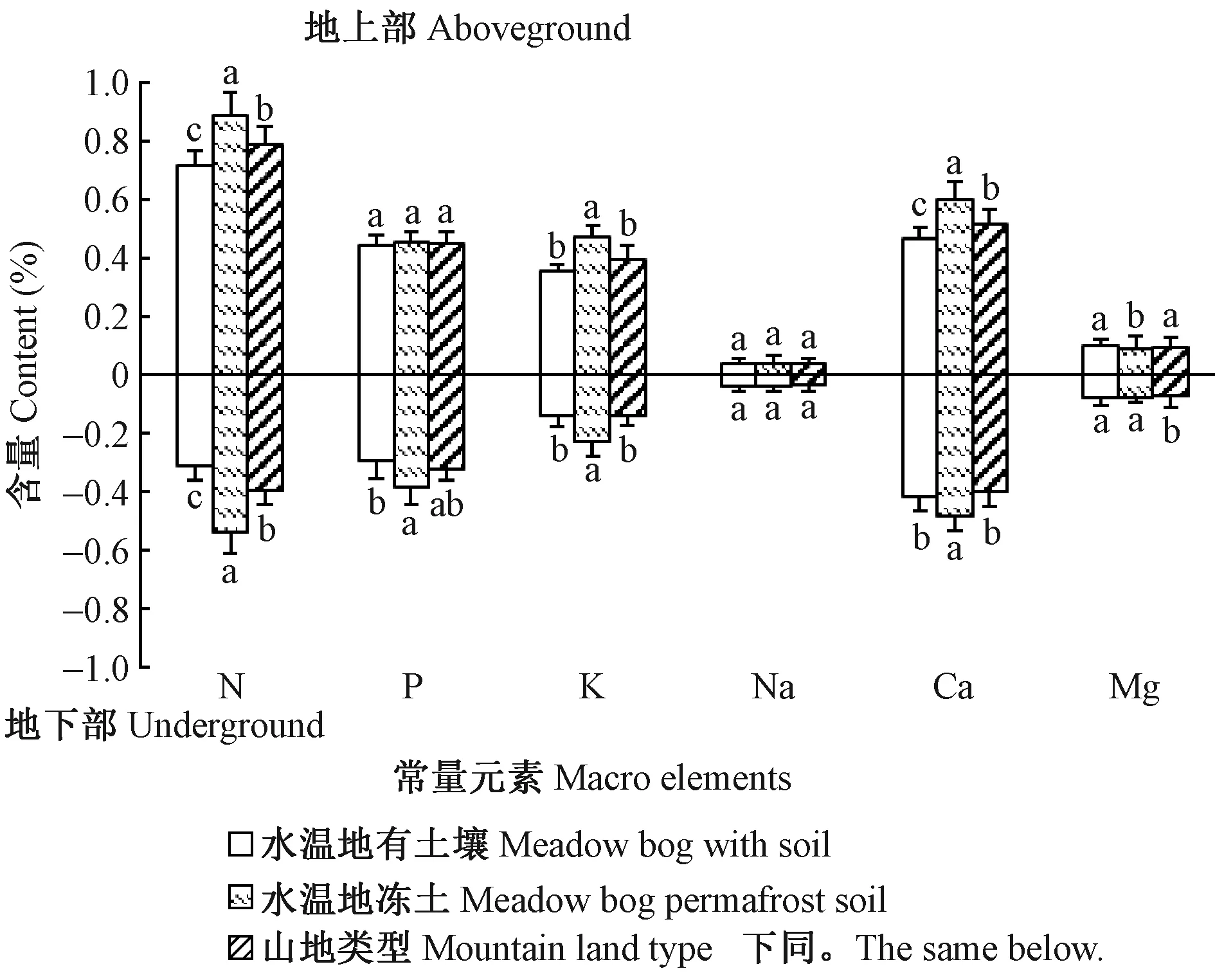
图5 3种立地类型中笃斯越橘地上部及地下部常量元素含量Fig.5 The V. uliginosum Macro elements content in aboveground and underground part of three site types
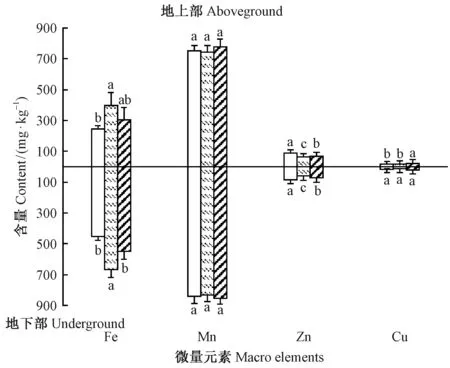
图6 3种立地类型中笃斯越橘地上部及地下部微量元素含量Fig.6 The V. uliginosum Micro elements content in aboveground and underground part of three site types
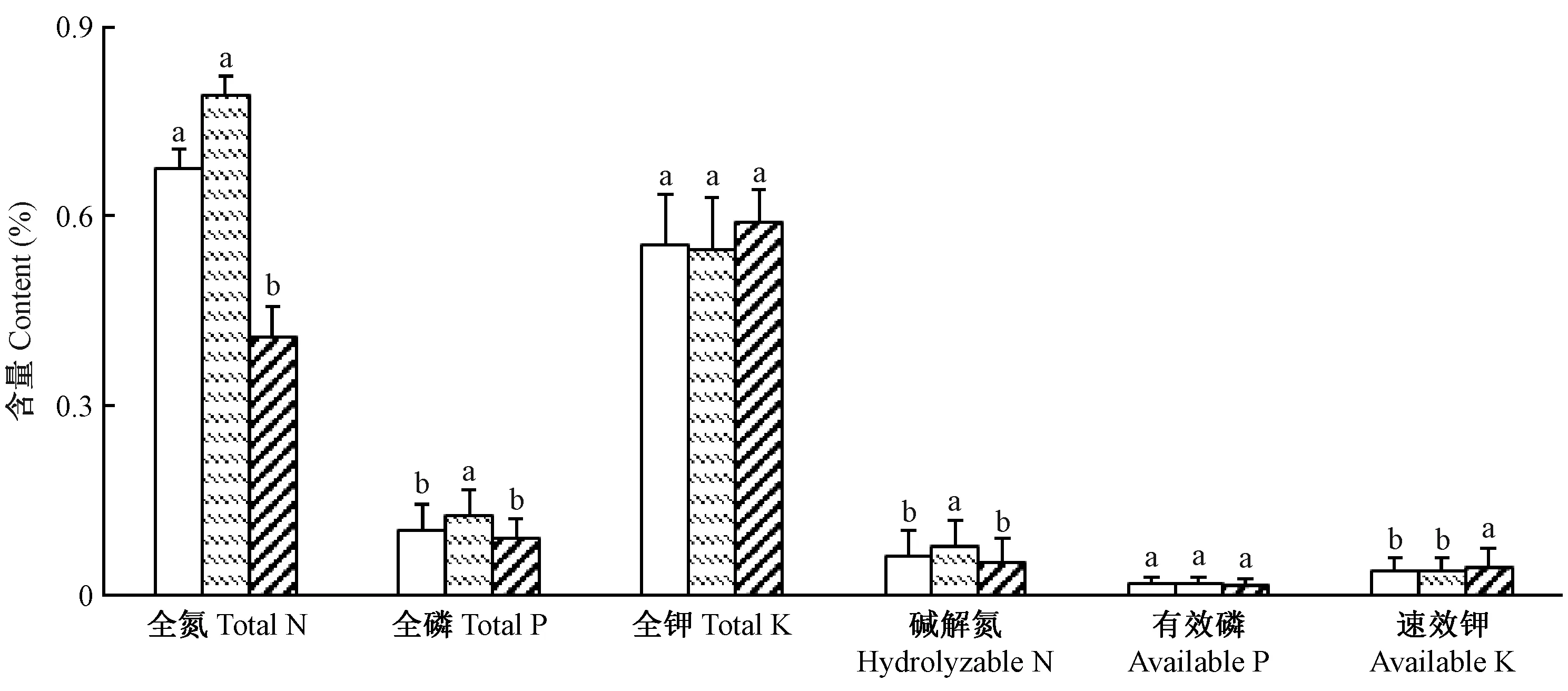
图7 3种立地类型中笃斯越橘根系集中分布层土壤养分含量Fig.7 The soil nutrient content of the V. uliginosum root centralized distribution layer of three site types
而全K和速效K含量则最低; 山地类型中的养分含量状况则与水湿地冻土类型相反,即呈现全K、速效K含量最高,全N、全P、碱解N、有效P含量均最低。3种立地类型中,除全K和有效P外,其他各种养分在3种立地类型中均呈现不同程度的差异水平,其中,山地类型的全N含量与水湿地有土壤类型和水湿地冻土类型差异显著(Plt; 0.05),水湿地冻土类型的全P含量与水湿地有土壤类型和山地类型差异显著(Plt; 0.05)。此外,水湿地有土壤类型中的碱解N、有效P、速效K含量分别为对应全效养分的8.99%、17.7%、6.9%; 水湿地冻土类型中的碱解N、有效P、速效K含量分别为对应全效养分的9.66%、14.51%、6.79%; 山地类型中的碱解N、有效P、速效K含量分别为对应全效养分的12.17%、15.61%、7.42%,由此可知,水湿地冻土类型中有效P、速效K占对应全效矿质元素的比例均最低,说明该立地类型中可供植物吸收利用的有效养分含量相对较低。
2.4笃斯越橘矿质元素间及其与根系内生真菌侵染率的关系
对笃斯越橘矿质养分和宿主植物根系内生真菌侵染率的相关性分析(表2)发现,笃斯越橘植株N、P、K、Ca、Fe元素间呈显著或极显著正相关,但均与Zn元素呈极显著负相关; 此外,Na元素与Mg元素显著正相关,Ca元素与Mn元素显著负相关。笃斯越橘植株矿质元素含量与宿主植物根系内生真菌侵染率的相关性分析结果(表2)显示,宿主植物根系内生真菌侵染率与植株N、P、K、Ca、Fe元素呈极显著正相关,与Zn元素呈极显著负相关(r=-0.944**)。由此可知,笃斯越橘体内N、P、K、Ca、Fe元素间可能具有一定的相互促进作用,而对Zn元素具有一定的抑制作用; 根系内生真菌侵染可以促进笃斯越橘植株对N、P、K、Ca、Fe元素的吸收,对Zn元素的吸收可能具有一定的限制作用。
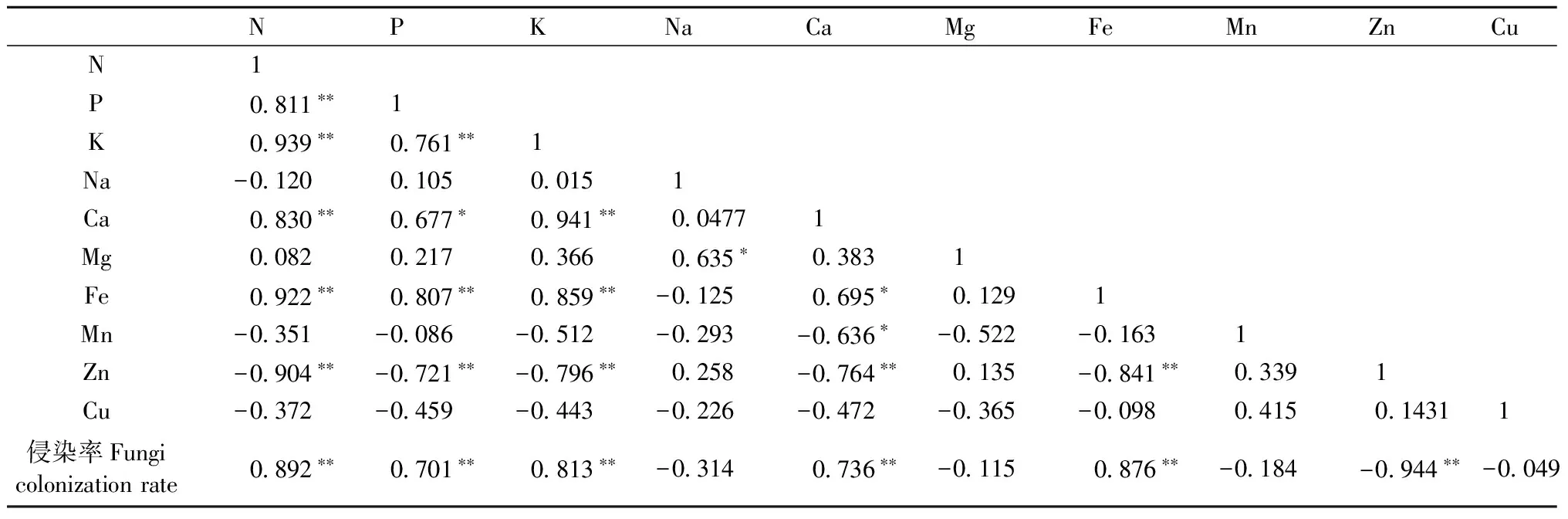
表2 笃斯越橘矿质养分含量与其内生真菌侵染率间的相关性①Tab.2 Correlation of mineral elements of V. uliginosum and endophytic fungi colonization rate
①*Plt; 0.05;**Plt; 0.01.
3 讨论
3.1笃斯越橘根系内生真菌多样性
大兴安岭地区3种立地类型中笃斯越橘根系内生真菌多样性shannon index在3.58~4.36之间(图1),远高于已报道的南极苔藓(H′=0.91~1.99)(Zhangetal., 2013)、维管植物(H′=1.44)(Rosaetal., 2010)和野生青檀(Pteroceltistatarinowii)(H′=2.05~2.32)(Chaietal., 2011),说明大兴安岭地区笃斯越橘根系内生真菌较为丰富,而不同立地类型中笃斯越橘根系内生真菌具有一定的立地类型特异性,如Cistella属真菌仅在山地类型出现,Tomentella属真菌仅出现于水湿地冻土类型,可能是因为内生真菌对笃斯越橘根系的侵染与不同时空环境及土壤等条件的变化有关(杨秀丽, 2010)。为深入探讨土壤理化性质对笃斯越橘根系内生真菌侵染特性的影响,本研究对3种立地类型中的土壤理化性质(全N、全P、全K、碱解N、有效P、速效K)进行了测定,发现3种立地类型中,除全K和有效P外,其余土壤养分在3种立地类型中呈现不同程度的显著性水平(图7),说明不同立地类型中土壤养分差异使得笃斯越橘根系生理状况及化学组成发生了变化(Carroll, 1988),从而对部分内生真菌的侵染产生地域特异性。ITS分析得到的9属内生真菌中,先前研究从杜鹃花科植物根系中分离得到Oidiodendron和Meliniomyces属真菌(Berchetal., 2002; Bougoureetal., 2005),并且Phialocephala属真菌作为宿主植物根际重要的益生菌,具有促进宿主植物生长及增强宿主植物抗性等作用(邓勋等, 2015);Phialocephala、Meliniomyces、Oidiodendron、Cladophialophora、Devriesia、Cryptosporiopsis、Clavaria等真菌也相继从不同宿主植物中分离得到(Petersonetal., 1980; Fisheretal., 1984; Seifertetal., 2004; Hambletonetal., 2005; Vohníketal., 2005; Daveyetal., 2007; Kowalskietal., 2011),说明本研究区域的笃斯越橘资源是后续研究中选择分离材料的较好样本。此外,冻土环境中由于土壤受到低温、供氧限制及养分可利用性等极端因素的影响,大部分生长于冻土环境中的生物很大程度上是依靠根系微生物活性来适应逆境环境(D’Amicoetal., 2006; Buzzinietal., 2012; Jansson and Tas, 2014; Beatetal., 2016),本研究结果中水湿地冻土类型的内生真菌多样性最丰富与上述研究结果较一致,推测大兴安岭地区笃斯越橘根系内生真菌是影响笃斯越橘生长的重要因素。
3.2笃斯越橘根系内生真菌侵染特性
宿主根系不但是共生真菌的生长载体,还为共生真菌的生长提供必要的生长物质,而共生真菌可从土壤中吸收矿质养分供宿主植物生长而被誉为“生物肥料”(刘润进等, 2007)。本研究表明,3种立地类型中笃斯越橘根系内生真菌侵染率均较高且差异显著(Plt; 0.05),与前人研究结果较一致(Goulartetal., 1993; 袁继鑫, 2013),可能是本研究区域内生真菌多样性较丰富(图1),不同菌属间的相互作用提高了侵染率; 而水湿地冻土类型中侵染率最高,可能是因为该立地类型中苔藓物质较多,苔藓中较多的活性物质有利于真菌侵染宿主根系(唐雪东等, 2005)。此外,显微观察结果表明,3种立地类型中存在根外菌丝、胞内有隔菌丝、胞内无隔菌丝、胞内菌丝团、表皮细胞缺失现象等,说明不同真菌在笃斯越橘根系中可能形成不同的侵染结构,而3种立地类型中均以根外菌丝的侵染结构最丰富,根外菌丝在土壤中可形成类似于网络结构的庞大菌丝体,菌丝可将各种植物的根系连接在一起,使宿主植物之间进行物质交换、能量流动、信息传递,同时还可以改善土壤的物理化学性状,从而提高土壤稳定性,增加土壤肥力,改善植物根系生长状况(Miransari, 2010)。因此,后续试验中可选取本研究区域的笃斯越橘根系作为研究材料,通过分离培养手段获得此类真菌,以此作为微生物菌肥应用于笃斯越橘栽培中,降低笃斯越橘的栽培成本和减轻对环境的污染(Carrilloetal., 2015)。
3.3笃斯越橘矿质营养特性及其与内生真菌侵染率间的相关性
菌根真菌对植物的促生长作用已被广泛研究,如外生菌根(Ectomycorrhiza, ECM)可促进马尾松对N、P、K元素的吸收及利用(高悦等, 2009); 丛枝菌根(Arbuscular mycorrhiza, AM)能够显著促进湖北海棠实生苗对P、Zn、Cu元素的吸收(Liu, 2005); Morandi等 (1986)接种杜鹃花类菌根真菌1~4周后其宿主植物茎部、根部的生物量显著增加。本研究表明,水湿地冻土类型中有效P、速效K占对应全效矿质元素的比例均最低,山地类型中碱解N、有效P、速效K含量占对应全效矿质元素的比例总体较高,但笃斯越橘矿质元素含量并未与根系层土壤养分相对应,反而水湿地冻土类型的笃斯越橘除Zn元素外,N、K、Ca、Fe元素含量均最高(图5、6),一方面可能是水湿地冻土类型中笃斯越橘根系内生真菌较丰富(图1),大量的菌丝可以扩大宿主植物根系与土壤的接触面而增加宿主的根际范围,进而促进宿主吸收矿质养分; 亦可能是水湿地冻土类型中大量的共生真菌可以产生广泛的水解酶及氧化酶类,其对活化土壤中复杂的有机质有重要作用(Bendingetal., 1996),笃斯越橘根系真菌侵染率与其矿质养分相关性分析结果与之对应,即真菌侵染率与植株N、P、K、Ca、Fe元素含量呈极显著正相关,与Zn元素呈极显著负相关(表2),说明笃斯越橘根系菌根真菌侵染可增加宿主植物体内的N、P、K、Ca、Fe元素含量(Malmeretal., 2003; Scagel, 2005; 徐丽娟等, 2012); 真菌侵染则减少笃斯越橘体内Zn元素含量,与前人(Bradleyetal., 1981; Martinoetal., 2000; Martinoetal., 2002)对杜鹃花的研究结果较一致。此外,Mn元素含量在笃斯越橘地上部及地下部中均较高,这对于其它果树可能引起中毒(安贵阳等, 2004; 唐玉琴等, 2013),但笃斯越橘能够正常生长,说明笃斯越橘对锰元素具有较强的耐性范围。罗淑华(1997)研究发现,茶树中Mn元素可促进植物体内硝态氮迅速转化为铵态氮,进而合成氨基酸,当植物吸收硝态氮时,其体内Mn元素含量会相应增加。对于大兴安岭地区笃斯越橘体内高含量的Mn元素是否与茶树中Mn元素的作用一致,有待进一步试验验证。
4 结论
大兴安岭地区笃斯越橘根系内生真菌种类较丰富(9属); 侵染率较高(54.98%~68.09%); 侵染结构多样,ITS测序分析得到Phialocephala、Meliniomyces真菌是3种立地类型中笃斯越橘根系优势内生真菌,而不同立地类型中笃斯越橘根系内生真菌具有一定的地域特异性; 笃斯越橘内生真菌侵染能够显著增加宿主植物体内N、P、K、Ca、Fe元素含量,而对宿主Zn元素的积累具有一定的抑制作用。因此,筛选不同立地类型中,尤其是不同根系养分水平下优良的笃斯越橘根系内生真菌群落,进一步发掘利用,将对减少化肥污染乃至生态环境可持续发展具有重要意义。
安贵阳,史联让,杜志辉, 等. 2004. 陕西地区苹果叶营养元素标准范围的确定. 园艺学报,31(1): 81-83.
(An G Y, Shi L R, Du Z H,etal. 2004. Studies on the standard range of apple leaf nutritional elements in Shanxi Province. Acta Horticulturae Sinica, 31(1): 81-83. [in Chinese])
鲍士旦. 2007. 土壤农化分析.3版. 北京: 中国农业出版社.
(Bao S D. 2007. Soil agro-chemistrical analysis.3rd edition. Beijing: China Agriculture Press. [in Chinese])
柴新义,陈双林. 2011. 青檀内生真菌菌群多样性的研究. 菌物学报,30(1): 18-26.
(Chai X Y, Chen S L. 2011. Diversity of endophytic fungi fromPteroceltistatarinowii. Mycosystema, 30(1): 18-26. [in Chinese])
邓 勋,宋小双,尹大川, 等. 2015. 深色有隔内生真菌提高宿主植物抗逆性的研究进展. 安徽农业科学,43(31): 10-11, 17.
(Deng X, Song X S, Yin D C,etal. 2015. Research advances in improving host plant resistance by Dark Septate Endophytes. Journal of Anhui Agri Sci, 43 (31): 10-11, 17. [in Chinese])
伏鸿峰. 2013. 大兴安岭野生笃斯越桔生物生态学特性及其繁育技术研究. 呼和浩特:内蒙古农业大学博士学位论文.
(Fu H F. 2013. Study on the bioecological characters and breeding technique of wildVacciniumuliginosumL. in Da Hinggan Mountains. Hohhot: Inner Mongolia Agricultural University. [in Chinese])
高 悦,吴小芹,孙民琴. 2009. 马尾松不同菌根苗对氮磷钾的吸收利用. 南京林业大学学报: 自然科学版,33(4): 77-80.
(Gao Y, Wu X Q, Sun M Q. 2009. Effects of ectomycorrhizal seedling of massonpine on absorption and utilization of N, P and K. Journal of Nanjing Forestry University: Natural Science Edition. 33(4): 77-80. [in Chinese])
何映霞,冉雪琴,王嘉福. 2008. 珙桐产黄酮内生真菌的分离和鉴定. 贵州农业科学,36(3): 3-6.
(He Y X, Ran X Q, Wang J F. 2008. Isolation and identification of endophytic fungi strains producing flavonoids fromDavidiainvolucrateBaill. Guizhou Agricultural Sciences, 36(3): 3-6. [in Chinese])
刘金江. 2013. 黑龙江省笃斯越橘资源利用现状及发展对策研究. 北京:中国农业科学院硕士学位论文.
(Liu J J. 2013. The present situation of development and utilization ofVacciniumuliginosumin Heilongjiang Province. Beijing:MS thesis of Chinese Academy of Agricultural Sciences. [in Chinese])
刘振华. 2010. 杜鹃花菌根真菌分离鉴定及多样性分析. 北京:中国林业科学研究院硕士学位论文.
(Liu Z H. 2010. Isolation, identification and Diversity analysis ofRhododendronPlants mycorrhizal fungi. Beijing:MS thesis of China Forest Science Research Institute. [in Chinese])
刘润进,陈应龙. 2007. 菌根学. 北京: 科学出版社.
(Liu R J, Chen Y L. 2007. Mycorrhizology. Beijing: Science Press. [in Chinese])
罗淑华. 1997. 谈谈植物营养元素的相互作用. 茶叶通讯,(01): 18-20.
(Luo S H. 1997. Talking about the interaction of plant nutrition elements. Tea communication, (01): 18-20. [in Chinese])
唐雪东,李亚东,李士举, 等. 2005. 不同土壤条件下越橘根系活力和菌根侵染率比较研究. 吉林农业大学学报,27(1): 43-47.
(Tang X D, Li Y D, Li S J,etal. 2005. A comparative study of root activity and mycorrhizal infection incidence of blueberry in different soil conditions. Journal of Jilin Agricultural University, 27(1): 43-47. [in Chinese])
唐玉琴,彭良志,淳长品, 等. 2013. 红壤甜橙园土壤和叶片营养元素相关性分析. 园艺学报,40(4): 623-632.
(Tang Y Q, Peng L Z, Chun C P,etal. 2013. Correlation analysis on nutrient element contents in orchard soils and sweet orange leaves in Southern Jiangxi Province of China. Acta Horticulturae Sinica, 40(4): 623-632. [in Chinese])
王贺新,乌凤章. 2012. 笃斯越橘与落叶松、苔藓的种间关系问题及研究展望. 东北农业大学学报,43(10): 10-13.
(Wang H X, Wu F Z. 2012. Problems and prospects of inter-specific relationships amongVacciniumuliginosum, larch and moss. Journal of Northeast Agricultural University, 43(10): 10-13. [in Chinese])
徐丽娟,刁志凯,李 岩, 等. 2012. 菌根真菌的生理生态功能. 应用生态学报,23(1): 285-292.
(Xu L J, Diao Z K, Li Y,etal. 2012. Eco-physiological functions of mycorrhizal fungi. Chinese Journal of Applied Ecology, 23(1): 285-292. [in Chinese])
杨秀丽. 2010. 大兴安岭兴安落叶松森林生态系统菌根及其真菌多样性研究. 呼和浩特:内蒙古农业大学博士学位论文.
(Yang X L. 2010. Mycorrhizal diversity in theLarixgmeliniiforest ecosystems of Da Hinggan Ling mountains. Hohhot:PhD thesis Inner Mongolia Agricultural University. [in Chinese])
尹德洁,苏淑钗,侯智霞, 等. 2011. 大兴安岭地区笃斯越桔种质资源调查. 经济林研究,29(2): 114-118.
(Yin D J, Su S C, Hou Z X,etal. 2011. Germplasm resources investigation of wild blueberry in Da Hinggan Mountains. Nonwood Forest Research, 29(2): 114-118. [in Chinese])
袁继鑫. 2013. 野生蓝莓菌根真菌的分离、鉴定及接种效应. 北京:北京林业大学硕士学位论文.
(Yuan J X. 2013. The separation, identification and inoculation effect of mycorrhizal fungi isolated from wild blueberries. Beijing:MS thesis of Beijing Forestry University. [in Chinese])
Bending G D, Read D J. 1996. Nitrogen mobilization from protein-polyphenol complex by ericoid and ectomycorrhizal fungi. Soil Biology and Biochemistry, 28(12): 1603-1612.
Berch S M, Allen T R, Berbee M L. 2002. Molecular detection, community structure and phylogeny of ericoid mycorrhizal fungi. Plant and Soil, 244(1): 55-66.
Beat F, Thomas R, Marcia P,etal. 2016. Microbial diversity in European alpine permafrost and active layers. Fems Microbiology Ecology, 92(3):1-18.
Bougoure D S, Cairney J W G. 2005. Fungi associated with hair roots of Rhododendron lochiae (Ericaceae) in an Australian tropical cloud forest revealed by culturing and culture-independent molecular methods. Environmental Microbiology, 7(11): 1743-1754.
Burggraaf A J P, Beringer J E. 1989. Absence of nuclear DNA synthesis in vesicular-arbuscular mycorrhizal fungi during in vitro development. New Phytologist, 1989, 111(1): 25-33.
Buzzini P, Branda E, Goretti Metal. 2012. Psychrophilic yeasts from worldwide glacial habitats: diversity, adaptation strategies and biotechnological potential. Fems Microbiology Ecology, 82(82): 217-241.
Bradley R, Burt amp; Amp A J, Read D J. 1981. Mycorrhizal infection and resistance to heavy metal toxicity in Calluna vulgaris. Nature, 292(5821): 335-337.
Brundrett M C. 2002. Coevolution of roots and mycorrhizas of land plants. New Phytologist, 154(2): 275-304.
Cairney J W G, Meharg A A. 2003. Ericoid mycorrhiza: a partnership that exploits harsh edaphic conditions. European Journal of Soil Science, 54(4): 735-740.
Carrillo R, Guerrero J, Rodríguez M,etal. 2015. Colonization of blueberry (Vacciniumcorymbosum) plantlets by ericoid mycorrhizae under nursery conditions, Cienc Investig Agrar, 42(3): 365-374.
Carroll G C. 1988. Fungal endophytes in stems and leaves: from latent pathogen to mutualistic symbiont. Ecology, 69(1): 2-9.
Chapman W K. 1991. Inocluation of ectomycorrhizal fungi in the IDFdk2 biogeoclimatic zone of British Columbia: new techniques, fungi and outplanting trials.Vancouver:PhD thesis of The University of British Columbia.
Davey M L, Currah R S. 2007. A new species ofCladophialophora(hyphomycetes) from boreal and montane bryophytes. Mycological Research, 111(1): 106-116
D’Amico S, Collins T, Marx J C,etal. 2006. Psychrophilic microorganisms: challenges for life. Embo Reports, 7(4): 385-389.
Fisher P J, Anson A E, Petrini O. 1984. Novel antibiotic activity of an endophyticCryptosporiopsissp. isolated fromVacciniummyrtillus. Transactions of the British Mycological Society, 83(1): 145-148.
Goulart B L, Schroeder M L, Demchak K,etal. 1993. Blueberry mycorrhizae: current knowledge and future directions. Acta Horticulturae, (346): 230-239.
Hambleton S, Sigler L. 2005.Meliniomyces, a new anamorph genus for root-associated fungi with phylogenetic affinities toRhizoscyphusericae(Hymenoscyphusericae),Leotiomycetes. Studies in Mycology, 53(1): 1-27.
Hultman J, Waldrop M P, Mackelprang R,etal. 2015. Multi-omics of permafrost, active layer and thermokarst bog soil microbiomes. Nature, 521(7551): 208-225.
Jansson J K, Tas N. 2014. The microbial ecology of permafrost. Nature Reviews Microbiology, 12(6): 414-425.
Koron D, Gogala N. 2000. The use of mycorrhizal fungi in the growing of blueberry plants(VacciniumcorymbosumL.). Acta Horticulturae, (525): 101-106.
Kowalski T, Kehr R D. 2011. Two new species ofPhialocephalaoccurring on Picea and Alnus. Canadian Journal of Botany, 73(1): 26-32.
Liu R J. 2005. Recent advances in the study of mycorrhizas in China. Programs and Abstracts of the 7th Korea-China Joint Symposium for Mycology.
Malmer N, Albinsson C, Svensson B M,etal. 2003. Interferences between Sphagnum and vascular plants: effects on plant community structure and peat formation. Oikos, 100(100): 469-482.
Martino E, Franco B, Piccoli G,etal. 2002. Influence of zinc ions on protein secretion in a heavy metal tolerant strain of the ericoid mycorrhizal fungusOidiodendronmaius. Molecular and Cellular Biochemistry, 231(1): 179-185.
Martino E, Turnau K, Girlanda M,etal. 2000. Ericoid mycorrhizal fungi from heavy metal polluted soils: their identification and growth in the presence of zinc ions. Mycological Research, 104(3): 338-344.
Miransari M. 2010. Contribution of arbuscular mycorrhizal symbiosis to plant growth under different types of soil stress. Plant Biology, 12(4): 563-569.
Morandi, Gianinazzi-Pearson. 1986. Influence of mycorrhizal infection and phosphate nutrition on secondary metabolite contents of soybean roots. Physiological amp; General Aspects of Mycorrhiza, 23(4): 787-791.
Peterson T A, Mueller W C, Englander L. 1980. Anatomy and ultrastructure of a Rhododendron root-fungus association. Canadian Journal of Botany, 58(58): 2421-2433.
Pigna M, Caporale A G, Cartes P,etal. 2013. Effects of arbuscular mycorrhizal inoculation and phosphorus fertilization on the growth of escarole (CichoriumendiviaL.) in an arsenic polluted soil. Journal of Soil Science amp; Plant Nutrition, 14(ahead): 199-209.
Powell C L, Bagyaraj D J. 1984. Effect of mycorrhizal inoculation on the nursery production of blueberry cuttings—a note. New Zealand journal of agricultural research, 27(3): 467-471.
Rosa L H, Almeida V L, Santiago I F,etal. 2010. Endophytic fungi community associated with the dicotyledonous plantColobanthusquitensis(Kunth) Bartl(Caryophyllaceae) in Antarctica. Fems Microbiology Ecology, 73(1):178-189.
Scagel C F. 2005. Inoculation with ericoid mycorrhizal fungi alters fertilizer use of highbush blueberry cultivars. Hortscience a Publication of the American Socience, 40(3): 786-794.
Seifert K A, Nickerson N L, Corlett M,etal. 2004. Devriesia, a new hyphomycete genus to accommodate heat-resistant, cladosporium-like fungi. Canadian Journal of Botany, 82(7): 914-926.
Vohník M, Albrechtová J, Vosátka M. 2005. The inoculation with Oidiodendron maius and Phialocephala fortinii alters phosphorus and nitrogen uptake, foliar C:N ratio and root biomass distribution inRhododendroncv. Azurro. Symbiosis, 40(3): 87-96.
Zhang T, Zhang Y Q, Liu H Y,etal. 2013. Diversity and cold adaptation on culturable endophytic fungi from bryophytes in the fildes region, King George Island, maritime Antarctica. Fems Microbiology letters, 341(1): 52-61.
(责任编辑 王艳娜)
AnalysisontheCharacteristicsofEndophyticFungiandMineralNutrientofVacciniumuliginosumintheDaxing’anMountains
Bai Yongchao Chen Lu Wei Xufang Jiang Rundi Li Binbin Gong Zhongzhi Hou Zhixia
(KeyLaboratoryforSilvicultureandConservationAttachedtoChinaMinistryofEducationBlueberryResearchandDevelopmentCenterBeijingForestryUniversityBeijing100083)
【Objective】 This study was investigated endophytic fungi diversity,infection rate,infection structure,and host mineral nutrient content to understond the effects of endophytic fungi colonization on the mineral nutrition ofV.uliginosum.【Method】 This study was conducted in the Daxing’an Mountains area with three soil types: Mountain land type, Meadow bog permafrost soil layer type, Meadow bog with soil layer type. The diversity of root mycorrhizal fungi ofV.uliginosumwas analyzed by modern biological techniques (ITS). Multivariate statistical analysis was used to study the relationship between mycorrhizal colonization and host plant mineral nutrition.【Result】 1) The diversity of endophytic fungi (H′=3.58~4.36) and infection structure (exogenous mycelium, intracellular hyphae with partition, intracellular nonseptate hyphae group, intracellular hyphae, missing of the epidermal cells) were rich, the infection rate was high (54.98%~68.09%) onV.uliginosumroots in the Greater Xing’an Mountains. The endophytic fungi in the root system ofV.uliginosumin different site types had the specificity. Among them, the mountain land type and the meadow bog with soil layer type were dominated byPhialocephala, while the dominant species of the meadow bog permafrost soil layer type wasMeliniomyces. 2) Among the three site types, the endophytic fungi diversity and infection rate were the highest in the meadow bog permafrost soil layer type, followed by the mountain land type, and the meadow bog with soil layer type was lowest. The content of most mineral elements in the three site types showed the same trend as that root endophytic fungi diversity and infection rate, with the exception of Zn element inV.uliginosum. 3) The endophytic fungi infection rate was significantly or extremely significantly positively correlated with N, P, K, Ca and Fe content, but had an extremely negative correlation with Zn content (r=-0.944**).【Conclusion】 The endophytic fungi can significantly promote the mineral nutrient accumulation ofV.uliginosum, suggesting that the endophytic fungi colonization is an important factor affecting the mineral nutrient status ofV.uliginosum, and the environmental conditions was important factor influencing the diversity and abundance of endophytic fungi inV.uliginosumroots.
Vacciniumuliginosum; endophytic fungi; diversity; colonization status; mineral nutrient
10.11707/j.1001-7488.20171006
2016-09-30;
2017-05-09。
中央高校基本科研业务专项基金项目(YX2013-12)。
*侯智霞为通讯作者。
S718.83
A
1001-7488(2017)10-0050-10

