2017年高考热点题型突破
李春燕 汤国柱
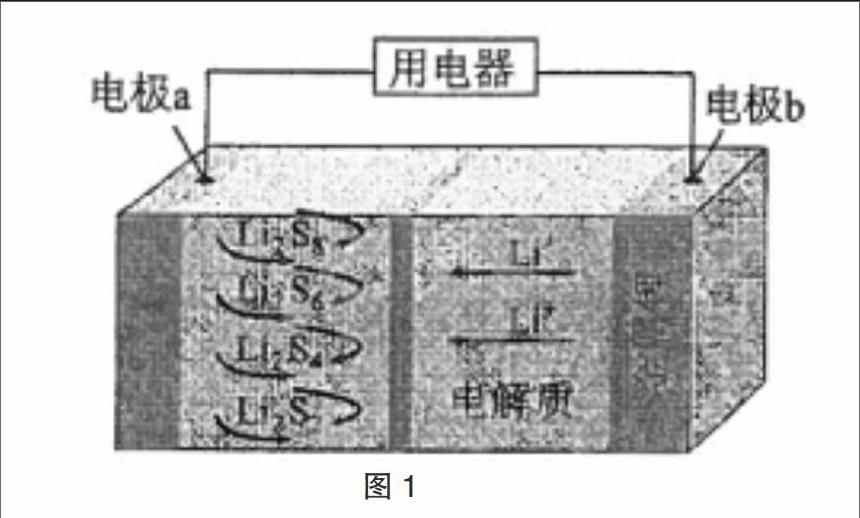


在2017年各地的高考题中,对电化学知识的考查占有很大的比重。电极反应式是电化学知识的核心,所以掌握电极反应式的书写技巧,是解决电化学问题的关键。
一、典型例题分析
【典例】(2017年全国III第11题)全固态锂硫电池能量密度高、成本低,其工作原理如图?譹?訛所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C. 石墨烯的作用主要是提高電极a的导电性
D. 电池充电时间越长,电池中的Li2S2量越多
【解析】该题主要考查原电池的工作原理。原电池工作时,电解质溶液中的阳离子Li+向正极移动,a为正极。由图可知,a极有多种反应,根据放电的多少,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4,故A正确。负极反应式为Li—e-=Li+,外电路中流过0.02 mol电子,0.02 molLi转化为Li+,负极材料减重0.14 g,选项B正确。石墨能导电,利用石墨烯作正极,可提高电极a的导电性,选项C正确。根据总式,电池充电时间越长,转移电子数越多,生成Li和S8越多,电池中的Li2S2量越少,选项D错误。
【答案】D
【解题思路】
1. 判断电池类型。该题考查的是 原电 池的工作原理。
2. 确定电极名称。原电池工作时,电解质溶液中的阳离子Li+向 正 极移动,则a为正极。
3. 找出电极材料及电极反应物。根据原电池的工作原理,原电池工作时,锂作负极,石墨能导电,利用石墨烯作正极,可提高电极a的导电性,选项C正确。
4. 正确选择电极产物。由图可知,a极有多种反应,根据放电的多少,正极产物有Li2S2、Li2S4、Li2S6、Li2S8。负极b的产物为Li+。
5. 写电极反应式。根据电荷守恒和原子守恒,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4,故A正确;负极反应式为Li—e-=Li+,外电路中流过0.02 mol电子,0.02 molLi转化为Li+,负极材料减重0.14 g,选项B正确。根据总式,电池充电时间越长,转移电子数越多,生成Li和S8越多,电池中的Li2S2量越少,选项D错误。
二、判断和书写电极反应式的技巧
1. 判断电池类型。
原电池,无电源,是化学能转化为电能的装置。其中干电池、二次电池放电时、燃料电池、金属发生电化学腐蚀都属于原电池。
电解池,有电源,是电能转化为化学能的装置。充电电池(又称为二次电池)充电时属于电解池。
2. 确定电极名称,判断电解质溶液中阴阳离子的移动方向。
原电池的负极和电解池的阳极,元素的化合价均升高,失去电子,发生氧化反应,电解质溶液中的阴离子向该极移动。
原电池的正极和电解池的阴极,元素的化合价均降低,得到电子,发生还原反应,电解质溶液中的阳离子向该极移动。
3. 找出电极材料及电极反应物。
原电池除燃料电池的负极反应物一般是活泼的金属单质,而燃料电池,一般是可燃物作负极反应物。
电解池的阳极反应物,按照物质的放电顺序:活性电极(金属活动顺序表中Ag以前的金属)>S■>I■>Br■>Cl■>OH■>SO4■>NO3■>F■,选择正确的反应物。
原电池的正极和电解池的阴极,电极一般不参与反应,电极周围的物质参与反应。若是电解质溶液中的离子得到电子参与反应时,原电池的正极一般选择电解质中主要的阳离子作反应物。电解池的阴极需要根据阳离子得到电子的顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+,选择反应物。
4. 正确选择电极产物。
电极产物在电解质的环境中,应能稳定存在。如在酸性介质中,生成的OH-会与H+结合生成H2O,产物是H2O而不是OH-;在碱性介质中,生成的CO2会与OH-结合生成CO32-,产物是CO32-而不是CO2;在碱性介质中,生成的H+会与OH-结合生成H2O,产物是H2O而不是H+;在水溶液中,O2-不能稳定存在。
5. 电极反应式应遵循电荷守恒和原子守恒的原则。
三、2017年高考题及高考模拟题荟萃
1.(2017年全国I第11题)支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图2所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
【解析】该题主要考查电解池原理和金属的防腐蚀原理。钢管桩表面腐蚀电流的理解是难点。钢管柱与电源的负极相连,受保护,通入保护电流抑制钢管桩表面腐蚀,使金属电化学腐蚀产生的电流接近零,A正确;通电后,被保护的钢管柱作阴极,高硅铸铁作阳极,因此电路电子被强制从高硅铸铁流向钢管柱,B正确;根据题干的信息,高硅铸铁为惰性辅助阳极,性质不活泼,所以高硅铸铁不损耗,C错误;通过外加电流抑制金属电化学腐蚀产生的电流,因此通入的保护电流应该根据环境条件变化调整。
【答案】C
2.(2017年全国II第11题)用电解氧化法可以在铝制品表面形成致密、耐腐蚀氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是endprint
A. 待加工铝质工件为阳极
B. 可选用不锈钢网作为阴极
C. 阴极的电极反应式为:Al3++3e-=Al
D. 硫酸根离子在电解过程中向阳极移动
【解析】该题考查的是电解池的工作原理,电解质溶液中的阴离子硫酸根离子和草酸根离子在电解过程中向阳极移动,阳离子氢离子向阴极移动,选项D正确。根据电解池的工作原理,铝要形成氧化膜,铝元素化合价升高,失去电子,因此铝为阳极,选项A正确。不锈钢网接触面积大,能增加电解效率,作阴极,所以选项B正确。电极产物在电解质的环境中,应能稳定存在。选项C中,产物Al能与电解质溶液中的H+反应,不能稳定存在,所以C不正确。根据阳离子得电子能力的顺序,阴极电极反应式为2H++2e-=H2↑。
【答案】C
3.(2017年海南高考第10题)一种电化学制备NH3的装置如图3所示,图中陶瓷在高温时可以传输H+.下列叙述错误的是( )
A. Pb电极b为阴极
B. 阴极的反应式为:N2+6H++6e﹣=2NH3
C. H+由阳极向阴极迁移
D. 陶瓷可以隔离N2和H2
【解析】该电池为电解池,主要考查电解池电极反应式的书写。由电化学制备NH3的装置可知,通入氮气的一端为阴极,通入氢气的一端为阳极,电解反应N2+3H2■2NH3,电解池中阳离子向阴极移动,Pb电极b上氢气失去电子,为阳极,故A错误;阴极上发生还原反应,则阴极反应为N2+6H++6e﹣=2NH3,故B正确;电解池中,H+由阳极向阴极迁移,故C正确;由图可知,氮气与氢气不直接接触,陶瓷可以隔离N2和H2,故D正确。
【答案】A
4.(广西2017届5月份考前模拟)在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2。其原理如图4所示。不正确的是( )
A. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B. 电源B极为负极
C. 与电源A极相连的惰性电极上发生的反应为
CH3COOH- 8e- + 2H2O=2CO2↑+8H+
D. 通电后,若有0 .1molH2生成,则转移0.2mol 电子
【解析】A. 在阴极上氢离子得电子生成氢气,但是阳离子氢离子会经过交换膜进入阴极室,阴极室的pH几乎保持不变,A错误;B. 右侧产生氢气,说明是阴极,右侧B电极是电源的负极,B正确;C. 在阳极上CH3COOH失电子生成二氧化碳,电极反应式为CH3COOH-8e- + 2H2O=2CO2↑+8H+,C正确;D. 在阴极上氢离子得电子生成氢气,即2H++2e-=H2↑,因此若有0.1molH2生成,则转移0.2mol电子,D正确。
【答案】A
5.(南昌市2017届第三次模拟)Al—Ag2O电池可用作水下动力电源,其原理如图5所示。电池工作时,下列说法错误的是
A. 电子由Al电极通过外电路流向Ag2O/Ag电极
B. 电池负极附近溶液pH升高
C. 正极反应式为Ag2O+2e- + H2O=2Ag+2OH-
D. 負极会发生副反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】A. 铝为负极,被氧化,Ag2O/Ag为正极,原电池工作时,电子由Al电极通过外电路流向Ag2O/Ag电极,故A正确;B.负极发生氧化反应:Al-3e- + 4OH-=AlO2- + 2H2O,则pH减小,故B错误;C. 正极发生还原反应,电极反应式为:Ag2O+2e- + H2O=2Ag+2OH-,故C正确;D.由于电解质呈碱性,铝可与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故D正确。
【答案】B
6.(2017天津第7题Ⅱ(4))某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图6),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答问题。
含铬元素溶液的分离和利用:用惰性电极电解时,■能从浆液中分离出来的原因是_______,分离后含铬元素的粒子是______;阴极室生成的物质为________(写化学式)。
【解析】该电池为电解池。用惰性电极电解混合物浆液时,Na+移向阴极,CrO42-通过阴离子交换膜移向阳极,脱离浆液。阳极发生的电极反应式为:2H2O+4e-=O2↑+4H+,H+与CrO42-发生反应:2H++2CrO42-≒Cr2O72- +H2O,所以分离后含铬元素的粒子是CrO42-和Cr2O72- 。阴极发生的电极反应为:2H2O-2e-=2OH- +H2↑,阴极室生成的物质为NaOH和H2。
【答案】在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液;CrO42-和Cr2O72- ; NaOH和H2。
7.(2017年北京第28题(2)③)某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下:向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。实验Ⅱ可证实假设d成立(笔者添加:溶液中存在Ag+,可产生Fe3+)。实验Ⅱ:装置如图7所示。其中甲溶液是________,操作及现象是________________。
【解析】原电池实验需要证明假设d成立:Fe2++Ag+=Fe3++Ag,所以甲溶液应该注入 FeCl2溶液(或FeSO4溶液)。
【答案】0.05 mol·L-1 NaNO3溶液 、 FeCl2溶液(或FeSO4溶液);按图连接好装置,电流表指针发生偏转,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深。
8.(2017年江苏第16题(4))“电解Ⅱ”是电解Na2CO3溶液,原理如图8所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
【解析】由图中的信息可知,生成氧气的为阳极室,溶液中水电离的OH-放电生成了氧气,破坏了水的电离平衡,产生的H+与CO32-结合转化为HCO3-,阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑ 。阴极室氢氧化钠溶液的浓度增大,说明阴极发生了反应:2H2O-2e-=2OH-+H2↑。
【答案】(4)4CO32-+2H2O-4e-=4HCO3-+O2↑ H2
责任编辑 李平安endprint

