紫茎泽兰对杉木种子萌发及幼苗生长的化感作用
, , , (.西南林业大学, 云南 昆明 65022;2.云南玉溪森林生态系统国家定位观测研究站, 云南 新平 65300;3.北京林业大学, 北京 00083;.海南省海口市秀英区秀英街道“双创”工作指挥部, 海口 5703)
紫茎泽兰对杉木种子萌发及幼苗生长的化感作用
曹子林1,2,3,王乙媛4,王晓丽1,杨桂英1
(1.西南林业大学, 云南 昆明 650224;2.云南玉溪森林生态系统国家定位观测研究站, 云南 新平 653400;3.北京林业大学, 北京 100083;4.海南省海口市秀英区秀英街道“双创”工作指挥部, 海口 570311)
为探讨紫茎泽兰地上部分气态挥发物对杉木种子发芽的化感作用,在半透明密闭保鲜盒内分别用25,75,225 g紫茎泽兰新鲜茎叶对杉木种子进行处理。结果表明,不同质量处理对杉木种子发芽过程有明显的影响,随着处理质量的增加,首日发芽数量下降,达到发芽高峰的天数延迟,发芽高峰当天发芽数降低,发芽过程曲线图由对照的急升急降逐渐变缓。不同质量处理对杉木种子萌发(发芽势、发芽率、发芽速率、萌发指数)及幼苗生长(胚根长、胚轴长、鲜重、干重)均有显著的影响。25 g处理时对种子萌发及幼苗生长抑制作用较弱,随着处理质量的增加,抑制作用增强。杉木种子萌发及幼苗生长与处理质量之间呈极显著或显著的负相关,这些指标随着处理质量的增加呈直线下降。紫茎泽兰在林下及林缘的广泛分布,可通过化感作用影响杉木的天然更新和生长。
紫茎泽兰; 杉木; 种子萌发; 幼苗生长; 化感作用
seedling growth; allelopathy
紫茎泽兰(Eupatoriumadenophorum)为菊科泽兰属的一种多年生草本植物。紫茎泽兰通过自然扩散途径,于20世纪40年代,从中缅边境传入我国云南省,后随西南风迅速向东和向北蔓延扩散。目前,已在云南、贵州、四川、广西、西藏、台湾等省(区)广泛分布,发生总面积达3 800多万hm2[1-3]。紫茎泽兰具有很强的繁殖能力,常形成庞大的群体,排斥其他植物的生长,剥夺其他物种的生存空间[4-5]。因此,紫茎泽兰的入侵破坏了生态平衡,降低了生物多样性,并对当地农、林、牧业生产造成严重危害,是我国面临的重大生态灾害物种之一[6-7]。杉木(CunninghamiaLanceolata)为杉科杉木属,其生长快、单产高、用途广,是我国南方优良的用材树种,在林业生产中具有十分重要的地位。杉木在我国浙江、福建沿海山地及台湾山区、云南东部、四川盆地西缘及安宁河流域、广东中部和广西中南部、秦岭南麓、桐柏山、大别山等地均有较广的分布;在这个范围内有大面积的杉木人工纯林,也有与马尾松、毛竹及其它阔叶树种组成的混交林[8]。从分布区看,杉木与紫茎泽兰有较大的重叠,如云南、贵州、四川、广西、台湾等省(区)。在这些省份,紫茎泽兰分布较广,并已经侵入到杉木、马尾松等林下[9]。据研究,紫茎泽兰有很强的化感作用[10-11],而且其水浸提液对杉木种子萌发会产生较大的影响[9]。然而,紫茎泽兰具有萜类挥发性成分[12-13],其是否会影响杉木天然更新过程仍未知。为此,本研究拟以紫茎泽兰新鲜植株地上部分为材料,在密闭空间内研究不同质量处理对杉木种子萌发及幼苗生长的影响,为了解紫茎泽兰对杉木天然更新过程的影响提供理论依据。
1 材料与方法
1.1 材 料
2013年3月,在云南省林木种苗站购买实验用的杉木种子。紫茎泽兰植株地上部分采集于昆明植物园杉木林带下,所采植株高度50~60 cm,且无病虫害。实验用的样品长度约25 cm,除剪口外不破坏其他组织,将其清洗后,放在高温灭菌后的报纸上晾干备用。
1.2 研究方法
1.2.1 紫茎泽兰对杉木种子萌发及幼苗生长化感作用的测定
试验前2天,在光照培养箱内喷0.15%的福尔马林溶液进行消毒。杉木种子用始温45 ℃的水浸泡24 h,然后用0.15%的福尔马林溶液浸泡20 min,把溶液倒掉,在带盖的容器中闷30 min后,将种子用蒸馏水冲洗3次[14]。参照文献[14]的方法,称取新鲜茎叶225,75,25 g分别放入一个半透明密闭保鲜盒(长27 cm、宽12 cm、高12 cm)的底部,对照保鲜盒的底部为空白,放上透气隔板后,将4个不加盖并在底部铺有2层定性滤纸的培养皿(9 cm)放在隔板上,用3 mL蒸馏水润湿滤纸后,每皿放50粒杉木种子,再扣上保鲜盒盖子。将保鲜盒放入光照培养箱中进行生物测定,培养温度为25 ℃,空气相对湿度75%左右,光照强度约1 225 lx,每天光照8 h,每天定时观察种子萌发状况,并通气约20 min,添加等量蒸馏水[14],每4 d更换1次新鲜茎叶。每天记录培养皿中总的发芽数,第5天计算发芽势,第16天统计发芽率[15],并计算发芽速率及萌发指数[11,16]。第16天测量每个培养皿中幼苗的胚根长和胚轴长,称鲜重后置于85 ℃烘干箱烘至恒重再称干重。
1.2.2 数据统计分析
采用SPSS 13.0处理软件对不同质量处理后的杉木种子发芽率、发芽势、发芽速率、萌发指数以及幼苗鲜重、干重、胚根长、胚轴长进行方差分析和多重比较[17]。采用化感效应指数(RI)进行评价,当T
表1 不同质量紫茎泽兰处理对杉木种子萌发的化感作用

处理(g) 发芽率 发芽势 发芽速率 萌发指数 实测值(%)RI值实测值(%)RI值实测值RI值实测值RI值071.5±3.3a45.5±2.6a7.72±0.27a86.0±5.1a2561.0±5.5ab-0.14727.5±5.0b-0.396∗5.86±0.81b-0.240∗50.0±13.8b-0.419∗7555.0±6.6bc-0.231∗24.5±2.9b-0.462∗5.38±0.77b-0.302∗49.0±7.9b-0.446∗22544.0±2.9c-0.385∗7.5±1.5c-0.835∗3.19±0.24c-0.586∗12.0±1.8c-0.861∗
注:表中同列不同小写字母表示在5%水平上差异显著;“*”表示经t检验不同处理与对照间分别在5%水平上差异显著。下同。
2 结果与分析
2.1 不同质量紫茎泽兰处理对杉木种子萌发及其过程的影响
2.1.1 不同质量紫茎泽兰处理对杉木种子萌发过程的影响
从图1可以看出,对照及各质量处理第2天就已经开始发芽,但不同处理杉木种子发芽过程不同。对照第2天、第3天发芽数分别为2.5、2.8粒,随后每天发芽数快速上升,至第5天达到发芽高峰为10.3粒;随后每天发芽数快速下降,至第10天发芽数下降为0,呈现出急升急降的趋势。此后,每天发芽数在1.3粒上下波动甚至不发芽。25 g处理第2天、第3天发芽数分别为1.3、1.5粒,往后每天发芽数较快增加,至第6天达到发芽高峰为7.3粒,随后每天发芽数较快下降,第10天时已降至0.8粒/d,急升急降的趋势较对照缓和。此后,每天发芽数在1.0粒上下波动甚至不发芽。75 g处理第2天发芽数为1.3粒,第3天开始缓慢上升,至第7天发芽数达到最大为5.5粒,此后每天发芽数缓慢下降,第11天下降至0,急升急降的趋势较25 g处理缓和。此后,每天发芽数少甚至没发芽。225 g处理第2天发芽数为0.5粒,第3天没有发芽,第4天开始发芽数缓慢增加,至第7天达到一个小的高峰,为5.0粒/d,此后发芽数缓慢下降,第11天发芽数下降至1.0粒/d,急升急降的趋势进一步变缓。随后每天发芽数都在1.3粒上下波动。
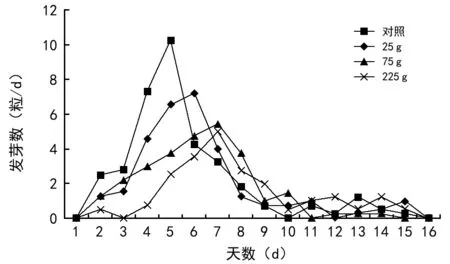
图1 不同质量紫茎泽兰处理后杉木种子逐日发芽情况
2.1.2 不同质量紫茎泽兰处理对杉木种子萌发的影响
由表1分析可知,对照的发芽率、发芽势、发芽速率和萌发指数分别为71.5%、45.5%、7.72和86.0。25 g紫茎泽兰新鲜茎叶处理杉木种子后,发芽率、发芽势、发芽速率和萌发指数分别为61.0%、27.5%、5.86和50.0,与对照相比,分别降低了14.7%、39.6%、24.1%和41.9%,表现为明显的抑制作用。75 g处理后,发芽率、发芽势、发芽速率和萌发指数分别为55%、24.5%、5.38和49.0,与对照相比,分别降低了23.1%、46.2%、30.3%和43.0%,与25 g处理相比抑制作用增强。225 g处理后,发芽率、发芽势、发芽速率和萌发指数分别为44.0%、7.5%、3.19和12.0,与对照相比,分别降低了38.5%、83.5%、58.6%和86.0%,与75 g处理相比抑制作用进一步增强。呈现出抑制作用随处理质量增加而增强的规律。RI值都为负值,其绝对值随处理质量增加而变大,说明抑制作用在增强。经方差分析表明:处理质量对这4个指标都有显著影响。多重比较结果显示:对发芽率、发芽速率及萌发指数而言,除25 g与75 g处理之间差异不显著外,其余不同质量处理之间均有显著差异。对发芽率来讲,225,75 g处理与对照之间、225 g与25 g处理之间均有显著差异,其余不同处理之间则都没有显著差异。
2.2 不同质量紫茎泽兰处理对杉木幼苗生长的影响
由表2分析可知,对照的鲜重、干重、胚根长和胚轴长分别为1.02 g、0.11 g、4.24 cm和0.86 cm。25 g紫茎泽兰新鲜茎叶处理杉木幼苗后,鲜重、干重、胚根长和胚轴长分别为0.79 g、0.07 g、3.95 cm和0.82 cm,与对照相比,分别降低了23.2%、38.1%、6.8%和3.8%,表现为明显的抑制作用。75 g处理后,鲜重、干重、胚根长和胚轴长分别为0.68 g、0.06 g、3.44 cm和0.73 cm,与对照相比,分别降低了33.3%、45.2%、19.0%和15.1%,与25 g处理相比抑制作用增大。225 g处理后,鲜重、干重、胚根长和胚轴长分别为0.33 g、0.05 g、2.03 cm和0.51 cm,与对照相比,分别降低了68.2%、52.4%、52.2%和40.6%,与75 g处理相比抑制作用进一步增强。呈现出抑制作用随处理质量增加而增强的规律。RI值都为负值,其绝对值随处理质量增加而变大,说明抑制作用在增强。经方差分析表明:处理质量对这4个指标都有显著影响。多重比较结果显示:对鲜重来讲,除25 g与75 g处理之间差异不显著外,其他不同质量处理之间均有显著差异。对干重而言,25,75,225 g与对照之间均有显著差异,其余不同质量处理之间差异均不显著。对胚根长、胚轴长来讲,225 g处理与25,75 g、对照之间差异都达到显著水平,但其他不同处理之间差异未达到显著水平。
表2 不同质量紫茎泽兰处理对杉木幼苗生长的化感作用

处理(g) 鲜重 干重 胚根长 胚轴长 实测值(g)RI值实测值(g)RI值实测值(cm)RI值实测值(cm)RI值01.02±0.05a0.11±0.01a4.24±0.33a0.86±0.08a250.79±0.12b-0.232∗0.07±0.01b-0.381∗3.95±0.46a-0.0700.82±0.09a-0.049750.68±0.09b-0.332∗0.06±0.01b-0.452∗3.44±0.10a-0.190∗0.73±0.03a-0.1542250.33±0.02c-0.682∗0.05±0.01b-0.524∗2.03±0.20b-0.521∗0.51±0.06b-0.410∗
2.3 杉木种子萌发对处理质量的响应
由表3分析可知,发芽率、发芽势、发芽速率和萌发指数与处理质量之间均呈极显著负相关关系(p<0.01)。说明随着紫茎泽兰处理质量的增加,发芽率、发芽势、发芽速率和萌发指数呈线性下降。
表3 杉木种子萌发与处理质量的回归分析

种子萌发指标 回归方程相关系数(r)显著水准(p)发芽率(%)y=-0.107x+66.5670.7190.002发芽势(%)y=-0.1417x+37.7670.8470.000发芽速率y=-0.0174x+6.95230.7990.000萌发指数y=-0.2751x+71.60.8020.000
2.4 杉木幼苗生长对处理质量的响应
由表4分析可知,鲜重、胚根长和胚轴长与处理质量之间均呈极显著负相关关系(p<0.01),干重与处理质量之间呈显著负相关关系(p<0.05)。说明随着紫茎泽兰处理质量的增加,鲜重、干重、胚根长和胚轴长呈线性下降。
表4 杉木幼苗生长与处理质量的回归分析

幼苗生长指标 回归方程相关系数(r)显著水准(p)鲜重(g)y=-0.0028x+0.92980.8930.000干重(g)y=-0.0002x+0.08370.5630.020胚根长(cm)y=-0.0097x+4.20620.8510.000胚轴长(cm)y=-0.0016x+0.85430.7610.001
3 结论与讨论
据研究紫茎泽兰挥发性成分中有许多萜类成分,Fischer等认为,萜类的毒性表现为对植物发芽和生长的抑制[12-13,19]。通常紫茎泽兰茎叶质量越大,在单位空间内释放的气态挥发物量越大,将使单位体积内气态挥发物浓度越高[14]。因此,随着处理质量的增加,单位体积内气态挥发物浓度越高,杉木种子首日发芽数减少,达到发芽高峰的天数延迟,达到发芽高峰当天的发芽数下降,发芽数开始明显下降的天数推迟,过程曲线图由急升急降逐渐变缓。这与紫茎泽兰气态挥发物对云南松种子萌发过程影响的规律基本一致[14]。不同质量紫茎泽兰处理对杉木种子萌发表现为化感抑制效应,且较低质量抑制作用较小,随质量升高,抑制作用增强。这可能是高质量时鲜茎叶产生的挥发性萜类等化感物质较多、浓度较大,影响了种子发芽时ATP的产生和呼吸作用[20],抑制种子内贮藏淀粉和蛋白质的分解,从而影响种子萌发所需要的物质和能量,致使种子萌发受抑制[21],进而显示了强的化感抑制作用,随质量降低这种作用在减弱。另外,萜类等化感物质会抑制植物胚根、胚轴的生长[16]。由于发芽速率较慢,培养皿中萌发的幼苗光合持续的时间较短,将影响其光合产物的积累;而且发芽率低、培养皿中幼苗少直接影响每个重复的幼苗鲜重及干重。由于具有浓度效应,故种子萌发及幼苗生长指标随着处理质量的增加而下降。
种子萌发是植物生活史中的关键阶段,其对物种天然更新十分重要[11,22]。发芽率降低会使植物在群落中的多度下降。发芽速率下降、发芽时间变长及出苗延后,将影响植物对地上、地下资源空间的利用和竞争[23-25]。幼苗胚根生长受抑制将导致其根系变短,吸收水肥空间范围变小,而胚轴生长受抑制导致植株矮小,影响其对光的利用和竞争,这些均会直接影响未来植株的生长发育及其在群落中的地位和作用[11]。在天然更新过程中,杉木种子落到林地表面及林外土壤表面,林下及林外紫茎泽兰往往形成优势种群。据研究杉木种子萌发及幼苗生长对紫茎泽兰浸提液较为敏感[9]。因此,一方面,紫茎泽兰的降水淋洗液会对杉木种子萌发产生影响。另一方面,其种子萌发及幼苗生长还受到气态挥发物化感作用的影响,如研究所示,随着处理质量的增加而下降。而且,许多挥发性化感物质在雨雾条件下,可以通过淋溶途径进入土壤。尽管萜类化合物在水中的溶解度很低,但萜类在水中的溶解性,已远远在它们能够显示生物活性的浓度之上[26-27]。这可能也是本研究中仅用25 g处理就能起抑制作用的原因。当土壤中挥发性化感物质积累到一定量后,将抑制植物种子萌发[28]。在杉木林下及林外大量生长的紫茎泽兰,其化感作用是影响杉木天然更新和生长的重要因素。
[1]万方浩,刘万学,郭建英.外来植物紫茎泽兰的入侵机理与控制策略研究进展[J].中国科学:生命科学,2011(1):13-21.
[2]Qu Y,Xiao Z Q,Zhou G Q,et al.Mapping the distribution of Crofton weed(EupatoriumadenophorumSpreng) in southwest of China using time series remote sensing data[D].Geoscience Remote Sensing IEEE International Symposium,2011:660-663.
[3]赵国晶,马云萍.云南省紫茎泽兰的分布与危害的调查研究[J].杂草学报,1989,3(2):37-40.
[4]刘伦辉,刘文耀,郑征,等.紫茎泽兰个体生物及生态学特性研究[J].生态学报,1989,9(1):66-70.
[5]冯玉元.变害为宝的紫茎泽兰[J].中国林业,2004(9):37.
[6]丁晖,徐海根,刘志磊.外来入侵植物紫茎泽兰对植物多样性的影响[J].生态与农村环境学报,2007,23(2):29-32.
[7]李振宇,谢焱.中国外来入侵种[M].北京:中国林业出版社,2002:163.
[8]俞新妥.杉木[M].福州:福建科学技术出版社,1983:1-2.
[9]孙运刚,刘济明,蒙剑,等.紫茎泽兰化感作用对6种贵州本地植物种子萌发的影响[J].贵州农业科学,2010,38(3):162-165.
[10]曹子林,王晓丽,涂璟.紫茎泽兰不同处理方法水提液对云南松种子萌发的化感作用[J].种子,2011,30(8):46-49,54.
[11]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2 782-2 787.
[12]田宇,侯婧,吴建平,等.紫茎泽兰挥发性成分及抑菌活性研究[J].农药学学报,2007,9(2):137-142.
[13]杨铁耀,杨海恩,葛发欢.紫茎泽兰挥发性成分分析[J].中药材,1999,22(8):407.
[14]曹子林,王晓丽,杨桂英.紫茎泽兰气态挥发物对云南松种子萌发及幼苗生长的化感作用[J].江西农业大学学报,2012,34(1):77-81.
[15]孙时轩.林木种苗手册[M].北京:中国林业出版社,1985:140-142.
[16]赵福庚,何龙飞,罗庆云.植物逆境生理生态学[M].北京:化学工业出版社,2004:13-14.
[17]Linder F,Laura H,Edward N,et al.SPSS for Windows version 13.0:A basic tutorial[M].California: McGraw-Hill custom publishing house,2007:46-55.
[18]Willianmson GB.Bioassay for allelopathy:measuring treatment response with independent controls[J].Journal chemical ecology,1998,14(1):181-187.
[19]Fischer N H,Williamson G B,Weidenhamer J D,et al.In search of allelopathy in the Florida scrub:The role of terpenoids[J].Journal of Chemical Ecology,1994,20(6):135-138.
[20]朱宇林,谭萍,陆绍锋,等.桉树化感效应下si对植物种子萌发的影响[J].种子,2010,29(8):19-22.
[21]熊勇,马卜功,杨青松,等.紫茎泽兰不同组织水提取液对水稻·玉米化感作用机制[J].安徽农业科学,2011,39(14):8 222-8 225,8 249.
[22]蒋高明.植物生理生态学[M].北京:高等教育出版社,2004:136.
[23]Ross MA,Harper JL.Occupation of biological space during seedling establishment[J].Journal of Ecology,1972,60:77-88.
[24]Fowler N.The role of competition in plant communities in arid and semi-arid regions[J].Annual Review of Ecological Systematics,1986,17:89-110.
[25]Weiner J,Wright DB,Castro S.Symmetry of below-ground competition between Kochia scoparia individuals[J].Oikos,1997,79:85-91.
[26]谢志军,厚毅清,王炜,等.萜类化合物的化感功能及其开发应用前景[J].中国农学通报,2010,26(24):233-237.
[27]Weidenhanler J D,Macias F A,Fischer N H,et al.Just how insoluble are monoterpenes[J].Journal of Chemistry Ecology.1993,19(8):1 799-1 807.
[28]Ross M A,Harper J L.Occupation of biological space during seedling establishment[J].Journal of Ecology,1972,60:77-88.
Allelopathic Effect ofEupatoriumadenophorumon Seed Germination and Seedling Growth ofCunninghamiaLanceolata
CAOZilin1,2,3,WANGYiyuan4,WANGXiaoli1,YANGGuiying1
(1.Southwest Forestry University,Kunming Yunnan 650224;2.National Station for Forest Ecosystem in Yuxi,Yunnan Province,Xinping Yunnan 653400,China;3.Beijing Forestry University,Beijing 100083,China;4.The Headquarters of “shuang chuang” Xiuying Street Agency of Xiuying District Of Haikou,Hainan Province,Haikou 570311,China)
To discuss the allelopathy of aboveground volatiles ofEupatoriumadenophorumon seed germination and seedling growth ofCunninghamialanceolata,C.Lanceolataseeds were treated by fresh stem and leave ofE.adenophorumof different quality (0,25,75,225 g) in translucent airtight boxes.The results showed that different quality treament had a significant influence on seed germination process ofC.Lanceolata,germination number in the day when seeds started to germination,germination number in the day of germination pinnacle,were all descended with the increasement of treament quality,the day when germination pinnacle came were delayed with treament quality increasement,so germination process curves became gently with the treament quality increasement.Moreover,different quality treament had a significant influence on seed germination (seed germination potential,seed germination rate,seed germination speed,germination index) and seedling growth (radicle length,hypocotyl length,fresh weight,dry weight) ofC.Lanceolata,showing a rule that a weaker inhibition on seed germination and seedling growth with the treament of 25 g,but the negative effect became stronger with treament quality increasement.The seed germination and seedling growth were very significantly or significantly negatively correlated with the treament quality,the index were decrease in a line with increasement of treament quality.E.adenophorumwere widely distributed in the ground and at the periphery ofC.Lanceolataforest,and may influence natural regeneration and growth ofC.Lanceolatabyallelopathy.
Eupatoriumadenophorum;CunninghamiaLanceolata; seed germination;
2017-01-20
云南省高校优势特色重点学科(生态学)建设项目资助。
曹子林(1974—),男,福建漳平人;北京林业大学博士生,副教授,硕士生导师,主要从事生态学方面的教学与研究工作;E-mail:fjcaozilin@qq.com。
10.16590/j.cnki.1001-4705.2017.07.032
S 791.27
A
1001-4705(2017)07-0032-05

