过敏性紫癜患儿尿液脂氧素A4、NF-κB的变化及其临床意义
应倩倩 沈梦娇 李蕴言 吴菱 狄亚珍 王佳佩 傅诗薇
过敏性紫癜患儿尿液脂氧素A4、NF-κB的变化及其临床意义
应倩倩 沈梦娇 李蕴言 吴菱 狄亚珍 王佳佩 傅诗薇
目的探讨脂氧素A4(LXA4)、NF-κB在过敏性紫癜(HSP)患儿尿液中的变化及在HSP发病机制中的作用。方法选取50例HSP患儿为病例组,其中紫癜性肾炎(HSPN)患儿20例;同期25例腹股沟疝术前患儿为对照组。留取晨尿,采用ELISA法检测尿液LXA4、NF-κB水平,比较病例组急性期、恢复早期与对照组LXA4、NF-κB水平,并比较HSPN患儿与非HSPN患儿急性期LXA4、NF-κB水平,分析病例组急性期LXA4和NF-κB的相关性。同时收集各组临床资料及病例组24h尿蛋白定量等实验室检查结果,分析HSPN患儿急性期LXA4、NF-κB水平与24h尿蛋白定量的相关性。结果 病例组急性期、恢复早期尿液LXA4水平均显著高于对照组(均P<0.01),且急性期显著低于恢复早期(P<0.01);病例组急性期、恢复早期尿液NF-κB水平亦均显著高于对照组(均P<0.05),且急性期显著高于恢复早期(P<0.01)。HSPN患儿急性期尿液LXA4水平显著低于非HSPN患儿,NF-κB水平显著高于非HSPN患儿,差异均有统计学意义(均P<0.05)。病例组急性期尿液LXA4水平与NF-κB水平呈负相关(r=0.347,P<0.05)。HSPN患儿急性期24h尿蛋白定量与LXA4水平呈负相关(r=0.562,P<0.05),与NF-κB无相关性(r=0.370,P>0.05)。 结论NF-κB可能参与HSP发病,并与病情严重程度相关,而LXA4可能为肾脏保护因子,且可能通过抑制NF-κB发挥抗炎作用。
过敏性紫癜 儿童 脂氧素A4NF-κB 24h尿蛋白
1 对象和方法
1.1 对象 选取2016年5至11月初次在宁波市妇女儿童医院住院的HSP患儿50例为病例组,均符合2006年欧洲风湿病防治委员会、欧洲儿童肾脏病防治委员会及美国风湿协会共同制定的诊断标准[10],男29例,女21例;年龄 2.5~15(7.0±3.0)岁。其中 20 例为 HPSN,男 9例,女 11 例,年龄 2.5~13(6.8±2.8)岁,均符合 2009 年中华医学会儿科学分会肾脏病学组制定的《紫癜性肾炎诊治循证指南(试行)》中的诊断标准[11]。患儿均为首次发病,1周内未用过抗组胺药物、肾上腺皮质激素及免疫抑制剂治疗,既往无过敏性疾病史,也无自身免疫性疾病史。选取同期宁波市妇女儿童医院外科住院的腹股沟疝术前患儿25例为正常对照组,男14例,女11例;年龄3~11(6.4±2.0)岁。病例组与对照组患儿性别和年龄比较差异均无统计学意义(均P>0.05)。本研究获得医院伦理委员会批准和患儿监护人知情同意。
1.2 方法
1.2.1 样本收集 病例组分别于急性期、恢复早期,对照组于体检当日留取晨尿8ml,以3 000r/min离心20min,分离上清液置-80℃冰箱冻存待检。患儿起病2周内为急性期,以非血小板减少性紫癜、关节炎、关节肿痛、腹痛或胃肠道出血为主要临床表现,治疗后,上述症状消失3d为恢复早期[12-13]。
1.2.2 尿液LXA4、NF-κB测定 采用ELISA法检测各样本LXA4、NF-κB水平,所有操作均按照试剂盒说明书严格执行。比较病例组急性期、恢复早期与对照组LXA4、NF-κB水平,并比较HSPN患儿与非HSPN患儿急性期LXA4、NF-κB水平,分析病例组急性期LXA4和NF-κB的相关性。
1.2.3 收集及整理临床资料 收集并整理病例组与对照组性别、年龄、现病史、既往史等临床资料及病例组24h尿蛋白定量等实验室检查结果,分析HSPN患儿急性期LXA4、NF-κB水平与24h尿蛋白定量的相关性。
1.3 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两组比较采用两独立样本t检验;计数资料组间比较采用χ2检验;两变量间相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿尿液LXA4、NF-κB水平比较 病例组急性期、恢复早期尿液LXA4水平均显著高于对照组(均P<0.01),且急性期显著低于恢复早期(P<0.01);病例组急性期、恢复早期尿液NF-κB水平亦均显著高于对照组(均P<0.05),且急性期显著高于恢复早期(P<0.01),见表 1。
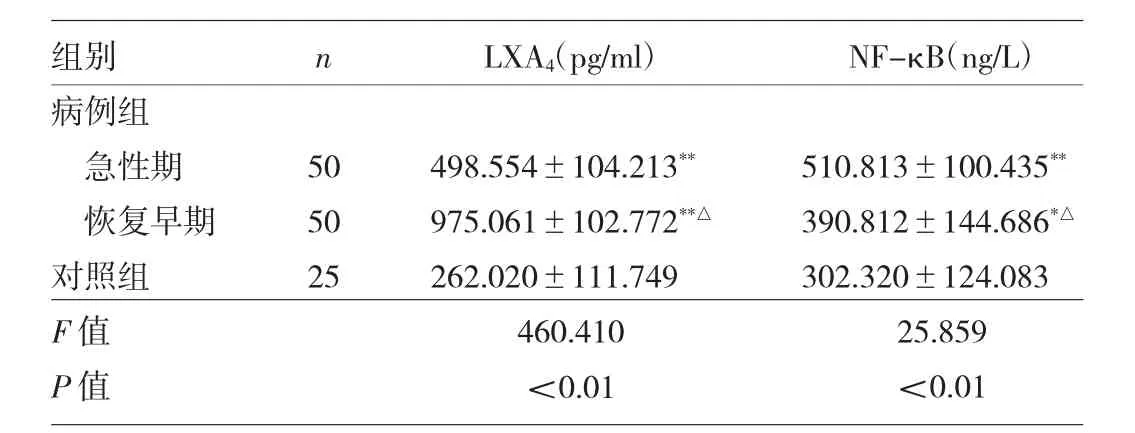
表1 两组患儿尿液LXA4、NF-κB水平比较
2.2 HSPN患儿与非HSPN患儿急性期尿液中LXA4、NF-κB水平比较 HSPN患儿急性期尿液LXA4水平显著低于非HSPN患儿,NF-κB水平显著高于非HSPN患儿,差异均有统计学意义(均P<0.05),见表2。
2.3 尿液LXA4、NF-κB与24h尿蛋白定量的相关性分析 病例组急性期尿液LXA4水平与NF-κB水平呈负相关(r=0.347,P<0.05)。HSPN患儿急性期24h尿蛋白量为 0.02~0.86(0.318±0.294)g/24h,LXA4水平为293.851~608.039(446.453±98.260)pg/ml,NF-κB 水平为 317.740~743.973(547.097±99.692)ng/L,HSPN 患儿急性期 24h尿蛋白定量与LXA4水平呈负相关(r=0.562,P<0.05),与 NF-κB 无相关性(r=0.370,P>0.05)。

表2 HSPN患儿与非HSPN患儿急性期尿液中LXA4、NF-κB 水平比较
3 讨论
HSP是以小血管为主要病变的系统性血管炎,具有发病率高、病程长、反复发作的特点。然其发病机制不明,目前研究认为的发病模式是各种刺激因子,包括感染原和过敏原作用于具有遗传背景的个体,激发辅助性T淋巴细胞及B淋巴细胞扩增并增强其活性,产生大量以免疫球蛋白A为主的免疫复合物,沉积在全身小血管壁而致血管炎性免疫反应。
LXs产生于机体发生炎症、过敏和血管病变时,是一类重要的内源性抗炎介质。LXA4是家族中的一员,有明确抗炎、促进炎症消退的作用,可通过不同方式调控多种炎症信号通路发挥抗炎活性,其中包括NF-κB信号通路[14]。NF-κB为p50/p65形成的异源二聚体,当细胞未受到外界刺激时,NF-κB/p65与其抑制蛋白IκB结合,以未活化的状态存在胞质中;而当受到刺激后,NF-κB/p65与IκB解离,随即NF-κB/p65被激活而进入胞核,调控TNF-α、IL-8等细胞因子相应基因的转录并促进细胞因子释放,导致炎症级联反应的发生,而这些因子增多又可以激活NF-κB,进一步加重细胞损伤。NF-κB信号通路与免疫密切相关,既参与机体防御病原体的入侵,又是炎症反应的启动闸门,其异常激活在多种自身免疫性疾病如炎症性肠病、川崎病发病中起重要作用[15-16]。既往研究表明LXA4与肾脏疾病相关,在肾脏纤维化、肾脏缺陷-再灌注损伤及多种肾脏炎性疾病中均有肾保护作用[17]。动物实验表明LXA4在急性肾损伤中起保护作用的部分机制是通过抑制NF-κB的激活,从而降低炎性因子表达及炎性细胞浸润[18]。
郎艳美[19]报道HSP患儿急性期血清中LXA4水平增高,恢复期进一步增高,且HSPN患儿水平低于仅有皮肤紫癜的HSP患儿,提示LXA4有抗炎作用,并具有保护肾脏作用。Wu等[6]研究表明在HSP患儿急性期尿液中也能检测到LXA4的升高。华冉等[20]研究发现HSP患儿急性期血清中NF-κB水平升高,恢复期下降,表明NF-κB参与HSP的发病。本研究发现HSP患儿急性期尿液中LXA4显著高于对照组,经治疗后,患儿恢复早期的尿液中LXA4水平进一步升高,与文献报道一致[21],推测LXA4可能通过合成增多来促进炎症消退。HSP患儿急性期及恢复早期NF-κB水平均显著高于对照组,恢复早期显著低于急性期,提示NF-κB参与HSP发病,随着病情好转而下降。HSPN患儿尿液LXA4水平显著低于非HSPN患儿,NF-κB水平显著高于非HSPN患儿,且HSPN患儿24h尿蛋白定量与尿液LXA4水平呈负相关,而与NF-κB水平无相关性,提示LXA4、NF-κB水平能反映炎症严重程度,且LXA4水平可反映肾损害程度,LXA4不足可能加重肾损害。LXA4有望成为HSP患儿肾损害的预测指标,且监测尿液较监测血液更便捷,因其无创,患者的痛苦较少。HSP患儿急性期LXA4水平与NF-κB水平呈负相关,猜测LXA4生成增多可能有利于NF-κB水平下降,进一步猜测LXA4可能通过拮抗NF-κB发挥抗炎作用,调控NF-κB信号通路可能成为HSP等血管炎症病变的治疗新靶点,在HSP患儿中LXA4是否通过抑制NF-κB信号通路来发挥抗炎作用还需要进一步研究。
[1] Da Dalt L,Zerbinati C,Strafella M S,et al.Henoch-Schonlein purpura and drug and vaccine use in childhood:a case-control study[J].ItalJ Pediatr,2016,42(1):60.doi:10.1186/s13052-016-0267-2.
[2] 吴天慧,李志辉,段翠蓉,等.3482例小儿过敏性紫癜流行病学分析[J].实用预防医学,2014,21(8):978-980.
[3] Davin J C,Coppo R.Henoch-Schonlein purpura nephritis in children[J].Nat Rev Nephrol,2014,10(10):563-573.doi:10.1038/nrneph.2014.126.
[4] Park S J,Suh J S,Lee J H,et al.Advances in our understanding of the pathogenesis of Henoch-Schonlein purpura and the implications for improving its diagnosis[J].Expert Rev Clin Immunol,2013,9(12):1223-1238.doi:10.1586/1744666X.2013.850028.
[5] 朱永琴,王其莉,邬思远,等.儿童过敏性紫癜的临床特点及血淋巴细胞亚群的变化[J].浙江医学,2013,35(11):1031-1032,1040.
[6] Wu S H,Liao P Y,Yin P L,et al.Inverse temporal changes of lipoxin A4 and leukotrienes in children with Henoch-Schonlein purpura[J].Prostaglandins Leukot Essent Fatty Acids,2009,80(4):177-183.doi:10.1016/j.plefa.2009.01.008.
[7] Shih R H,Wang C Y,Yang C M.NF-kappaB signaling pathways in neurological inflammation:a mini review[J].Front Mol Neurosci,2015,8:77.doi:10.3389/fnmol.2015.00077.
[8] Hu F,Liu X X,Wang X,et al.Lipoxin A4 inhibits proliferation and inflammatory cytokine/chemokine production of human epidermal keratinocytes associated with the ERK1/2 and NF-kappaB pathways[J].J DermatolSci,2015,78(3):181-188.doi:10.1016/j.jdermsci.2015.03.009.
[9] Jiang X,Li Z,Jiang S,et al.Lipoxin A4 exerts protective effects against experimental acute liver failure by inhibiting the NF-kappaB pathway[J].Int J Mol Med,2016,37(3):773-780.doi:10.3892/ijmm.2016.2483.
[10] Ozen S,Ruperto N,Dillon M J,et al.EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J].Ann Rheum Dis,2006,65(7):936-941.doi:10.1136/ard.2005.046300.
[11] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志,2009,47(12):911-913.doi:10.3760/cma.j.issn.0578-1310.2009.12.007.
[12] 高天霁,付艳华,陈宁宁,等.过敏性紫癜急性期患儿血清IL-1β检测的意义[J].临床儿科杂志,2015,33(8):758.doi:10.3969 j.issn.1000-3606.2015.08.020.
[13] 廖培元,吴升华.过敏性紫癜患儿血清白三烯B_4白介素-5的测定及其临床意义[J].中国当代儿科杂志,2006,8(3):198-200.
[14] 周游,蒋兴亮.脂氧素调控炎症信号通路的研究进展[J].中华临床医师杂志(电子版),2015,6:989-993.doi:10.3877/cma.j.issn.1674-0785.2015.06.024.
[15] Wang H,Gu J,Hou X,et al.,Anti-inflammatory effect of miltirone on inflammatory bowel disease via TLR4/NF-kappaB/IQGAP2signaling pathway[J].Biomed Pharmacother,2017,85:531-540.doi:10.1016/j.biopha.2016.11.061.
[16] Shangguan W,Du Z,Yang H,et al.[Effects of intravenous immunoglobulin upon the overexpression and over-activation of nuclearfactor-kappaB and matrix metalloproteinase-9 in murine modelof Kawasakidisease][J].Zhonghua YiXue Za Zhi,2014,94(12):938-943.
[17] 张庆松,李钢,高红宇.脂氧素对肾脏疾病作用的进展[J].医药导报,2015,34(7):923-927.doi:10.3870/yydb.2015.07.022.
[18] Deng L L,Zhong L,LeiJ R,et al.[Protective effect of lipoxin A4 against rhabdomyolysis-induced acute kidney injury in rats][J].XiBao Yu Fen ZiMian YiXue Za Zhi,2012,28(9):907-910.
[19] 郎艳美.过敏性紫癜患儿血清脂氧素A4、白介素-22的变化及意义[D].石家庄:河北医科大学,2015.
[20] 华冉,鹿玲.过敏性紫癜患儿血清低糖基化IgA1、核因子κB与炎症递质的研究[J].临床儿科杂志,2016,34(4):268-272.doi:10.3969/j.issn.1000-3606.2016.04.007.
[21] 孙兴珍,朱从龙,舒思静.过敏性紫癜患儿血清LXA4、sVCAM-1与TNF-α表达的意义[J].现代预防医学,2012,39(19):4997-4998,5003.
(本文由浙江省医学会风湿病学分会推荐)
Urinary lipoxin A4and NF-κB levels in children with Henoch-Schnlein purpura and their clinical significance
YING Qianqian,SHEN Mengjiao,LI Yunyan,et al.
Medicine School,Ningbo University,Ningbo 315000,China
Objective To investigate the changes of lipoxin A4(LXA4)and nuclear factor-κB(NF-κB)levels in the urine of children with Henoch-Schnlein purpura(HSP),and their clinical significance. Methods Fifty children with HSP,including 20 with HSP nephritis(HSPN),and 25 age-matched children with inguinal hernia(control group)were enrolled in the study.The morning urine specimens were collected and ELISA was used to determine the levels of LXA4and NF-κB.LXA4and NF-κB levels were compared between case and control groups,and among different subgroups,and the correlation between LXA4and NF-κB was analyzed. Results The urinary LXA4levels in acute phase and early recovery phase ofHSP patients were significantly higher than those in controlgroup(both P<0.01),and the urinary LXA4levels in acute phase patients were significantly lower than those in early recovery phase (P<0.01).The urinary NF-κB levels in acute phase and early recovery phase of HSP patients were also significantly higher than those in control group(both P<0.05),while the urinary levels of NF-κB in acute phase was significantly higher than those in early recovery phase(P<0.01).The urinary levels of LXA4in acute phase of HSP patients without kidney damage were significantly higher than those in HSPN,and the urinary levels of NF-κB were significantly lower(P<0.05).There was a significantly negative correlation between the urinary levels of LXA4and NF-κB(r=0.347,P<0.05)in acute phase HSP patients.Meanwhile,there was a significantly negative correlation between LXA4 and 24-h urinary protein(r=0.562,P<0.05),while there was no correlation between NF-κB and 24-h urinary protein(r=0.370,P>0.05)in acute phase of HSPN. Conclusion NF-κB may be involved in the pathogenesis of HSP,and associated with disease severity.LXA4 may protect kidney against inflammation by inhibiting NF-κB.
Henoch-Schnlein purpura Children Lipoxin A4Nuclear factor-κB 24-hour urinary protein
10.12056/j.issn.1006-2785.2017.39.21.2017-1597
浙江省医药卫生平台研究计划(2015ZDA027);宁波市医学科技项目(2015C50014);宁波市自然基金项目(2014A610280)
315000 宁波大学医学院(应倩倩、沈梦娇、傅诗薇);宁波市妇女儿童医院小儿风湿免疫科(李蕴言、吴菱、狄亚珍、王佳佩)
狄亚珍,E-mail:dyz028sci@163.com
2017-07-07)
陈丽)

