莲子胚培养再生植株及原生质体分离的研究
, , ,
(中山大学生命科学学院/广东省热带亚热带植物资源重点实验室, 广东 广州 510275)
莲子胚培养再生植株及原生质体分离的研究
蔡颖欣,汤宇环,邵晓宇,黄霞
(中山大学生命科学学院/广东省热带亚热带植物资源重点实验室, 广东 广州 510275)
以莲子胚为外植体建立江溪红莲离体培养再生体系,并以所得再生植株的展开叶片为材料,摸索原生质体分离的条件,为荷花体细胞杂交育种提供实验基础。结果表明,较理想的芽增殖培养基为MS+1 mg/L 6-BA+0.1 mg/L NAA;成苗阶段采用固液双层培养基最适宜。而最佳的叶片原生质体分离酶液组合为2%纤维素酶+1%离析酶+0.1%果胶酶。
荷花; 芽增殖; 植株再生; 原生质体
荷花(Nelumbonucifera)为睡莲科多年水生草本花卉,是一种重要的经济作物。其叶片和花具有相当高的观赏价值;地下茎莲藕和种子莲子是我国常见的蔬菜;据《本草纲目》记载,荷花全株均可入药[1-3]。传统的荷花繁殖方法主要采用分藕繁殖,需要进行大面积的缸栽或者池栽,且繁殖系数较低,大大限制了荷花种植业的发展[4-6]。为了解决这一问题,研究者们尝试通过离体培养来进行荷花的快速繁殖。已有的报道多以地下茎上的芽为外植体进行离体培养获得再生植株[6-11]。该体系中外植体消毒困难,而且取材时间(季节)显著影响芽诱导频率[6,11]。孔德政等[5]采用荷花胚为外植体,通过胚萌发直接得到完整植株,但并未观察到芽增殖现象。以江溪红莲的胚为材料进行组织培养,首次研究不同生长调节物质组合对芽增殖的影响以及不同培养方式对再生植株生长状况的影响,以建立高效、稳定的荷花离体培养植株再生体系,为种苗工厂化生产奠定基础。同时,利用所得到的无菌苗,以其展开的幼叶为材料进行原生质体分离条件的摸索,为荷花原生质体培养及体细胞杂交育种提供实验基础。
1 材料与方法
1.1 材 料
供试材料为江溪红莲(NelumbonuciferaGaertn. cv. Jiangxi Honglian)的成熟莲子,由广东省三水荷花世界提供。
1.2 方 法
1.2.1 种子消毒及胚的获得
莲子用自来水清洗干净,使用园艺剪枝剪剥除莲子的外壳(果皮),用70%的酒精消毒1 min,无菌水冲洗2~3次。然后用0.1%的次氯酸钠消毒8~10 min,无菌水冲洗5~6次。使用解剖刀将种子的子叶沿中缝剥开,取出胚(图1 A),并去掉胚上的薄膜。
1.2.2 胚萌发培养
将处理好的胚接种到胚萌发培养基上,每瓶接种4个胚,于(25±1)℃,1 500~2 000 lx,每天16 h光照条件下培养。胚萌发培养基组成为:以MS[12]为基本培养基,添加0.5 mg/L 6-BA、0.1 mg/L NAA、20 g/L蔗糖和7 g/L 琼脂,pH=5.7。
1.2.3 芽增殖培养
胚萌发后,将幼叶切除,取单个幼芽接种到添加不同浓度6-BA(0.5~1.5 mg/L)和NAA 0.05~0.1 mg/L(如表1所示)的芽增殖培养基MS+20 g/L蔗糖+7 g/L琼脂(pH=5.7)上,每瓶接种4个芽,20个芽作为1个处理组合,每个处理重复3次。培养温度为(25±1)℃,每天光照时间为16 h,光照强度1 500~2 000 lx。培养25 d后分别统计存活率和芽增殖系数。
存活率(%)=存活的外植体个数/接种的外植体总数×100%;
芽增殖系数=获得的丛生芽总个数/接种的幼芽个数。
1.2.4 成苗培养
将生长健壮的芽转入成苗培养基中,分别采用固体培养及固液双层培养2种方式,于(25±1)℃,1 500~2 000 lx,每天16 h光照培养。每瓶接种1个芽,10瓶为1个处理,每个处理重复3次。培养4周后统计实验结果,比较2种培养方法植株的茎生长状况、幼叶展开状况等,探索最适合荷花植株生长的培养方式。
固体培养基组成为:MS+0.2 mg/L NAA+20 g/L蔗糖+1 g/L活性炭+7 g/L琼脂,pH=5.7。液体培养基为:MS+0.2 mg/L NAA+20 g/L蔗糖,pH=5.7。固体培养基于高压灭菌前分装至培养瓶;而液体培养基则高压灭菌后用于固液双层培养,即将芽接种到固体培养基上后直接加入液体培养基,浸没培养材料。
1.2.5 叶片原生质体的分离纯化
通过以上步骤获得江溪红莲的离体再生植株后,取展开4~7 d的幼叶作为分离原生质体的材料。将叶片剪成1 mm×2 mm左右,按1∶5(材料∶酶解液,w/v)的比例加入酶解液,(25±1)℃,40~60 r/min,黑暗条件下进行酶解。酶解液组成为: CPW溶液[13],添加0.5 mol/L甘露醇、5 mmol/L MES以及不同浓度的Cellulase R-10、Macerozyme R-10和Pectolase Y-23,pH=5.4。
酶解约6 h后,将去除了叶片残渣的酶解混合液于1 000 r/min离心5 min,弃上清,沉淀重悬于含0.5 mol/L甘露醇和5 mmol/L MES的CPW溶液(即原生质体清洗液)中,分别使用孔径为0.15,0.075,0.048 mm筛网过滤,滤液于1 000 r/min离心5 min,弃上清,沉淀重悬于原生质体清洗液中进行离心洗涤,重复洗涤3次。最后加入适量的原生质体清洗液重悬纯化后的原生质体并用血球计数板统计原生质体的产量。
1.3 统计分析
使用Excel 2007和SPSS 19.0软件进行数据的统计分析,平均值以平均数 ± 标准误表示,分别进行2个样本平均数的t检验或采用邓肯氏新复极差检验法(Duncan's multiple ranger test)进行多重比较。
2 结果与分析
2.1 不同浓度6-BA和NAA组合对芽增殖的影响
于胚萌发培养基上培养7 d左右,江溪红莲的种子胚开始伸长萌发,并逐渐长出幼叶。将幼叶切除,取单个幼芽进行芽增殖培养,结果见表1、图1 B和图1 C所示。
由表1可看出,6-BA浓度增加可提高芽增殖系数,但其浓度达到1.5 mg/L 时,芽的存活率由100%降低到86.67%,而与含相同NAA的处理组合比较,芽增殖系数也有所下降。当6-BA浓度为0.5 mg/L时,NAA浓度升高有利于芽增殖。综合考虑,MS培养基中添加1 mg/L 6-BA和0.1 mg/L NAA对江溪红莲芽增殖的效果最好。
表1 6-BA和NAA对江溪红莲芽增殖的影响

处理6⁃BA(mg/L)NAA(mg/L)存活率(%)芽增殖系数10.50.05100.00±0.001.47±0.13d20.50.10100.00±0.002.18±0.08c31.00.10100.00±0.003.40±0.15a41.00.1086.67±2.892.54±0.12b
注:同列中不同小写字母表示差异显著(plt;0.05)。
2.2 培养方式对再生植株生长的影响
如图1 D、E、F和表2所示,固体培养基上加入液体培养基后,有利于江溪红莲离体再生植株的生长。虽然2种培养方式对生根没有明显的影响,但使用固液双层培养基进行培养时,幼叶和茎生长均显著优于只使用固体培养基进行培养;另外,固体培养基上的植株幼叶很难展开,而固液双层培养基上的植株幼叶数量多且展开早,这为进行原生质体分离提供了很好的叶片材料。
2.3 不同酶组合对叶片原生质体分离的影响
在植物原生质体分离中,最常用的酶是纤维素酶、离析酶和果胶酶,从表3可以看出,酶的组合极大的影响到原生质体的产量。果胶酶对江溪红莲叶片原生质体分离的影响最显著,不加果胶酶时,原生质体脱壁不完全,产量低;但随着果胶酶浓度升高,原生质体的产量也有所下降。实验发现,纤维素酶、离析酶和果胶酶3种酶混合使用,且果胶酶浓度适中才能得到较多质量好的原生质体。本次试验中,使用含2%纤维素酶、1%离析酶和0.1%果胶酶的酶混合液进行分离时,所得原生质体的产量最高,达到3.6×105g。
表2 培养方式对江溪红莲再生植株生长状态的影响

培养方式叶片总数(展开的叶片数量)再生植株的茎长(cm)再生植株的整体长势固体培养2.3±0.4b(0.87±0.12B)15.63±0.45B+固液2层培养3.5±0.3a(1.97±0.12A)20.77±0.60A+++
注:同列中不同小写字母表示差异显著(plt;0.05),大写字母表示差异极显著(plt;0.01);“+”越多表示植株的整体长势越旺盛。
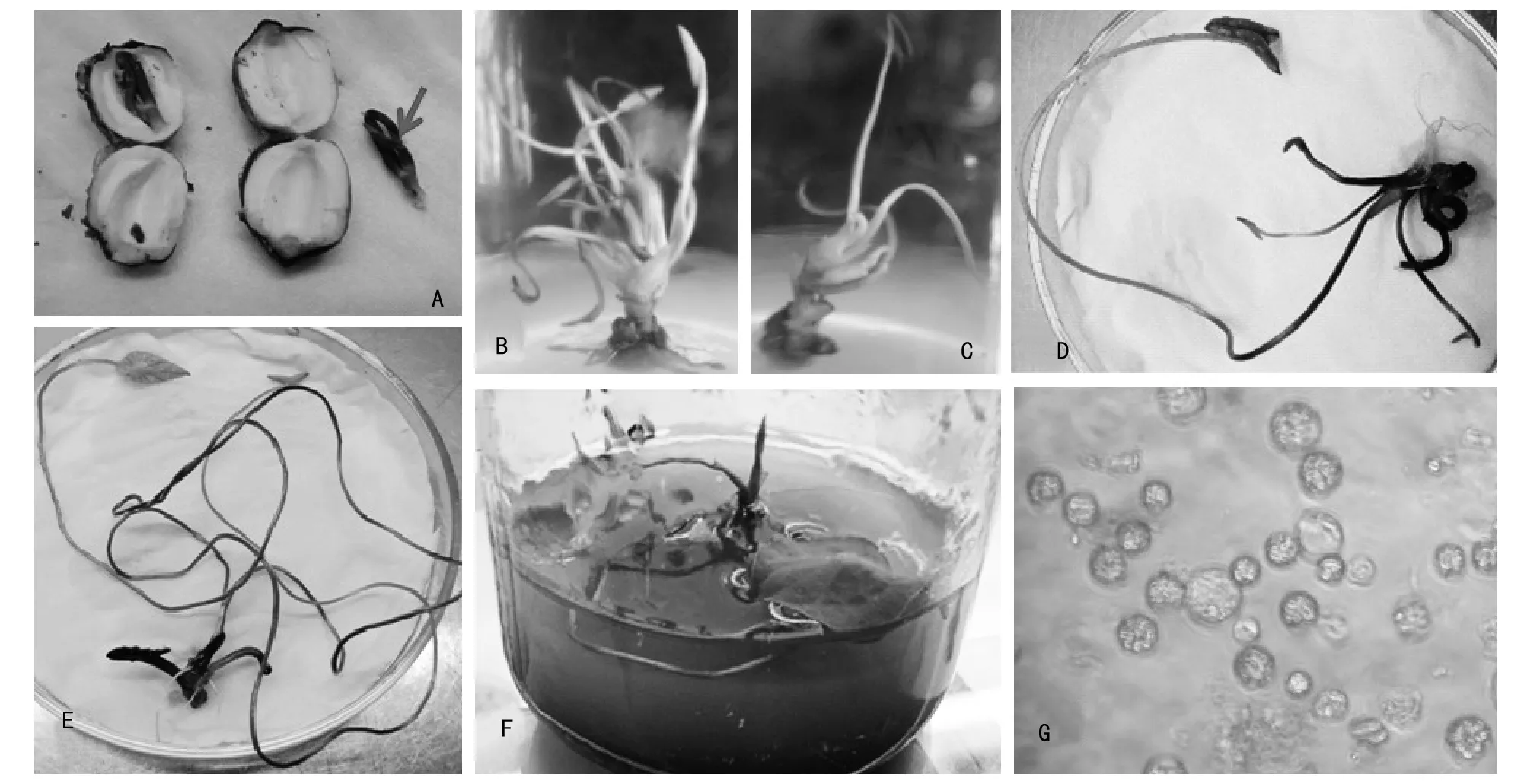
注:A为外植体制备(箭头所指为莲子胚);B为添加1 mg/L 6-BA 和0.1 mg/L NAA时芽增殖的状况;C为添加1.5 mg/L 6-BA和0.1 mg/L NAA时芽增殖的状况;D为于固体培养基上生长2周的再生植株;E为于固液双层培养基上生长2周的再生植株;F为于固液双层培养基上生长3~4周的再生植株;G为叶片原生质体分离结果(酶解配方:2%纤维素酶,1%离析酶,0.1%果胶酶)。图1 江溪红莲的胚培养及原生质体分离
表3 不同酶组合对江溪红莲叶片原生质体分离的影响
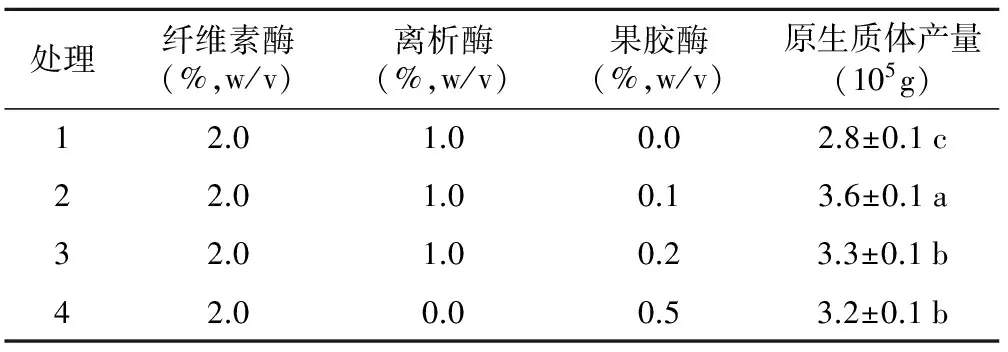
处理纤维素酶(%,w/v)离析酶(%,w/v)果胶酶(%,w/v)原生质体产量(105g)12.01.00.02.8±0.1c22.01.00.13.6±0.1a32.01.00.23.3±0.1b42.00.00.53.2±0.1b
注:同列中不同小写字母表示差异显著,相同字母表示差异不显著(pgt;0.05)。
3 讨 论
荷花外植体初代培养最主要的问题之一就是污染,已有的报道都使用氯化汞进行消毒,对于荷花子藕顶芽即使消毒20 min污染率仍然很高,成活率仅为47.4%[6]。孔德政等[5]发现,莲子胚用氯化汞消毒10 min可达到较好的效果,但外植体的成活率也只能达到65%左右,而且由于使用浓硫酸浸泡莲子破除外壳,外植体可能同时受到硫酸和氯化汞的伤害,致使荷花胚的萌发率较低,最高只达到42%左右。本试验采用园艺剪枝剪剥除莲子的外壳,然后用次氯酸钠消毒10 min左右即可达到很好的效果,荷花胚的萌发率可达到100%。
有研究表明,6-BA在荷花芽诱导和增殖过程中起重要作用[9,11,14],本试验也发现,适当增加6-BA浓度能提高荷花芽的增殖系数,但浓度过高则对芽增殖有抑制作用甚至影响其存活率。
固体培养对荷花试管苗生长具有环境胁迫效应,能够抑制茎、叶的生长以及叶片的展开[6]。本试验所用的固液双层培养基环境与荷花的自然生长环境比较接近,因此试管苗生长更加旺盛,不仅茎伸长快、叶片数目较多,而且叶片也较易展开。这一培养系统为使用无菌苗的展开叶片分离原生质体提供了很好的实验材料。
利用原生质体培养和融合技术培育新品种是植物生物技术育种的有效途径之一[15],但尚未见荷花原生质体培养成功的报道,仅Treesaksri等[13]以盆栽苗的幼芽为材料分离原生质体,产量只达到3.3×104g。本试验以无菌试管苗的展开幼芽为材料,原生质体产量可达3.6×105g。该实验体系取材重复性好,且材料新鲜,适宜用于荷花原生质体培养和融合的相关研究。而在分离原生质体时,酶的选择和酶浓度的确定也很关键,实验表明,纤维素酶和离析酶是荷花原生质体分离的必要酶,而加入果胶酶能够使原生质体脱壁效果更好,因此3种酶的搭配使用能获得比较好的分离效果。
[1]中国科学院武汉植物研究所.中国莲[M].北京:科学出版社,1987:1-3.
[2]Sridhar K R,Bhat R.Lotus-a potential nutraceutical source [J].Journal of Agricultural Technology,2007,3(1):143-145.
[3]La-ongsri W,Trisonthi C,Balslev H.Management and use ofNelumbonuciferaGaertn. in Thai wetlands[J].Wetlands Ecology Managment,2009,17:279-289.
[4]李志炎,林正秋.中国荷文化[M].杭州:浙江人民出版社,1995:53-61.
[5]孔德政,李艳妮,杨秋生,等.荷花胚组织培养的初步研究[J].河南科学,2007,25(4):593-595.
[6]徐君,李静会,李欣,等.荷花顶芽初代组织培养[J].江苏农业科学,2013,41(3):38-39.
[7]彭静,柯卫东,黄新芳.莲藕的组织培养与快速繁殖[J].植物生理学通讯,2001,37(1):38.
[8]张建福,王锋.莲藕组织培养与微繁殖技术初探[J].上海农业科技,2002(6):17-18.
[9]刘玫,陈晔,孙崇波,等.几种珍贵荷花品种组织培养技术研究[J].浙江农业科学,2002(3):108-111.
[10]Arunyanart S,Chaitrayagun M.Induction of somatic embryogenesis in lotus (NelumbonuciferaGeartn.)[J].Scientia Horticulturae,2005,105:411-420.
[11]Shou S Y,.Miao L X,Zai W S,et al.Factors influencing shoot multiplication of lotus (Nelumbonucifera)[J].Biologia Plantarum,2008,52(3):529-532.
[12]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Physiolgia Plantarum,1962,15:473-497.
[13]Treesaksri S,Aranyanart S.Protoplast isolation of lotus (NelumbonuciferaGaertn.)cv.Buntharik[J].Agricultural Science Journal (Thailand),2001,32(4):263-266.
[14]Yu X,Sheng J,Zhao L,et al.In vitro plant regeneration of lotus (Nelumbonucifera)[J].Open Life Science,2015,10:142-146.
[15]黄国文.植物原生质体融合技术的研究进展[J].湖南科技学院学报,2011,32(12):30-34.
(本栏目责任编辑:周忠燕)
Researches on Plant Regeneration from Embryos and Protoplast Isolationof Lotus
(Nelumbonucifera)CAIYingxin,TANGYuhuan,SHAOXiaoyu,HUANGXia
2016-10-26
中央高校基本科研业务费专项资金资助(121 gpy 41)。
蔡颖欣(1989—),女,广东广州人;硕士,研究方向:经济作物生物技术育种;E-mail:qbennyq@qq.com。
黄 霞(1974—),女,广东廉江人;副教授,博士,主要从事植物生理与分子生物学等研究工作;E-mail:huangxia@mail.sysu.edu.cn。
10.16590/j.cnki.1001-4705.2017.03.125
S 645.1
A
1001-4705(2017)03-0125-04

