基于图像处理非破坏性精确测量魔芋小叶面积
赵青华,杨朝柱,刘二喜,覃 宇,潘娅妮
(1.恩施州农业科学院,湖北 恩施 445000;2.湖北省魔芋种子种苗工程技术中心,湖北 恩施 445000;3.湖北省农业科技创新中心鄂西综合试验站,湖北 恩施 445000)
基于图像处理非破坏性精确测量魔芋小叶面积
赵青华,杨朝柱*,刘二喜,覃 宇,潘娅妮
(1.恩施州农业科学院,湖北 恩施 445000;2.湖北省魔芋种子种苗工程技术中心,湖北 恩施 445000;3.湖北省农业科技创新中心鄂西综合试验站,湖北 恩施 445000)
魔芋属半荫生植物,其单生叶片是地上部分唯一的器官,精准、无损测定魔芋叶面积是研究其生理功能、人工栽培改善群体结构、增加产量的前提.以叶形指数相似的椭圆为标尺,离体和活体采集图像,利用Image Pro-Plus 6.0分析,研究了光照、曝光值、旋转角度、倾斜角度、相机分辨率、拍摄距离、位置等因素对魔芋小叶面积测定精度的影响.结果表明:椭圆面积作为标尺,可消除图像变形引起的误差,光照强度不低于200k Lux,倾斜角度0~8°,分辨率不低于80万像素,离体测定相对误差小于0.60%,非破坏性活体测定相对误差低于1.00%.该方法简单、精确度高,为动态监测魔芋叶面积参数提供方便.
魔芋;小叶面积;非破坏性测量;叶形指数;图像处理
叶片是植物重要的生物学器官,是截获光源进行CO2固定和光合原初反应的场所、同化物积累的“源”,同时也是蒸腾作用和呼吸作用的关键部位.叶面积大小是反应植物生长发育、预测生产能力和农业生产人工调控的重要指标.因此,精确测量叶面积是植物光合生理、群体结构和冠层生理等研究基础,对农业生产具有重要的指导作用[1-2].测定叶面积的方法较多,有网格法、复印称重法、比重法、描轮廓称重法、叶面积仪法、图像处理法、模型预测法等,各有利弊,数字图像处理法和非破坏性法是叶面积测定的发展趋势[3-12].
魔芋是我国西南山区重要的园艺作物,属天南星科魔芋属多年生草本植物,种类繁多,其叶片属大型复叶,通常一个生长周期和一个生长季节只发生一片叶,地面的部分为叶,通过叶柄与地下球茎相连,另一端与三全裂叶相连,不同种类小叶叶形和面积差异较大,有椭圆、倒卵圆等形状,珠芽魔芋、西盟魔芋、滇魔芋和悠乐魔芋小叶面积大,疣柄魔芋和甜魔芋次之,花魔芋、白魔芋及其衍生种较小.小叶奇数羽状互生排列或二次羽状或二岐分裂后羽状排列,全缘,渐尖,基部下延成鳍状[13].魔芋起源于热带丛林底层,属典型的半荫生植物,小叶形状、大小受种类、着生部位、光照、水肥影响较大[13].Patel等[14]用疣柄魔芋的1个裂片面积建模预测全株叶面积,相关系数达到0.93以上,李雁鸣等[15]用校正系数法预测叶面积,与实际误差较大,黑田俊朗回归分析花魔芋小叶面积,基部小叶和顶端小叶回归系数分别为0.617和0.537,用花魔芋、白魔芋和“鄂魔芋1号”(花魔芋×白魔芋杂交选育的品种)[16]小叶长×宽回归分析,发现不同品种和单株其回归系数不同.由此可见,很难用统一模型精确的估算魔芋叶面积,因此,建立魔芋叶面积快速、无损和精确测量方法,对于深入研究与叶面积相关的生理功能、群体结构动态演变和农业生产意义重大.
1 材料与方法
1.1魔芋
花魔芋(Amorphophalluskonjac),白魔芋(Amorphophallusalbus)以及二者杂交后代“鄂魔芋1号”(A.konjac×A.albuscv.‘Emoyu 1 hao’),种植于恩施州农业科学院高新示范园30目防虫网室(Alt.=490 m),70%遮阴,常规管理.
1.2主要仪器设备
Cannon Image CLASS MF4010B扫描打印一体机,E1200点易拍(1 000万像素),Oppo7 plus手机相机(1 200万像素),Epson stylus Photo R330喷墨打印机,Smart Sensor As813光照计,LS160II莱塞激光数显倾斜角度测定仪,厚度3 mm有机玻璃板.
1.3标准面积样品制作
用CorDraw软件,以px为单位绘制圆形(R=400 px)、椭圆形(R1=566 px,R2=283 px)、长方形(L=502 px,W=251 px)、正方形(SL=355 px),线条宽度0.5 mm,图形等距离居中排列,根据统计3种魔芋小叶长宽比值位于1.7~3.0之间(每个种n=30),因此长方形和椭圆的长轴与短轴比值为2.为便于测定旋转角度,中间用垂直的十字架标记.用A4纸张,8位灰度300 dpi、JPG格式导出,将图形导入Image Pro-Plus 6.0(IPP6.0)软件,测定标准图形面积.再将图片导入A4 Word文档,保持图形大小一致,用Epson喷墨打印机高质量打印,沿图形距边界约 2 mm剪下,然后用300 dpi100%比例灰度扫描,导入IPP软件计算面积,换算成cm2,以扫描仪正中、上、下、左、右5个位点的平均值作为标准样品的面积.
1.4小叶面积测定
将已知面积的标准图放置魔芋小叶中央,以色差较大的白色作为背景,以有机玻璃压平,用点易拍3 724×2 806分辨率灰度模式拍照,将图片导入IPP6.0软件,选取测定部位自动测定像素值,面积A叶片(cm2)=Pixels叶片/Pixels标样×A标样.以300 dpi扫描获得的面积作为实际面积.
2 结果与分析
2.1几种测定方法的比较
选取5片魔芋小叶(鄂魔芋1号),采用传统复印剪纸称重法、描轮廓法、扫描法和拍照法进行测定,如表1所示.拍照法与扫描法十分接近,相对误差仅为0.2%,而复印称重法与其他3种方法差异达到极显著水平,复印称重法获得结果偏高,这与复印后增加了油墨质量以及吸潮有关,改进后直接描轮廓称重法与实际值接近,与前人结果相似[4-5].由此可见,拍照法是精确测定魔芋叶面有效方法.
2.2图像处理法测定魔芋小叶面积的影响因素
用已知面积的图形为标准(见表2)测定小叶面积,四种标样差异不显著,相对误差不超过0.30%,都可以用作测定标尺,但椭圆和长方形相对误差更小(见表3).椭圆与叶片形状相似,因此用相对较大椭圆作为标样测定叶面积时易于将其限定于叶缘之内.
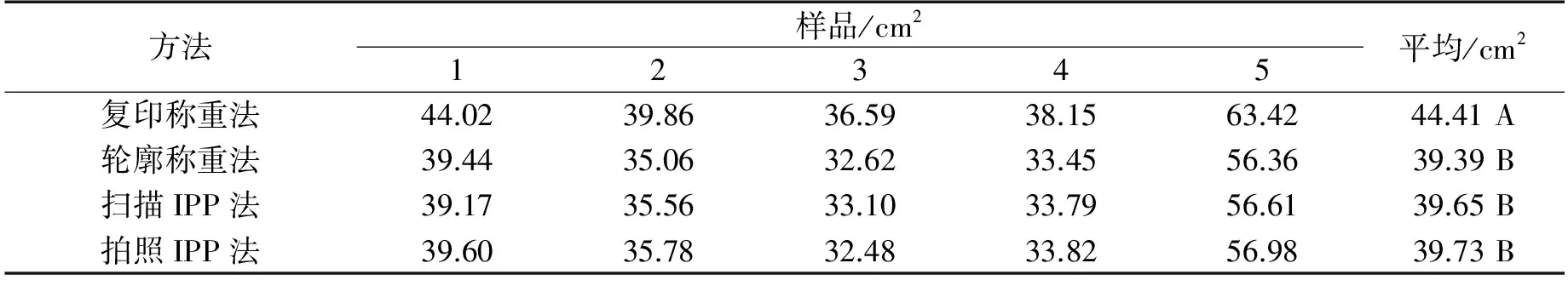
表1 几种测量叶面积方法比较
注:大写字母表示达到极显著差异水平(Plt;0.001).

表2 扫描法测定的标样面积*
注:*:300dpi扫描,Area=像素/(300dpi×300dpi)×2.54×2.54;**:叶片为“鄂魔芋1号”小叶(下同).
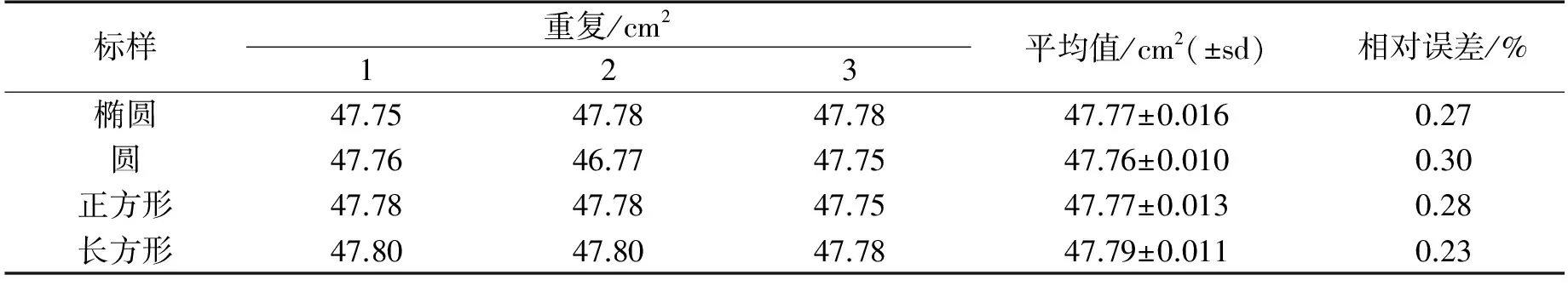
表3 不同标样测定的魔芋叶片面积

图1 光线强度对魔芋叶片像素和面积的影响(自动曝光)Fig.1 Effect of light intensity on pixels and area of leaflet (automatic exposure)

光照强度300Lux,auto表示自动曝光,hand表示手动曝光图2 曝光值对魔芋叶片像素和面积的影响Fig.2 Effect of exposure value on pixels and area of leaflet
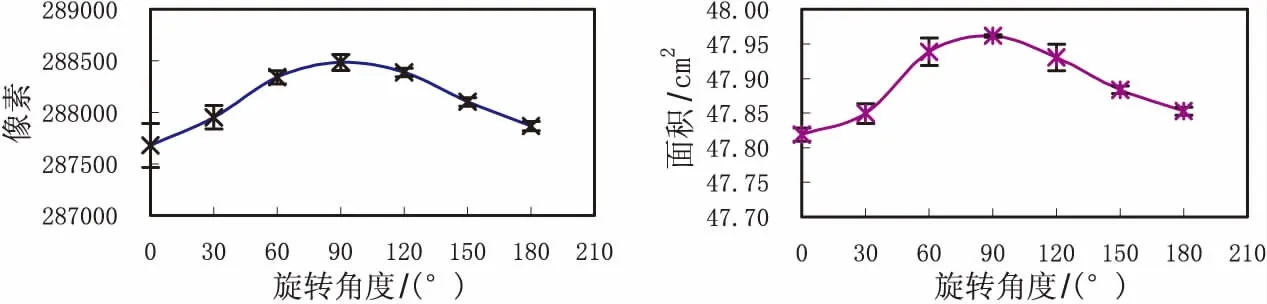
图3 旋转角度对魔芋叶片像素和面积的影响(自动曝光,下同)Fig.3 Effect of rotation angle on pixels and area of leaflet (automatic exposure,the same as below)

图4 位置对魔芋叶片像素和面积的影响Fig.4 Effect of location on pixels and area of leaflet

图5 倾斜角度对魔芋叶片像素和面积的影响(自动曝光)Fig.5 Effect of angle of inclination on pixels and area of leaflet
以椭圆作为标尺,长轴与短轴同叶片平行,用点易拍拍照,研究了光照、曝光值、位置、旋转角度、倾斜角度、拍摄距离以及分别率对叶片像素和面积的影响,室内环境自动曝光或用可调剂光强的日光灯进行补光,3次重复,实验结果见图1~7.曝光度和光照强度主要影响图像的明暗程度,拍摄时图片较暗,边界相对模糊,其像素值偏高,光照强度低于200 Lux和曝光值低于-5或高于-2时,图片效果较差,输入IPP软件不能自动识别;勾选自动曝光后,光照强度对像素的影响不大;与之相反,随光照强度和曝光值增加,面积有增加的趋势,这可能与受光不均匀有关,但相对误差小于0.37%,勾选自动曝光后,面积相对误差不超过0.2%.旋转角度对像素和面积影响一致,垂直方向较大,面积的相对误差不超过0.18%,不同位置像素和面积也有变化,面积相对误差不超过0.16%,可能与横向和垂直的分辨率以及镜头角度等机械误差有关,扫描时位置也有同样影响.像素与底板的倾斜角度呈正向线性关系,与镜头距离呈负相关,倾斜角度超过5°时,面积有增加趋势,相对误差不超过0.37%;距离超过25 cm后,面积趋于稳定,相对误差不超过0.15%,而距离为13 cm时,相对误差为0.53%.分别率越大,像素越高,低于80万像素时,边界出现断点,放大后图像不够清楚,80~1 000万像素,面积相对误差不超过0.21%,但存储空间随像素增加而增大.

图6 拍摄距离对魔芋叶片像素和面积的影响Fig.6 Effect of distance on pixels and area of leaflet

图7 拍摄分辨率对魔芋叶片像素和面积的影响(自动曝光)Fig.7 Effect of camear resolution on pixels and area of leaflet
研究过程中还发现,利用IPP软件测定,以线性标尺参照,标尺的位置、放置方向、图像分辨率、图像的明暗程度等对标定影响较大,同时增加人为判定所导致的误差.以分界清晰,颜色差异明显的平面图形作为参照和底色,通过自动勾选边界,消除光照强度、曝光度、位置、分辨率和变焦等影响,为非破坏性活体精确测定魔芋叶面积奠定了基础.
2.3非破坏性测量魔芋叶面积
以普通相机(Oppo 7 plus,1 200万像素),用白色泡沫板为底色,椭圆标尺粘在3 mm有机玻璃上,标尺长轴与主叶脉平行,位于叶片近中点,压平,采用不同焦距近似垂直拍照3次,测定3种魔芋顶端小叶面积,以300 dpi扫描测定作为实际面积,结果见表4.该方法测定的不同长宽比小叶面积的精度高,且焦距影响小,相对误差不到1.0%,同时发现,叶形指数(叶片的长宽比)[3]对精度影响较大,越接近标尺比例,相对误差越小,因此,测定过程中还可以根据叶片实际情况调整椭圆标尺的大小和长宽比例.随机活体测定3种魔芋各5片小叶,相对误差为0.04%~0.50%(见表5).由此可见,该方法重复性好,精度高.

表4 椭圆标样活体测定3种魔芋顶端小叶面积
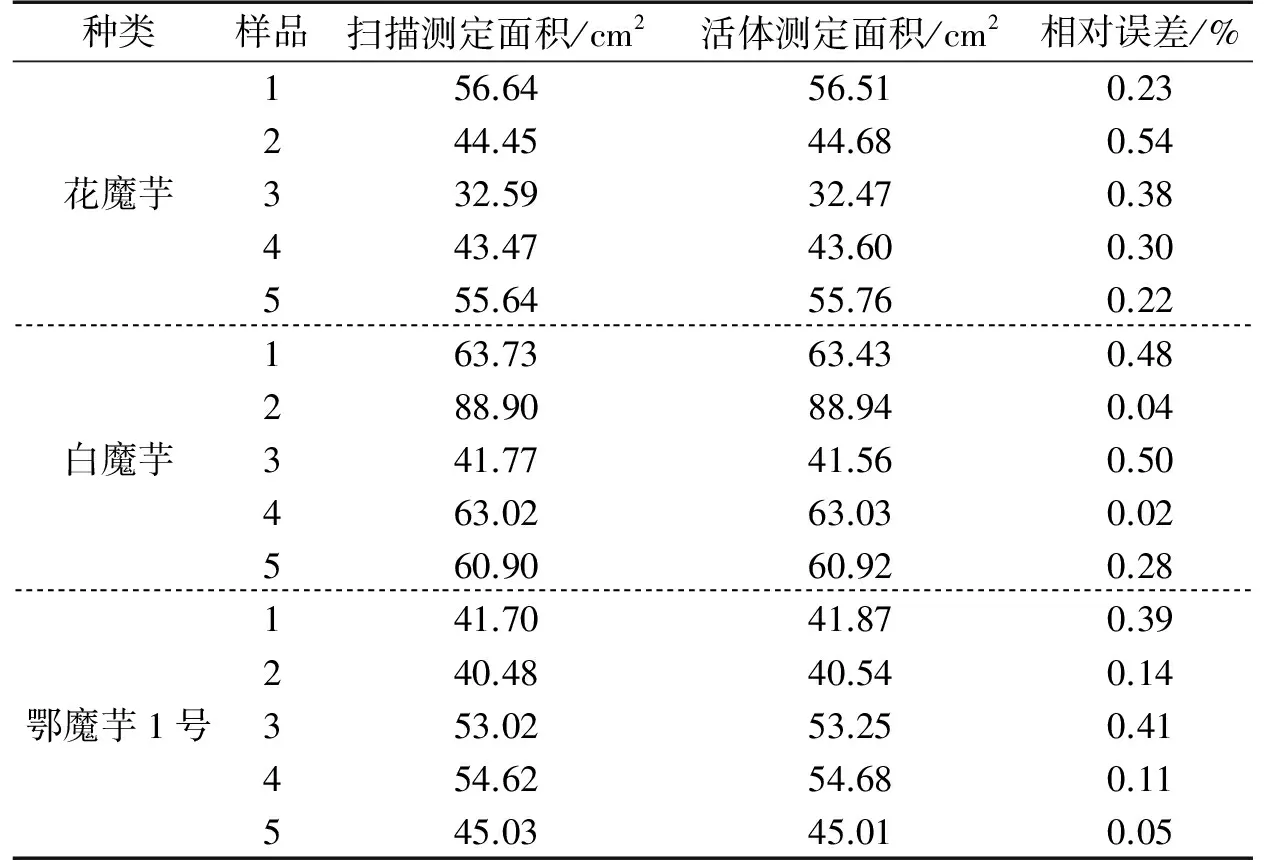
表5 椭圆标样活体拍照随机测定不同魔芋5片小叶面积
3 结论与讨论
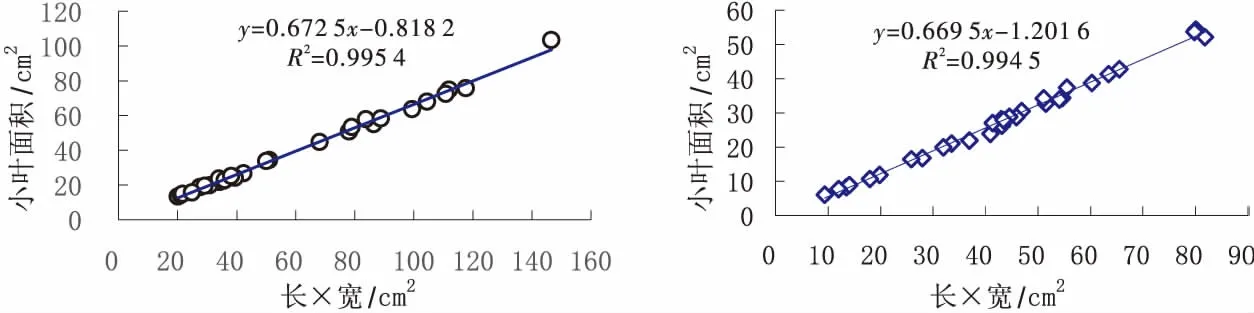
图8 鄂魔芋1号2个单株小叶面积线性回归分析(n=30)Fig.8 Correlation between leaflet area and width×length in 2 separate plant of cv.‘Emoyu 1 hao’(n=30)
魔芋是我国西南高海拔和高原山区特色作物,光饱和点、补偿点和净光合速率低,属典型半荫生作物(semi-shading crop)[13,17-21].因此,增加叶面积和比叶面积系数、提高光合效率和延长光合时间是栽培措施改善库源关系、发挥增产潜力的主攻方向[17-21].魔芋叶片大小、小叶数量受光照条件、种芋大小和年龄影响大,不同种属、品种及个体叶形指数(长/宽)也有差异,回归系数不同(见图8、图9),不同部位小叶回归系数也不一致,矫正系数法测定的相对误差达到10%以上,因此很难用统一的模型进行预测[14-15].数字图像处理法测定精度高,但受采集条件光照强度和受光均匀、曝光值、拍摄角度焦距远近以及图像变形程度等影响.

图9 花魔芋(左)和白魔芋(右)小叶面积回归分析(n=30,单株)Fig.9 Correlation between leaflet area and product of width and length in 2 separate plants of A.konjac(left) and A.albus(right)(n=30)
以叶面积性状指数近的已知面积的椭圆作为参照,色彩差异较大的底色,普通相机采集图像,利用经典的生物学分析软件Image Pro-Plus处理,可以消除图像变形、光线不均、明暗度、距离、角度以及相机长宽分辨率差异等影响,精确测量魔芋小叶面积,活体测量相对误差低于1.0%,本结果为研究魔芋叶面积动态变化、光合生理和栽培调控奠定了基础.在实际测量过程中,椭圆的面积可根据叶片大小进行调整,中心十字架还可以作为精确测量叶形指数的标尺.
魔芋叶片(leaf blade)属大型复叶,由5至几百片小叶(leaflet)组成,可以通过测定所有小叶的面积求和获得整个叶片的面积,但工作量较大,且基部叶片着生点叶眿粗壮,不易压平,因此,多点参照或以测定少量叶片后以此为参照获得整株叶面积信息是下一步研究的方向.
[1] 郭孝玉,孙玉军,王轶夫,等.基于改进人工神经网络的植物叶面积测定[J].农业机械学报,2013,44(2):200-205.
[2] LAUBHANN D,ECKMULLNER O,STERBA H.Applicability of non-destructive substitutes for leaf area in different stands of Norway spruce(PiceaabiesL.Karst.)focusing on traditional forest crown measures[J].Forest Ecology and Management,2010,260(9):1498-1506.
[3] 盛双,王国聪,颜权, 等.大叶桉叶面积测定方法的比较研究[J].广西林业科学,2011,40(2): 140-143.
[4] 柳觐,倪书邦,宫丽丹,等.澳洲坚果叶面积测定方法比较[J].中国农学通报,2014,30(25):142-147.
[5] 柏军华,王克如,初振东,等.叶面积测定方法的比较研究[J].石河子大学学报(自然科学版),2005,23(2):216-218.
[6] 于峰,林杉,张峻峰,等.一种基于图像特征值算法的叶面积测定方法[J].中国农业大学学报,2007,12(4):67-69.
[7] 宰松梅,温季,郭冬冬,等.基于支持向量机模型和图像处理技术的甜椒叶面积测定.农业工程学报,2011,27(3):237-241.
[8] 高君亮,郝玉光, 张景波,等.基于数字图像处理的防护林体系三种杨树叶面积测定[J].农业机械化,2003(7):39-42.
[9] 陈积山,朱瑞芬,张月学.基于GIS在苜蓿叶面积测定中的应用[J].草业科学,2012,29(7):1044-1048.
[10] 陈智芳,王景雷,宋 妮.GIS空间分析技术在棉花叶面积测定中的应用[J].中国农学通报,2012,28(9):145-149.
[11] 聂鹏程,杨燕,刘飞,等.植物叶面积无损测量方法及仪器开发[J].农业工程学报, 2010,26(9) :198 -202.
[12] 钟新月,陈亮,李文略,等.苎麻叶面积测定方法比较研究[J].中国麻业科学,2005,37(5):259-264.
[13] 刘佩英.魔芋学[M].北京:中国农业出版社,2003:46-47.
[14] PATEL BM,MEHTA MM.Note on a rapid method of determining leaf area in elephant foot corm(A.paeoniifolius)[J].Gujarat Agri Uni Res Jour,1987,13(1):45.
[15] 李雁鸣,胡寅华,张建平,等.魔芋叶面积测定方法的初步研究[J].河北农业大学学报,2000,23(4):23-25.
[16] 杨朝柱,牟方贵,刘二喜,等.魔芋杂交新品种‘鄂魔芋1号’[J].园艺学报,2015,42(S2):2879-2880.
[17] 李南林.光照对魔芋生长的影响研究[D].重庆:西南大学,2015:1-2.
[18] KENGO I,NOBUO C.The effect of light intensity on Konjak ultrastructure of chloroplasts(AmorphophalluskonjacK.Koch)[J].Jpn J Crop Sci,1984,53(4):503-509(in Japanese)
[19] KUNIO M,AKIO O.Effect leaf of shading on photosynthesis,respiration,area and corm weight in Konjak plants(AmorphophalluskonjacK.Koch)[J]. Jpn J Crop Sci,1981,50(4):553-559(in Japanese)
[20] KUNIO M,YOSHIHARU W,KAZUYUKI W.Dry matter accumulation in underground organs of Konjak plant as affected by photosynthate production[J].Jpn J Crop Sci,2002,71(1):24-27(in Japanese)
[21] 李珍,谢世清,徐文果.不同光照条件下喜阴植物谢君魔芋对稳态和动态光源的响应特征[J].广西植物,2016,36(5):529-538.
责任编辑:高山
PreciseandNon-destructiveMeasurementofKonjac(AmorphophallusBlume)LeafletAreaBasedonImageProcessingMethod
ZHAO Qinghua,YANG Chaozhu*,LIU Erxi,QIN Yu,PAN Yani
(1.Academy of Agricultural Sciences of Enshi Autonomous Prefecture,Enshi 445000,China; 2.Engineering Technology Center of Konjac Seed amp; Seedlings of Hubei Province,Enshi 445000,China; 3.Comprehensive Experimental Station of Western Hubei Province,Agricultural Science amp; Technology Innovation Center,Enshi 445000,China)
Konjac(Amorphophallusblume)is a semi-shading plant with single compound leaf blade on the ground.Precise and non-destructive measurement of Konjac(AmorphophallusBlume)leaflet area is a prerequisite to study its physiological function,improve the population structure in artificial cultivation and increase the output.In this paper,taking the eclipse similar to the leaf index as the standard,conducting in vitro and in vivo collection of the image and using Image Pro-Plus 6.0 for analysis,we studied the effects of light,exposure value,rotation angle,angle of inclination,camera resolution,shooting distance and position on precise measurement of Konjac leaflet area.The results indicated that using elliptical area as standard could eliminate the errors caused by the image distortion,and the light intensity should be no less than 200k Lux,the angle of inclination is between 0~8°,the resolution is no less than 800,000 pixels,the relative error of in vitro measure is less than 0.60% and the relative error of non-destructive in vivo measure is less than 1.00%.As a simple,precise and non-destructive method,it is easy to dynamically monitor the parameters of theAmorphophallusblumeleaflet area.
Konjac(Amorphophallusblume);leaflet area;non-destructive measurement;leaf index;image processing
2017-08-25.
湖北省农业科技创新中心项目(2016-620-000-001-062);2017年湖北省现代农业特色产业竞争性立项项目(鄂农计发【2017】1号);湖北省鄂西民族专项(2016AKB048).
赵青华(1978-),女,高级农艺师,主要从事魔芋品种遗传改良的研究;*
:杨朝柱(1972-),男,博士,正高职高级农艺师,主要从事魔芋品种选育与技术推广的研究.
1008-8423(2017)04-0361-05
10.13501/j.cnki.42-1569/n.2017.12.001
S632.3
A

