多种修复技术对城市内河水质及微生物群落的影响
沈 益,胡 南
(南京工业大学生物与制药工程学院,江苏 南京 211800)
多种修复技术对城市内河水质及微生物群落的影响
沈 益,胡 南
(南京工业大学生物与制药工程学院,江苏 南京 211800)
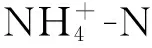
河流治理;微生物群落;高通量测序;水质修复;城市内河
城市发展过程中,工业废水、生活污水、农业用水的直接排放,使得城市河流水体N、P等水质因子严重超标,水体富营养化严重。城市河流水体污染的加剧、生态环境的退化以及水体自净能力的减弱[1],严重影响了城市河流的各项生态功能。

随着生物技术的发展,河流水体微生物群落结构的变化越来越受到关注[9]。普遍认为,河流生态系统中,微生物的吸收、代谢对水体本身的自净和修复发挥着极其重要的作用。若河流本身的微生物群落结构遭到破坏,即使短时间治污成效明显,也极易再次污染,因此水体微生物群落结构的多样性与丰度逐渐被当作鉴定河流水质的一项重要指标[10-11]。刘正辉[12]通过高通量测序、荧光定量PCR等技术测定了东江水体的微生物群落结构,发现东江上下游的微生物群落主要为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteridetes),且受水体氮质量浓度的梯度变化影响,这些微生物群落具有显著的季节和空间变化特性。谭旭[13]通过高通量测序技术分析了赤水河水体的微生物多样性,发现赤水河中优势菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteridetes)和放线菌门(Actinobacteria),且赤水河夏季的微生物丰度及多样性均高于冬季。
虽然关于水体修复的研究报道有很多,但多数集中于江河、湖泊的水体修复,而关于城市内流河的水体修复研究较少,缺少对比和优化,鉴定指标也以水质参数为主,需要丰富和完善。笔者采用不同的修复技术对同一河流水域的水样进行修复,以水质参数、微生物多样性、菌群丰度为鉴定指标,全面分析不同的修复技术对城市河流的修复效果,旨在为城市河流的水体修复提供借鉴。
1 材料与方法
1.1 样品的采集与处理
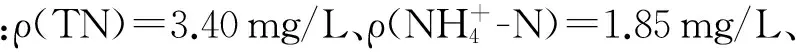
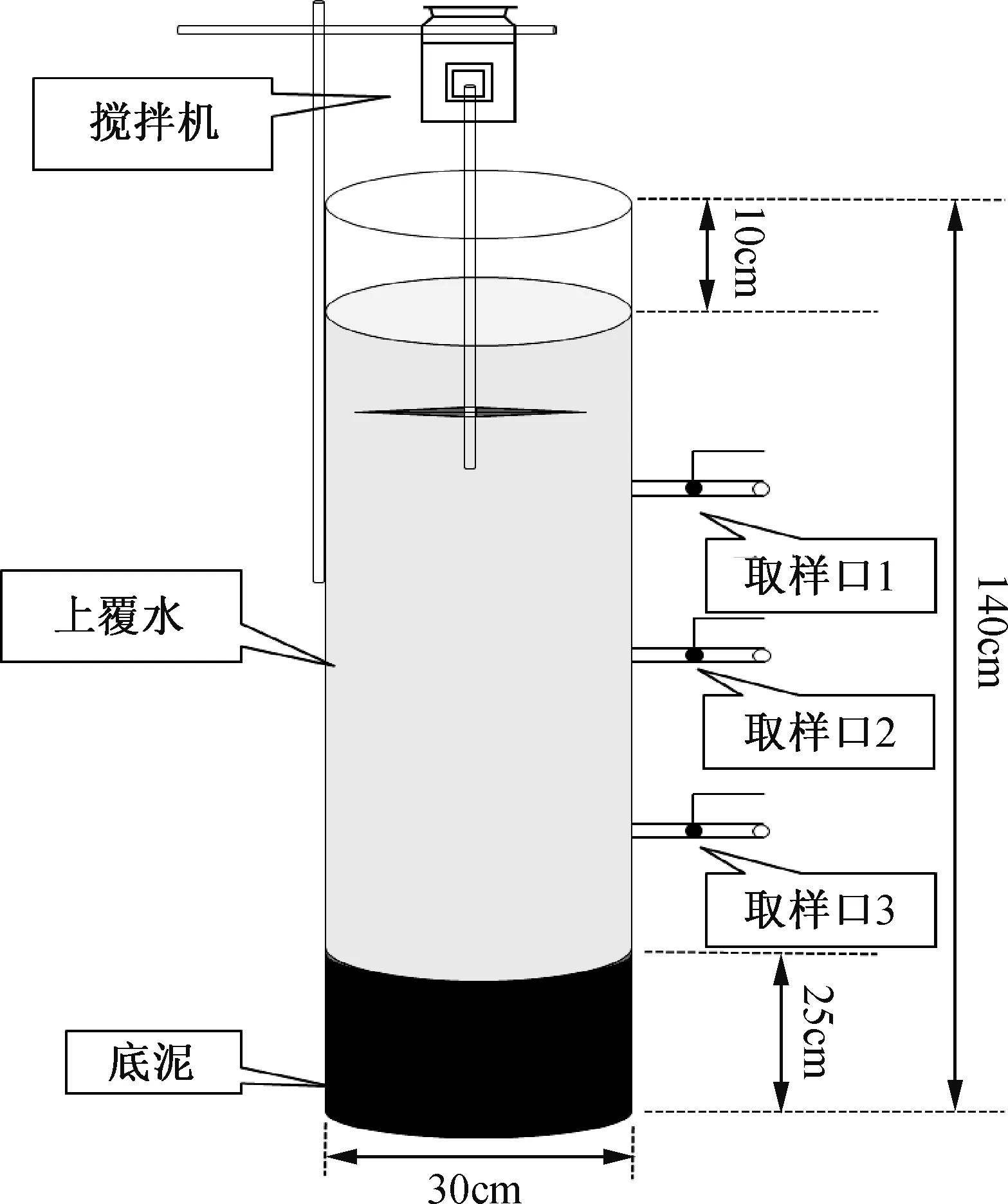
图1 有机玻璃储水器示意图
1.2 实验设计与准备
实验所用的菌剂为光合细菌和反硝化芽孢杆菌。光合细菌在市场购得,反硝化芽孢杆菌为实验室从环境中筛选出的除氮、脱COD较强的两株芽孢杆菌GY-45和GY-46。实验所用碳源为乙酸(分析纯AR),每次的投加量为3 g,COD理论增加值为12.12 mg/L。所用增氧设备为ACO-001电磁式空气泵(浙江森森实业有限公司),用玻璃转子流量计(LZB-3WB)控制增氧流量为0.63 dm3/min。实验周期为8 d,增氧方式采用连续增氧,至实验结束。菌剂和碳源的投加时间为实验前4 d,每天上午9点。其中,光合菌剂(YSB)每天的投加量为5 mL,反硝化芽孢杆菌(GY-45,GY-46)每天的投加量为1.5 mg。实验中,菌剂、碳源以及投加量等,均为目前城市内河治理中常用的菌剂、碳源种类和剂量。
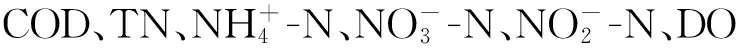

表1 不同储水器的处理方案
注:1~6 表示储水器的编号;A、B、C、M分别表示增氧(aeration)、空白(blank)、碳源(carbon)、菌剂(microbe)。
1.3 水质分析方法
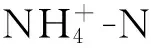
1.4 水样总DNA的提取
每个储水器取250 mL水样,用0.22 μm微孔滤膜过滤后,在超净工作台将滤膜剪碎,放入50 mL离心管中。用水样DNA提取试剂盒(OMEGA)提取样品总DNA。
1.5 16S rDNA片段的 PCR扩增
PCR采用TransStartFastPfu DNA PolyMerase,20 μL 反应体系:4 μL 5×FastPfu Buffer;2 μL 1.5 mM dNTPs;0.8 μL Forward Primer(5 μmoL/L);0.8 μL Reverse Primer(5 μmoL/L);0.4 μL FastPfu Polymerase;10 ng Template DNA;补ddH2O至20 μL。反应条件为:95℃预变性5 min;95℃变性30 s;55℃退火30 s;72℃延伸45 s,共计27个循环。最后72℃退火5 min,10℃保存。2%琼脂糖凝胶电泳检测PCR产物。
1.6 数据处理
本文所用绘图软件为origin 8.0。采用CANNO软件进行PCA、RDA等相关性分析
2 结果分析
2.1 水质净化效果
表2是各储水器净化后的水质参数。从表2可以看出,与对照水样(1B)相比,2C水样的DO值明显降低,仅为0.1 mg/L;4M水样DO值也略微下降,为4.9 mg/L;其余各水样的DO值均显著上升,在7.2~8.6 mg/L之间,达到并超过国家Ⅱ类水质标准。这主要是由于在投加碳源之后,提高水体微生物反硝化能力的同时也为水体微生物的生长提供了更加有利的条件,但微生物的生长必然会消耗大量的DO[14]。
在脱氮方面,与对照水样(1B)相比,2C、5CA和6CAM水样的TN均明显降低,脱氮率分别为57.94%、60.59%和59.71%,脱氮效果显著[15]。而3A和4M水样的TN没有明显变化,说明单独添加菌剂或者增氧对水体脱氮均无明显作用。其中,菌剂的脱氮效果与实验室对菌株脱氮效率的测定结果存在较大差距,这可能是因为菌株脱氮效率的测定是在较高浓度的TN环境(35.14 mg/L)下进行的,而实验水样中的TN值(3.40 mg/L)远低于这个水平。
COD脱除方面,3A、4M的 COD质量浓度分别为23.32 mg/L和12.93 mg/L,COD脱除率分别为32.87%和62.78%,而其他水样COD的质量浓度均有所增加,这可能是由于添加的碳源没有被及时利用所致。
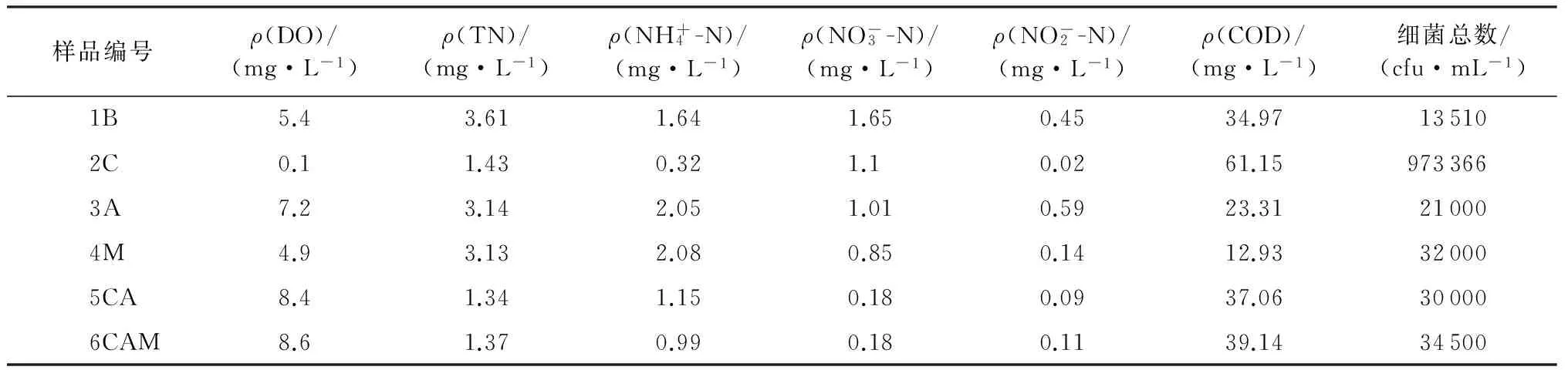
表2 各储水器的水质参数
与对照水样(1B)相比,其余水样的细菌总数(TB)均增加了2~72倍,2C水样增加尤为显著,这说明了实验所用的修复技术有利于水体微生物的生长。
2.2 菌落结构多样性分析
将扩增后的PCR产物进行高通量测序,得到的16s rRNA基因序列数目和OTUs总数见表3。通过Shannon指数和PD whole tree指数评估各水样微生物群落的多样性。从表3可以看出,各水样均有高于88%的OTUs被发现,测序结果可以真实地反映水样的微生物群落结构。2C水样的Shannon多样性指数和PD whole tree多样性指数均明显低于1B和其他水样,说明2C水样的微生物多样性在投加碳源之后明显降低,水体生态极其脆弱。3A和4M水样分别应用了曝气和生物投菌技术,其PD whole tree指数分别为61.25和61.09,与原样相比,水体的生物多样性均有所增加,但是低于5CA和6CAM水样,这两个水样综合运用了多种生物修复技术,PD whole tree多样性指数分别为65.44和68.61。

表3 不同方法处理后水体微生物OTUs多样性分析
高通量测序结果表明,1B、2C、3A、4M、5CA、6CAM中的微生物分别隶属于31、18、33、34、32、36个门,其水样的微生物群落门水平相对丰度见图2。从图2可知,2C水样中的微生物种群多样性明显低于其他水样,且以变形菌门(Proteobacteria93%)为主,其次为拟杆菌门(Bacteroidetes1%)和厚壁菌门(Firmicutes4%),在其他细菌门中的分布均低于0.1%。其余各水样中的微生物主要以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)为主,其次为厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadete)等。在其余水样中,不同菌门的相对丰度也有差别。3A和4M水样中优势菌门的丰度比较相似,而在5CA水样中,变形菌门(Proteobacteria63%)的相对丰度与原样相比提高了6%,放线菌门(Actinobacteria9%)的相对丰度则降低了11%。6CAM在变形菌门(Proteobacteria47%)的相对丰度则低于1B,而其在拟杆菌门(Bacteroidetes38%)的相对丰度则明显高于1B、2C、3A、4M(16%、7%、9%、15%)。

图2 不同水样微生物群落门水平下相对丰度比较
变形菌门虽然是各水样的主要优势菌群,但其在变形菌门内的群落分布也有差别(图3)。2C水淹的β-变形菌纲(Betaproteobacteria 63%)和γ-变形菌纲(Gammaproteobacteria 22%)在变形菌门中占据着极大的优势。3A和4M水样的β-变形菌纲(Betaproteobacteria 38% 37%)、γ-变形菌纲(Gammaproteobacteria 13% 18%)和α-变形菌纲(Alphaproteobacteria11% 20%)在其水样中的丰度则大致相同。5CAM水样中也是以β-变形菌(Betaproteobacteria 32%)为主,α-变形菌纲(Alphaproteobacteria 16%)的丰度略高于γ-变形菌纲(Gammaproteobacteria 11%)。6CAM水样β-变形菌纲(Betaproteobacteria 32%)丰度与5CAM水样相同,而α-变形菌纲(Alphaproteobacteria 15%)的丰度要明显高于γ-变形菌纲(Gammaproteobacteria 5%)。由此可见,投加了碳源的水样(2C),水体微生物多样性急剧下降,优势菌群极少,水体生态很差。而经过曝气(3A)、生物投菌技术(4M)后的水样,种群丰度和多样性均比较相似,高于原样,水体生态得到修复。综合处理(5CA、6CAM)的水样,种群丰度和多样性有较大差别,高于原样,水体生态修复效果高于其余水样。
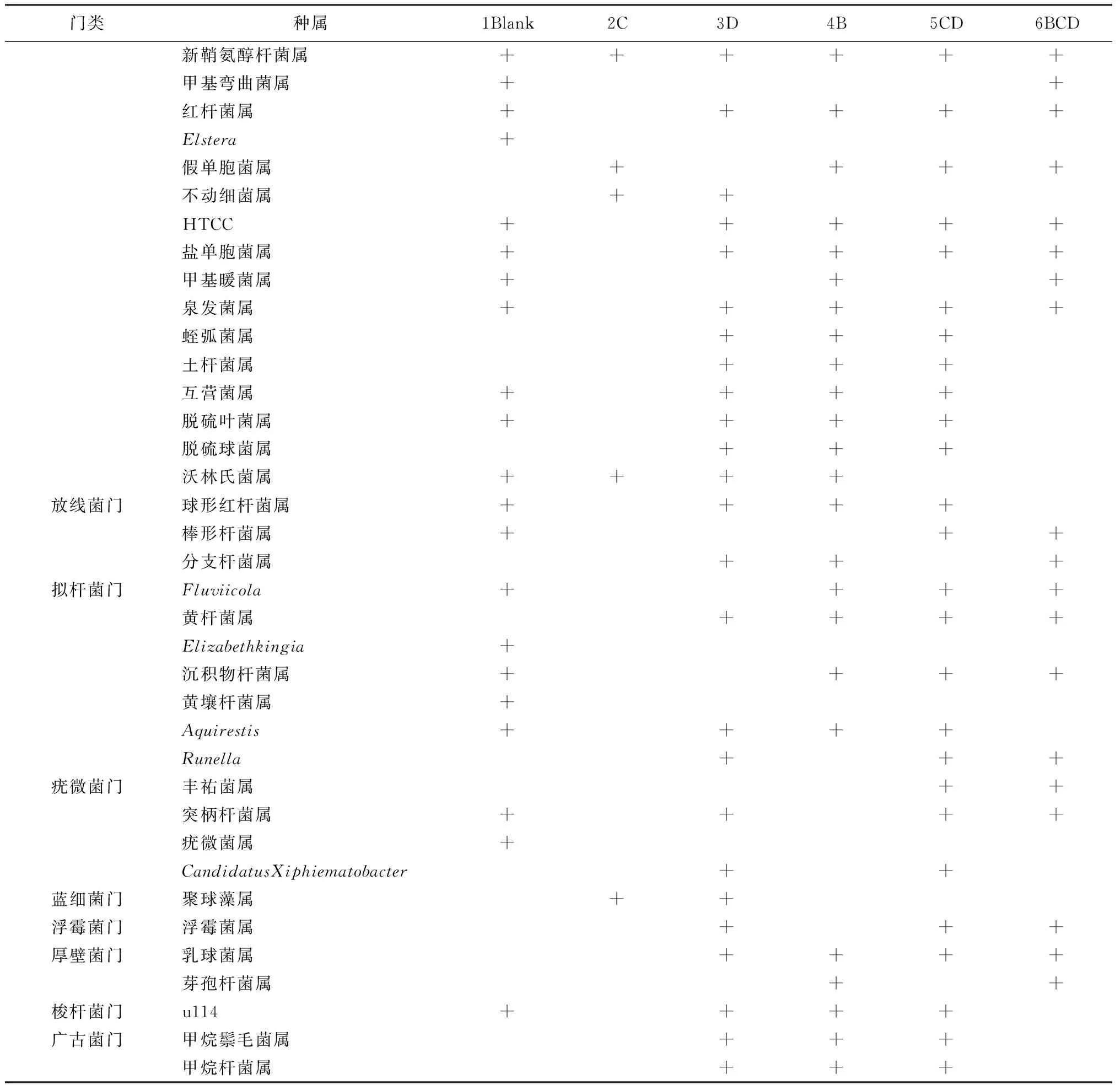
1B、2C、3A、4M、5CA、6CAM中的微生物分别隶属于96、51、109、94、102、106个属,丰度高于0.1%的优势菌属分别有14个、6个、18个、17个、13个和16个(表4)。其中,各水样中,芽孢杆菌属(Bacillus)和红细菌属(Rhodobacter)的相对丰度分别为0.007%、0.001%、0.040%、0.100%、0.009%、0.100%和0.100%、0.020%、0.200%、0.700%、0.300%、0.700%。这表明,实验所用的光合细菌和反硝化芽孢杆菌在投加后均得到了较好的生长。
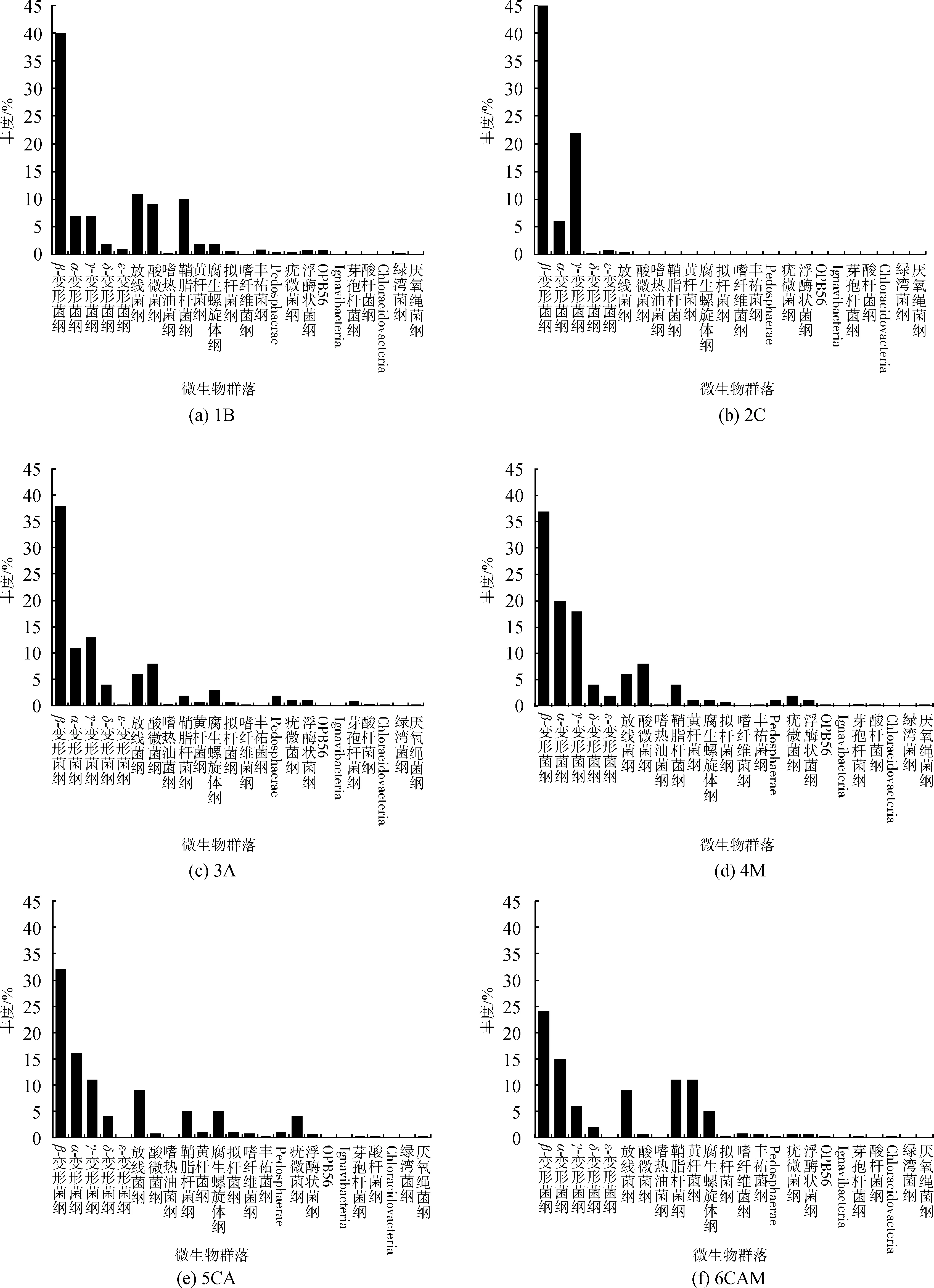
图3 各水样中微生物群落的纲水平丰度
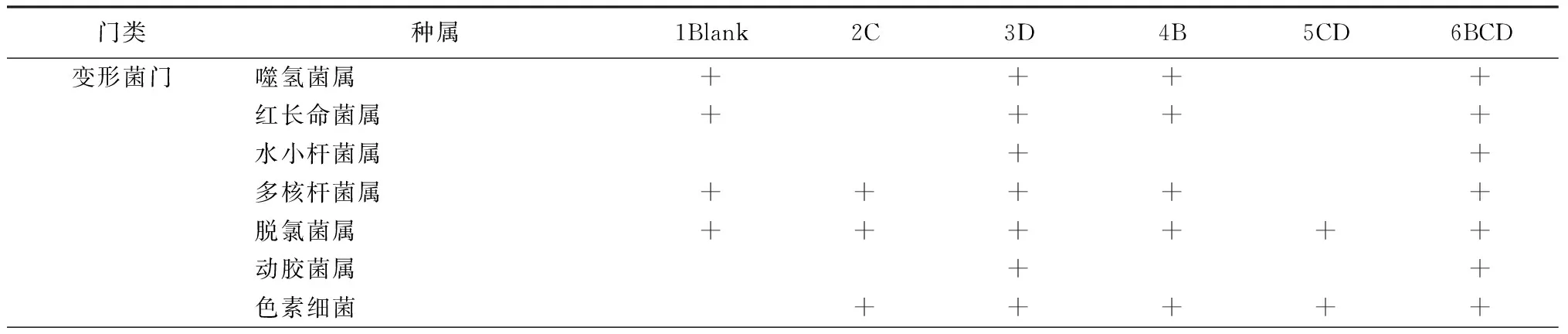
门类种属1Blank2C3D4B5CD6BCD变形菌门噬氢菌属++++红长命菌属++++水小杆菌属++多核杆菌属+++++脱氯菌属++++++动胶菌属++色素细菌+++++
续表4
注:“+”为相对丰度大于0.1%的属。
2.3 相关性分析
通过不同样本的主要微生物种属对各样本进行主成分分析(PCA),见图4。PCA的前两个变量共可解释76.7%的数据,其中第一轴可以解释55.8%的数据,第二轴可以解释20.9%的数据。从图4可以看出,1B、3A和4M样品在PCA图上的距离接近,表明这3个样本的群落组成很相似,而5CA和6CAM的群落组成则较为相似。2C距离其他样本较远,表明2C样本的群落组成与其他样本差异很大。这说明了在河流治理过程中,添加碳源容易改变水体本身的群落组成,少数菌群容易竞争形成优势菌群,并对微生物的生长产生抑制作用,而增氧和投菌技术在提高生物多样性的同时,不会对水体微生物群落结构产生较为明显的变化。
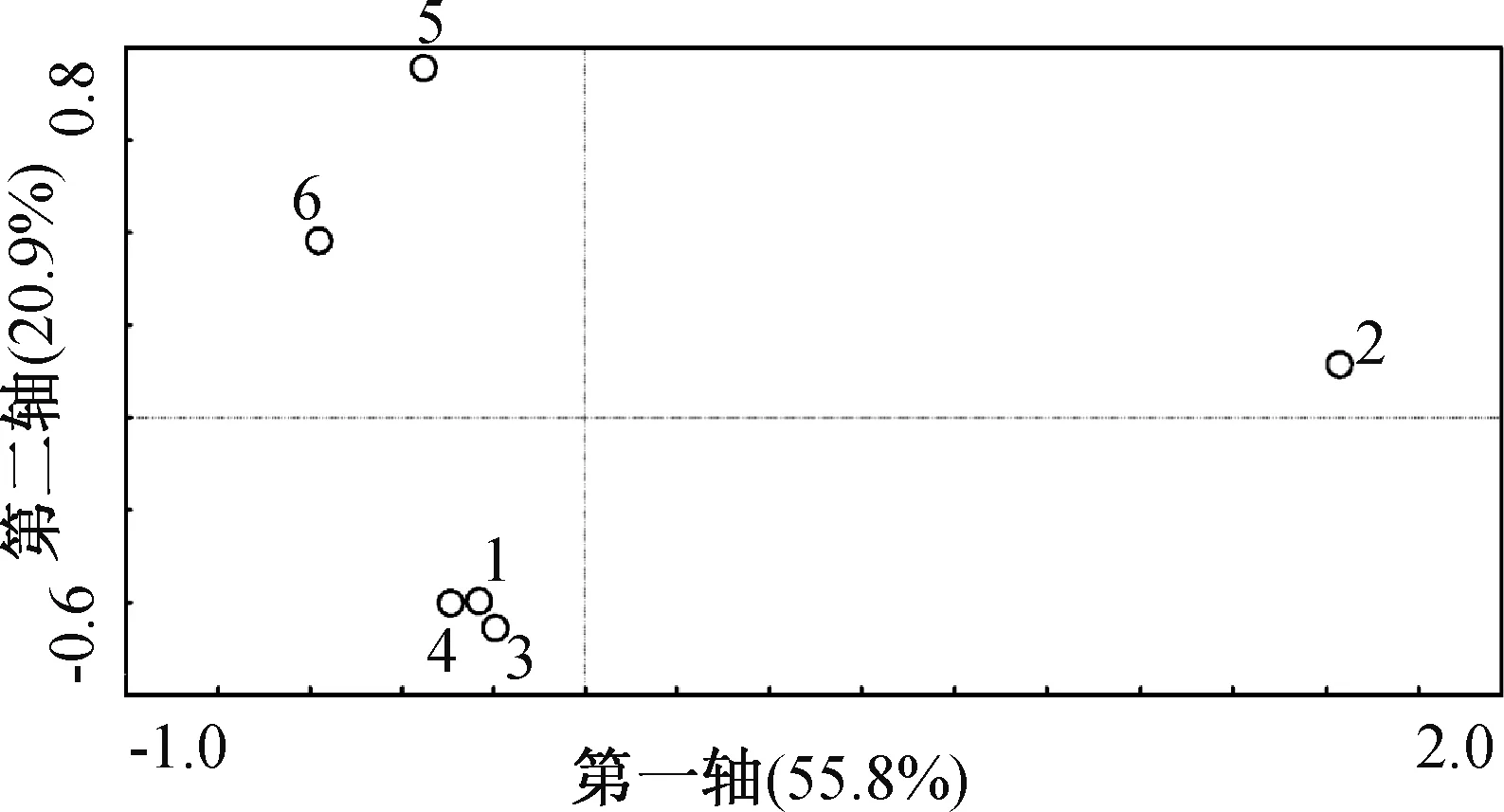
图4 不同样本的主成分分析
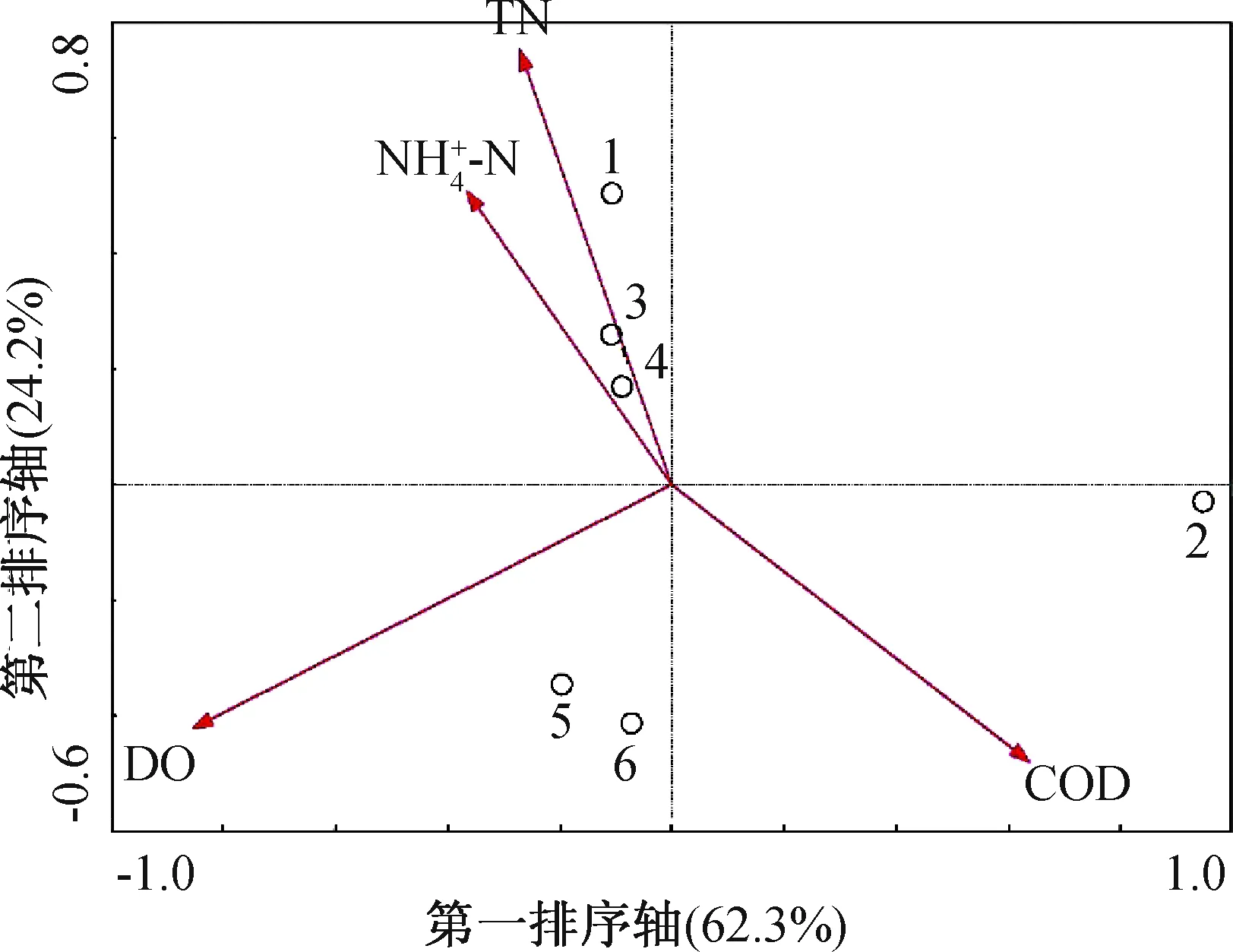
图5 不同样本的降趋势对应分析
3 讨 论
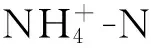
4 结 论
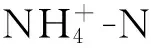
[1]张兴波,于霞.城市河流污染现状及生态修复研究[J].绿色科技,2016(12):105-106.(ZHANG Xingbo,YU Xia.Research on the current pollution situation of city rivers and the restoration of biology[J].Journal of Green Science and Technology,2016(12):105-106.(in Chinese))
[2]陈星,许钦,何新玥,等.城市浅水湖泊生态系统健康与保护研究[J].水资源保护,2016,32(2):77-81.(CHEN Xing,XU Qin,HE Xinyue,et al.Research on health evaluation and protection of urban shallow lake ecosystem[J].Water Resources Protection,2016,32(2):77-81.(in Chinese))
[3]黄显峰,郑延科,方国华,等.平原河网地区河流生态修复技术研究与实践[J].水资源保护,2017,33(5):170-176.(HUANG Xianfeng,ZHENG Yanke,FANG Guohua,et al.Research and practices of river ecological restoration technology applied in plain river network area[J].Water Resources Protection,2017,33(5):170-176.(in Chinese))
[4]李泽峰.人工湿地在汾河生态修复污水处理中的应用[J].山西水利,2012(1):28-32.(LI Zefeng.Application of constructed wetland in Fenhe River ecological rehabilitation and sewage treatment[J].Shanxi Water Resources,2012(1):28-32.(in Chinese))
[5]孙从军,张明旭.河道曝气技术在河流污染治理中的应用[J].环境保护,2001(4):12-14,20.(SUN Congjun,ZHANG Mingxu.Application of aeration technique in river pollution control[J].Environmental Protection,2001(4):12-14,20.(in Chinese))
[6]高慧琴,刘凌,闫峰,等.底泥疏浚对湖泊内源磷释放的短期效应研究[J].水资源保护,2011,27(3):33-37.(GAO Huiqin,LIU Lin,YAN Feng,et al.Short-term effect of sediment dredging on endogenous phosphorus release[J].Water Resources Protection,2011,27(3):33-37.(in Chinese))
[7]吴霞,谢悦波.直接投菌法在城市重污染河流治理中的应用研究[J].环境工程学报,2014(8):3331-3336.(WU Xia,XIE Yuebo.Application of directly adding microbial agent to improve water quality of heavily polluted urban river[J].Chinese Journal of Environmental Engineering,2014(8):3331-3336.(in Chinese))
[8]黄民生,徐亚同,戚仁海.苏州河污染支流:绥宁河生物修复试验研究[J].上海环境科学,2003(6):384-388.(HUANG Minsheng,XU Yatong,QI Renhai.Insitu bioremediation of seriously polluted Sui-ning Greek[J].Shanghai Environmental Sciences,2003(6):384-388.(in Chinese))
[9]魏源送,郑嘉熹,王光宇,等.地表水微生物溯源技术的开发和应用进展[J].水资源保护,2016,32(1):1-11.(WEI Yuansong,ZHENG Jiaxi,WANG Guangyu,et al.Development and application progress of microbial source tracking in surface water[J].Water Resources Protection,2016,32(1):1-11.(in Chinese))
[10]杨柳燕,王楚楚,孙旭,等.淡水湖泊微生物硝化反硝化过程与影响因素研究[J].水资源保护,2016,32(1):12-22.(YANG Liuyan,WANG Chuchu,SUN Xu,et al.Study on microbial nitrification and denitrification processes and influence factors in freshwater lakes[J].Water Resources Protection,2016,32(1):12-22.(in Chinese))
[11]燕文明,刘凌,赵倩维,等.小型浅水湖泊表层沉积物氨氧化古菌群落结构特征[J].河海大学学报(自然科学版),2016,44(5):449-453.(YAN Wenming,LIU Ling,ZHAO Qianwei,et al.Characteristics of community structure of AOA in surface sediments of small shallow lakes[J].Journal of Hohai University (Natural Sciences),2016,44(5):449-453.(in Chinese))
[12]刘正辉.东江氨氮污染河段的微生物群落特征[D].广州:华南理工大学,2011.
[13]谭旭.茅台地区赤水河水体微生物多样性分析[D].北京:北京化工大学,2014.
[14]丁怡,王玮,王宇晖,等.DO和碳源在人工湿地脱氮中的耦合关系分析[J].工业水处理,2015(1):5-8.(DING Yi,WANG Wei,WANG Yuhui,et al.Analysis on the coupling relationship between dissolved oxygen and carbon source in the nitrogen removal of constructed wetlands[J].Industrial Water Treament,2015(1):5-8.(in Chinese))
[15]吴文卫,杨逢乐,李转寿.利用微生物菌剂净化城市河道水质试验研究[J].环境科学导刊,2013(2):63-65.(WU Wenwei,YANG Fengle,LI Zhuanshou.A research on purifying urban river water by microbial agents[J].Environmental Science Survey,2013(2):63-65.(in Chinese))
Effectsofvariousremediationtechnologiesonwaterqualityandmicrobialcommunityinurbaninlandrivers
SHENYi,HUNan
(SchoolofBiologicalandPharmaceuticalEngineering,NanjingTECHUniversity,Nanjing211800,China)
river improvement; microbial community; high-throughput sequencing; water quality restoration
10.3880/j.issn.1004-6933.2017.06.26
沈益(1991—),男,硕士研究生,研究方向为环境微生物。E-mail:406205391@qq.com
X522
A
1004-6933(2017)06-0167-08
2016-11-28 编辑:彭桃英)

