典型人工纳米材料的水环境行为研究进展
侯 俊,次瀚林,吕博文,苗令占,刘智临
(1. 河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;2. 河海大学环境学院, 江苏 南京 210098)
典型人工纳米材料的水环境行为研究进展
侯 俊1, 2,次瀚林1, 2,吕博文1, 2,苗令占1, 2,刘智临1, 2
(1. 河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;2. 河海大学环境学院, 江苏 南京 210098)
概述典型人工纳米材料释放到水环境中可能发生的团聚、沉降、溶解等行为及其影响因素(包括pH值、离子强度、天然有机物、无机胶体、水动力条件等)。这些水环境条件通过静电作用、位阻效应、桥联作用与溶解离子络合作用等影响纳米颗粒的行为。分析当前研究的不足,认为应开展自然环境条件下的纳米材料行为研究,例如更低浓度的纳米材料环境行为、纳米材料与天然胶体之间的相互作用等,为进一步研究和预测人工纳米材料在水环境中的归趋提供理论依据。
人工纳米材料;水环境;环境行为;综述
人工纳米材料(engineered nanomaterials,ENMs)在广义上被定义为人为制造出的三维空间内至少有一维尺寸在1~100 nm的颗粒材料[1-2]。ENMs因为尺寸小、比表面积大、表面活性高等特性,在光学、医疗药剂、电子、陶瓷工业等诸多领域获得应用[3]。近年来,ENMs的大量生产和广泛应用不可避免地造成这些材料释放到环境中[4-5]。据调查,2010年全球63%~91%的ENMs进入垃圾填埋场,8%~28%释放到土壤中,0.4%~7%进入水体,还有0.1%~1.5%排入大气中[6]。ENMs在环境中的迁移规律见图1[7],进入土壤和大气的部分ENMs也会随着物质循环过程进入水环境中[7]。研究表明,ENMs作为一种新型污染物,会对环境造成不良影响[8-9]。因此早在2008年,经济合作与发展组织等国际组织就表示研究ENMs的环境行为并评估其环境效应是十分必要的,ENMs在环境中尤其是水环境中的迁移转化规律受到研究者的广泛关注。
ENMs由于其特殊的表面性质,会受到DLVO(derjaguin-landon-verwey-overbeek)作用力如范德华力、静电作用力,以及非DLVO作用力如空间位阻作用、架桥作用等的影响,在水环境中发生团聚、沉降、溶解等行为,显著影响其在水环境中的归趋、水生生物之间的相互作用以及生物毒性[10-11]。例如ENMs团聚沉降等行为会影响其在水体中的纵向分布,ENMs粒径和浓度会随水深变化从而对不同深度水体中的生物产生不同的毒性效应,此外纳米金属氧化物在水中溶解释放的金属离子也会对生物产生毒性作用。现有的研究表明,水环境中的大部分环境要素,例如粒子性质(粒径、表面电荷、粒子形态)、水化学指标(pH、离子强度、氧化还原条件、天然有机质(natural organic matter,NOM))等都会与ENMs相互作用从而改变其物理化学性质[12-14],影响ENMs的环境行为,同时水动力条件也会影响ENMs在水环境中的团聚和沉降过程[15]。

图1 ENMs在环境中的迁移转化示意图
1 ENMs在水环境中的环境行为
ENMs被释放到水体中,形成高度分散的多相体系,ENMs在基液中会发生团聚、沉降、溶解等行为(图1),而这些环境行为对评估ENMs在水环境中的迁移转化规律及生物毒性有着至关重要的作用[16-17]。
1.1 ENMs在水环境中的聚沉行为
在水环境中,ENMs表面带有电荷而吸引周围相反电荷,这些反号离子在两相界面呈扩散分布,形成双电层结构[18]。根据DLVO理论,ENMs之间存在范德华引力和双电层排斥力,二者之和决定了颗粒之间是相互吸引还是排斥[19]。范德华力和静电斥力共同作用使得ENMs之间存在能量势垒。pH和离子强度引起静电斥力的变化破坏了由能量势垒造成的ENMs颗粒之间的稳定平衡,当静电斥力降低,能量势垒减弱或消失,ENMs颗粒之间更容易发生团聚。ENMs本身的性质也会影响其聚集。Tso等[20]发现,在同样的环境条件下,nZnO比nTiO2和nSiO2团聚速率快,且更容易溶解释放离子。Li等[21]的研究表明,nAg在水中的团聚与其表面涂层有关。除此之外,在水环境中还存在大量的大分子NOM 和无机胶体,浓度远大于ENMs,因此ENMs与大分子NOM 和无机胶体之间的异相团聚也不可忽略[22]。Huynh等[23]发现,ENMs与NOM 或自然胶体的异团聚效率与各相浓度有关。
ENMs在水环境中团聚成较大的颗粒后,会在重力作用下沉降,ENMs的沉降过程是造成ENMs从水环境迁移到沉积物的主要原因。Zhu等[24]发现在水溶液中,尺寸较大的ENMs团聚体迅速沉降到底部,尺寸较小的颗粒悬浮于溶液中。Lyu等[25]进行了长期的聚沉实验,实验结果表明,nCeO2在水中团聚后,会产生分层现象,粒径大于1 000 nm的颗粒沉降在底部,粒径较小的则悬浮于溶液中,因此认为粒径1 000 nm左右是nCeO2重力与浮力平衡的临界尺寸。此外,由于自然水体中存在大量天然无机胶体,ENMs与无机胶体之间的异团聚更容易发生,无机胶体是造成ENMs沉降的主要因素[26]。ENMs在水中的沉降过程符合一级反应动力学[27],可以通过式(1)估算ENMs的沉降速率[27-28]:
(1)
式中:Ct为时间t时的物质浓度;Vs为沉降速率;C0为初始浓度;Cns为实验时间内未沉降物质的浓度;h为沉降高度;Kdis为溶解常数,溶解量很少时可忽略;t为沉降时间。
由于沉降速率与ENMs自团聚和异团聚速率及团聚体粒径相关[27],因此沉降也会受到水环境条件的影响,在不同自然水体中,ENMs沉降速率不同[28]。沉降速率快表明ENMs在水体中停留时间较短,而在水底沉积物中积累量较多,沉降速率慢则意味着ENMs会在水体中经过更长距离的运输,从而分布更加广泛。沉降速率这一参数对于预测ENMs环境浓度及迁移转化规律和潜在生物毒性等有着重要意义。
ENMs的聚沉行为是研究其在水环境中的迁移性、可生物利用性及生物毒性的关键,在ENMs环境行为的研究中受到广泛关注。
1.2 ENMs在水环境中的溶解动力学
一些金属或金属氧化物ENMs会在水溶液中发生溶解行为,产生金属离子,例如nCuO、nAg、nZnO在水溶液中可以解离出Cu2+、Ag+和Zn2+。ENMs溶解的程度也受到自身性质和水化学条件的影响[29-30]。通常粒径较小、比表面积较大的颗粒更容易溶解,例如,小尺寸(4±1nm)的nZnO比一般的nZnO(gt;10nm)更容易溶解产生Zn2+[31]。当nAg在水中发生聚集行为、形成粒径较大的聚集体时,nAg溶解速率降低[32]。因此,当nAg初始浓度较高时,nAg颗粒更容易聚集,比表面积变小,Ag+释放量降低[33]。这是因为小尺寸颗粒比表面积更大,具有更高的表面能。除此之外,nAg表面涂层也会影响其溶解规律,例如聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)和单宁酸包裹的nAg比柠檬酸盐包裹的nAg更容易溶解[34]。在之前的研究中,通常用准一级反应动力学方程描述ENMs溶解释放金属离子的过程[32-33,35]:
Ct=C0(1-e-kt)
(2)
式中:C0为初始ENMs初始浓度;k为一级反应速率常数。
但He等[36]认为在自然条件下,准一级反应具有一定的局限性,例如nAg在水体中发生团聚和氧化还原反应会影响nAg的溶解,因此Zhang等[37-38]采用两阶段反应模型拟合nAg的溶解过程:
(3)
式中:CAgNPs(0)为实始的nAg浓度;CAgNPs(E)为反应过程中达到溶解平衡时的nAg浓度;CAgNPs(t)为溶解过程中t时刻nAg的浓度。
在第一阶段,只有易发生反应的“活跃”部分nAg颗粒溶解,而第二阶段,由于受到nAg溶解性的限制或者nAg团聚或发生氧化还原反应,溶解反应停止,溶解银离子浓度达到平衡状态。氧化还原反应影响nAg溶解主要是由于好氧条件下nAg颗粒表面容易生成Ag2O,抑制nAg溶解释放Ag+[36]。因此研究溶解性质类似于nAg的ENMs,例如nCuO、nZnO[29-30]等金属类ENMs溶解行为,还需要考虑ENMs自身团聚以及水体中的氧化还原条件对溶解的影响。
2 水中ENMs环境行为的影响因素
ENMs在水环境中的团聚、沉降、溶解等环境行为会受到水化学条件和水动力条件的影响,例如pH、离子强度、天然有机质、无机胶体、水流剪切力等。
2.1 pH和离子强度

通常静电作用稳定的ENMs体系,其稳定程度除了受到ENMs表面电荷的影响,还取决于整个体系中电解质的浓度。ENMs在水溶液中会形成双电层结构,水中的离子会产生压缩双电层或吸附电中和效应,从而促进ENMs的团聚。有研究表明,二价离子比单价离子更有利于促进ENMs聚集,因为二价离子压缩双电层作用显著[46]。相同pH条件下,二价离子可以显著增快纳米硼、C60、nTiO2及其他纳米金属或氧化物等ENMs的聚集速率[24,47-49]。通过测量zeta电位发现,ENMs表面电荷随电解质溶液浓度升高而降低,这是因为电解质溶液中的离子会覆盖在ENMs表面形成离子屏障,降低ENMs的表面电荷,从而促进ENMs团聚。
引起胶体快速聚沉的电解质浓度称为临界聚沉浓度。根据Schulze Hardy法则,临界聚沉浓度与离子价位(Z)倒数的六次方成正比。有研究发现Ca2+和Mg2+溶液对柠檬酸包裹的nAg(nAgCIT)的临界聚沉浓度远低于Na+溶液,符合Schulze Hardy法则[50]。几种常见ENMs的临界聚沉浓度如表1所示。此外电解质也可以影响ENMs的溶解。Chambers等[51]研究发现阴离子可以加速nAg的溶解,主要原因是阴离子与纳米Ag形成Ag(Ⅰ)复合物或反应生成沉淀。
表1几种常见ENMs的临界聚沉浓度mmol/L

ENMs种类C(Na+)C(Ca2+)nAgCIT[50]122±2.82.2±0.1nAgPVP[52]111.54.9nCeO[25]28216nCuO[53]54.52.9C[47]601204.8
2.2 天然有机质及沉积物
在自然水体中存在各种NOM,例如蛋白质、多糖、腐殖酸、富里酸、微生物分泌的胞外聚合物等,由于ENMs比表面积较大,在自然水体中,ENMs会吸附大量NOM[19],吸附了NOM的ENMs之间由于位阻效应和静电排斥,稳定性增强[54]。现有的研究结果表明,细菌胞外聚合物(EPS)、藻酸盐和牛血清蛋白(BSA)等有机物都会增加ENMs的稳定性,抑制其聚集,如图2(a)所示,其中BSA作用更明显[35,55-56]。不同有机质抑制ENMs团聚的作用机制也不相同。Miao等[35]通过zeta电位的测量发现,EPS和多糖可以改变nCuO表面电荷电性,说明在这两种NOM 存在时,静电排斥是抑制nCuO团聚的主要机制;而BSA并没有明显改变nCuO的表面电性,且BSA分子量小,因此认为空间位阻效应是BSA抑制nCuO团聚的主要机制。NOM 除了抑制ENMs粒径增长,还可以使已经团聚的ENMs团聚体解聚(图2(b)),例如nTiO2在pH=8.2且含有1.125 mmol/L Ca2+和0.21 mmol/L Mg2+的水体中(模拟自然湖水的pH和硬度)团聚成3 000 nm左右的团聚体,添加藻酸盐后团聚体解聚,粒径减小,主要是由于nTiO2团聚体吸附藻酸盐而产生空间位组效应和静电排斥作用,因此藻酸盐浓度越高,解聚现象越明显[57]。此外,EPS、藻酸盐和BSA还可以促进nCuO的溶解,其中EPS促进nCuO溶解释放Cu2+的能力更强,是由于EPS是一种复杂的高分子聚合物,其中含有多糖、蛋白质和腐殖类物质,官能团种类较多,与金属离子结合能力较强,从而加速了nCuO的溶解[35]。
虽然通常认为NOM 可以增加ENMs稳定性,抑制其聚集,但在特定条件下或延长反应时间,某些大分子NOM 也可能促进ENMs的团聚。例如添加多糖可以增加nCuO在各种浓度Na+溶液中的稳定性,但在高浓度Ca2+溶液中由于多糖分子与Ca2+的架桥作用形成凝胶状有机质胶体,这些有机胶体包裹并连接在nCuO团聚体之间(图2(c)),即在高浓度二价阳离子条件下nCuO颗粒的团聚现象更加明显[53]。Bian等[31]研究发现,腐殖酸浓度在7.3~14 mg/L范围内,nZnO颗粒最稳定,不易团聚,但在长期观察中发现,120 min之后,ENMs悬液不稳定,并有团聚倾向,nZnO的Zeta电位由正值变为负值,表明在120 min内腐殖酸逐渐吸附于ENMs表面,ENMs与腐殖酸复杂的官能团发生架桥反应改变了nZnO的表面电性。有机质浓度也会影响ENMs团聚,Oriekhova等[58]在研究中发现,低浓度(lt;1 mg/L)富里酸(fulvic acid,FA)可以抑制nCeO2团聚;但逐渐增加FA浓度,溶液中形成较大FA-nCeO2配合物,低pH时nCeO2和FA电性相反,更容易形成配合物,高pH时二者电性相同,不易形成配合物。因此NOM对ENMs团聚行为的影响与NOM 种类、浓度及水环境条件如离子强度、pH等有关。

(a) NOM抑制ENMs团聚

(b) NOM使RNMs团聚体解聚

(c) NOM凝胶通过架桥作用促进ENMs团聚
自然水体中也存在沉积物,由于ENMs可以吸附于沉积物表面,吸附到固相成分表面的ENMs,可移动性降低,可生物利用性也会降低[59]。Van Koetsem等[60]将沉积物溶于超纯水中,向其中加入nAg和nCeO2,进行离心分离,探究ENMs在固相和液相中的分布规律。结果表明,经过离心分离后,比起Ag+和Ce3+,nAg和nCeO2更倾向于停留在液相中,这说明比起溶解于水中的离子而言,ENMs移动性较强,更易迁移。沉积物作为一种载体,上面吸附着多种有机物和排放进水体中的污染物[61],这些物质都可能与ENMs发生反应,从而影响ENMs的性质。
2.3 天然无机胶体
自然水体中存在大量无机胶体,无机胶体的颗粒浓度远大于ENMs。在水环境中,无机胶体与ENMs之间的相互作用对于ENMs的聚沉行为也有着非常重要的影响[27]。无机胶体分为黏土矿物、水合氧化物胶体及其他悬浮物质等。黏土矿物具有特殊的层状结构,会与ENMs发生团聚。硅离子和铝离子对低价离子的同晶型取代使黏土表面带有永久负电荷,但黏土边缘所带电荷会受到水环境pH和离子强度的影响,黏土颗粒还具有一定的离子交换能力[62]。黏土矿物与ENMs之间主要通过静电作用发生异团聚。Zhou等[63]研究了蒙脱土和nAg、nTiO2两种典型ENMs之间的异团聚,为了模拟自然水体环境并探究异团聚作用机制,实验选取了两种pH条件,pH=4低于蒙脱土边缘pHzpc,edge,pH=8高于pHzpc,edge。虽然蒙脱土zeta电位随pH变化很小,但在低pH时,蒙脱土表面和边缘电荷电性相反,体系不稳定,蒙脱土可以降低nAg、nTiO2的临界聚沉浓度,促进团聚;pH=8时,蒙脱土表面和边缘都带负电,静电排斥作用使得体系较为稳定[63-64],如图3所示。高岭土、伊利石与nAg、nTiO2之间的异团聚规律也是如此[64-65]。此外Wang等[64]还研究了NOM 对该体系聚集的影响,腐殖酸吸附在ENMs和高岭土表面,并通过静电作用或位阻效应抑制ENMs与高岭土之间的团聚,从而增强体系的稳定性。除金属或金属氧化物ENMs之外,其他ENMs(例如氧化石墨烯)也会与无机胶体发生异团聚。Zhao等[66]研究了纳米氧化石墨烯(GO)与不同种类天然无机胶体(蒙脱土、高岭土和针铁矿)在水环境中的异团聚。研究表明,GO和带正电荷的针铁矿由于静电吸引而发生异团聚,但与带负电的蒙脱土和高岭土之间没有这样的反应。该研究用一种线性模型与GO-针铁矿吸附等温线拟合,吸附于针铁矿表面的GO不容易脱附,这种解吸的滞后性主要是由于GO-针铁矿团聚体多层构型稳定性较高。Sotirelis等[67]通过研究GO和高岭土之间的热力学吸附过程,发现GO与高岭土之间的异团聚是焓驱动下的放热非自发反应,在高温下更容易发生。
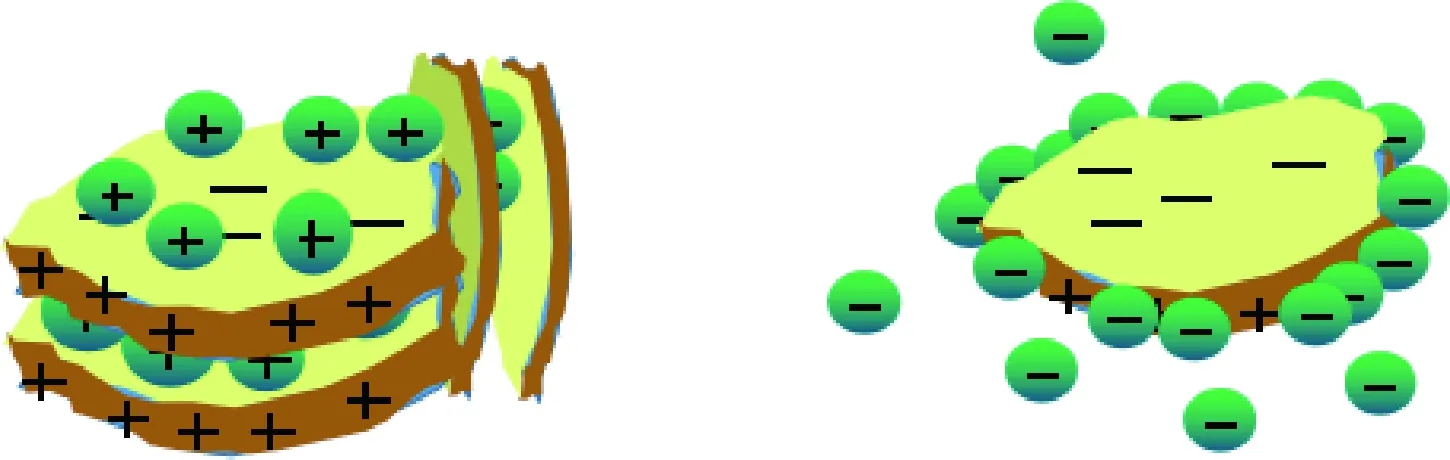
(a) pHlt;pHzpc,edge,黏土表面和边缘电荷相反

(b) pHgt;pHzpc,edge,黏土表面和边缘电荷相同
常见的水合氧化物胶体有SiO2、Al2O3的水合物等。Praetorius等[44]通过SiO2和nTiO2团聚实验数据和描述胶体碰撞的Smolu-Model模型拟合,计算得到不同水环境条件下的异团聚速率(αhetero)。Praetorius等[44]认为SiO2和nTiO2二元体系中,聚集过程分为两个步骤,首先nTiO2吸附在SiO2表面,该过程为初级团聚,随后吸附了nTiO2的SiO2颗粒之间聚集形成更大的颗粒,成为二次团聚。研究结果表明酸性条件(pH=5)时,异团聚速率与nTiO2浓度有关,当浓度较低时,αhetero很小,只有当nTiO2浓度达到临界浓度时才发生异团聚,且由于SiO2和nTiO2电性相反,因此αhetero可以接近1。当pH=8,SiO2和nTiO2电性相同,αhetero主要由盐浓度决定,在盐溶液浓度低时αhetero很小,盐溶液浓度高时αhetero接近1,腐殖酸(SRHA)可以抑制SiO2和nTiO2之间的异团聚。该研究将NPs和NCs之间的异团聚情况用量化的方式表征。
总体上讲,无机胶体与ENMs之间的异团聚也会受到水环境条件的影响,与ENMs自团聚相似,当体系中存在相反电荷时,由于静电吸引,团聚现象明显,但当体系中电荷电性相同,则可认为是同相团聚,例如黏土与nAg在中性pH条件下的异团聚行为与黏土胶体团聚行为相似[65]。无机胶体和ENMs都是纳米尺寸级别的颗粒物,目前,异团聚的研究方法和分析手段是借鉴ENMs自团聚的研究,但通过体系平均粒径的变化无法准确区分ENMs自团聚和ENMs与其他胶体的异团聚以及这两个过程发生的先后顺序,这也是这一领域目前存在的问题。
2.4 水动力条件
在自然水体中,水流条件及由水流产生的剪切力是影响ENMs聚集行为不可忽略的因素。但目前,关于不同水动力条件下的ENMs稳定性的研究较少。Yin等[68]研究发现在pH值、搅拌时间等其他条件相同时,随着搅拌速度的增加,赤铁矿颗粒絮凝现象越来越明显,且絮凝体平均粒径增大;当搅拌速度大于1 400 r/min时,絮凝体的平均粒径减小,说明搅拌速度过大时,会对絮凝体造成破坏。Chekli等[69]研究了ENMs在海水、湖水、河水、污水厂出水、地下水等5种水体中的团聚情况,并在团聚实验中施加一定的机械搅拌,明显观察到ENMs被破坏,ENMs粒径随剪切力增强而减小,但这种变化在一定程度上是可逆的,即剪切力减弱或停止后,ENMs会再次团聚,这是由于ENMs之间既有易被破坏的物理作用例如范德华力,也存在较为强烈的化学作用,例如氢键、有机物架桥等[15,70]。通过化学作用链接的团聚体结构紧密,不易受到水动力条件的影响,但通过物理作用形成的团聚体结构松散,在水流速较快的时候容易被分散[15]。团聚体的形态结构与水环境条件有关,ENMs在海水中的聚集体结构较为松散,容易被破坏,但在湖水中的聚集体结构紧密,不易被破坏。这是由于在海水中主要受到离子强度的影响,聚集体之间通过范德华力或静电作用结合起来,而在湖水中,由于包裹了天然有机物,聚集体之间通过化学键的作用结合,不易受到破坏。因此水动力条件对ENMs团聚行为的影响与水化学条件和团聚机制有关。
水流剪切力除了会改变ENMs团聚体的尺寸,还会破坏ENMs由于团聚沉降形成的纵向分层现象,使得沉降的ENMs再悬浮,增加ENMs的可移动性[25]。
3 结论与展望
迄今为止,对于ENMs在水环境中的环境行为,特别是团聚行为的研究已经取得很大进展,现有研究结果表明,ENMs在水环境中的团聚、沉降和溶解等行为除了受到其自身性质的影响,还与水环境条件如pH、离子强度、NOM种类和浓度、天然无机胶体和水动力条件等有关。在自然水环境中,ENMs的迁移受自身理化性质和水环境条件的共同影响,阐明各因素的交互作用机制,有助于准确评价ENMs在自然水环境中的行为和归趋。虽然研究者们对于ENMs在水环境中的行为取得了一些共识,但该领域的研究还存在一些问题有待解决:
a. 在水环境中,ENMs的含量是非常微量的,但由于检测手段的限制,目前的研究大多是在mg级别,更低浓度的、接近自然环境或污水处理系统浓度的ENMs聚沉、溶解等行为的研究是目前所欠缺的。
b. 在自然条件下ENMs与无机胶体的异团聚比ENMs自团聚更容易发生,但目前这方面研究还不够完善,特别是在NOM 存在条件下,ENMs与天然无机胶体之间的异团聚和沉降规律及机制还有待进一步探索。
c. ENMs在复杂体系中,例如当水体中还存在其他颗粒物如无机胶体或蛋白质、微生物等生物质时,目前只是宏观地通过粒径变化来表征ENMs的性质,而未能通过有效的方法将ENMs的自团聚和ENMs与其他胶体的异团聚区分开,运用更直接的颗粒分析手段进行ENMs单颗粒的分析将有助于深入研究ENMs在复杂水体中的行为,这也将成为今后的研究重点。
[1]DUNPHY K A,FINNEGAN M P,BANFIELD J F.Influence of surface potential on aggregation and transport of titania nanoparticles[J].Environmental Science amp; Technology,2006,40(24):7688-7693.
[2]李轶,殷亚远,王超,等.纳米二氧化钛和铜对大型溞的联合毒性[J].河海大学学报(自然科学版),2016,44(2):95-100.(LI Yi,YIN Yayuan,WANG Chao,et al.Joint toxicity of titanium dioxide nanoparticles and copper on Daphnia magna [J].Journal of Hohai University (Natural Sciences),2016,44(2):95-100. (in Chinese))
[3]夏俊,陆光华,赵海洲,等.人工纳米材料在流动水域中的环境行为与生物效应[J].水资源保护,2013,29(6):1-5.(XIA Jun,LU Guanghua,ZHAO Haizhou,et al.Environmental behaviors and biological effects of manufactured nanomaterials in flowing waters[J].Water Resources Protection,2013,29(6):1-5.(in Chinese))
[4]NOWACK B,BUCHELI T D.Occurrence,behavior and effects of nanoparticles in the environment[J].Environmental Pollution,2007,150(1):5-22.
[5]GOTTSCHALK F,SONDERER T,SCHOLZ R W,et al.Modeled environmental concentrations of engineered nanomaterials(TiO2,ZnO,Ag,CNT,fullerenes)for different regions[J].Environmental Science amp; Technology,2009,43(24):9216-9222.
[6]KELLER A A,MCFERRAN S,LAZAREVA A,et al.Global life cycle releases of engineered nanomaterials[J].Journal of Nanoparticle Research,2013,15(6):1692.
[7]MEESTERS J A J,QUIK J T K,KOELMANS A A,et al.Multimedia environmental fate and speciation of engineered nanoparticles:a probabilistic modeling approach[J].Environmental Science:Nano,2016,3(4):715-727.
[8]CHAE Y J,PHAM C H,LEE J,et al.Evaluation of the toxic impact of silver nanoparticles on Japanese medaka(Oryzias latipes)[J].Aquatic Toxicology,2009,94(4):320-327.
[9]SCOWN T M,VAN AERLE R,TYLER C R.Review:do engineered nanoparticles pose a significant threat to the aquatic environment?[J].Critical Reviews in Toxicology,2010,40(7):653-670.
[10]LI X,LENHART J J,WALKER H W.Aggregation kinetics and dissolution of coated silver nanoparticles[J].Langmuir,2011,28(2):1095-1104.
[11]GAISER B K,FERNANDES T F,JEPSON M A,et al.Interspecies comparisons on the uptake and toxicity of silver and cerium dioxide nanoparticles[J].Environmental Toxicology and Chemistry,2012,31(1):144-154.
[12]AIKEN G R,HSU-KIM H,RYAN J N.Influence of dissolved organic matter on the environmental fate of metals,nanoparticles,and colloids[J].Environmental Science and Technology-Columbus,2011,45(8):31-96.
[13]CHANG Y N,ZHANG M,Xia L,et al.The toxic effects and mechanisms of CuO and ZnO nanoparticles[J].Materials,2012,5(12):2850-2871.
[14]YANG Y,ZHANG C,HU Z.Impact of metallic and metal oxide nanoparticles on wastewater treatment and anaerobic digestion[J].Environmental Science:Processes amp; Impacts,2013,15(1):39-48.
[15]LV X,TAO J,CHEN B,et al.Roles of temperature and flow velocity on the mobility of nano-sized titanium dioxide in natural waters[J].Science of the Total Environment,2016,565:849-856.
[16]APPLEROT G,LELLOUCHE J,LIPOVSKY A,et al.Understanding the antibacterial mechanism of CuO nanoparticles:revealing the route of induced oxidative stress[J].Small,2012,8(21):3326-3337.
[17]KLAINE S J,ALVAREZ P J J,BATLEY G E,et al.Nanomaterials in the environment:behavior,fate,bioavailability,and effects[J].Environmental Toxicology and Chemistry,2008,27(9):1825-1851.
[18]VERWEY E J W,OVERBEEK J T G.Theory of the stability of lyophobic colloids[M].New York:Courier Corporation,1999.
[19]ZHANG Y,CHEN Y,WESTERHOFF P,et al.Impact of natural organic matter and divalent cations on the stability of aqueous nanoparticles[J].Water Research,2009,43(17):4249-4257.
[20]TSO C,ZHUNG C,SHIH Y,et al.Stability of metal oxide nanoparticles in aqueous solutions[J].Water Science and Technology,2010,61(1):127-133.
[21]LI X,LENHART J J.Aggregation and dissolution of silver nanoparticles in natural surface water[J].Environmental Science amp; Technology,2012,46(10):5378-5386.
[22]PRAETORIUS A,SCHERINGER M,HUNGERBÜHLER K.Development of environmental fate models for engineered nanoparticles:a case study of TiO2nanoparticles in the Rhine River[J].Environmental Science amp; Technology,2012,46(12):6705-6713.
[23]HUYNH K A,MCCAFFERY J M,CHEN K L.Heteroaggregation of multiwalled carbon nanotubes and hematite nanoparticles:rates and mechanisms[J].Environmental Science amp; Technology,2012,46(11):5912-5920.
[24]ZHU M,WANG H,KELLER A A,et al.The effect of humic acid on the aggregation of titanium dioxide nanoparticles under different pH and ionic strengths[J].Science of the Total Environment,2014,487:375-380.
[25]LV B,WANG C,HOU J,et al.Influence of shear forces on the aggregation and sedimentation behavior of cerium dioxide(CeO2)[J].Journal of Nanoparticle Research,2016,18(7):1-12.
[26]QUIK J T K,STUART M C,WOUTERSE M,et al.Natural colloids are the dominant factor in the sedimentation of nanoparticles[J].Environmental Toxicology and Chemistry,2012,31(5):1019-1022.
[27]QUIK J T K,VAN DE MEENT D,Koelmans A A.Simplifying modeling of nanoparticle aggregation-sedimentation behavior in environmental systems:a theoretical analysis[J].Water Research,2014,62:193-201.
[28]QUIK J T K,VELZEBOER I,WOUTERSE M,et al.Heteroaggregation and sedimentation rates for nanomaterials in natural waters[J].Water Research,2014,48:269-279.
[29]BONDARENKO O,IVASK A,KKINEN A,et al.Sub-toxic effects of CuO nanoparticles on bacteria:kinetics,role of Cu ions and possible mechanisms of action[J].Environmental Pollution,2012,169:81-89.
[30]MAJEDI S M,KELLY B C,LEE H K.Role of combinatorial environmental factors in the behavior and fate of ZnO nanoparticles in aqueous systems:a multiparametric analysis[J].Journal of Hazardous Materials,2014,264:370-379.
[31]BIAN S W,MUDUNKOTUWA I A,RUPASINGHE T,et al.Aggregation and dissolution of 4 nm ZnO nanoparticles in aqueous environments:influence of pH,ionic strength,size,and adsorption of humic acid[J].Langmuir,2011,27(10):6059-6068.
[32]LIU J,HURT R H.Ion release kinetics and particle persistence in aqueous nano-silver colloids[J].Environmental Science amp; Technology,2010,44(6):2169-2175.
[33]ZHANG W,YAO Y,SULLIVAN N,et al.Modeling the primary size effects of citrate-coated silver nanoparticles on their ion release kinetics[J].Environmental Science amp; Technology,2011,45(10):4422-4428.
[34]DOBIAS J,BERNIER-LATMANI R.Silver release from silver nanoparticles in natural waters[J].Environmental Science amp; Technology,2013,47(9):4140-4146.
[35]MIAO L,WANG C,HOU J,et al.Enhanced stability and dissolution of CuO nanoparticles by extracellular polymeric substances in aqueous environment[J].Journal of Nanoparticle Research,2015,17(10):404.
[36]HE D,JONES A M,GARG S,et al.Silver nanoparticle-reactive oxygen species interactions:application of a charging-discharging model[J].The Journal of Physical Chemistry C,2011,115(13):5461-5468.
[37]ZHANG C,HU Z,DENG B.Silver nanoparticles in aquatic environments:physiochemical behavior and antimicrobial mechanisms[J].Water Research,2016,88:403-427.
[38]KITTLER S,GREULICH C,DIENDORF J,et al.Toxicity of silver nanoparticles increases during storage because of slow dissolution under release of silver ions[J].Chemistry of Materials,2010,22(16):4548-4554.
[39]PHILIPPE A,SCHAUMANN G E.Interactions of dissolved organic matter with natural and engineered inorganic colloids:a review[J].Environmental Science amp; Technology,2014,48(16):8946-8962.
[40]ZHANG Y,CHEN Y,WESTERHOFF P,et al.Stability of commercial metal oxide nanoparticles in water[J].Water Research,2008,42(8):2204-2212.
[41]HSU J P,NACU A.An experimental study on the rheological properties of aqueous ceria dispersions[J].Journal of Colloid and Interface Science,2004,274(1):277-284.
[42]VALE G,FRANCO C,DINIZ M S,et al.Bioavailability of cadmium and biochemical responses on the freshwater bivalve Corbicula fluminea-the role of TiO2nanoparticles[J].Ecotoxicology and Environmental Safety,2014,109:161-168.
[43]REDDY K J,MCDONALD K J,KING H.A novel arsenic removal process for water using cupric oxide nanoparticles[J].Journal of Colloid and Interface Science,2013,397:96-102.
[44]PRAETORIUS A,LABILLE J,SCHERINGER M,et al.Heteroaggregation of titanium dioxide nanoparticles with model natural colloids under environmentally relevant conditions[J].Environmental Science amp; Technology,2014,48(18):10690-10698.
[45]ZHANG H,CHEN B,BANFIELD J F.Particle size and pH effects on nanoparticle dissolution[J].The Journal of Physical Chemistry C,2010,114(35):14876-14884.
[46]SON J,VAVRA J,FORBES V E.Effects of water quality parameters on agglomeration and dissolution of copper oxide nanoparticles(CuO-NPs)using a central composite circumscribed design[J].Science of the Total Environment,2015,521:183-190.
[47]CHEN K L,ELIMELECH M.Aggregation and deposition kinetics of fullerene(C60)nanoparticles[J].Langmuir,2006,22(26):10994-11001.
[48]BAALOUSHA M.Aggregation and disaggregation of iron oxide nanoparticles:influence of particle concentration,pH and natural organic matter[J].Science of the Total Environment,2009,407(6):2093-2101.
[49]LIU X,WAZNE M,HAN Y,et al.Effects of natural organic matter on aggregation kinetics of boron nanoparticles in monovalent and divalent electrolytes[J].Journal of Colloid and Interface Science,2010,348(1):101-107.
[50]BAALOUSHA M,NUR Y,RÖMER I,et al.Effect of monovalent and divalent cations,anions and fulvic acid on aggregation of citrate-coated silver nanoparticles[J].Science of the Total Environment,2013,454:119-131.
[51]CHAMBERS B A,AFROOZ A N,BAE S,et al.Effects of chloride and ionic strength on physical morphology,dissolution,and bacterial toxicity of silver nanoparticles[J].Environmental Science amp; Technology,2013,48(1):761-769.
[52]HUYNH K A,CHEN K L.Aggregation kinetics of citrate and polyvinylpyrrolidone coated silver nanoparticles in monovalent and divalent electrolyte solutions[J].Environmental Science amp; Technology,2011,45(13):5564-5571.
[53]MIAO L,WANG C,HOU J,et al.Effect of alginate on the aggregation kinetics of copper oxide nanoparticles(CuO NPs):bridging interaction and hetero-aggregation induced by Ca2+[J].Environmental Science and Pollution Research,2016,23(12):11611-11619.
[54]HYUNG H,KIM J H.Natural organic matter(NOM)adsorption to multi-walled carbon nanotubes:effect of NOM characteristics and water quality parameters[J].Environmental Science amp; Technology,2008,42(12):4416-4421.
[55]GEBAUER J S,MALISSEK M,SIMON S,et al.Impact of the nanoparticle-protein corona on colloidal stability and protein structure[J].Langmuir,2012,28(25):9673-9679.
[56]SALEH N B,PFEFFERLE L D,ELIMELECH M.Influence of biomacromolecules and humic acid on the aggregation kinetics of single-walled carbon nanotubes[J].Environmental Science amp; Technology,2010,44(7):2412-2418.
[57]LOOSLI F,LE COUSTUMER P,STOLL S.Effect of electrolyte valency,alginate concentration and pH on engineered TiO2nanoparticle stability in aqueous solution[J].Science of the Total Environment,2015,535:28-34.
[58]ORIEKHOVA O,STOLL S.Effects of pH and fulvic acids concentration on the stability of fulvic acids-cerium(Ⅳ)oxide nanoparticle complexes[J].Chemosphere,2016,144:131-137.
[59]GIMBERT L J,HAMON R E,CASEY P S,et al.Partitioning and stability of engineered ZnO nanoparticles in soil suspensions using flow field-flow fractionation[J].Environmental Chemistry,2007,4(1):8-10.
[60]VAN KOETSEM F,GEREMEW T T,WALLAERT E,et al.Fate of engineered nanomaterials in surface water:factors affecting interactions of Ag and CeO2nanoparticles with(re)suspended sediments[J].Ecological Engineering,2015,80:140-150.
[61]RAKOWSKA M I,KUPRYIANCHYK D,HARMSEN J,et al.In situ remediation of contaminated sediments using carbonaceous materials[J].Environmental Toxicology and Chemistry,2012,31(4):693-704.
[63]ZHOU D,ABDEL-FATTAH A I,KELLER A A.Clay particles destabilize engineered nanoparticles in aqueous environments[J].Environmental Science amp; Technology,2012,46(14):7520-7526.
[64]WANG H,DONG Y,ZHU M,et al.Heteroaggregation of engineered nanoparticles and kaolin clays in aqueous environments[J].Water Research,2015,80:130-138.
[65]LIU J,HWANG Y S,LENHART J J.Heteroaggregation of bare silver nanoparticles with clay minerals[J].Environmental Science:Nano,2015,2(5):528-540.
[66]ZHAO J,LIU F,WANG Z,et al.Heteroaggregation of graphene oxide with minerals in aqueous phase[J].Environmental Science amp; Technology,2015,49(5):2849-2857.
[67]SOTIRELIS N P,CHRYSIKOPOULOS C V.Heteroaggregation of graphene oxide nanoparticles and kaolinite colloids[J].Science of the Total Environment,2017,579:736-744.
[68]YIN W Z,YANG X S,ZHOU D P,et al.Shear hydrophobic flocculation and flotation of ultrafine Anshan hematite using sodium oleate[J].Transactions of Nonferrous Metals Society of China,2011,21(3):652-664.
[69]CHEKLI L,ZHAO Y X,TIJING L D,et al.Aggregation behaviour of engineered nanoparticles in natural waters:characterising aggregate structure using on-line laser light scattering[J].Journal of Hazardous Materials,2015,284:190-200.
[70]TELEKI A,WENGELER R,WENGELER L,et al.Distinguishing between aggregates and agglomerates of flame-made TiO2by high-pressure dispersion[J].Powder Technology,2008,181(3):292-300.
Researchprogressofwaterenvironmentbehavioroftypicalengineerednanomaterials
HOUJun1,2,CIHanlin1,2,LYUBowen1,2,MIAOLingzhan1,2,LIUZhilin1,2
(1.KeyLaboratoryofIntegratedRegulationandResourceDevelopmentonShallowLakes,MinistryofEducation,HohaiUniversity,Nanjing210098,China; 2.CollegeofEnvironment,HohaiUniversity,Nanjing210098,China)
This paper has reviewed the aggregation, sedimentation, dissolution and other behaviors and influence factors (pH, ionic strength, natural organic matter, inorganic colloid and hydrodynamic force) of typical ENMs that are likely to occur in aquatic environment. These water environment conditions affect the behaviors of nanoparticles by means of electrostatic interaction, steric hindrance, bridging and complexation with dissolved ions mechanism. In view of current insufficient research in this regard, future studies are proposed to focus on nanomaterials behaviors under natural environmental conditions, such as lower concentration of nanomaterials and the interactions between nanomaterials and natural colloids in order to provide a theoretical basis for further research and prediction of the fates of ENMs in water.
engineered nanomaterials;aquatic environment;environmental behavior;research progress
10.3880/j.issn.1004-6933.2017.06.01
国家自然科学基金(51479047);江苏省杰出青年基金(BK20160038)
侯俊(1979—),男,博士,研究员,博士生导师,主要从事水环境保护与生态修复研究。E-mail:hhuhjyhj@126.com
X171.5
A
1004-6933(2017)06-0001-08
2017-06-23 编辑:徐 娟)

