交趾黄檀和微凹黄檀木材构造特征及GC-MS的辨析
吴青思,王旋,夏金尉,沈丽金,张耀丽*
(1.南京林业大学材料科学与工程学院,南京 210037; 2.苏州市质量技术监督综合检验检测中心,苏州 215104 )
交趾黄檀和微凹黄檀木材构造特征及GC-MS的辨析
吴青思1,王旋1,夏金尉2,沈丽金2,张耀丽1*
(1.南京林业大学材料科学与工程学院,南京 210037; 2.苏州市质量技术监督综合检验检测中心,苏州 215104 )
从构造特征和挥发性成分两方面对交趾黄檀和微凹黄檀进行了辨析,详细阐述了交趾黄檀和微凹黄檀的木材构造特征,总结了以下辨别要点:交趾黄檀黑色条纹规整,轴向薄壁组织主要为翼状和细带状;微凹黄檀黑色条纹不规整,轴向薄壁组织主要为星散-聚合状和细带状;交趾黄檀木射线为1~2列,单列较多;微凹黄檀木射线几乎单列,偶2列。用甲苯-乙醇对两种木材的粉末进行提取,GC-MS测试,结果表明:交趾黄檀和微凹黄檀的总离子流图存在一定差别,从交趾黄檀抽提液中鉴定出13种化合物,微凹黄檀中鉴定出12种化合物。微凹黄檀中的苯甲醛、肉桂醛、4-甲氧基-4-氟查耳酮挥发性成分的相对含量比交趾黄檀中的高,且前者的相对含量分别是0.803%,1.134%和0.155%;后者的相对含量分别是0.402%,0.071%和0.088%;交趾黄檀中米氏碱的相对含量比微凹黄檀中的高,前者是0.634%,后者是0.235%。
交趾黄檀; 微凹黄檀; 解剖构造; 气质联用
根据国家标准GB/T 18107—2000《红木》分类规定,交趾黄檀与微凹黄檀都属于红酸枝木类木材,均隶属于豆科黄檀属树种[1-2]。其中交趾黄檀俗称“大红酸枝”、 “老红木”,主要分布在泰国东北部混交林和越南南部以及柬埔寨、老挝的部分地区[3]。微凹黄檀俗称“南美红酸枝”、“可可菠萝”,市场上也称“小叶红酸枝”,主要分布在中美洲地区。
在中国古典家具中,“紫檀”体现的是典雅庄重,“黄花梨”体现的是文人雅趣,但它们价格昂贵,而红酸枝木材价格相对合理,材质优良,在家具制作中得到广泛应用。交趾黄檀和微凹黄檀外观相似,颜色变化多端,花纹美观,但两者价格相差甚大。不诚信商家用微凹黄檀冒充交趾黄檀的现象时有发生。笔者通过对交趾黄檀与微凹黄檀构造特征的研究,阐述其识别要点。借助气质联用技术(GC-MS),分析交趾黄檀与微凹黄檀的GC-MS总离子流图,鉴别化学成分,研究结果不仅能为两者的辨别提供科学依据,而且对提高该木材的附加值也有参考作用。
1 材料与方法
1.1 试验材料和仪器
试验材料交趾黄檀、微凹黄檀皆来自于南京林业大学材料科学与工程学院木材学标本室。
试验所用化学药剂甘油、氢氧化钠、生物制片透明剂(简称TO);光学树脂胶、甲苯、乙醇和试验仪器索氏提取器和气相色谱质谱联用仪(GC-MS)来自苏州市质量技术监督综合检验检测中心。
1.2 试验方法
1.2.1 木材切片制作及观察
将交趾黄檀与微凹黄檀锯成标准三切面的10 mm×10 mm×10 mm大小的木块,放入甘油-氢氧化钠混合溶液中软化,然后进行切片、染色、制片,将制作好的切片放在显微镜下观察。
1.2.2 木材挥发物提取方法及GC-MS测试条件
将木材磨粉,筛取60~40目(250~380 μm)的木粉,烘干,准确称取(1.0±0.2)g (精确至0.00 01 g),用经甲苯-乙醇(体积比1∶1)处理过的定性滤纸包好,放进索氏抽提器中,加入不少于150 mL甲苯-乙醇(体积比1∶1)混合液。根据GB/T 2677.6—1994《造纸原料有机溶剂抽出物含量的确定》的方法抽提6 h[4-6],将抽提液过0.45 μm 滤膜取1 mL后待测,抽提好的溶液进行气相色谱质谱(GC-MS)分析。每个样品进样3次。色谱柱DB-5MS(30 m×0. 25 mm×0. 25 μm),载气为氦气,流速1 mL/min;柱温从50℃以5℃/min升温至250℃,然后保持2 min;汽化室温度为220℃;进样量1.0 μL。
2 结果与分析
2.1 交趾黄檀和微凹黄檀的辨别
2.1.1 交趾黄檀构造特征
心、边材区别明显,边材灰白色,心材新切面紫红褐或暗红褐。材面上橘黄底色不明显,纵切面常见黑色或栗褐色条纹,条纹规整,油性足。木材结构细,纹理直。散孔材。生长轮不明显或略明显。管孔肉眼下略见,单管孔为主,数量少至略少;管孔内含红色或暗红色树胶。单穿孔;管间纹孔式互列,系附物型纹孔,导管与射线间纹孔式类似管间纹孔式。轴向薄壁组织主为翼状、细带状(宽 1~4 细胞)(图1);薄壁细胞中具分室含晶细胞,内含菱形晶体;叠生。木纤维壁厚至甚厚;壁上为单纹孔或略具狭缘;叠生。木射线细,波痕显著,叠生;射线宽1~2列细胞,单列射线较多,射线通常高9~11细胞(图2),射线组织同形单列及多列。

图1 交趾黄檀横切面(×10)Fig. 1 Cross section of Dalbergia. cochinchinensisPierre (×10)

图2 交趾黄檀弦切面(×20)Fig. 2 Tangential section of D. cochinchinensisPierre (×20)
2.1.2 微凹黄檀构造特征
心、边材区别明显,边材浅黄白色,心材新切面呈橘黄至橙黄色,久则变为红褐色或紫红褐色;常带黑褐色条纹,条纹不规整,有时比较凌乱;若将木材表面刮除,其黄底色明显。生长轮不明显。管孔在放大镜下明显。散孔材,有半散孔材趋势,主要为单管孔;内含橘红色树胶;单穿孔,管间纹孔式互列,系附物型。导管与射线间纹孔式类似管间纹孔式。轴向薄壁组织主要为星散-聚合状、带状(多数宽1个细胞,与木射线相交,呈交叉网状)(图3)。木纤维壁厚至甚厚;壁上为单纹孔或略具狭缘;叠生。木射线细,波痕略明显至明显,叠生;射线单列,偶见双列,高通常8~10细胞(图4);射线组织同形单列。
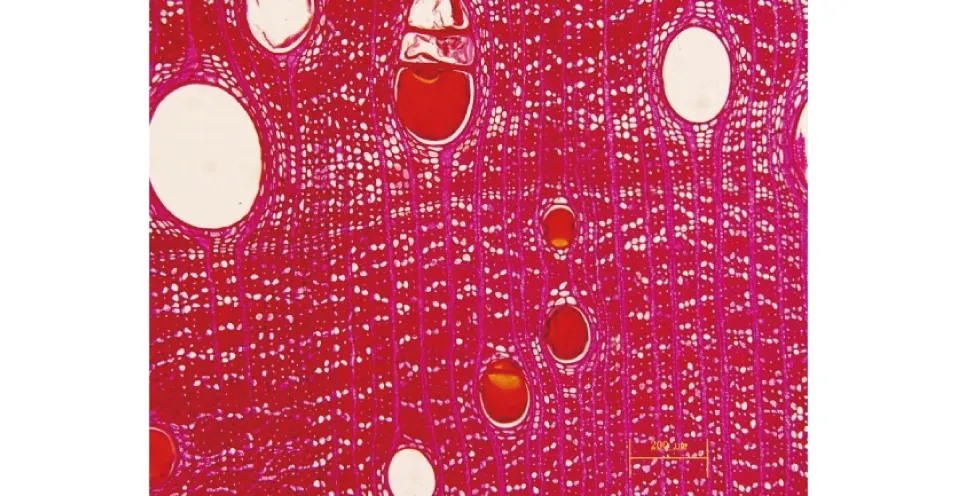
图3 微凹黄檀横切面(×10)Fig. 3 Cross section of D. retusa Hesml(×10)
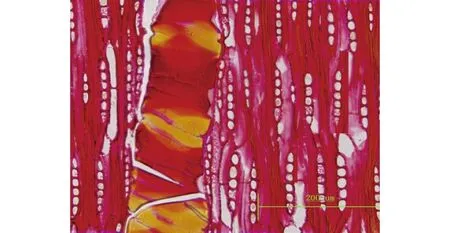
图4 微凹黄檀弦切面(×20)Fig. 4 Tangential section of D. retusa Hesml(×20)
2.1.3 交趾黄檀和微凹黄檀木材辨别要点
1)交趾黄檀的橘黄底色调不明显,而微凹黄檀橘黄底色调显著;交趾黄檀材面上的黑色或栗褐色条纹比微凹黄檀的规整。
2)交趾黄檀轴向薄壁组织主要为翼状和细带状,带为1~4个细胞宽;微凹黄檀轴向薄壁组织主要为星散-聚合状和细带状,带多为1个细胞宽,与木射线呈交叉网状。
3)交趾黄檀木射线为1~2列,单列较多;微凹黄檀木射线几乎单列,偶2列。
4)在放大镜下,交趾黄檀波痕比微凹黄檀的明显。
2.2 交趾黄檀和微凹黄檀提取物成分的GC-MS分析
将交趾黄檀和微凹黄檀木粉分别在甲苯-乙醇(体积比1∶1)混合液中抽提 6 h后,将抽提液进行GC-MS测试,得到相应的GC-MS总离子流图(图5和图6)。

图5 交趾黄檀总离子流图Fig. 5 Total ion chromatogram ofD. cochinchinensis Pierre

图6 微凹黄檀总离子流图Fig. 6 Total ion chromatogram of D. retusa Hesml
由图5可以看出,交趾黄檀的主要出峰时间是33~45 min,期间有4个显著的峰,最后一个峰的丰度最高。由图6可见,微凹黄檀的主要出峰时间是33~50 min,期间也有4个显著的峰,第1个峰的丰度最高。因此,根据交趾黄檀和微凹黄檀GC-MS总离子流图的差别,也能对这两种材料进行辨别。
经质谱NIST08检索并辅助人工解析,从交趾黄檀甲苯-乙醇抽提液中鉴定出匹配度和相对含量较高的13种化合物(表1),从微凹黄檀中鉴定出12种化合物(表2)。从表1可以看出,交趾黄檀中4个显著的峰分别是34.725 min的9H-吡啶(3,4-b)吲哚、35.562 min的N-ethyl-N,N′-diphenyl-Thiourea、36.972 min的4,4′-(1-甲基亚乙基)双(2-甲基苯酚)和38.289 min的喹啉-6-甲腈,它们的相对含量分别为5.510%,9.241%,8.207%和45.077%。从表2中可以看出,微凹黄檀中的4个显著的峰分别是35.562 min的N-ethyl-N,N′-diphenyl-Thiourea、36.485 min的3,3′,5,5′-四甲基联苯胺、38.081 min的油酸酰胺和40.282 min的6,12-Dimethylbenz[a]anthracene,它们的相对含量分别是24.121%,3.375%,5.693%和11.873%。其中,重叠的峰是35.562 min出现的N-ethyl-N,N′-diphenyl-Thiourea。

表1 交趾黄檀可挥发性化学成分Table 1 Volatile components of D. cochinchinensis Pierre

表2 微凹黄檀可挥发性化学成分Table 2 Volatile components of D. retusa Hesml
对比表1和表2,交趾黄檀和微凹黄檀挥发物共有5种成分相同,它们分别是6.894 min出现的苯甲醛、15.148 min出现的肉桂醛、35.181 min出现的4-甲氧基-4-氟查耳酮、35.562 min出现的N-ethyl-N,N’-diphenyl-Thiourea和37.376 min出现的米氏碱。其中,苯甲醛在交趾黄檀挥发性成分中的相对含量为0.402%,而在微凹黄檀中的相对含量为0.803%,后者约为前者的2倍。肉桂醛在交趾黄檀挥发性成分的相对含量为0.071%,而在微凹黄檀中挥发性成分的含量为1.134%,后者约为前者的10~15倍。这与杨伟明、杨柳[7]所得的结果基本一致。此外,4-甲氧基-4-氟查耳酮在交趾黄檀挥发性成分的相对含量为0.088%,在微凹黄檀中挥发性成分的含量为0.155%,后者约为前者的2倍;N-ethyl-N,N’-diphenyl-Thiourea在交趾黄檀挥发性成分的相对含量为9.241%,在微凹黄檀中挥发性成分的含量为24.121%,后者约为前者的2.5倍;米氏碱(Michler’s base)在交趾黄檀中其相对含量为0.634%,在微凹黄檀中其含量为0.235%,前者约为后者的3倍。
苯甲醛俗称苦杏仁油,可用作香料[8];苯并呋喃及其衍生物具有抗肿瘤、抗结核病、抗糖尿病、抗炎抗菌的活性[9-10];肉桂醛具有桂皮油和肉桂油的香味,可增强消化功能,有活络筋骨、镇痛、解热、降压调脂、抗菌等作用[11-12];喹啉是一类重要的氮杂环类化合物,其衍生物具有抗肿瘤、抗疟疾、抗菌抗炎等特性[13];查耳酮及其衍生物具有抗真菌的作用,也是合成天然抗氧化剂和抗肿瘤药物黄酮类化合物的常用物质[14];柚皮素对肝纤维化和肝肿瘤有一定的抑制作用[15]。通过对交趾黄檀和微凹黄檀苯-醇抽提液中鉴定出的主要化学成分推断:交趾黄檀和微凹黄檀木材中含有药用价值的成分。
3 结 论
1)从木材颜色、花纹、轴向薄壁组织类型、木射线角度阐明了交趾黄檀和微凹黄檀的4个鉴别要点。
2)交趾黄檀GC-MS谱图的主要出峰时间跨度比微凹黄檀短,且出峰比较集中;交趾黄檀4个显著的峰与微凹黄檀4个显著的峰中有1个峰重合。
3)苯甲醛、肉桂醛、4-甲氧基-4-氟查耳酮和N-ethyl-N,N′-diphenyl-Thiourea在微凹黄檀中的相对含量比在交趾黄檀中的高,米氏碱在交趾黄檀中的相对含量比在微凹黄檀中的高。
[1]翟东群, 姜笑梅, 殷亚方. 红木资源现状及变化趋势[J]. 木材工业, 2014, 28(2):26-30.
ZHAI D Q, JIANG X M, YIN Y F. Status and trends of Hongmu resources [J]. China Wood Industry, 2014, 28(2):26-30.
[2]姜笑梅, 殷亚方, 刘波. 《濒危野生动植物种国际贸易公约》保护与管制木材种类的诠释[J]. 木材工业, 2010, 24(5):36-38.
JIANG X M, YIN Y F, LIU B. The list of wood species protected and controlled by the CITES [J]. China Wood Industry, 2010, 24(5):36-38.
[3]何拓, 罗建举. 交趾黄檀及其相似树种木材构造的比较分析[J]. 林业工程学报, 2016, 1(4):58-63.
HE T, LUO J J. Comparison and analysis of the wood structure ofDalbergiacochinchinensisPierre and its similar species[J]. Journal of Forestry Engineering, 2016, 1(4):58-63.
[4]石江涛, 骆嘉言. 气质联用技术在红木挥发油成分分析中的应用[J]. 林业科技开发, 2015, 29(3):77-80.
SHI J T, LUO J Y, Comparison of volatile oil in four rosewood species by gas chromatography-mass spectrometry (GC-MS) [J]. Forest Products Processing and Utilization, 2015, 29(3):77-80.
[5]孙书冬, 周旭, 罗炘, 等. 四种红酸枝木类树种的鉴别[J]. 林产工业, 2012, 39(3):50-53.
SUN S D, ZHOU X, LUO X, et al. Identification of four kinds ofDalbergia[J]. China Forest Products Industry, 2012, 39(3):50-53.
[6]朱涛. 基于GC-MS技术不同进样方式的红木识别研究及其指纹图谱构建[D]. 合肥:安徽农业大学, 2013.
ZHU T. Identification of Hongmu and fingerprints construction with different injection methods based on the technique of GC-MS[D]. Hefei:Anhui Agricultural University, 2013.
[7]杨伟明, 杨柳. 顶空/气质联用法鉴别交趾黄檀与微凹黄檀[J]. 浙江林业科技, 2013, 33(4):29-33.
YANG W M, YANG L. Identification ofDalbergiacochinchinensesandDalbergiaretusaby headspace gas chromatography-mass spectrometry[J]. Journal of Zhejiang Forestry Science and Technology, 2013, 33(4):29-33.
[8] 刘伟华, 张同来, 张建国, 等. 甲苯氧化制苯甲醛技术进展[J]. 化工生产与技术, 2004, 11(3):24-28.
LIU W H, ZHANG T L, ZHANG J G, et al. Progress in oxidation of toluene to benzaldehyde[J]. Chemical Production and Technology, 2004, 11(3):24-28.
[9]高文涛, 程秀萍, 李阳. 碱促进的新颖苯并呋喃类化合物的合成[J]. 有机化学, 2012, 32(10):1919-1924.
GAO W T, CHEN X P, LI Y. A novel strategy for the synthesis of benzofuran derivatives [J]. Chinese Journal of Organic Chemistry, 2012, 32(10):1919-1924.
[10]施义民. 苯并呋喃及咔唑类衍生物的合成及抗肿瘤活性研究[D]. 昆明:云南民族大学,2014.
SHI Y M. Studies on the synthesis and antitumor activities of novel benzofuran and carbazole derivatives[D]. Kunming:Yunnan Minzu University,2014.
[11]张利青, 张占刚, 付岩, 等. 桂皮醛药理作用的研究进展[J]. 中国中药杂志, 2015, 40(23):4568-4571.
ZHANG L Q, ZHAGN Z G, FU Y, et al. Research progress of trans-cinnamaldehyde pharmacological effects[J]. China Journal of Chinese Materia Medica, 2015, 40(23):4568-4571.
[12] RASHEEHA N, IFTIKHAR H, ABDUL T,et al. Antimicrobial activity of the bioactive components of essential oils from Pakistani spices againstSalmonellaand other multi-drug resistant bacteria[J]. BMC Complement Alternat Med, 2013, 13(1):265.
[13]王京, 张磊, 李文赟, 等. 喹啉衍生物的抗肿瘤活性研究进展[J]. 国外医药抗生素分册, 2013, 34(2):60-70.
WANG J, ZHAGN L, LI W Y, et al. Advances in research on antitumor activities of quinolines[J]. World Notes on Antibiotics, 2013, 34(2):60-70.
[14]李湘洲, 郭远良, 旷春桃, 等. 查尔酮的结构修饰及抗癌、抗炎活性研究进展[J]. 中南林业科技大学学报, 2011, 2(31):95-99.
LI X Z, GUO Y L, KUAGNG C T, et al. Research progress of the anti-cancer, anti-inflammatory activities of chalcone as bioactive plant constituents[J]. Journal of Central South University of Forestry amp; Technology, 2011, 2(31):95-99.
[15]吕爱新, 于宏伟, 赵志强, 等. 柚皮素研究进展[J]. 安徽农业科学, 2011, 39(13):7734-7735.
LYU A X, YU H W, ZHAO Z Q, et al. Research progress of naringenin [J]. Journal of Anhui Agriculture Science, 2011, 39(13):7734-7735.
IdentificationandGC-MSanalysisofDalbergiacochinchinensisPierreandDalbergiaretusaHesml
WU Qingsi1, WANG Xuan1, XIA Jinwei2, SHEN Lijin2, ZHANG Yaoli1*
(1. College of Material Engineering, Nanjing Forestry University, Nanjing 210037, China;2. Suzhou Quality and Technical Supervision Comprehensive Test Center, Suzhou 215104, Jiangsu, China)
The wood structural features ofDalbergiacochinchinensisPierre andD.retusaHesml were analyzed in this paper. Their wood powder was extracted with 6-h toluene-ethanol at 100℃ by soxhlet extraction, then examined with the gas chromatography-mass spectrometry (GC-MS). The results showed that yellow grounding ofD.cochinchinensisPierre was not obvious, and black stripes were neat, grounding ofD.retusaHesml was mainly orange, and black stripes were littery. The axial parenchyma ofD.cochinchinensisPierre was mainly wing-shaped and thin strip (band width 1-4 cells), axial parenchyma ofD.retusaHesml was scattered-polymerization and thin strip (band width 1 cell) and was often cross mesh with wood rays. The wood ray was single or double row inD.cochinchinensisPierre and single or rare double row inD.retusaHesml wood. The wood rays ofD.cochinchinensisPierre were more obvious than those ofD.retusaHesml when under the magnifying glass. There were some differences between the total ion chromatogram ofD.cochinchinensisPierre andD.retusaHesml wood. Thirteen types of compounds fromD.cochinchinensisPierre extractives and 12 types of compounds fromD.retusaHesml were identified. The relative contents of the Benzaldehyde, Cinnam aldehyde and 1-(4-fluorophenyl)-3-(4-methoxyphenyl)prop-2-en-1-one inD.retusaHesml were 0.803%, 1.134%, 0.155%, respectively, which were higher than those inD.cochinchinensisPierre, counting to be 0.402%, 0.071%, 0.088%, respectively. The relative content of the Michler’s base inD.cochinchinensisPierre was 0.634%, which is higher than that inD.retusaHesml, counting as 0.235%. After the analysis of the volatile components, it can be inferred from the results that two kinds of wood have functions of anti-tumor, anti-bacteria anti-inflammatory, active muscles, lowering blood pressure and adjusting lipidemia. In addition,D.cochinchinensisPierre can help to defeat malaria and liver fibrosis, liver cancer in some way.
DalbergiacochinchinensisPierre;DalbergiaretusaHesml; anatomical structure; GC-MS
2016-09-27
2017-03-09
国家自然科学基金(31670558);江苏高校优势学科建设工程资助项目(PAPD)。
吴青思,女,研究方向为木材学。
张耀丽,女,教授。E-mail:zhangyaoli@126.com
S781.1
A
2096-1359(2017)06-0026-05

