水稻叶片低温应答蛋白质组学研究进展
高田祥, 喻娟娟,2, 孙晓梅, 戴绍军*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234;2.东北林业大学 盐碱地生物资源环境研究中心,哈尔滨 150040)
水稻叶片低温应答蛋白质组学研究进展
高田祥1, 喻娟娟1,2, 孙晓梅1, 戴绍军1*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234;2.东北林业大学 盐碱地生物资源环境研究中心,哈尔滨 150040)
近年来,人们利用高通量蛋白质组学技术分析了水稻(OryzasativaL.)叶片低温应答过程中蛋白质组的动态变化特征,在水稻叶片中鉴定到了504种低温响应蛋白质.系统分析了这些蛋白质的丰度变化模式,综述了水稻叶片应对不同程度低温胁迫(5~15 ℃处理0~8 d)过程中参与光合作用、糖类与能量代谢、胁迫与防御、转录与蛋白质代谢、信号转导,以及膜与转运等过程中的蛋白质丰度变化特征,为全面理解水稻低温应答的分子网络调控机制提供了线索.
水稻; 叶片; 低温胁迫; 蛋白质组学
0 引 言
低温是限制植物生产力和地理分布的主要非生物胁迫因素之一[1].低温导致植物代谢水平降低,植株叶片卷曲枯萎,花粉不育,生物量下降,甚至死亡[2-3].水稻(OryzasativaL.)是全球重要的粮食作物,低温胁迫会对其产量造成明显影响,同时水稻也是重要的单子叶模式植物,研究其低温应答机制对于解析植物低温响应分子机理和粮食生产都具有重要意义[4].近年来,水稻蛋白质组学研究从系统生物学水平层面为植物低温应答分子网络机制提供了重要信息.目前,人们已经在水稻叶片中鉴定到504种低温应答蛋白质.本文作者整合分析了水稻叶片在各种低温处理(5~15 ℃,0~8 d)条件下的蛋白质丰度模式(表1),为理解光合作用、糖类与能量代谢、胁迫与防御、转录与蛋白质代谢、信号转导,以及膜与转运等代谢过程对于水稻叶片低温应答的作用提供帮助.
1 低温抑制光合作用
低温严重影响温带植物的光合作用,造成低温光抑制[5].蛋白质组学研究发现多种参与光合作用的蛋白质的丰度受到低温的影响.在14 ℃处理48、72和96 h后,水稻叶片中叶绿素a/b结合蛋白(CAB)、光系统II(PSII)作用中心P680叶绿素a载脂蛋白(chlorophyll A apoprotein)、放氧复合体蛋白(OEC)和放氧增强子蛋白(OEE)的丰度均上升[6].CAB能与光合色素形成捕光复合体(LHC),LHC能够捕获光能并迅速将能量传递给PSII作用中心P680,引起光化学反应,维持类囊体膜结构,以及调节激发能量在PSII与光系统I(PSI)之间的分配[7].OEC是PSII的重要成员,能够裂解水并释放氧气[8].OEE是OEC的组成成员,在OEC参与光能吸收过程中发挥重要作用.这些蛋白质的丰度上升有助于水稻维持水光解放氧从而适应低温环境.
光合电子传递过程也受到低温胁迫的影响.细胞色素b6f蛋白复合体(Cytb6f)是光合膜上参与光合作用原初反应过程的主要膜蛋白超分子复合体之一,连接PSII到PSI的电子传递过程,氧化质醌并产生跨膜质子梯度,催化ATP合成.铁氧还蛋白-NADP还原酶(FNR)能够催化NADPH的合成,在光合电子传递过程中发挥关键作用.在14 ℃处理48和96 h后,Cytb6f丰度上升,而FNR丰度下降[6],这表明在低温促进了水稻叶片水光解放氧作用后,光合电子传递链原初反应被激活,但低温抑制了酶的活性,使光合电子传递过程减慢.
参与碳同化过程的多种酶的表达丰度也受到低温影响.核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)具有羧化酶和加氧酶的双重活性,它是光合作用中决定碳同化速率的关键酶,同时也参与植物的光呼吸途径.RuBisCO活化酶(RCA)可以催化RuBisCO从无活性状态变为有活性状态.景天庚酮糖-1,7-二磷酸酶(SBPase)在植物光合作用卡尔文循环过程中控制碳的流入和再生.在6 ℃处理6和24 h后,水稻叶片中RuBisCO、RCA和SBPase的丰度均下降[1,6],这表明低温直接影响了水稻叶片碳同化的速率.
2 低温诱导糖类与能量代谢的动态调节
碳与能量代谢(糖酵解、三羧酸循环途径等)为水稻低温应答提供了基本碳骨架和能量供应[8].蛋白质组学研究发现,低温影响了水稻叶片糖酵解相关酶的丰度模式.在14 ℃处理48和72 h后,水稻叶片中的UDP-葡萄糖焦磷酸化酶(UDPase)、磷酸甘油酸激酶(PGK)、烯醇化酶(ENO)和果糖激酶(FK)的丰度上升[1,3,6].UDPase将1-磷酸葡萄糖与UTP分子合成为UDP-葡萄糖.PGK是糖酵解的关键酶,在PGK催化下,1,3-二磷酸甘油酸转变为3-磷酸甘油酸,并形成ATP分子.ENO催化2-磷酸甘油酸形成高能化合物磷酸烯醇式丙酮酸,是糖酵解中的关键酶之一.己糖激酶(HK)在调控基础代谢中起主要作用,FK作为己糖激酶的一种,在植物基础代谢中催化果糖的磷酸化,从而影响糖酵解的过程[3].此外,水稻叶片中三羧酸循环相关酶的丰度模式也受到低温的影响.在14 ℃处理48和72 h后,二氢硫辛酰转乙酰基酶(DLAT)和异柠檬酸脱氢酶(IDH)的丰度降低[6],而苹果酸脱氢酶(MDH)的丰度上升[1,6].DLAT是丙酮酸脱氢酶复合体的一部分,能够催化丙酮酸脱羧反应使丙酮酸转变为乙酰CoA和CO2.IDH通过催化异柠檬酸氧化脱羧生成α-酮戊二酸,使6碳化合物变为5碳化合物,是三羧酸循环中的限速步骤.MDH催化L-苹果酸脱氢变成草酰乙酸,再生的草酰乙酸可再次进入三羧酸循环用于柠檬酸的合成.这些蛋白质丰度变化表明,在低温条件下,水稻通过调节体内糖类与能量代谢途径来保持基础物质与能量的供应.
3 低温诱导水稻叶片胁迫防御机制
活性氧分子(ROS)包括超氧阴离子自由基(O2·-)、过氧化氢(H2O2)、单线态氧(1O2)及羟自由基(·OH),它们的过量积累会对植物体内的蛋白质、DNA与脂质等造成氧化损伤[9].植物体内通过一系列抗氧化酶清除过量的ROS,维持ROS稳态.其中,超氧化物歧化酶(SOD)是机体内天然存在的ROS清除因子,它可以催化O2·-转化为H2O2和H2O,它构成了植物细胞抵御ROS的第一道防线.蛋白质组学研究发现,在14 ℃处理48和96 h后,水稻叶片中SOD的丰度上升.另外,抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和过氧化物酶(POD)在解除H2O2毒性过程中具有重要作用.APX可以利用抗坏血酸作为电子供体,将H2O2转化为H2O.CAT不需要底物的参与,能够直接催化H2O2分解为H2O与O2[10].而POD通过催化酚类化合物、木质素前体及生长素等多种底物来还原H2O2[11].APX丰度在低温处理条件下一直增强.而CAT丰度仅在14 ℃处理48 h后增强,这表明CAT仅在该处理条件下比较活跃.而POD丰度在14 ℃处理48和72 h时减弱,在5 ℃处理12、24和36 h,以及10 ℃处理24和72 h时增强,这表明POD途径在5和10 ℃时能够积极响应低温胁迫.此外,谷胱甘肽过氧化物酶(GPX)能催化还原型谷胱甘肽(GSH)变为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构.谷胱甘肽硫转移酶(GST)能以GSH为底物将H2O2转化为H2O.谷胱甘肽还原酶(GR)能够利用还原型NAD(P)H将GSSG催化成GSH.蛋白质组学研究结果表明,低温处理条件下,水稻叶片中GPX、GST和GR丰度上升,这将有利于增强GSH-GSSG循环,应答低温胁迫.重要的是,植物体内的H型硫氧还蛋白(Thx h)通过还原靶蛋白的二硫键参与氧化还原调节.硫氧还蛋白过氧化物酶(TPx)是小分子抗氧化酶,对低温胁迫反应迅速,能够通过减少H2O2或单态氧来抵御氧化胁迫[12].蛋白质组学研究表明,在低温处理条件下,水稻叶片中Thx h和TPx丰度显著上升,这对于维持体内氧化平衡具有重要作用.
此外,其他胁迫应答相关蛋白质在应对低温胁迫时发挥作用.例如,铁蛋白(Fer)可容纳大量铁,并以稳定的形式储存,在维持细胞内铁的代谢平衡、清除铁介导的自由基反应、保护细胞免受环境胁迫带来的氧化损伤方面发挥重要作用[13].在10和15 ℃分别处理24 h后,水稻叶片中Fer的丰度均上升.晚期胚胎富集蛋白(LEA)可以通过多种方式来保护由于失水而造成的细胞结构破坏,如作为水合作用的缓冲器、隔离离子、直接保护其他蛋白或膜结构和复性蛋白等.类原纤蛋白(FBN)是一种糖蛋白,对于弹性纤维的合成必不可少.类渗调蛋白(OSM)被证实是一种逆境适应蛋白,伴随植物对各种胁迫的适应而产生,并大量积累[14].在14 ℃处理24和96 h后,LEA、FNB和OSM丰度上调从而应对低温[6].
4 低温影响转录、翻译与翻译后调控
转录调控是植物应答逆境的重要策略之一.蛋白质组学研究发现水稻叶片中多种参与转录调控的蛋白质丰度受到低温影响.水稻叶绿体茎环结合蛋白(CSP)在24 h低温处理后丰度上升,而在48和72 h处理后丰度下降[3].CSP能够绑定和切割RNA,参与叶绿体核糖体RNA代谢.另外,组蛋白(His)与双螺旋DNA结合成DNA-组蛋白复合物;三角状五肽重复区蛋白(PPR)具有叶绿体或线粒体定位序列,参与叶绿体和线粒体RNA的加工[15];而富含甘氨酸RNA结合蛋白(GRP)与RNA结合,调节基因表达,参与植物应答多种逆境反应的调节,如盐、干旱、水涝、外源脱落酸和水杨酸等[16].在低温条件下,水稻叶片中His和PPR丰度下降,而14 ℃处理72和96 h后,水稻中GRP丰度上升[6],这表明水稻可通过基因转录与转录后调控应对低温胁迫.
蛋白质组学研究发现,低温还导致水稻叶片中参与蛋白质合成的蛋白质丰度改变.低温处理24 h后,水稻叶片中真核起始因子4A(eIF4A)、延伸因子2(EF-2)和延伸因子1-β(EF1-β)的丰度上升[1,3].eIF参与翻译起始过程,EF在mRNA翻译时催化氨基酸链延伸[17-18].此外,核糖体蛋白质在蛋白质的生物合成中起重要作用.14 ℃处理48、72和96 h后,水稻叶片中多数核糖体蛋白丰度上升[6].这表明,水稻叶片中某些参与应对低温胁迫的蛋白质的合成受到促进.
蛋白质组学研究发现,蛋白质正确折叠与加工对水稻低温应答十分重要.低温处理48 h的水稻叶片中的热激蛋白(HSP)丰度上升,而处理96 h后HSP丰度下降[1,6].与之相反,14 ℃处理48 h水稻叶片中的肽基-脯氨酰基顺反异构酶(PPIase)丰度下降,而处理96 h后的PPIase丰度明显增强[6].这两种蛋白质都参与胁迫应答过程中蛋白质的折叠[19-20],它们丰度的变化将有助于低温应答过程中蛋白质正确折叠.

表1 水稻叶片低温应答蛋白质组学研究的处理条件与鉴定结果
此外,水稻叶片蛋白质降解过程也受到低温的影响.蛋白质组学研究发现,低温处理条件下,水稻叶片中的半胱氨酸蛋白酶、天冬氨酸蛋白酶和类FtsH蛋白丰度均增强.这些蛋白质均参与叶片蛋白质的水解过程.此外,在14 ℃处理48 h水稻叶片中蛋白酶体亚型α-1和枯草杆菌蛋白酶SBT1.7丰度降低[6].这表明,在低温条件下水稻叶片蛋白质降解存在多种调节模式.
5 低温应答信号转导通路
蛋白质组学发现多种蛋白质参与水稻叶片低温胁迫应答信号转导过程,主要包括:1)小G蛋白参与低温应答信号转导.6 ℃处理6和24 h后水稻叶片中的Ras蛋白(Ras)丰度上升[1].Ras作为小G蛋白家族成员之一,参与多种胁迫应答的信号转导过程;2)5 ℃处理3 d后,水稻叶片中钙网蛋白(CRT)丰度上升[4].CRT通过与微量钙离子结合,在Ca信号转导中起着关键的作用,从而调控逆境应答过程中基因表达与代谢过程;3)蛋白质激酶参与低温信号传递过程.低温处理条件下,水稻叶片中二磷酸核苷激酶(NDPK)大量积累[6,21-22].NDPK参与调控蛋白质可逆磷酸化过程,也受到低温胁迫的影响[23];4)14-3-3蛋白参与低温信号转导.在低温条件下,水稻叶片中14-3-3蛋白丰度降低[6].14-3-3蛋白可以调节多种蛋白质的可逆磷酸化状态,从而调节这些蛋白质参与信号转导和胁迫防御等过程来参与植物的逆境应答.
6 低温影响质膜转运
低温造成植物质膜流动性降低,运输能力下降[24].在植物细胞内,V型H+-ATP酶(VHA)广泛存在于细胞内膜系统,能够利用ATP水解产生的能量将H+转移到细胞器内,形成跨膜的H+电化学势梯度,从而促进其他物质的跨膜运输交换.5 ℃处理48 h和14 ℃处理96 h的水稻叶片中VHA亚基B和VHA亚基D的丰度都下降[22],这将抑制水稻叶片细胞的物质转运.此外,14 ℃处理48 h的水稻叶片中ATP-binding cassette transponer(ABC)转运蛋白丰度下降[6].ABC转运蛋白家族是一组跨膜蛋白,具有ATP结合区域的单向底物转运泵,能够以主动转运方式完成多种分子的跨膜转运[25].此外,14 ℃处理76和96 h水稻叶片中的非特异性脂质转移蛋白(nsLTP)和温度应激诱导脂质运载蛋白(TSIL)的丰度均上升[6].nsLTP是植物体内一类碱性的小分子量蛋白质,具有在生物膜间转运脂质的活性.TSIL定位在细胞质膜,受温度应激诱导[26].
7 结论与展望
低温对于植物形态结构和代谢活动都有明显的影响甚至伤害,研究水稻叶片对低温胁迫的应对与调控机制具有重要意义.蛋白质组学研究揭示了水稻叶片低温应答的基本策略(图1),主要包括:1)调整光合相关蛋白质的丰度应对光抑制;2)调整糖类与能量代谢保证体内能量供应;3)调节抗氧化酶系统清除过量ROS;4)在转录、翻译以及翻译后修饰等水平上调控低温应答过程;5)NDPK和14-3-3调控目标蛋白可逆磷酸化过程传递低温信号;6)调节转运蛋白丰度来调控细胞内物质吸收与转运.这些蛋白质组学研究结果为深入研究水稻低温应答的分子机理提供了重要证据.今后,应该进一步开展磷酸化蛋白质组、糖基化蛋白质组,以及氧化还原蛋白质组等翻译后修饰组学研究,并结合分子遗传学研究,为解析低温应答蛋白质功能提供证据.
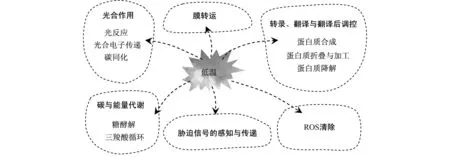
图1 水稻叶片低温胁迫应答蛋白质参与的代谢途径
[1] Yan S P,Zhang Q Y,Sun W N,et al.Comparative proteomic analysis provides new insights into chilling stress responses in rice [J].Molecular & Cellular Proteomics,2006,5(3):484-496.
[2] Hayashi T,Yamaguchi T,Nakayama K,et al.Susceptibility to coolness at the young microspore stage under high nitrogen supply in rice (OryzasativaL.).Proteome analysis of mature anthers [J].Plant Production Science,2006,9(3):212-218.
[3] Cui S X,Hang F,Liu J Y,et al.A proteomic analysis of cold stress responses in rice seedlings [J].Proteomics,2005,5 (12):3162-3172.
[4] Komatsu S,Yang G,Yamaguchi M,et al.Over-expression of calcium-dependent protein kinase 13 and calreticulin interacting protein 1 confers cold tolerance on rice plants [J].Molecular Genetics and Genomics,2007,277(6):713-723.
[5] Allen G J,Al E.A defined range of guard cell calcium oscillation parameters encodes stomatal movements [J].Nature,2001,411(6841):1053-1057.
[6] Neilson K A,Mariani M,Haynes P A.Quantitative proteomic analysis of cold-responsive proteins in rice [J].Proteomics,2011,11(9):1696-1706.
[7] 孙钦秒,冷静,李良壁,等.高等植物光系统Ⅱ捕光色素蛋白复合体结构与功能研究的新进展 [J].植物学通报,2000,17(4):289-301.
Sun Q M,Leng J,Li L B,et al.Recent advances of studies on the structure and function of the light-harvesting chlorophyⅡ A/B-protein complex [J].Chinese Bulletin of Botany,2000,17(4):289-301.
[8] 刘军铭,赵琪,尹赜鹏,等.利用蛋白质组学技术揭示的植物高温胁迫响应机制 [J].应用生态学报,2015,26(8):2561-2570.
Liu J M,Zhao Q,Yin Z P,et al.Heat-responsive mechanisms in plant revealed by proteomic analysis:A review [J].Chinese Journal of Applied Ecology,2015,26(8):2561-2570.
[9] Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction [J].Annual Review of Plant Biology,2004,55:373-399.
[10] Mittler R,Vanderauwera S,Van-Breusegem F,et al.Reactive oxygen gene network of plant [J].Trends in Plant Science,2004,9(10):490-498.
[11] Passardy F,Penel C,Dunand C.Performing the paradoxical:how plant peroxidases modify the cell wall [J].Trends in Plant Science,2004,9(11):534-540.
[12] Chae H Z,Kim I H,Rhee S G.,et al.Cloning,sequencing,and mutation of thiol-specific antioxidant gene ofSaccharomycescerevisiae[J].Journal of Biological Chemistry,1993,268(22):16815-16821.
[13] 张川芳.不结球白菜叶片低温应答生理与蛋白质组学分析 [D].上海:上海师范大学,2016.
Zhang C F.Physiological and proteomics analysis ofBrassicacampestrisssp.chinensisMakino leaves in response to low temperature stress [D].Shanghai:Shanghai Normal University,2016.5
[14] 何宝坤,李德全.植物渗调蛋白的研究进展 [J].生物技术通报,2002,(02):6-10.
He B K,Li D Q.Research progress in plant osmotins [J].Biotechnology Bulletin,2002,(02):6-10.
[15] Fujii S,Smalli.The evolution of RNA editing and pentatricopeptide repeat genes [J].New Phytologist,2011,191(1):37-47.
[16] Fusaro A F,Boccasn,Sachettos-Martins G,et al.AtGRP2,a cold-induced nucleo-cytoplasmic RNA-binding protein,has a role in flower and seed development [J].Planta,2007,225(6):1339-1351.
[17] Rizhsky L,Liang H J,Mittler R,et al.When defense pathways collide.The response of Arabidopsis to a combination of drought and heat stress [J].Plant Physiology,2004,134(4):1683-1696.
[18] Mittler R.Abiotic stress,the field environment and stress combination [J].Trends in Plant Science,2006,11(1):15-19.
[19] Matz J M,Blake M J,Holbrook N J,et al.Characterization and regulation of cold-induced heat shock protein expression in mouse brown adipose tissue [J].The American Journal of Physiology,1995,269(1 Pt 2):38-47.
[20] Fischer G,Schmid F X.The mechanism of protein folding.Implications of in vitro refolding models for de novo protein folding and translocation in the cell [J].Biochemistry,1990,29(9):2205-2212.
[21] Lee D G,Ahsan N,Lee B H,et al.An approach to identify cold-induced low-abundant proteins in rice leaf [J].Comptes Rendus Biologies,2007,330(3):215-225.
[22] Hashimoto M,Komatsu S.Proteomic analysis of rice seedlings during cold stress [J].Proteomics,2007,7(8):1293-1302.
[23] Moon H,Lee B,Yun D J.NDP kinase 2 interacts with two oxidative stress-activated MAPKs to regulate cellular redox state and enhances multiple stress tolerance in transgenic plants [J].Proceedings of the National Academy of Sciences USA,2003,100(1):358-363.
[24] Liu X Y,Li B,Meng Q W,et al.Overexpression of tomato chloroplast omega-3 fatty acid desaturase gene alleviates the photoinhibition of photosystems 2 and 1 under chilling stress [J].Photosynthetica,2008,46(2):185-192.
[25] 王华丙,张振义,包锐,等.ABC转运蛋白的结构与转运机 [J].生命的化学,2007,27(3):208-210.
Wang B H,Zhang Z Y,Bao R,et al.Structure and transporter of ABC transporter [J].Chemistry of Life,2007,27(3):208-210.
[26] 常晓燕,赵丽华,付凤玲,等.拟南芥温度诱导脂质运载蛋白TIL1参与雌配子体发育 [J].植物生理学报,2014,50(03):253-262.
Chang X Y,Zhao L H,Fu F L,et al.Temperature-induced lipid transport protein TIL1 in Arabidopsis thaliana participates in female gametophyte development [J].Plant Physiology Communications,2014,50(03):253-262.
(责任编辑:顾浩然,冯珍珍)
Advanceoflowtemperature-responseproteomicsinriceleaves
Gao Tianxiang1, Yu Juanjuan1,2, Sun Xiaomei1, Dai Shaojun1*
(1 Development Center of Plant Germplasm Resources,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China;2 Alkali Soil Natural Environmental Science Center,Northeast Forestry University,Harbin 150040,China)
In recent years,high-throughput proteomic investigations have provided important information for understanding low temperature response mechanisms in rice (OryzasativaL.) leaves.In this paper,the diverse patterns of 504 low temperature response proteins in rice leaves under various low temperature stress conditions (5~15 ℃for 0~8 d) were analyzed.This provides new clues for understanding the regulatory and metabolic pathways in rice leaves in response to low temperature,including photosynthesis,carbohydrate and energy metabolism,stress and defense,transcription and protein metabolism,signal transduction,membrane and transport.These also provide valuable information for breeding high quality varieties of rice.
rice; leaves; low temperature stress; proteomics
Q 945.78
A
1000-5137(2017)05-0707-06
2017-09-07
上海市科委地方院校能力建设项目(14390502700);上海高校“东方学者”特聘教授项目(2011);上海植物种质资源工程技术研究中心项目(17DZ2252700)
高田祥(1991-),女,硕士研究生,主要从事植物生理与分子生物学方面的研究.E-mail:thalia1@163.com
导师简介: 戴绍军(1972-),男,教授,博士生导师,主要从事植物蛋白质组学方面的研究.E-mail:daishaojun@hotmail.com
*

