葡萄糖对热带假丝酵母菌株SFX-Y9木糖醇发酵的影响
赵祥颖,张立鹤,韩延雷,杨丽萍,田延军,刘建军
(山东省食品发酵工业研究设计院,山东省食品发酵工程重点实验室,山东 济南,250013)
葡萄糖对热带假丝酵母菌株SFX-Y9木糖醇发酵的影响
赵祥颖*,张立鹤,韩延雷,杨丽萍,田延军,刘建军
(山东省食品发酵工业研究设计院,山东省食品发酵工程重点实验室,山东 济南,250013)
以热带假丝酵母SFX-Y9为研究对象,考察葡萄糖添加对木糖醇发酵的影响。研究发现,菌株SFX-Y9以葡萄糖为碳源培养种子,不仅可以提高菌体浓度、缩短培养时间,而且对木糖的转化基本没有影响;发酵培养基中添加少量葡萄糖可以提高木糖消耗速率、缩短发酵周期。采用5 L发酵罐通过精准控制过程溶氧和低流速流加葡萄糖可以进一步提高木糖消耗速率,同时可以提高木糖转化率约15%。在最佳供氧和葡萄糖为辅助碳源的条件下,菌株SFX-Y9木糖醇最大生产速率可达5.0 g/(L·h)以上,转化率可达80%以上,生产成本可以与化学加氢竞争,具有非常好的工业开发应用前景。
热带假丝酵母;木糖醇;葡萄糖;耗糖速率;转化率
木糖醇是一种五碳的多元醇甜味剂,甜度与蔗糖相当,具有抗龋齿、吸湿性好、生物稳定性高、甜度与蔗糖相当等优点,被广泛地应用在食品工业中[1]。同时,木糖醇在医疗、制药、化工、涂料等行业也有广泛用途[2]。
木糖醇目前主要是以木糖为原料采用化学加氢法生产。生产用木糖主要来源于半纤维素水解,如果采用水解液直接加氢,因为水解液中其他糖类物质的存在会造成木糖醇分离困难。所以,工业生产一般是先精制木糖,然后以纯木糖为原料经化学加氢制备木糖醇。化学加氢生产木糖醇转化率高、提取收率高,但加氢需要的氢气为易燃易爆物质,厂区安全级别要求高,具有较大的安全隐患。木糖醇也可以通过生物转化生产,有许多酵母可以转化木糖生成木糖醇。生物转化的优点是条件温和,生产过程安全,但生物转化转化率偏低,转化周期长,生产成本与化学加氢相比没有竞争力。为了降低原料成本,人们多寄希望于直接采用半纤维素水解液为原料进行木糖醇发酵[3]。半纤维素原料在水解过程中会产生糠醛、香草醛等对酵母菌体生长有害的化学物质,水解液需经预先脱毒处理才能用于生物转化[4],并且因为原料中的其他糖、醇成分的干扰,同样会造成后续木糖醇分离纯化困难[5]。因此,采用水解液为原料不但不能降低成本反而会增加生产成本,用水解液作原料进行木糖醇生物转化并不可取[6]。从生产实际考虑,采用纯净木糖为原料进行生物转化仍是最佳选择,但如果和化学加氢形成竞争力,必须进一步提高木糖转化效率,降低原料成本;同时提高菌株发酵效率、缩短转化周期,降低转化成本[7]。
酵母转化木糖生成木糖醇的转化率一般只能达到理论值的65% ~ 85%,主要原因是菌体消耗了一部分木糖醇提供木糖还原所需NADPH。为了提高木糖的转化率,降低木糖的消耗,可以通过添加低成本辅助碳源提供NADPH,提高木糖转化率,葡萄糖是理想的选择。葡萄糖同化速率快,有利于菌体生长,并且来源丰富、价格便宜,只有木糖的1/5。但葡萄糖的存在对木糖的利用有阻遏作用[8],添加葡萄糖可能会延滞木糖的消耗,从而使发酵周期延长,同样会增加生产成本。
通过添加少量的葡萄糖提高木糖转化率最初是由日本YAHASHI等[9]提出来的。他们通过控制适当的葡萄糖浓度消除了葡萄糖对木糖的阻遏作用,提高木糖转化率约20%。韩国OH等[10]曾通过流加控制合适的葡萄糖浓度,使木糖转化率得到较大幅度提升,最高达93%。而VANDESKA[11]等人报道,在发酵培养基中添加葡萄糖为木糖的1/10时,菌体量增加2倍,但木糖醇转化率和产率却有所降低。KASTNER等研究结果显示,添加葡萄糖发酵过程中会积累乙醇,反而抑制了菌体的后续生长降低了转化率[12]。
作者等前期从自然界分离到1株高产木糖醇的热带假丝酵母(Candidatropicalis)SFX-Y9[13],经条件优化后,木糖消耗速率最高可达6 g/(L·h),但转化率却只有70%左右。本项目以菌株SFX-Y9为研究对象考察葡萄糖添加对木糖醇发酵的影响,探讨利用辅助碳源提高木糖转化效率的可能性。
1 材料和方法
1.1材料与试剂
1.1.1 菌种
菌株candidatropicatisSFX-Y9,山东省食品发酵工程重点实验室筛选并保藏。
1.1.2 培养基
种子培养基(g/L):木糖(或葡萄糖)50,酵母膏 5,玉米浆 5,MgSO4·7H2O 1,KH2PO42,NaCl 2,pH自然。
发酵培养基(g/L):木糖150~200,酵母膏5,玉米浆 5,(NH4)2SO42,MgSO4·7H2O 2,KH2PO42,NaCl 2,pH自然。
所有培养基中的木糖均与其他成分分开灭菌。
1.2培养方法
1.2.1 种子培养
用接种针从斜面培养基上取1环接种到装有50 mL发酵培养基500 mL三角瓶中,30 ℃、180 r/min摇床培养8~12 h。
1.2.2 摇瓶发酵
培养好的种子液按10%接种量接种到发酵培养基中,装液量为50 mL/500 mL,30 ℃、180 r/min摇床培养。
1.2.3 5 L发酵罐实验条件
发酵培养基,初始木糖质量浓度约为150 g/L,另外添加10 g/L葡萄糖。接种10%种子液(用50 g/L葡萄糖为碳源的种子培养基,斜面接种后培养8 h)。接种培养4~6 h后开始流加葡萄糖,流加速率为1 g/(L·h);当木糖浓度降至50 g/L左右分两次补加木糖80 g/L。发酵过程中,0~8 h控制相对溶解氧浓度为20%~30%,8 h后逐步将相对溶氧水平降至0~5%。发酵过程中定时取样分析木糖、木糖醇、葡萄糖、菌体浓度、pH等参数。
1.3分析方法
1.3.1 木糖、木糖醇、乙醇定量分析
将发酵液离心取上清液,稀释适当的倍数,采用HPLC分析木糖、木糖醇、乙醇含量,采用外标法进行定量。
HPLC分析条件:
色谱仪:戴安UV3000,检测器:示差检测器,色谱柱:Carbomix Ca-NP5:8%,流动相:超纯水,流速:0.8mL/min,进样量:20 μL,柱温:80 ℃。
1.3.2 葡萄糖测定
采用SBA-40D葡萄糖测定仪测定。
1.3.3 蛋白含量的测定
参照BRADFORD的考马斯亮蓝法[14],以牛血清蛋白为标准品。
1.3.4 生物量测定
发酵液稀释10倍,在600 nm下测定吸光度。
1.3.5 pH值测定
利用PSH-2C精密型酸度计对发酵液进行测定。
1.4计算方法
(1)

(2)
2 结果和讨论
2.1葡萄糖对菌株SFX-Y9生长的影响
分别以木糖和葡萄糖为碳源种子培养基培养菌株SFX-Y9,培养过程中糖的消耗速率与菌体生长曲线如图1所示。结果显示以葡萄糖为碳源SFX-Y9糖消耗速率(图1-A)和菌体生长速率(图1-B)明显比以木糖为碳源快。种龄10 h,葡萄糖为碳源的种子液菌体浓度是木糖的1.45倍,说明SFX-9同化葡萄糖的能力更强,葡萄糖更有利于菌株的生长快,与文献[9-10]报道一致。

图1 碳源对菌株SFX-Y9底物消耗和生长速率的影响Fig.1 Effect of carbon on the growth of strains SFX-Y9
2.2种子培养基碳源对菌株SFX-Y9木糖醇发酵的影响
葡萄糖虽然有利于菌株的生长,但木糖醇发酵是以木糖为底物转化的,以葡萄糖为碳源培养菌种,接种后因为碳源的转换可能会造成菌体生长和木糖消耗延滞。分别以葡萄糖和木糖为碳源培养的菌株SFX-Y9种子液,然后接种进行木糖醇发酵,发酵过程木糖的消耗、木糖醇的积累、菌体生长以及过程pH 变化如图2所示。
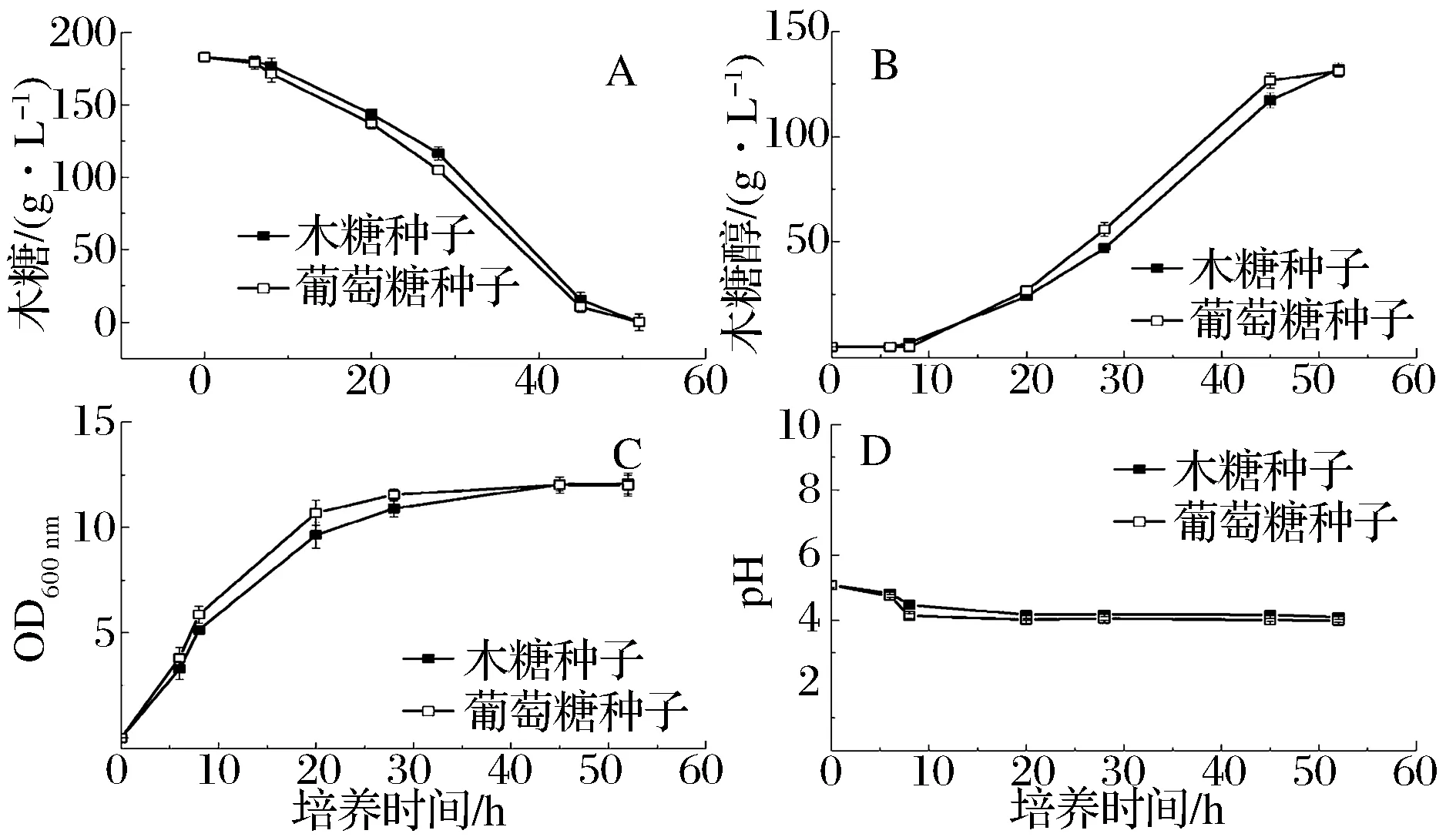
—■—木糖培养菌种 —□—葡萄糖培养菌种(A)木糖消耗;(B)木糖醇的积累;(C)菌体浓度;(D)发酵液pH图2 不同种子培养基对菌株SFX-9木糖醇发酵的影响Fig.2 Effect of different seed media on the xylitol fermentation of SFX-9
从结果来看,以葡萄糖为碳源培养菌种,接种后没有观察到菌体生长和木糖消耗的延滞现象。可能是因为葡萄糖为碳源种子液,菌体浓度比木糖为碳源的高,相对接种量大的原因,接种后木糖的耗糖速率(图2-A)、菌体生长(图2-B)、木糖醇生成速率(图2-C)反而比木糖培养的种子液略快。以葡萄糖为碳源培养菌种,不仅生长速度快,并且对木糖醇发酵也没有影响,工业生产中用葡萄糖代替木糖培养菌种可以节省原料成本。
2.3葡萄糖添加对菌株SFX-Y9木糖醇发酵的影响
酵母转化木糖生产木糖醇的代谢机制为:木糖在木糖还原酶(XR)的作用下以加氢生成木糖醇,木糖醇在木糖醇脱氢酶(XDH)的作用下氧化成木酮糖进入磷酸五糖途径(HMP)[1]。XR辅酶是NADPH,XDH辅酶为NAD+,在限制供氧的条件下,NAD+再生受到限制,抑制了XDH 的活性,从而导致木糖醇积累。酵母转化木糖生成木糖醇的转化率一般只能达到理论值的65%~85%,主要原因是菌体消耗了一部分木糖醇提供木糖还原所需辅酶NADPH。以葡萄糖为辅助碳源进行木糖醇发酵的目的就是希望菌种可以利用葡萄糖提供辅酶NADPH,减少木糖的消耗。本研究在菌种培养实验的基础上,考察了在发酵培养基中添加葡萄糖对菌株SFX-Y9木糖消耗速率和转化率的影响。实验结果显示(表1),葡萄糖添加量在5~30 g/L之间时木糖消耗速率随着葡萄糖添加量的增加逐渐加快,当葡萄糖添加量增加至40 g/L时,木糖消耗速率开始出现下降趋势。研究在发酵培养基中添加葡萄糖最初目的是为了降低木糖消耗,提高木糖/木糖醇转化率,但实验结果并没有预期的木糖转化率提高,只有添加量为10~20 g/L时木糖转化率略有增加。

表1 初始葡萄糖浓度对菌株SFX-Y9木糖醇发酵的影响
注:发酵培养基木糖质量浓度按190 g/L配制,不添加葡萄糖实验组,接种木糖为碳源的种子液,添加葡萄糖的实验组,接种葡萄糖为碳源的种子液,接种量均为10%,为了保持接种量一致性,种子液培养时间略有不同。
为了进一步探讨葡萄糖添加对菌株SFX-Y9木糖消耗的影响机制,选取30 g/L葡萄糖添加对其发酵进程进行了考察。实验分为2组,一组在发酵培养基中添加30 g/L葡萄糖,对照组不添加葡萄糖,均接种10%葡萄糖为碳源的种子液,实验发酵进程如图3所示。

A-木糖消耗;B-木糖醇的积累;C-菌体浓度;D-发酵液pH图3 葡萄糖添加对菌株SFX-Y9木糖醇发酵进程的影响Fig.3 Effect of glucose on the xylitol fermentation progress of SFX-Y9
实验结果显示,发酵培养基中添加葡萄糖,发酵前期菌体生长速率明显高于对照组,培养前8 h发酵液的OD比对照组提高30%,培养20 h以后菌体浓度差距缩小,发酵结束时菌体浓度差距并不明显(与表1结果相似)。培养前8 h,对照组的木糖消耗速率略高于葡萄糖添加组,但8 h以后葡萄糖添加组木糖消耗速率明显加快,并迅速超过未添加组,最终发酵周期比对照组缩短8 h以上。添加葡萄糖转化率70.8%,未添加组转化率为69.2%,差距不明显。所以葡萄糖添加主要作用是促进菌体生长,对转化率贡献率较低。对添加葡萄糖木糖醇发酵液中有少量乙醇积累(约10 g/L),而纯木糖发酵发酵液中基本检测不到乙醇(图4),因此推测菌株SFX-Y9对葡萄糖消耗可能更多是经糖酵解途径,然后进一步在乙醇脱氢酶的作用下还原生成乙醇,同时再生了NAD+,这样可能促进木糖醇的进一步代谢,抵消了葡萄糖对转化率的贡献。
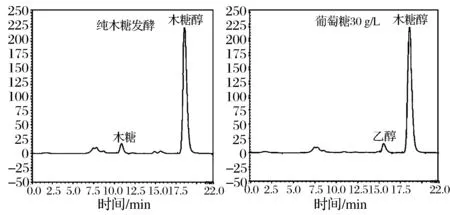
图4 葡萄糖添加对菌株SFX-9代谢产物的影响Fig.4 Effect of glucose on the products(metabolites)of SFX-Y9
2.4葡萄糖低速流加对菌株SFX-Y9木糖醇发酵的影响
摇瓶实验结果显示,葡萄糖的添加虽然可以缩短菌株发酵周期,但对其木糖转化率增加并不明显,推测可能是因为葡萄糖代谢反而激发了木糖醇的进一步消耗造成的。摇瓶发酵由于条件所限,对过程参数和底物浓度的控制都不能进行调节,因此采用5 L罐发酵,通过过程参数的控制和对糖浓度的调节,继续考察了葡萄糖对菌株SFX-Y9木糖醇发酵的影响。实验发现采用一次添加葡萄糖的方式进行发酵,结果与摇瓶培养相似,添加葡萄糖只能缩短发酵周期,对木糖转化率几乎没有贡献。一次性添加葡萄糖,菌株优先利用葡萄糖,木糖消耗受到抑制,菌体葡萄糖和木糖代谢不同步,并且葡萄糖主要通过EMP途径代谢,对木糖转化率贡献较低。葡萄糖对木糖的阻遏效应当葡萄糖浓度低于某一值时解除,可以实现木糖和葡萄糖同步利用。通过流加的方式控制发酵液中葡萄糖浓度,结果表明采用低速(1 g/(L·h))流加葡萄糖可以明显提高木糖的转化率。同时适当降低初始木糖浓度,可以减轻初始糖浓度对菌体生长的抑制。实验采用初始木糖质量浓度为150 g/L,添加10 g/L葡萄糖,发酵4~6 h后,用每小时1 g/L的速率流加葡萄糖,当发酵液中木糖浓度降至50 g/L时,分2次补加木糖80 g/L,发酵进程如图6所示。发酵结果显示发酵过程中发酵液中基本检测不到葡萄糖,平均木糖消耗速率达4.0 g/(L·h)以上,最高木糖消耗速率达7.0 g(L·h)以上,木糖醇平均生产速率达3.5 g/(L·h)以上,木糖醇最大生产速率可达5.0 g/(L·h)以上,木糖转化率达82.4%,发酵液中几乎检测不到乙醇(图5)。发酵过程中共计流加葡萄糖约40 g/L,对木糖转化率的贡献约10%。比一次添加葡萄糖发酵木糖转化率提高约15%。
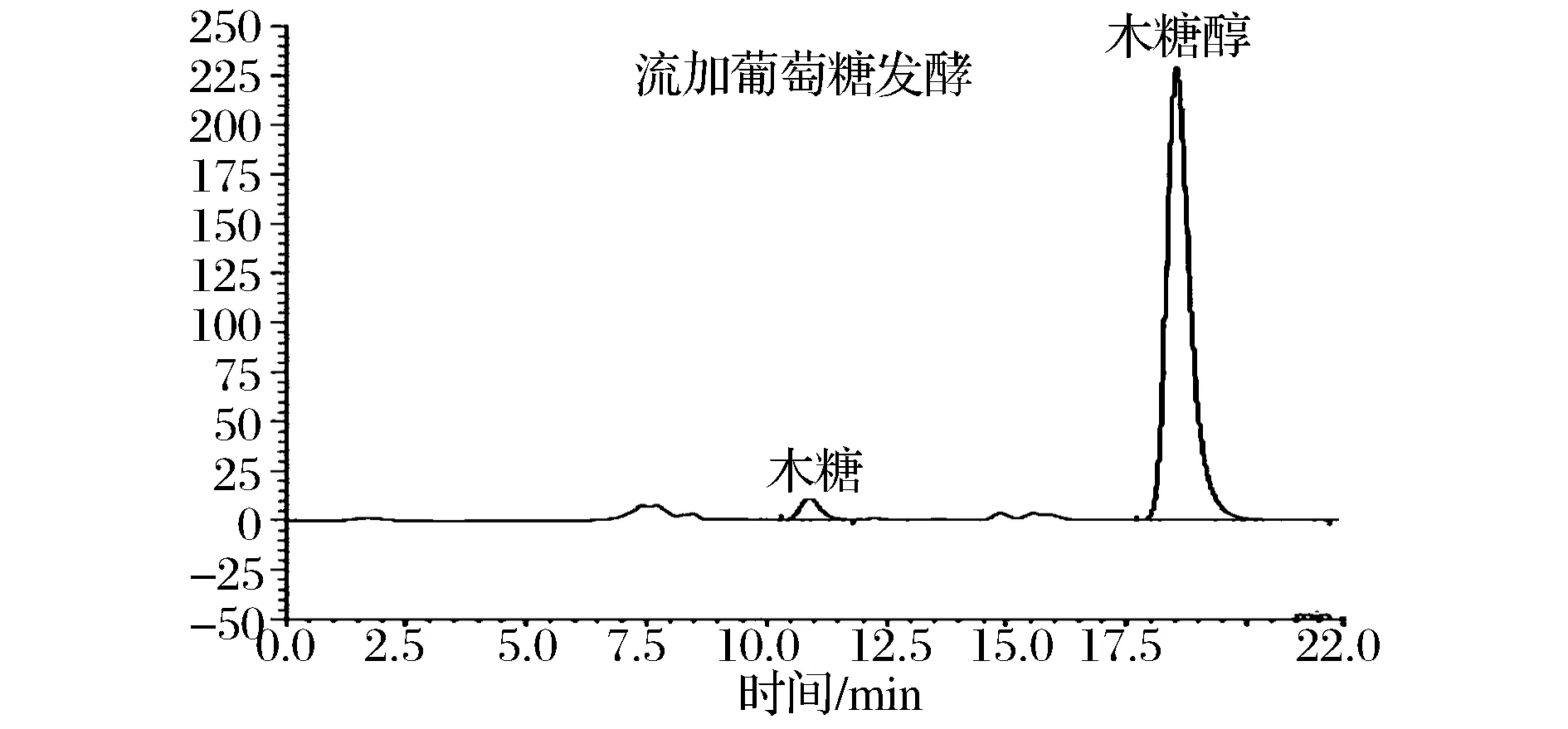
图5 低速流加葡萄糖对菌株SFX-Y9代谢产物的影响Fig.5 The products of SFX-Y9 in low speed fed glucose

图6 5 L发酵罐补料发酵进程Fig.6 The process of fed-batch fermentation in 5 L fermenter
3 结论
作者前期分离到1株木糖醇高产菌株SFX-Y9,经进一步优化后,木糖消耗速率最高可达6 g/(L·h),是1株有工业应用潜力的菌株。文献报道采用葡萄糖为辅助碳源可以提高木糖的转化率。本项目研究了葡萄糖对该菌株生长及木糖醇发酵的影响。实验结果显示,用葡萄糖为碳源种子培养基培养种子,可以提高菌体浓度,缩短培养时间,并且对木糖醇发酵基本没有影响,完全可以替代木糖用于菌种培养;发酵培养基中添加少量葡萄糖可以缩短发酵周期10%以上。采用5 L发酵罐,通过严格控制过程溶氧和采用低流速流加葡萄糖不仅可以进一步提高木糖消耗速率,同时可以提高木糖转化率约15%。综上,葡萄糖添加对菌株SFX-Y9木糖醇发酵效益的提高还是非常显著的。在最佳供氧和葡萄糖为辅助碳源的条件下,菌株SFX-Y9木糖醇最大生产速率可达5.0 g/(L·h)以上,转化率可达80%以上,生产成本可以与化学加氢竞争,具有非常好的工业开发应用前景。
[1] UR-REHAM S,MUSHTAQ Z,ZAHOOR T,et al.Xylitol:a review on bioproduction,application, health benefits, and related safety issues[J].Critical Reviews Food Science and Nutrition,2015,55(11):1 514-1 528.
[2] AZARPAZHOOH A, LAWERNCE H, Shah P.Xylitol for preventing acute otitis media in children up to 12 years of age[J].Cochrane Database of Systematic Reviews, 2016,3(8): 1-41.
[3] ANDRES F H P,PRISCILA V D A,MARIA D G D A F.Sugarcane straw as a feedstock for xylitol production byCandidaguilliermondiiFTI 20037[J].Brazilian Journal of Microbiology, 2016,47(2):489-496.
[4] RAFIQUL I S M, SAKINAH AMM, ZULARISAM AW. Inhibition by toxic compounds in the hemicellulosic hydrolysates on the activity of xylose reductase fromCandidatropicalis[J]Biotechnol Letters,2015, 37:191-196.
[5] ROSA S M A,FELIPE M G A,SILVA SS,et al.Xylose reductase production byCandidaguilliermondiiFTI 20037[J]. Applied Biochemistry and Biotechnoloy,1998,70-72:127-135.
[6] VENKATESWAR R L,GOLI JK, GENTELA J,et al.Bioconversion of lignocellulosic biomass to xylitol:an overview[J].Bioresource Technology, 2016,213:299-310.
[7] TOM B G,KEN I,MATTI L.A rare sugar xylitol.Part I: the biochemistry and biosynthesis of xylitol[J].Applied Microbiology and Biotechnology,2007,74:277-281.
[8] PANCHAL CJ, BAST L,RUSSELL I,et al.Repression of xylose utilization by glucose in xylose-fermenting yeasts[J].Canadian Journal of Microbiology,1988,34:1 316-1 320.
[9] YAHASHI Y,HORITSU H K,KAWAIT,et al.Production of xylitol fromD-xylose byCandidatropicalis: the effect ofD-glucose feedingCandidatropicalisIF0 0618[J].Journal of Fermentation and Bioengineering,1996, 81(2):148-152.
[10] OH DK,KIM SY.Increase of xylitol yield by feeding xylose and glucose inCandidatropicalis[J].Applied Microbiology and Biotechnology,1998, 50:419-425.
[11] VANDESKAE, AMARTEY S, KUZMANOVA S,et al.Fed-batch culture for xylitol production byCandidaboidinii[J].Process Biochemistry,1996,31(3) :265-270.
[12] Kastner J R,Eiteman M A,Lee S A.Glucose repression of xylitol production inCandidatropicalismixed-sugar fermentations[J]. Biotechnology Letters,2001,23:1 663-1 667.
[13] 刘建军,杨其义,赵祥颖,等.土壤中产木糖醇酵母菌株的筛选其发酵条件优化[J].现代食品科技,2013,29(7):1 632-1 637.
[14] 宁正祥. 食品成分分析手册[M].北京:中国轻工业出版社,1997:78-79.
EffectofglucoseonxylitolfermentationbyCandidatropicalisSFX-Y9
ZHAO Xiang-ying*, ZHANG Li-he, HAN Yan-lei, YANG Li-ping, TIAN Yan-jun, LIU Jian-jun
(Shandong Provincial Key Laboratory of Food and Fermentation Engineering, Shandong Food Fermentation Industry Research amp; Design Institute, Jinan 250013,China)
The effects of glucose on xylitol fermentation byCandidatropicalisSFX-Y9 was studied in this paper. Results showed that strains SFX-Y9 with glucose as carbon source to cultivate seeds could shorten training time and improve the concentration of cells, and had little influence upon conversion of xylose. When the fermentation medium was supplemented with a small amount of glucose, it could increase the consumption rate of xylose and shorten the fermentation cycle. Through the control of dissolved oxygen and the glucose fed-batch could further increase the rate of xylose consumption in 5 L fermentor, and the conversion rate of xylose increased by about 15%. Under the condition of optimal oxygen supply and glucose as a secondary carbon source, the production rate of xylitol can reach 5.0 g/(L·h), and the rate of conversion can reach more than 80%. The production cost of xylitol by microbial conversion can compete with the chemical hydrogenation, and it has a bright application future.
Candidatropicalis;xylitol; glucose; sugar consuming rate;yield
10.13995/j.cnki.11-1802/ts.014898
硕士,研究员(赵祥颖研究员为通讯作者,E-mail:xyzhao68@126.com)。
山东省自主创新重大专项(2014XGC07001)
2017-06-07,改回日期:2017-07-18

