小麦低聚肽和谷氨酰胺对大鼠胃肠黏膜损伤的保护作用
刘文颖,杨贤,曹珂璐,谷瑞增,潘兴昌,孙桂菊*
1(中国食品发酵工业研究院,北京,100015) 2(东南大学公共卫生学院,江苏 南京,210009)
小麦低聚肽和谷氨酰胺对大鼠胃肠黏膜损伤的保护作用
刘文颖1,杨贤2,曹珂璐1,谷瑞增1,潘兴昌1,孙桂菊2*
1(中国食品发酵工业研究院,北京,100015) 2(东南大学公共卫生学院,江苏 南京,210009)
观察灌胃小麦低聚肽和谷氨酰胺对非甾体类药物(NSAIDs)致大鼠胃肠黏膜损伤的保护作用。挑选70只SD大鼠随机分为空白对照组、损伤组及低、中、高剂量小麦低聚肽组[灌胃剂量分别为20、100、500 mg/(kg·d)]和小麦蛋白组、谷氨酰胺组[灌胃剂量均为20 mg/(kg·d)]。每天灌胃1次,连续灌胃30 d。大鼠处死前,用非甾体类药物灌胃损伤大鼠胃肠2次。取大鼠血清、胃和小肠黏膜组织,观察血清细胞因子、胃肠病理切片、小肠黏膜抗氧化酶和阿片受体mRNA表达的变化。结果显示非甾体类药物可以显著增加小肠黏膜的氧化应激水平,小麦低聚肽能上调小肠黏膜中GSH-Px的活力,具有一定的抗氧化功能,能够减轻胃肠黏膜损伤。小麦低聚肽还可以显著降低了血清中TNF-α含量,下调mu-阿片受体mRNA的表达。说明非甾体类药物可以诱导大鼠胃肠黏膜损伤的模型,小麦低聚肽可以有效减少大鼠胃肠黏膜损伤。低剂量小麦低聚肽组作用最强,效果优于谷氨酰胺组。
小麦低聚肽;谷氨酰胺;非甾体类药物;胃肠黏膜损伤
非甾体类药物(non-steroidal anti-inflammatory drugs,NSAIDs)如阿司匹林、吲哚美辛等,是有效的镇痛药物,多用于关节炎、滑囊炎、肌腱炎、扭伤、劳损以及其他的损伤等[1]。然而,NSAIDs会导致胃肠道损伤,引起胃肠道不适、胃肠道溃疡等[2]。小麦低聚肽是以小麦谷朊粉为原料,经生物酶法生产的分子质量在1 000u以下的小分子肽混合物,具有较高的谷氨酰胺含量(谷氨酰胺含量占22%左右),并且水溶性好,易于消化吸收,可作为一种优良的谷氨酰胺补充剂。作为一种天然安全的蛋白肽类物质,小麦低聚肽具有多种生理活性,如抗氧化、降血压、降胆固醇、增强免疫力等[6]。小麦低聚肽中富含谷氨酰胺,谷氨酰胺对胃肠黏膜的生长与健康有着重要的积极作用。目前国内外对小麦低聚肽保护胃肠黏膜损伤方面的研究较少,有待进行深入和系统的研究。
本研究以谷氨酰胺为对照,通过NSAIDs诱导胃肠损伤的大鼠动物模型,来观察小麦低聚肽对胃肠损伤的保护作用及其机制。
1 材料与方法
1.1材料
1.1.1 试验动物
清洁级SD大鼠70只,雄性,体重180~200 g,购于浙江省实验动物中心(许可证号:SCXK(浙)2008-0033);标准鼠粮,购于南京市江宁区青龙山实验动物繁殖场;大鼠饲养于东南大学环境医学工程教育部重点实验室动物房。
1.1.2 主要试剂
小麦低聚肽,由中国食品发酵工业研究院提供,平均分子质量小于1 000 u的低分子肽混合物,比例达到92%,基本上是由2~6个氨基酸构成;谷氨酰胺,Waters公司;考马斯亮蓝蛋白浓度测试盒、SOD、CAT、GPx、MDA测定试剂盒,南京建成生物工程研究所;细胞因子IL-1β、IL-6、TNF-α放免试剂盒,北方生物技术研究所;反转试剂盒,南京百斯凯科技有限公司;引物,由生工生物工程(上海)有限公司合成;PCR试剂盒,生工生物工程(上海)有限公司。其他均为国产分析纯。
1.1.3 试验仪器
722N可见光分光光度计,上海精密仪器有限公司;FMJ-182放射免疫γ-计数器,上海原子核研究所日环仪器一厂;PCR仪,德国eppendorf公司。
1.2实验方法
1.2.1 动物分组和样品采集
70只SD大鼠随机分为7组,分别是空白对照组(用Con表示)、损伤组(用P Con表示)、低剂量小麦低聚肽组(灌胃剂量为20 mg/kg,用LWP来表示)、中剂量小麦低聚肽组(灌胃剂量为100 mg/kg,用MWP来表示)、高剂量小麦低聚肽组(灌胃剂量为500 mg/kg,用HWP来表示)、小麦蛋白组(灌胃剂量为20 mg/kg,用WPro来表示)和谷氨酰胺组(灌胃剂量为20 mg/kg,用Gln来表示)。低、中、高剂量小麦低聚肽组每天用不同浓度的小麦低聚肽溶液1 mL灌胃,小麦蛋白组和谷氨酰胺组每天用小麦蛋白溶液和谷氨酰胺溶液1 mL灌胃,空白对照组和损伤组大鼠每天按等体积蒸馏水灌胃,灌胃共30 d。
30 d末次灌胃后30 min,损伤组,低、中、高剂量小麦低聚肽组、小麦蛋白组和谷氨酰胺组大鼠以非甾体类药物损伤剂(阿司匹林0.6 g/kg及吲哚美辛50 mg/kg混合)灌胃,45 min后重复给损伤剂1次。在末次给损伤剂后2 h,股动脉采血后颈部脱臼处死所有大鼠,取血清,-20 ℃保存备用;剪取小块胃体、十二指肠,浸泡于10%中性甲醛固定液固定,备用;取胃、小肠黏膜组织,-70 ℃保存备用。
1.2.2 胃、十二指肠病理组织学观察
取大鼠的胃、十二指肠组织(每只动物的取材部位相同),用甲醛固定,石蜡包埋,切片,H.E.染色,进行病理组织学观察。
1.2.3 小肠黏膜超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、丙二醛(MDA)的测定
样本前处理:准确称取小肠黏膜组织50 mg,加入生理盐水450 μL制成10%的匀浆,3 500 r/min离心10 min,取上清再用生理盐水按1∶4稀释成2%的匀浆待测。SOD、CAT、GPx、MDA的测定按试剂盒说明书进行。
1.2.4 血清细胞因子白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的测定
细胞因子IL-1β、IL-6、TNF-α的测定按放免试剂盒说明书进行。
1.2.5 小肠黏膜RT-PCR阿片受体mRNA表达分析
1.2.5.1 总RNA提取
取约50 mg的大鼠小肠黏膜组织,用电动匀浆机彻底匀浆后,采用TRIzol一步抽提法提取胰脏的总RNA。
1.2.5.2 反转录
分别取1 μg/μL各样品的总RNA 2 μL进行反转录。反转录反应体积为25 μL,其中含Oligo dT(18)5μmol/L引物,4 mmol/L dNTP,加DEPC水至10 μL,70 ℃变性5 min,冰上冷却。再加入8 U RNA酶抑制剂,100 U反转录酶,5 μL 5×RT Buffer(含250 mmol/L Tris-HC1 pH 8.3,150 mmol/L MgCl2,375 mmol/L KC1,50 mmol/L DTT),补充DEPC水至25 μL,37℃反应60 min,95 ℃变性5 min,反转录产物(RT Products)-20 ℃保存备用。
1.2.5.3 阿片受体mRNA的RT-PCR分析
阿片受体引物序列见表1。
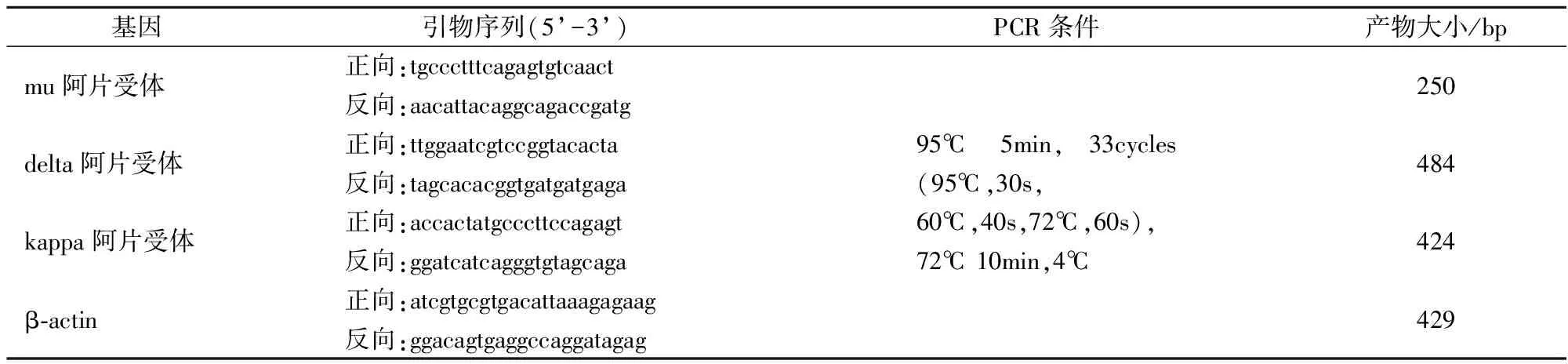
表1 mu阿片受体、delta阿片受体、kappa阿片受体和β-actin引物参数
1.2.6 统计学处理
用SPSS 13.0统计软件进行统计分析。数据以(平均值±标准差)表示,采用单因素方差分析,组间两两比较用t检验。plt;0.05为差别有显著性意义。
2 结果
2.1胃、十二指肠病理学变化
非甾体类药物损伤剂造成的胃损伤性病变主要表现为胃黏膜上皮细胞轻微或轻度变性、坏死,固有层和黏膜下层有少量嗜酸性粒细胞浸润。病理学检查发现,低剂量组的损伤比较轻微,其次是中剂量组,高剂量小麦低聚肽组、小麦蛋白组和谷氨酰胺组基本一致,损伤稍微重一些。损伤组的损伤最重,出现较严重的胃黏膜上皮细胞变性、坏死,炎性细胞浸润。具体病变状况见图1。
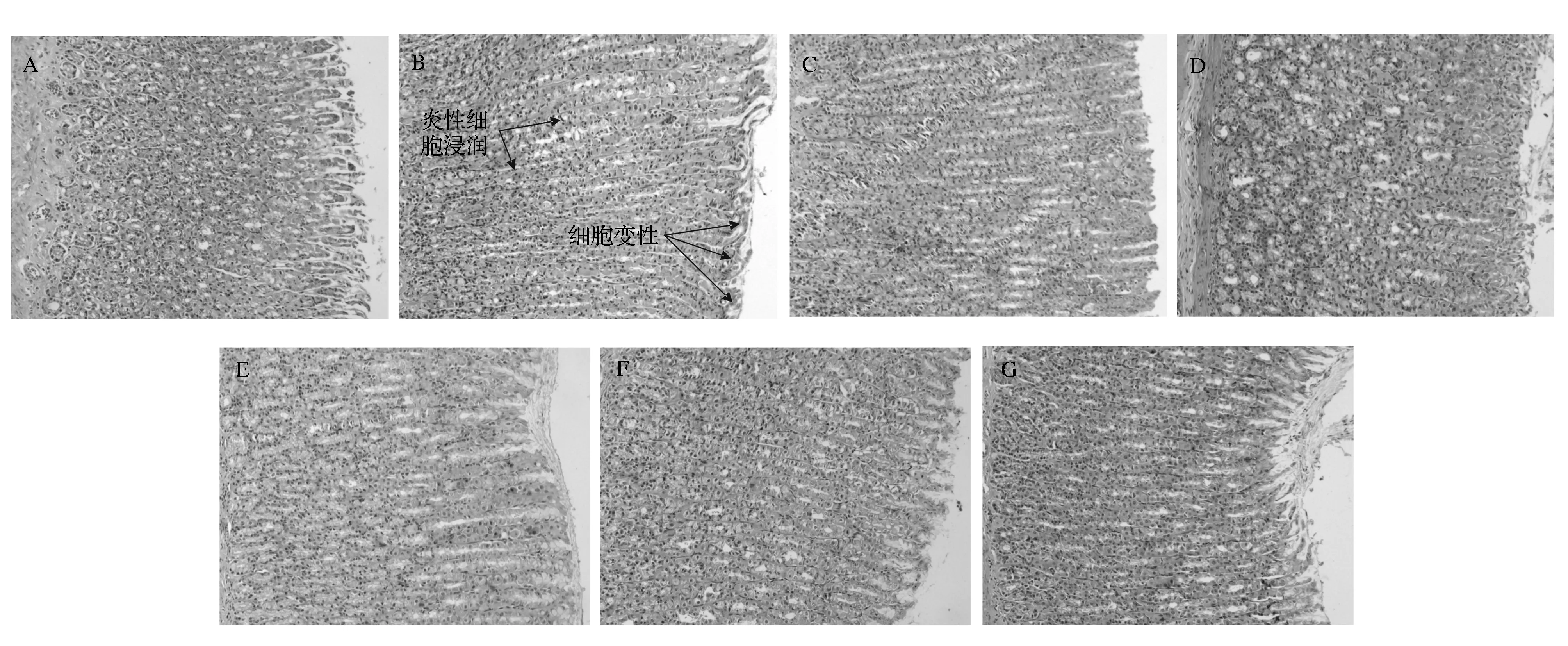
图1 大鼠胃体组织形态学观察(200×)Fig.1 Histologic observation of stomach body in rats (200×)注:A=空白组,B=损伤组,C=低剂量小麦低聚肽组,D=中剂量小麦低聚肽组,E=高剂量小麦低聚肽组,F=小麦蛋白组,G=谷氨酰胺组A=control group, B=damage group, C=low dose of wheatoligopeptide group, D=medium dose of wheat oligopeptide group, E=high dose of wheat oligopeptide group, F=wheat gluten group, G=glutamine group。图2同。
非甾体类药物损伤剂造成的十二指肠黏膜损伤主要表现为绒毛轻微或轻度水肿。病理学检查发现,低剂量组大鼠十二指肠损伤较轻,其次是中剂量组,高剂量小麦低聚肽组、小麦蛋白组和谷氨酰胺组基本一致,损伤稍微重一些。损伤组的损伤最重。具体病变状况见图2。
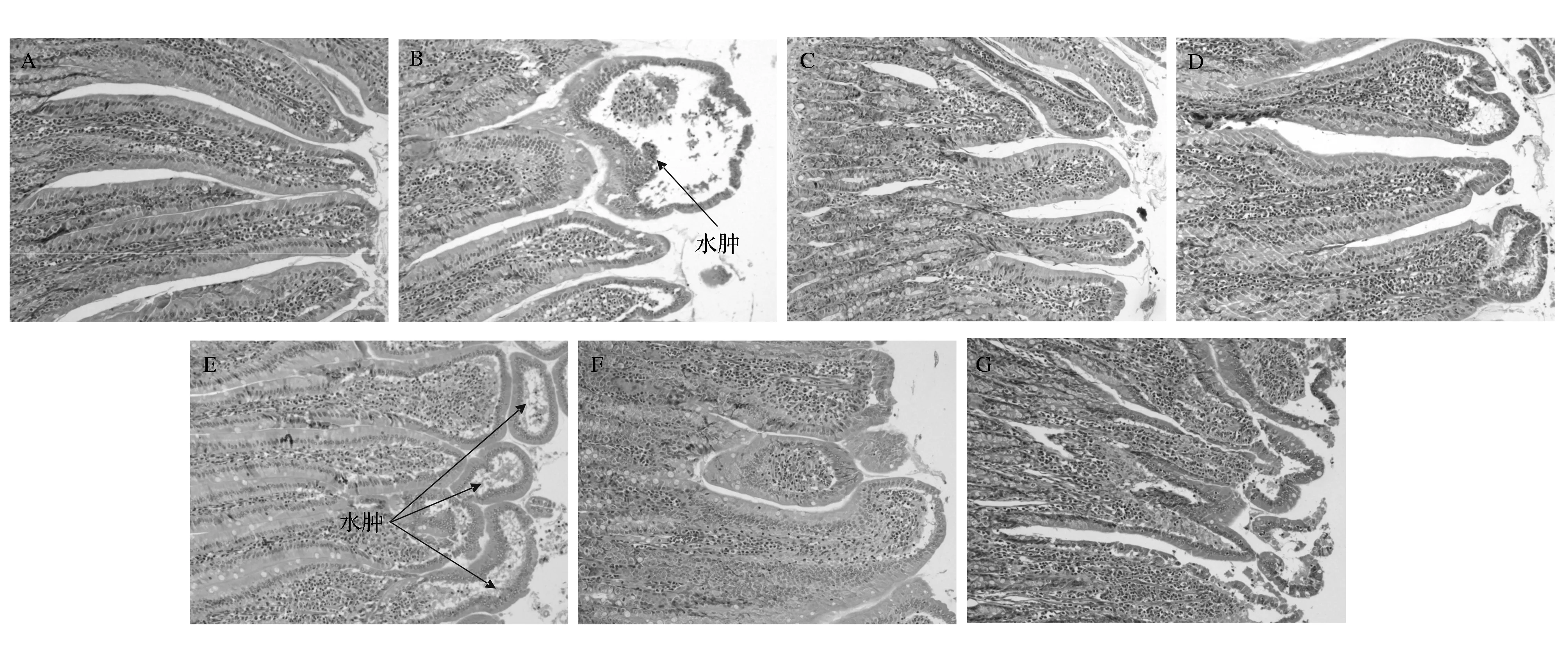
图2 大鼠小肠形态学观察(200×)Fig.2 Histologic observation of small intestine in rats (200×)
2.2小麦低聚肽对大鼠小肠黏膜SOD、CAT、GPx的活性及MDA的影响(表2)
灌胃后,药物损伤组大鼠胃肠道后,其小肠黏膜氧化应激加剧,表现为小肠黏膜SOD、CAT、GPx的活力显著下降。与空白对照组相比,损伤模型组动物小肠黏膜SOD、CAT和GPx的水平均明显降低(t=2.518,plt;0.05;t=2.798,plt;0.05;t=2.264,plt;0.05),而MDA含量则明显高于空白对照组(t=2.801,plt;0.05)。
灌胃给予低、中剂量小麦低聚肽组动物小肠黏膜GPx活性明显回升,高于损伤模型组(t=2.347,plt;0.05;t=2.855,plt;0.05);低剂量小麦低聚肽组动物小肠黏膜MDA含量明显低于损伤模型组(t=2.549,plt;0.05)。

表2 小麦低聚肽对大鼠小肠黏膜SOD、CAT、GPx的活性及MDA的影响(n=10)
注:*表示与空白对照组相比差异显著(plt;0.05),#表示与损伤模型组相比差异显著(plt;0.05)。
2.3血清细胞因子的变化
灌胃后,与空白组相比,损伤组血清中IL-1β、IL-6含量无变化。与损伤组相比,灌胃小麦低聚肽、小麦蛋白和谷氨酰胺组血清中IL-1β、IL-6含量无变化。但是与空白组相比,损伤组血清中TNF-α含量要显著升高(t=2.651,plt;0.05);与损伤组相比,低剂量小麦低聚肽组血清TNF-α含量要显著降低(t=2.279,plt;0.05),其他处理组血清中TNF-α含量无变化(见表3)。

表3 血清中细胞因子的变化(n=10) 单位:ng/L
注:*表示与空白对照组相比差异显著(plt;0.05),#表示与损伤模型组相比差异显著(plt;0.05)。
2.4小肠黏膜阿片受体mRNA表达的变化
通常在小肠黏膜,delta、kappa阿片受体是不转录的。通过RT-PCR的方法来观察大鼠小肠黏膜阿片受体的转录发现,非甾体类药物损伤大鼠小肠黏膜后,损伤模型组的大鼠小肠黏膜mu阿片受体转录高于空白组。中、低剂量小麦低聚肽干预30 d后再药物损伤,发现小麦低聚肽能显著下调小肠黏膜mu阿片受体的转录(t=2.367,plt;0.05;t=2.448,plt;0.05)。

图3 小肠黏膜阿片受体mRNA表达Fig.3 mRNA expression of opioid receptor in small intestine mucosa
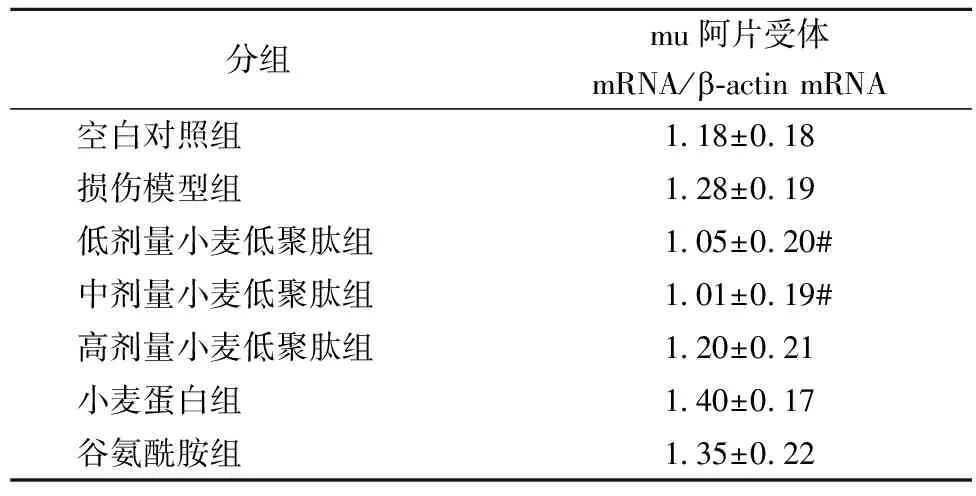
表4 小肠黏膜阿片受体mRNA表达的变化
注:*表示与空白对照组相比差异显著(plt;0.05),#表示与损伤模型组相比差异显著(plt;0.05)。
3 讨论
NSAIDs是一类常见的药物,具有消炎、止痛、退热和抗血小板的作用,主要用于炎性疾病、关节炎、疼痛、发热、缺血性脑血管障碍等疾病的预防与治疗。NSAIDs中不同种类药物对胃肠道黏膜损害的危险程度不一致,安全剂量范围也不一样。例如,成人阿司匹林口服量约为1.0~2.0 g/d。很多临床的结果显示NSAIDs的大量使用对胃肠黏膜的损伤比人们预期的要大得多。
近年来研究发现,NSAIDs导致的消化道损伤与组织的氧化应激有重要关系[12]。有文献报道大鼠灌胃NSAIDs之后消化道黏膜的MDA含量显著增加[13]。而本研究发现低剂量的小麦低聚肽可以减少肠损伤大鼠的小肠黏膜的MDA含量,本结果提示小麦低聚肽可以降低组织的氧化应激水平。
SOD、CAT和GSH-Px是机体清除活性自由基的主要酶类。SOD可以把超氧自由基转化为过氧化氢,体内的CAT和GSH-Px会立即将其分解为完全无害的水[14-15]。抗氧化酶类的相互协作构成了机体自由基产生与清除的平衡。本研究发现NSAIDs的急性损伤会导致小肠黏膜中SOD活性的下降,这个结果是与NAIR的研究结论相一致的[16]。CAT是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。它可促使过氧化氢分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受过氧化氢的毒害,是生物防御体系的关键酶之一。本研究发现灌胃大剂量NASIDs后大鼠小肠黏膜CAT活性会下降,这与NAIR的研究结果一致[16]。GSH-Px是减少氧化应激的关键酶,能催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,同时促进过氧化氢的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。本研究的结果显示灌胃大剂量的NSAIDs后小肠黏膜的GSH-Px活性显著下降,而小麦低聚肽却能提高肠损伤大鼠肠黏膜GSH-Px的活性。
以上结果提示小麦低聚肽可以增加部分抗氧化应激酶的活力,从而减少了肠损伤情况下黏膜的氧化应激。同时也进一步加深了本研究对于NSAIDs致氧化应激损伤的这方面的认识。SUETSUNA等报道小麦低聚肽在体外有很强的抗氧化活性[17],而本研究的结果进一步证实小麦低聚肽在体内也能发挥抗氧化作用。
在NSAIDs介导的胃肠道损伤的病理过程中,TNF-α是主要的致炎细胞因子,同时它也加剧了机体和组织中ROS的产生[8]。IL-6和IL-1β是炎症反应中其他的重要介质[9]。本研究中灌胃高剂量的NSAIDs后,大鼠血清中TNF-α的含量显著上升,这个结果与MURAKAMI的研究一致[10]。而低剂量的小麦低聚肽能显著降低大鼠血清中TNF-α的含量,这可能因为小麦低聚肽有一定的消炎抗感染作用[11]。TNF-α、IL-6和IL-1β是胃肠道损伤过程中重要的致炎因子,因此,抑制一些炎症因子可能是一个有效减少胃肠道损伤的重要手段。
阿片受体可以细分为三类:mu、delta和kappa阿片受体。脑啡肽和强啡肽各自是delta和kappa阿片受体内源性配体。HUEBNER和FUKUDOME发现一些来源小麦蛋白的肽具有很高的阿片样活性[18-19]。已有研究发现mu阿片受体与小肠运动有确定的联系[20-21]。药理学的研究也显示无论是体内还是体外试验阿片受体激动剂都会影响小肠的运动,这与阿片受体激动剂能影响神经递质的释放从而影响肠蠕动的反射有关[22-23]。另外ROY等人观察mu阿片受体敲除的小鼠时发现mu阿片受体的存在延长了食物的胃肠通过时间[24]。但是,阿片受体对于小肠黏膜的作用研究比较少。本研究结果显示灌胃小麦低聚肽会显著降低小肠黏膜mu阿片受体的转录,这可能是小麦低聚肽发挥其生物学功能的一个可能途径。本实验的研究结果发现低、中剂量的小麦低聚肽比高剂量的小麦低聚肽有更好的小肠保护作用,推测小麦低聚肽可能是通过抑制受体表达、受体的过饱和等途径来影响机体的生理功能。本研究将开展进一步的机制研究。
本研究明确了谷氨酰胺对胃肠黏膜的保护与修复作用,但游离的谷氨酰胺不稳定,小麦低聚肽中的谷氨酰胺以低聚肽形式存在,比游离的谷氨酰胺稳定,低剂量小麦低聚肽组对胃肠黏膜的保护与修复作用更强,可在一定程度上作为谷氨酰胺的替代品使用。
4 结论
灌胃一定量的小麦低聚肽、小麦蛋白、谷氨酰胺30 d后,能减少非甾体类药物对胃肠黏膜的损伤。低、中剂量小麦低聚肽处理组的大鼠胃肠组织损伤的程度要比模型组低,低剂量小麦低聚肽组作用最强,效果优于小麦蛋白组和谷氨酰胺组。其作用机制可能与小麦低聚肽能够上调小肠黏膜谷胱甘肽过氧化物酶(GPx)的活力,降低小肠黏膜的脂质过氧化水平有关。通过对分子机制进行初步探讨,发现小麦低聚肽能减少非甾体类药物对小肠黏膜的损伤可能与其能调控mu阿片受体的转录有关。
[1] MIGLIORE A, GRANATA M, TORMENTA S, et al.Hip viscosupplementation under ultra-sound guidance riduces NSAID consumption in symptomatic hip osteoarthritis patients in a long follow-up.Data from italian registry[J]. European Review for Medical and Pharmacological Sciences, 2011,15(1):25-34.
[2] JARUPONGPRAPA S, USSAVASODHI P, KATCHAMART W.Comparison of gastrointestinal adverse effects between cyclooxygenase-2 inhibitors and non-selective, non-steroidal anti-inflammatory drugs plus proton pump inhibitors: a systematic review and meta-analysis[J]. Journal of Gastroenterology, 2013,48(7):830-838.
[3] 刘文颖, 谷瑞增, 鲁军, 等.小麦低聚肽中抗氧化肽的分离纯化及结构鉴定[J]. 食品工业, 2016, 37(6): 106-108.
[4] SHIN-ICHI F, MASSAAKI Y.Opioid peptides derived from wheat gluten: their isolation and characterization[J]. FEBS Letters, 1992,296(1): 107-111.
[5] 代卉, 乐国伟, 孙进, 等.小麦肽对受环磷酰胺免疫抑制小鼠的免疫调节及抗氧化功能[J]. 生物工程学报, 2009, 25(4): 549-553.
[6] 金振涛, 马永庆, 刘艳, 等.小麦低聚肤粉中谷氨酞胺含量测定方法及其临床应用前景[J]. 食品与发酵工程, 2011, 37(11): 189-193.
[7] 王延州.小麦蛋白谷氨酰胺肽制备及对肠粘膜损伤修复效果的研究[D]. 北京:中国农业科学院, 2014.
[8] BERG J, FELLIER H, CHRISTOPH T, et al.The analgesic NSAID lornoxicam inhibits cyclooxygenase (COX)-1/-2, inducible nitric oxide synthase (iNOS), and the formation of interleukin (IL)-6 in vitro [J]. Inflammation Research, 1999,48(7):369-379.
[9] MIAO Jin-feng, ZHANG Jin-qiu, ZHENG Liu-hai, et al.Taurine attenuates Streptococcus uberis-induced mastitis in rats by increasing T regulatory cells [J]. Amino Acids, 2012,42(6):2 417-2 428.
[10] MURAKAMI N, AIHARA S, IWATA K, et al.Effect of a novel non-steroidal anti-inflammatory drug (M-5011) on cytokine levels in rats with monosodium urate crystal-induced pleurisy [J]. Japanese Journal of Pharmacology, 1999,79(4):439-446.
[11] RIVAS L, LUQUE-ORTEGA J R, FERNANDEZ-REYES M, et al.Membrane-active peptides as anti-infectious agents [J]. Journal of Applied Biomedicine, 2010,8(3):159-167.
[12] MAITY P, BINDU S, DeEY S, et al.Indomethacin, a non-steroidal anti-inflammatory drug, develops gastropathy by inducing reactive oxygen species-mediated mitochondrial pathology and associated apoptosis in gastric mucosa: a novel role of mitochondrial aconitase oxidation[J]. Journal of Biological Chemistry, 2009,284(5):3 058-3 068.
[13] COLUCCI R, FORNAI M, ANTONIOLI L, et al.Characterization of mechanisms underlying the effects of esomeprazole on the impairment of gastric ulcer healing with addition of NSAID treatment [J]. Digestive and Liver Disease, 2009,41(6):395-405.
[14] REGOLI F.Trace metals and antioxidant enzymes in gills and digestive gland of the Mediterranean mussel Mytilus galloprovincialis [J]. Archives of Environmental Contamination and Toxicology, 1998,34(1):48-63.
[15] SULLIVAN-GUNN M J, LEWANDOWSKI P A.Elevated hydrogen peroxide and decreased catalase and glutathione peroxidase protection are associated with aging sarcopenia[J]. BMC geriatrics, 2013, 13(1): 104.
[16] NAIR P, KANWAR S S, SANYAL S N.Effects of non steroidal anti-inflammatory drugs on the antioxidant defense system and the membrane functions in the rat intestine [J]. Nutricion Hospitalaria, 2006,21(6):638-649.
[17] SUETSUNA K, CHEN J R.Isolation and characterization of peptides with antioxidant activity derived from wheat gluten [J]. Food Science and Technology Research, 2002,8(3):227-230.
[18] HUEBNER F R, LIEBERMAN K W, RUBINO R P, et al.Demonstration of high opioid-like activity in isolated peptides from wheat gluten hydrolysates [J]. Peptides, 1984,5(6):1 139-1 147.
[19] FUKUDOME S, YOSHIKAWA M.Opioid- peptides derived from wheat gluten-their isolation and characterization [J]. Febs Letters, 1992,296(1):107-111.
[20] YU YE, CUI YUN, WANG XIANG, et al.In vitro characterization of the effects of endomorphin 1 and 2, endogenous ligands for the mu-opioid receptors, on mouse colonic motility [J]. Biochemical Pharmacology, 2007,73(9):1 384-1 393.
[21] CARAI M A M, COLOMBO G, GESSA G L, et al.Investigation on the relationship between cannabinoid CB1 and opioid receptors in gastrointestinal motility in mice [J]. British Journal of Pharmacology, 2006,148(8):1 043-1 050.
[22] HO A, LIEVORE A, PATIERNO S, et al.Neurochemically distinct classes of myenteric neurons express the mu-opioid receptor in the guinea pig ileum [J]. Journal of Comparative Neurology, 2003,458(4):404-411.
[23] FICHNA J, GACH K, PERLIKOWSKA R, et al.Novel endomorphin analogues with antagonist activity at the mu-opioid receptor in the gastrointestinal tract [J]. Regulatory Peptides, 2010,162(1-3):109-114.
[24] ROY S, LIU H C, LOH H H.mu-Opioid receptor-knockout mice: the role of mu-opioid receptor in gastrointestinal transit [J]. Molecular Brain Research, 1998,56(1/2):281-283.
Protectiveeffectofwheatoligopeptidesandglutamineagainstgastrointestinalmucosadamageinrats
LIU Wen-ying1, YANG Xian2, CAO Ke-lu1, GU Rui-zeng1, PAN Xing-chang1, SUN Gui-ju2*
1(China National Research Institute of Food and Fermentation Industries, Beijing 100015, China) 2(School of Public Health, Southeast University, Nanjing 210009, China)
Purpose: The present study was aimed to investigate the effect of wheat oligopeptide and glutamine on non-steroidal anti-inflammatory drugs (NSAIDs) which induced gastrointestinal mucosa damage in rats. Method: 70 SD rats were randomly divided into control group, damage group, low, medium and high doses of wheat peptide group (the doses were 20, 100 and 500 mg/(kg·d), wheat gluten group and glutamine group (the doses were both 20 mg/(kg·d)). The rats were administered once a day for 30 days. Before sacrificing, NSAIDs were infused into the digestive tract twice. Serum, stomach and small intestine mucosa samples were collected to observe the changes in serum cytokine, pathological section of stomach and small intestine, as well as enzyme activity of small intestinal antioxidase and opioid receptor mRNA expression. Results: Wheat oligopeptides administration reduced gastrointestinal mucosa damage, and significantly decreased the level of TNF-alpha in serum. Oxidative stress was significantly increased after NSAID infusion.. Wheat oligopeptides increased GSH-Px activity in mucous membrane of small intestine. Mu opioid receptor mRNA expression decreased more significantly in wheat oligopeptides treated rats than in the control group. Conclusion: Non-steroidal anti-inflammatory drugs can induce small intestinal damage in rats and wheat oligopeptides administration can protect gastrointestinal tissue against NSAID-induced gastrointestinal damage and oxidative stress. Lower doses of wheat peptide group showed the strongest effects, even better than glutamine group.
wheat oligopeptides; glutamine;non-steroidal anti-inflammatory drugs; gastrointestinal mucosa damage
10.13995/j.cnki.11-1802/ts.013679
硕士,工程师(孙桂菊教授为通讯作者,E-mail:gjsun@seu.edu.cn)。
国家十三五重点研发计划(2016YFD0400604);国家高技术研究发展计划(863计划)项目(2013AA102205-02);国家自然科学基金面上项目(31671963);北京市科委专项(Z161100005016030,Z171100001317006)
2016-12-27,改回日期:2017-05-10

