沟叶结缕草八氢番茄红素基因ZmPSY的克隆、亚细胞定位及表达分析
董笛,滕珂,于安东,檀鹏辉,梁小红*,韩烈保*
(1.北京林业大学草坪研究所,北京100083;2.北京草业与环境研究发展中心,北京100097)
沟叶结缕草八氢番茄红素基因ZmPSY的克隆、亚细胞定位及表达分析
董笛1**,滕珂2**,于安东1,檀鹏辉1,梁小红1*,韩烈保1*
(1.北京林业大学草坪研究所,北京100083;2.北京草业与环境研究发展中心,北京100097)
八氢番茄红素合成酶(phytoene synthase,PSY)是生物类胡萝卜素合成途径中的一个关键酶。本实验从沟叶结缕草中克隆得到ZmPSY基因(Genbank登录号为:KY264128)。该基因开放阅读框为1230 bp,编码409个氨基酸残基。亚细胞定位结果显示,ZmPSY定位于叶绿体中。实时荧光定量分析表明,ZmPSY基因在沟叶结缕草幼嫩的叶片中表达量最高。ZmPSY可受外施激素脱落酸(ABA)的诱导,但受外施激素水杨酸(SA)、茉莉酸甲酯(MeJA)的抑制。本实验为深入研究沟叶结缕草八氢番茄红素合成酶基因的功能奠定了基础。
沟叶结缕草;八氢番茄红素基因;克隆;亚细胞定位;表达分析
类胡萝卜素是一种在植物体内广泛存在的色素,除了作为次级代谢物在光合作用中发挥作用外,它还有防止氧化、为植物着色等功能[1-3]。八氢番茄红素(phytoene)是所有类胡萝卜素物质合成的前体物质[4]。八氢番茄红素合成酶(phytoene synthase,PSY)是调控类胡萝卜素合成的一种关键酶,可催化香叶基香叶基焦磷酸(geranylgeranyl pyrophosphate, GGPP)转化为八氢番茄红素,此过程是类胡萝卜素合成途径中的第一个限速反应[5]。类胡萝卜素合成途径碳通量的增加往往导致PSY过表达植株出现矮化等表型,植株抗逆性亦有所提高。脐橙(Citrussinensis)CsPSY基因在香港金橘(Fortunellahindsii)中的异源表达导致β-胡萝卜素及番茄红素的积累量显著增加[6]。过表达PSY基因的番茄(Solanumlycopersicum)[7]和烟草(Nicotianatabacum)[8]中表现出植株矮化的表型。过表达枸杞(Lyciumchinense)PSY基因的洋桔梗(Eustomagrandiflorum)抗逆性增强,耐强光性及耐盐性均得到显著提高[9]。
沟叶结缕草(Zoysiamatrella)是世界上最受欢迎的暖季型草坪草之一,因具有较强的抗旱、耐盐和耐贫瘠能力,其被广泛应用于高尔夫球场、运动场和城市绿化[10-11]。目前,拟南芥(Arabidopsisthaliana)[12]、马铃薯(Solanumtuberosum)[13]、番茄[14]、小麦(Triticumaestivum)[15]等模式植物和重要作物中八氢番茄红素合成酶基因的相关研究相继展开,但沟叶结缕草的PSY基因鲜有研究报道,其功能并不清楚。本研究旨在从沟叶结缕草中克隆八氢番茄红素合成酶基因(ZmPSY),进而研究其表达特征和亚细胞定位情况,为深入研究其功能奠定基础[16]。
1 材料与方法
1.1试验材料
1.1.1植物材料 本实验所用沟叶结缕草为本实验室保种,营养基质为蛭石、草炭、珍珠岩等体积的混合基质。采用12 cm×12 cm的花盆,置于人工气候箱中,光周期为14 h/10 h(日/夜),温度为28/25 ℃(日/夜),湿度约为70%。亚细胞定位本生烟草(Nicotianabenthamiana)为本实验室保存,培养条件同沟叶结缕草。实验时间为2016年8月至2017年3月。
1.1.2主要试剂 反转录试剂盒Prime ScriptRTReagent Kit、RACE试剂盒、限制性内切酶BglⅡ、pMD18-T、PrimeSTAR MAX Premix均购自TaKaRa公司。GoldStar Best MasterMix、UltraSYBR Mixture购自北京康为世纪生物科技有限公司。RNA提取试剂盒(Plant RNA Kit)、PCR纯化试剂盒(Cycle-Pure Kit)、质粒提取试剂盒(Plasmid Mini KitⅠ)购自OMEGA公司。In-fusion连接酶购自中美泰和生物公司。农杆菌GV3101、EHA105、植物双元表达载体3302Y3为本实验室保存。激素脱落酸(abscisic acid, ABA)、茉莉酸甲酯(methyl jasmonate, MeJA)、水杨酸(salicylic acid, SA)购于SIGMA公司,大肠杆菌感受态DH5α购自北京全式金公司。其他试剂为国产分析纯。
1.2试验方法
1.2.1引物设计 根据前期获得的ZmPSY基因片段,利用Preme Primer 5.0软件设计3′端特异性引物ZmPSY-RACE-3′-1、ZmPSY-RACE-3′-2和5′端特异性引物ZmPSY-RACE-5′-1、ZmPSY-RACE-5′-2用于RACE扩增ZmPSY基因的3′端及5′端。将3′端及5′端扩增序列进行比对拼接,设计扩增基因全长引物ZmPSY-F和ZmPSY-R。另设计qPCR-F及qPCR-R用于荧光定量PCR(quantitative real-time PCR,qRT-PCR)。以结缕草Actin基因(登录号:GU290546)[17]作为内参基因,设计荧光定量的内参基因序列Actin-F/R,根据3302Y3载体序列和基因序列设计用于构建载体的引物Y3-ZmPSY-F/R。
1.2.2基因克隆 选取生长12周的健康沟叶结缕草植株叶片,参照试剂盒说明书提取RNA并进行反转录,获得的cDNA置于-20 ℃保存。3′RACE以ZmPSY-RACE-3′-1/UPM为引物进行第一轮扩增,再以第一轮扩增产物为模板, ZmPSY-RACE-3′-2/NEST为引物进行第二轮扩增,反应程序均为95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,30个循环;72 ℃ 5 min,12 ℃保温。5′RACE以ZmPSY-RACE-5′-1/UPM为引物进行第一轮扩增,反应程序均为95 ℃ 10 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,30个循环;72 ℃ 5 min,12 ℃保温。再以第一轮扩增产物为模板,ZmPSY-RACE-5′-2/NEST为引物进行第二轮扩增,反应程序为95 ℃ 10 min; 95 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 60 s,30个循环;72 ℃ 5 min,12 ℃保温。上述第二轮PCR产物经琼脂糖凝胶电泳检测后纯化并连接pMD18T载体,转化大肠杆菌感受态。经筛选后送至生物公司进行测序。

表1 引物序列及用途Table 1 Sequence and usage of primers
利用DNAMAN 7.0软件对3′端及5′端测序结果进行拼接,根据拼接结果设计引物ZmPSY-F/R进行基因全长扩增。反应程序为95 ℃ 10 min, 95 ℃ 30 s,54 ℃ 30 s,72 ℃ 60 s,30个循环;72 ℃ 5 min;12 ℃保温。扩增产物经琼脂糖凝胶电泳检测后连接pMD18-T载体,转化大肠杆菌感受态,挑取阳性克隆的菌液送至生物公司测序。
1.2.335S-ZmPSY-YFP载体构建 对上述测序结果正确的菌液大量提取质粒,并以其为模板,以Y3-ZmPSY-F/R为引物进行目的片段的扩增,反应程序为98 ℃ 10 s;98 ℃ 10 s,58 ℃ 30 s,68 ℃ 60 s,25个循环;72 ℃ 3 min;12 ℃保温。将提取的3302Y3载体质粒用限制性内切酶BglⅡ进行单酶切。PCR产物以及酶切产物纯化后利用无缝连接酶进行连接,转化大肠杆菌并对测序正确的菌液进行保存,用于后续实验。
1.2.4生物信息学分析 采用NCBI网站Conserved DomainSearch功能进行ZmPSY蛋白保守结构域分析。利用ExPASy数据库(http://expasy.org/)以及SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对ZmPSY蛋白的一级结构、二级结构等特性进行分析。利用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测目的基因信号肽。通过Cell-PLoc package(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc/)进行亚细胞定位预测。通过BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在数据库中寻找ZmPSY蛋白的同源序列,利用DNAMAN 7.0对不同物种的PSY蛋白序列进行同源比对。通过MEGA 5.0对不同物种PSY基因编码同源蛋白构建系统进化树。
1.2.5亚细胞定位 对含有构建成功的35S-ZmPSY-YFP载体的大肠杆菌提取质粒,转化EHA105农杆菌,注射健康生长2周的本生烟草叶片,注射后的烟草置于黑暗环境下培养48 h[18]。于共聚焦显微镜下观察YFP信号在细胞中的分布情况。
1.2.6基因表达分析 对不同生长时期、不同部位及激素处理后的ZmPSY基因进行表达分析。具体做法为:采集生长12个月的健康沟叶结缕草幼嫩、成熟、衰老叶片以及成熟的根、茎、叶组织,分别提取RNA。选取健康生长的盆栽沟叶结缕草,分别喷施10 μmol/L ABA,10 μmol/L MeJA,0.5 mmol/L SA。在喷施后第0,1,3,6,12和24 h分别于各盆中取样,样品在液氮中速冻后于-80 ℃保存,之后分别提取RNA。每个处理3次重复。将上述RNA反转录为cDNA。以qPCR-F、qPCR-R为引物,结缕草Actin基因为内参,利用BIO-RAD荧光定量仪进行定量分析。反应程序为95 ℃ 10 min;95 ℃ 10 s,60 ℃ 60 s,30个循环。
1.3数据分析
利用Bio-Rad CFX Manager进行数据收集及数据录入,利用Microsoft Excel 2010进行数据分析和绘图。
2 结果与分析
2.1ZmPSY基因的克隆
以沟叶结缕草cDNA为模板,以ZmPSY-F、ZmPSY-R为引物,进行ZmPSY基因扩增,获得约1200 bp单一条带(图1)。测序结果正确,表明成功获取ZmPSY基因全长。
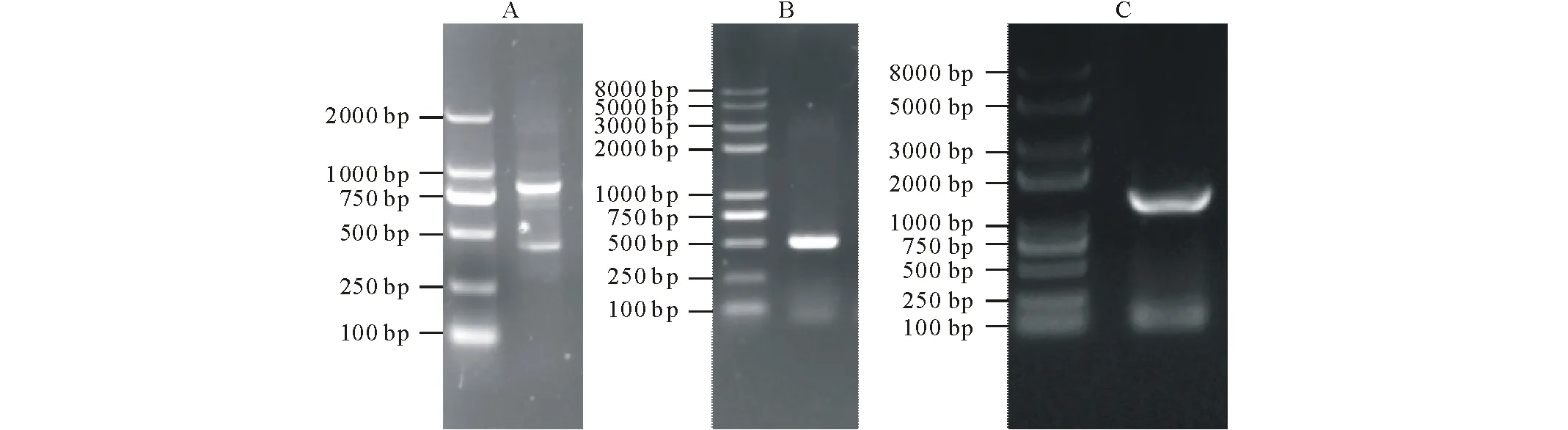
图1 ZmPSY基因的克隆Fig.1 Cloning of ZmPSY A:3′ RACE;B:5′ RACE;C:基因全长。A:3′ rapid amplification of cDNA ends;B:5′ rapid amplification of cDNA ends;C:The full length of gene.
2.2生物信息学分析
ZmPSY基因开放阅读框共1230 bp,编码409个氨基酸残基。保守结构域分析表明该基因属于Isoprenoid_Biosyn_C1超家族,为类异戊二烯生物合成酶家族。一级结构分析表明,ZmPSY基因编码蛋白质分子量为46.365 kDa;负电荷氨基酸残基以及正电荷氨基酸残基数目分别为48及58;理论等电点为9.20;不稳定系数为63.49,说明该基因编码蛋白质不稳定;总平均亲水性为-0.329,为亲水蛋白。二级结构分析显示,ZmPSY蛋白氨基酸残基形成的组件中α螺旋及无规则卷曲占大部分,分别占总数的51.10%和25.18%,延伸链、β转角数目共占总数的23.71%。SignalP 4.1信号肽预测结果显示,基于Y值最高点判定,ZmPSY蛋白具有信号肽,且其最可能的剪切位点预测在第20和第21位点之间。Cell-PLoc package亚细胞定位预测结果表明,ZmPSY蛋白最有可能定位于细胞叶绿体中。BLAST数据库分析显示,ZmPSY蛋白较为保守,不同物种的PSY蛋白质与ZmPSY有较高的同源性。进一步构建PSY系统进化树发现,ZmPSY与粟(Setariaitalica)的PSY亲缘关系最近(图2)。

图2 ZmPSY蛋白的遗传进化树分析Fig.2 Phylogenetic analysis of ZmPSY protein orthologs
2.3亚细胞定位
将含有35S-ZmPSY-YFP载体的EHA105农杆菌注入健康生长的本生烟草叶片,48 h黑暗处理后于共聚焦显微镜下观察烟草叶片中黄色荧光蛋白分布情况(图3)。图中红色荧光为叶绿体自发荧光,黄色荧光为YFP蛋白所发荧光。亚细胞定位结果表明ZmPSY定位于叶绿体中,此结果与前期亚细胞定位预测结果相符。
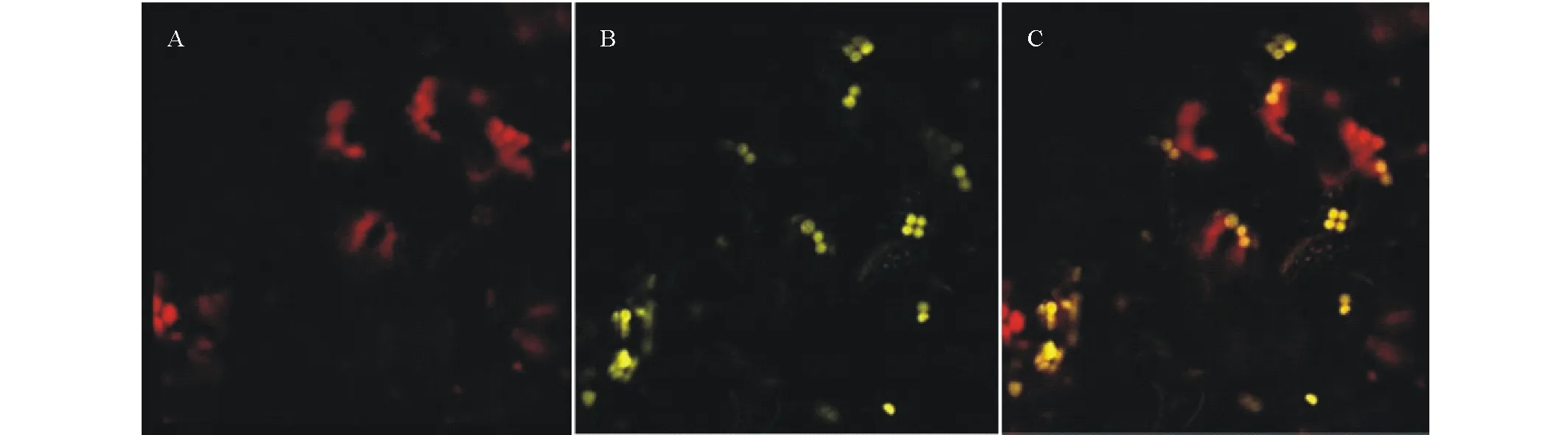
图3 ZmPSY亚细胞定位情况Fig.3 Subcellular localization of ZmPSY A:叶绿体自发荧光 Chloroplast autofluorescence;B:激发光下 35S-ZmPSY-YFP Ultraviolet field;C:融合场 Merged.
2.4ZmPSY基因的表达分析

图4 ZmPSY在不同组织中的表达分析Fig.4 ZmPSY expression in different organs of Z. matrella 不同字母表示差异显著(Plt;0.05)。下同。Different letters mean significant differences (Plt;0.05). The same below.
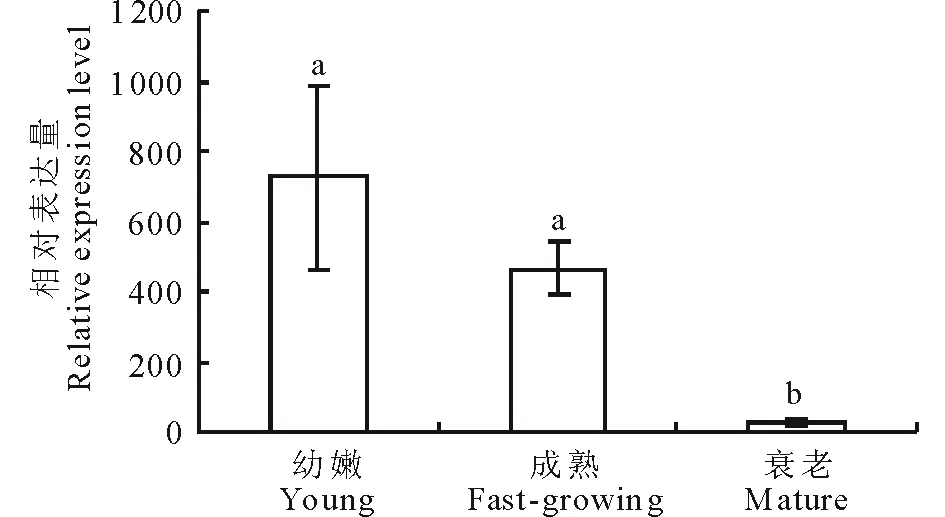
图5 ZmPSY在叶片不同生长时期中的表达分析Fig.5 ZmPSY expression in different developmental stages of leaves
2.4.1ZmPSY基因在不同组织的表达分析 荧光定量结果表明,ZmPSY基因的表达量在沟叶结缕草的不同组织中存在差异。在根、茎中,ZmPSY基因表达量均较低,叶片中ZmPSY基因的表达量最高,分别是根中的4.73倍和茎中的5.27倍(图4)。
2.4.2ZmPSY基因在叶片不同发育时期的表达分析 选择幼嫩、成熟、衰老3个不同时期的植物叶片材料,荧光定量结果表明,在幼嫩时期,ZmPSY基因的表达量最高。成熟时期基因表达量变为幼嫩时期的0.64倍。在衰老时期,ZmPSY基因的表达量显著降低,为幼嫩时期的0.03倍(图5)。
2.4.3ZmPSY基因在不同激素处理下的表达分析 荧光定量结果表明,10 μmol/L的ABA对沟叶结缕草ZmPSY基因的表达有促进作用。在ABA处理的早期,ZmPSY基因的表达受到轻微抑制,1和3 h的表达量分别为处理前的0.84和0.74倍。随着处理时间的增加,ZmPSY基因的表达量显著增加并在6 h达到峰值,为对照的18.01倍,在处理24 h时ZmPSY基因的表达量逐渐下降(图6)。
10 μmol/L 的MeJA喷施处理沟叶结缕草,1 h即表现出显著的抑制作用,ZmPSY基因的表达量为处理前的49.9%。ZmPSY基因的表达量在处理3 h后到达最低值,为对照组的19.7%。用MeJA处理后,ZmPSY基因的表达呈先下降后上升的趋势,且总体上受到明显抑制(图7)。
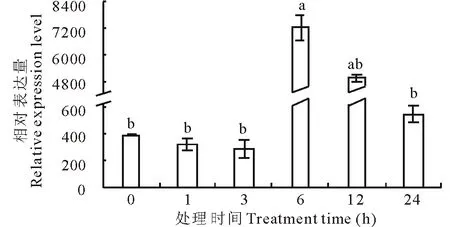
图6 ZmPSY在ABA处理后的叶片中的表达分析Fig.6 ZmPSY expression under ABA treatment in leaf
在0.5 mmol/L SA处理的早期,ZmPSY基因的表达量有所下调。处理1和3 h后,ZmPSY基因的表达量分别为处理前的0.29和0.22倍。随着处理时间的延长,ZmPSY基因的表达量有所上升,处理12 h时的表达量为处理前的0.72倍。经SA处理后,ZmPSY基因的表达量总体呈先下降后逐步恢复的趋势(图8)。

图7 ZmPSY在MeJA处理后的叶片中的表达分析Fig.7 ZmPSY expression under MeJA treatment in leaf
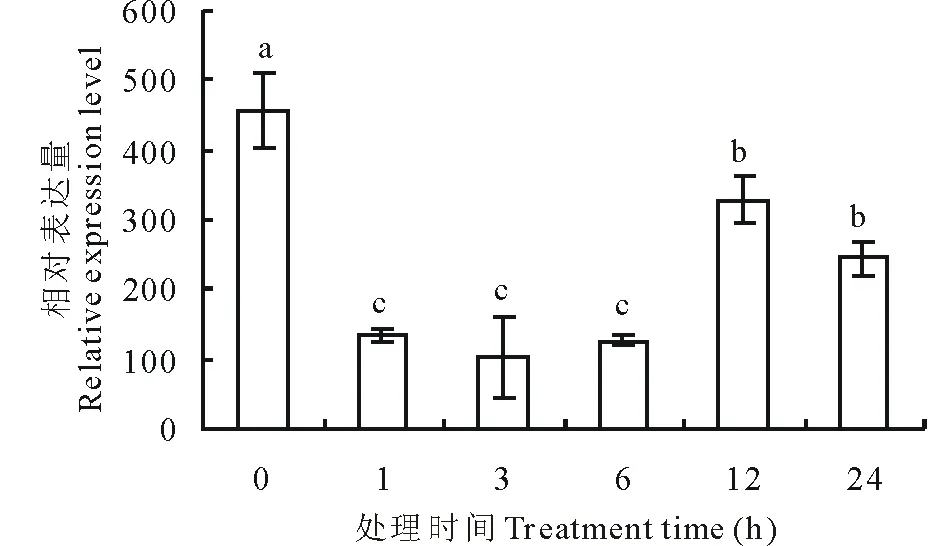
图8 ZmPSY在SA处理后的叶片中的表达分析Fig.8 ZmPSY expression under SA treatment in leaf
3 讨论
ZmPSY催化香叶基香叶基焦磷酸转化为八氢番茄红素,而后八氢番茄红素进经过一系列的反应最终形成番茄红素。番茄红素在番茄红素环化酶作用下降解形成α-胡萝卜素以及β-胡萝卜素[19]。类胡萝卜素合成过程中,PSY为类胡萝卜素合成过程中重要的限速酶[20],故而在生物工程中常将PSY作为控制类胡萝卜素合成的调控基因[21]。
本研究从沟叶结缕草内克隆得到ZmPSY基因。生物信息学分析表明ZmPSY基因开放阅读框共1230 bp,编码409个氨基酸。该蛋白属于Isoprenoid_Biosyn_C1超家族,为类异戊二烯生物合成酶,有相同的“类异戊二烯合酶折叠”,且催化位点由大部分反向平行的α螺旋形成的大中心腔和位于相对壁上的两个富含天冬氨酸的区域组成。ZmPSY主要组件为α螺旋及无规则卷曲,还有少量的延伸链、β转角。信号肽预测结果显示ZmPSY蛋白具有信号肽,且其最可能的剪切位点预测在第20和第21位点之间。同源比对结果表明PSY是一个相对保守的蛋白,其在不同物种中的同源性很高。进化树构建显示ZmPSY与粟中PSY亲缘关系最近。亚细胞定位结果显示,ZmPSY蛋白定位于叶绿体中。这与Qin等[22]对柠檬(Cucumismelo)PSY的亚细胞定位结果一致。类胡萝卜素在叶绿体内生成并累积,PSY通常定位于叶绿体内[23]。
荧光定量结果显示,不同组织中ZmPSY表达量存在明显差异,叶片组织中的表达量显著高于根、茎组织,此结果与前人实验结果类似[24-25]。叶片组织中叶绿体含量较高,且叶片为类胡萝卜素产生的主要器官[26]。叶片中的ZmPSY表达量也存在一定程度的差异,衰老叶片内ZmPSY表达量少于幼嫩叶片、成熟叶片表达量。Salvini等[27]在向日葵(Helianthusannuus)中进行的不同植物组织PSY表达量分析的结果表明向日葵成熟叶片的PSY相对表达量略高于幼嫩叶片,本实验结果与此存在一定差异,这可能是由于物种之间存在差异,具体原因有待进一步研究。
ABA、MeJA、SA 3种不同激素处理沟叶结缕草,并于处理后不同时间点测定ZmPSY相对表达量。结果表明10 μmol/L ABA对沟叶结缕草ZmPSY基因的表达有促进作用,处理6 h后ZmPSY基因的表达量明显提高。研究表明,外源ABA能在一定程度上促进番茄果实中番茄红素含量增加[28]。高等植物中,质体中的类胡萝卜素降解转化间接合成脱落酸,沟叶结缕草ZmPSY基因的转录可能受到ABA的抗逆信号转导途径的影响,并与植物抗逆性有一定关系[29]。MeJA、SA处理沟叶结缕草对ZmPSY基因的表达有抑制作用,MeJA、SA处理后ZmPSY基因的表达量均呈先下降后上升随后趋于稳定的趋势,但总体趋势均为降低。有实验证明SA处理过的果实番茄红素含量较低[30],也有实验显示SA可增强类胡萝卜素合成途径中PSY基因的表达[31],实验结论的差异可能是由于SA施用浓度的不同引起的。对PSY基因激素反应元件的分析结果显示MeJA反应元件存在于部分物种的PSY基因启动子中,一定浓度的MeJA处理抑制果实番茄红素、类胡萝卜素的积累[32-34]。
4 结论
本研究首次从沟叶结缕草中克隆得到八氢番茄红素合成酶基因,ZmPSY基因开放阅读框1230 bp,编码409个氨基酸,属于Isoprenoid_Biosyn_C1超家族。ZmPSY具有信号肽,且定位在叶绿体中。荧光定量结果表明,ZmPSY基因在幼嫩的叶片中表达量最高。外施ABA激素可诱导该基因的表达,而SA、MeJA则可抑制ZmPSY的表达。本研究为进一步研究ZmPSY基因功能奠定了基础。
References:
[1] Matthews P D, Wurtzel E T. Metabolic engineering of carotenoid accumulation inEscherichiacoliby modulation of the isoprenoid precursor pool with expression of deoxyxylulose phosphate synthase. Applied Microbiology and Biotechnology, 2000, 53(4): 396-400.
[2] Hirschberg J. Carotenoid biosynthesis in flowering plants. Current Opinion in Plant Biology, 2001, 4(3): 210-218.
[3] Schledz M, Al-Babili S, Lintig J V,etal. Phytoene synthase from Narcissus pseudonarcissus: functional expression, galactolipid requirement, topological distribution in chromoplasts and induction during flowering. Plant Journal for Cell amp; Molecular Biology, 1996, 10(5): 781.
[4] Grünewald K, Hagen C. β-carotene is the intermediate exported from the chloroplast during accumulation of secondary carotenoids inHaematococcuspluvialis. Journal of Applied Phycology, 2001, 13(1): 89-93.
[5] Fraser P D, Romer S, Shipton C A,etal. Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit-specific manner. Proceedings of the National Academy of Science, 2002, 99(2): 1092-1097.
[6] Zhang J C, Tao N G, Qiang X,etal. Functional characterization of CitrusPSYgene in Hongkong kumquat (FortunellahindsiiSwingle). Plant Cell Reports, 2009, 28(11): 1737-1746.
[7] Fray R G, Wallace A, Fraser P D,etal. Constitutive expression of a fruit phytoene synthase gene in transgenic tomatoes causes dwarfism by redirecting metabolites from the gibberellin pathway. Plant Journal, 1995, 8(5): 693-701.
[8] Busch M, Seuter A, Hain R. Functional analysis of the early steps of carotenoid biosynthesis in tobacco. Plant Physiology, 2002, 128(2): 439-453.
[9] Ji J, Cao H Y, Wang G,etal. Overexpression ofLyciumchinensemiller phytoene sythase (LmPSY) gene to enhance the resistance ofEustomagrandiflorum. Journal of Tianjin University, 2015, (3): 262-268.
季静, 曹海燕, 王罡, 等. 过表达枸杞LmPSY基因提高洋桔梗抗逆性的研究. 天津大学学报, 2015, (3): 262-268.
[10] Hu H G, Zhang Z M, Ji F F,etal. Variation analysis of drought resistance of germplasm resources ofZoysiaWilld.in Chinese main region. Acta Agrestia Sinica, 2014, (2): 224-228.
胡化广, 张振铭, 季芳芳, 等. 中国主要地区结缕草属植物种质资源抗旱性变异分析. 草地学报, 2014, (2): 224-228.
[11] Inokuma C, Sugiura K, Imaizumi N,etal. Transgenic Japanese lawngrass (ZoysiajaponicaSteud.) plants regenerated from protoplasts. Plant Cell Reports, 1998, 17(5): 334-338.
[12] Welsch R, Medina J, Giuliano G,etal. Structural and functional characterization of the phytoene synthase promoter fromArabidopsisthaliana. Planta, 2003, 216(3): 523-534.
[13] Pasare S, Wright K, Campbell R,etal. The sub-cellular localisation of the potato (SolanumtuberosumL.) carotenoid biosynthetic enzymes, CrtRb2 and PSY2. Protoplasma, 2013, 250(6): 1381.
[14] Fray R G, Grierson D. Identification and genetic analysis of normal and mutant phytoene synthase genes of tomato by sequencing, complementation and co-suppression. Plant Molecular Biology, 1993, 22(4): 589-602.
[15] Liu H J, Feng Z G, Dong Y,etal. Cloning and sequence analysis of wheat phytoene synthase gene. Journal of Henan Agricultural Sciences, 2014, (12): 15-18.
刘慧娟, 冯志国, 董瑶, 等. 小麦八氢番茄红素合成酶基因的克隆和序列分析. 河南农业科学, 2014, (12): 15-18.
[16] Cunningham F X, Gantt E. Genes and enzymes of carotenoid biosynthesis in plants. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49(1): 557-583.
[17] Teng K, Li J, Zhang L,etal. Cloning and expression of an alcohol dehydrogenase gene (ZjADH) fromZoysiajaponica. Chinese Journal of Grassland, 2016, 38(3): 7-13.
滕珂, 李俊, 张兰, 等. 日本结缕草ZjADH基因的克隆及表达分析. 中国草地学报, 2016, 38(3): 7-13.
[18] Teng K, Chang Z, Li X,etal. Functional and RNA-sequencing analysis revealed expression of a novel stay-green gene fromZoysiajaponica(ZjSGR) caused chlorophyll degradation and accelerated senescence inArabidopsis. Frontiers in Plant Science, 2016, (7): 1894.
[19] Zou L P, Gao H P, Zhong Y Q. Research advances in the expression regulation of the genes related with lycopene biosynthesis in plants. Journal of Anhui Agricultural Sciences, 2009, (33): 16232-16233.
邹礼平, 高和平, 钟亚琴. 植物番茄红素生物合成相关基因的表达调控研究进展. 安徽农业科学, 2009, (33): 16232-16233.
[20] Zhou X, Carter T E, Cui Z,etal. Genetic diversity patterns in Japanese soybean cultivars based on coefficient of parentage. Crop Science, 2002, 42(4): 1331.
[21] Shewmaker C K, Sheehy J A, Daley M,etal. Seed-specific overexpression of phytoene synthase: increase in carotenoids and other metabolic effects. Plant Journal, 1999, 20(4): 401-412.
[22] Qin X, Coku A, Inoue K,etal. Expression, subcellular localization, and cis-regulatory structure of duplicated phytoene synthase genes in melon (CucumismeloL.). Planta, 2011, 234(4): 737-748.
[23] Dellapenna D, Pogson B J. Vitamin synthesis in plants: Tocopherols and carotenoids. Annual Review of Plant Biology, 2006, 57(1): 711-738.
[24] Zhai S, Li G, Sun Y,etal. Genetic analysis ofphytoenesynthase1 (Psy1) gene function and regulation in common wheat. BMC Plant Biology, 2016, 16(1): 228.
[25] Obrero, González-Verdejo C I, Román B,etal. Identification, cloning, and expression analysis of three phytoene synthase genes fromCucurbitapepo. Biologia Plantarum, 2015, 59(2): 201-210.
[26] Giuliano G, Tavazza R, Diretto G,etal. Metabolic engineering of carotenoid biosynthesis in plants. Trends in Biotechnology, 2008, 26(3): 139.
[27] Salvini M, Bernini A, Fambrini M,etal. cDNA cloning and expression of the phytoene synthase gene in sunflower. Journal of Plant Physiology, 2005, 162(4): 479-484.
[28] Weng Q, Zhou B L, Yu Y,etal. Effects of exogenous ABA, BR, ETH on changes of lycopene’s contents in fruit of tomato. Journal of Shenyang Agricultural University, 2007, (6): 784-787.
翁倩, 周宝利, 于洋, 等. 外源ABA、BR和ETH对番茄果实番茄红素含量的影响. 沈阳农业大学学报, 2007, (6): 784-787.
[29] Seo M, Koshiba T. Complex regulation of ABA biosynthesis in plants. Trends in Plant Science, 2002, 7(1): 41.
[30] Wang Y Y, Li B Q, Qin G Z,etal. Defense response of tomato fruit at different maturity stages to salicylic acid and ethephon. Scientia Horticulturae, 2011, 129(2): 183-188.
[31] Gao Z, Meng C, Zhang X,etal. Induction of salicylic acid (SA) on transcriptional expression of eight carotenoid genes and astaxanthin accumulation inHaematococcuspluvialis. Enzyme and Microbial Technology, 2012, 51(4): 225-230.
[32] Saniewski M, Czapski J. The effect of methyl jasmonate on lycopene and β-carotene accumulation in ripening red tomatoes. Experientia, 1983, 39(12): 1373-1374.
[33] Liu L H. Regulation of Carotenoids Accumulation in Tomato Fruit by Jasmonic Acid and Brassinosteroid[D]. Hangzhou: Zhejiang University, 2015.
刘丽红. 茉莉酸和油菜素甾醇调控番茄果实类胡萝卜素积累的机理研究[D]. 杭州: 浙江大学, 2015.
[34] Wang H, Ou C, Zhuang F,etal. The dual role of phytoene synthase genes in carotenogenesis in carrot roots and leaves. Molecular Breeding, 2014, 34(4): 2065-2079.
Cloning,subcellularlocalizationandexpressionanalysisofanovelphytoenesynthasegene,ZmPSY,inZoysiamatrella
DONG Di1**, TENG Ke2**, YU An-Dong1, TAN Peng-Hui1, LIANG Xiao-Hong1*, HAN Lie-Bao1*
1.Turfgrass Research Institute of Beijing Forestry University, Beijing 100083, China; 2.Beijing Research amp; Development Center for Grass and Environment, Beijing 100097, China
The formation of phytoene by phytoene synthase is a key limiting step in the carotenoid biosynthesis pathway. In this study a novel gene,ZmPSY(GenBank Accession number: KY264128), was cloned fromZoysiamatrella. Subcellular localization results proved that ZmPSY was localized in the chloroplasts. Expression analysis showed thatZmPSYhad a higher expression level in leaves compared to roots and stems. The expression ofZmPSYin leaves also varied at different development stages, with the greatest expression seen in young leaves. qRT-PCR determination revealed thatZmPSYcould be induced by exogenous abscisic acid (ABA), but suppressed by salicylic acid (SA) and methyl jasmonate (MeJA). This study paved the way for further discovery of the functional roles ofZmPSY.
Zoysiamatrella; phytoene synthase gene; cloning; subcellular localization; expression analysis
10.11686/cyxb2017176http//cyxb.lzu.edu.cn
董笛, 滕珂, 于安东, 檀鹏辉, 梁小红, 韩烈保. 沟叶结缕草八氢番茄红素基因ZmPSY的克隆、亚细胞定位及表达分析. 草业学报, 2017, 26(11): 69-76.
DONG Di, TENG Ke, YU An-Dong, TAN Peng-Hui, LIANG Xiao-Hong, HAN Lie-Bao. Cloning, subcellular localization and expression analysis of a novel phytoene synthase gene,ZmPSY, inZoysiamatrella. Acta Prataculturae Sinica, 2017, 26(11): 69-76.
2017-04-06;改回日期:2017-05-12
北京市博后基金“苔草优良耐荫基因的挖掘与分子调控机制研究(No.2017-ZZ-087)”,北京市农林科学院博后基金,深圳市科技计划项目(JCYJ20160331151245672,JSGG20160229155434792)和国家高技术研究发展计划(863计划)(2013AA102607)资助。
董笛(1994-),女,山东青岛人,在读硕士。E-mail: didoscori@163.com。滕珂(1989-),男,山东淄博人,在读博士后。E-mail: tengke.123@163.com。**共同第一作者These authors contributed equally to this work.
*通信作者Corresponding author. E-mail: liang81511@163.com, hanliebao@163.com

