L-茶氨酸对H2O2损伤的瘤胃上皮细胞活性的影响
陈文,陈珍,杨光提,黄远强
(湖南省浏阳市畜牧兽医水产局,湖南浏阳410300)
L-茶氨酸对H2O2损伤的瘤胃上皮细胞活性的影响
陈文,陈珍,杨光提,黄远强
(湖南省浏阳市畜牧兽医水产局,湖南浏阳410300)
以体外分离培养的60日龄湘东黑山羊瘤胃上皮细胞作为试验材料,利用H202构建损伤模型,通过分别添加4、8、12和16mmol/L的L-茶氨酸溶液,来测定L-茶氨酸对瘤胃上皮细胞活性的影响。结果表明:L-茶氨酸的浓度在8~16mmol/L时能够显著增加的瘤胃上皮细胞的活性(P<0.05),并且随着添加浓度的增加其活性增加,且在24h时处理效果较好。由此可知,L-茶氨酸对H202损伤的湘东黑山羊瘤胃上皮细胞具有一定的保护作用。
L-茶氨酸;瘤胃上皮细胞;细胞活性
胃肠道的氧化应激主要是由两种应激通过产生自由基引起的,包括急性和慢性应激。长期应激会对动物机体造成很大的损伤,产生的自由基会造成特定维生素和微量元素的大量耗损,从而使畜禽的免疫力下降,进而造成机体的功能障碍甚至是诱发死亡[1]。研究表明,活性氧的产生能够诱发多种类型的胃肠疾病[2]。并且H2O2是引起胃粘膜细胞氧化损伤的主要活性氧。
绿茶作为一种养生性饮品,随着研究者对于其功能的逐步认知,目前已经得到广泛的关注[3]。天然的茶氨酸仅以游离的形式存在,并且主要是L型[4]。作为茶科植物中的主要活性成分,茶氨酸主要是借助氨基酸转运系统来完成在组织和细胞内的作用的,并且研究表明,茶氨酸对组织损伤具有一定的保护作用,例如脑组织[5-7]和肝组织[8-9]。
作为反刍动物特有的消化器官,瘤胃在反刍动物消化过程中起着决定性的作用。反刍动物能够高效的利用高纤维的饲料原料,离不开瘤胃的功劳。反刍动物的瘤胃功能完善和健康,能够保证反刍动物的正常生理活动。本试验借助构建的离体氧化损伤模型,通过添加不同浓度梯度的L-茶氨酸来分析其对湘东黑山羊瘤胃上皮细胞活性的影响,为更加全面的了解L-茶氨酸对瘤胃上皮受损的保护作用,探索其作用机制提供了理论依据。
1 材料与方法
1.1 试验仪器
分光光度计(BIO RAD680,美国),二氧化碳培养箱(SELECTA,西班牙),倒置相差显微镜(Ol ympus,日本),高压蒸汽灭菌锅(SANYO,日本),超净工作台(SANYO,日本),水平摇床(哈尔滨市东联电子技术开发有限公司,H ZS-H),鼓风干燥箱(上海申贤恒温设备厂)
1.2 试验试剂
胎牛血清(Cel l m ax)、基本培养基(Dul becco’s m odi f i ed eagl e m edi um∶nut ri ent m i xt ure F-12,DM EM/F12)、0.25%Trypsi n+0.02%EDTA、磷酸盐缓冲溶液(PBS)、青霉素均购自(Gi bco,美国);两性霉素B+庆大霉素(Gent am i ci n/am phot eri ci n Sol ut i on)购自 Therm o Fi shersci ent i f i c(R-015-10,10×1m L,美国);L- 茶氨酸(L-t heani ne,CAS∶3081-61-6,纯度≥99%,H PLC);3-(4,5- 噻唑 -2)-2,5- 二苯基四氮唑溴盐(M TT)、二甲基亚砜(DM SO)购自美国Si gm a公司。
1.3 细胞培养
试验选择4只60日龄(体重为8.2±0.8 kg)健康的湘东黑山羊。采用颈静脉放血的方法,待山羊死亡后即刻采取瘤胃组织,冲洗并弃内容物,后用生理盐水反复冲洗,干净后进行取样。对瘤胃上皮进行钝性剥离,浸泡于4℃含10倍双抗、5倍庆大霉素的DM EM-F12培养基中,转移至细胞培养室;组织用含5倍双抗的PBS液清洗3~5次;将组织尽量剪碎,加入0.25%胰酶消化液;37℃空气浴振荡消化,收集酶解液,加入适量完全培养基重悬细胞,依次经100μm孔径筛网过滤,收集滤液,1000 r/m i n离心5 m i n,去上清,将细胞重悬于DM EM/F12完全培养液中,并调整细胞浓度为1×106/m L,置于CO2培养箱,37℃,5%CO2培养。
1.4 试验方法
1.4.1 条件培养液的配制
将L-茶氨酸在完全培养基中进行充分溶解,使其终浓度达到32m m ol/L的浓缩液。处理时用完全培养基进行稀释,使最终的工作液分别为4m m ol/L、8m m ol/L、12m m ol/L、16m m ol/L 各 20m L。保存在4℃冰箱中备用。
1.4.2 细胞的分组及处理
当细胞密度达到80%~90%时,进行换液,用PBS对贴壁细胞进行冲洗,重复一次,加入1m L的胰蛋白酶消化细胞,放入恒温恒湿的CO2培养箱中消化4 m i n。倒置显微镜下观察,当所有细胞变亮、变圆且有部分细胞漂浮时,迅速用完全培养基终止消化。轻轻吹打细胞,使其形成细胞悬液,吸取悬液进行离心1000 r/m i n 5 m i n,保留底部沉淀。随后用完全培养基使细胞重悬,相同比例接种在两个培养皿中。培养箱中放置1h,随后重吸细胞悬液,转移至新的培养皿中培养,重复接种过程一次,进一步纯化[10]。纯化后细胞可备用于试验处理,待细胞密度达到60%~70%时,分为6组,每组6个重复,分为对照组添加0、Ⅰ组 800 μm ol/L H2O2、Ⅱ组4m m ol/L L-茶氨酸+800 μm ol/L H2O2、Ⅲ组8m m ol/L L- 茶 氨 酸 +800 μm ol/L H2O2、 Ⅳ 组12m m ol/L L-茶氨酸 +800 μm ol/L H2O2和Ⅴ组16m m ol/L L-茶氨酸+800 μm ol/L H2O2,分别处理12、24、48h,随后PBS冲洗三遍,将M TT加入试验处理组各孔,并在培养箱中孵育4h,吸取上清液。后向每孔种添加150 μL DM SO,水平摇床中振荡10 m i n,570 nm波长测定其各孔的吸光度值。
2 数据处理与分析
试验数据采用SPSS 21软件进行分析,统计方法采用LSD法,对各水平间数据进行多重比较,试验结果以均值±标准误的形式进行呈现。
3 结果
3.1 不同浓度L-茶氨酸对H2O2诱导的受损瘤胃上皮细胞存活率的影响
本试验的研究目的,主要是围绕L-茶氨酸的保护机制来探索,探究其对受损瘤胃上皮细胞活性的影响。试验首先采用不同浓度水平(4、8、12、16m m ol/L)的L-茶氨酸来处理细胞,孵育1h后与H2O2(0.8 m m ol/L)共同培养24h。试验结果(图1)表明:瘤胃上皮细胞的活性对于H2O2的刺激很敏感(P<0.01)。H2O2对细胞的损伤作用,只有在L-茶氨酸浓度不低于8m m ol/L的情况下才得到改善。当L-茶氨酸的孵育浓度达到8、12和16 m m ol/L时,其细胞活性分别为(62.43±8.21)%、(69.55±6.78)%、(76.44±7.42)%,与H 2O2单独添加组比较,显著增加 (P<0.01),由此可知,L-茶氨酸的浓度在8~16m m ol/L时能够显著改善受损的瘤胃上皮细胞的细胞活力。

图1 不同L-茶氨酸水平下瘤胃上皮细胞活性
3.2 不同浓度L-茶氨酸不同作用时间下H2O2诱导的受损瘤胃上皮细胞的存活率
试验结果如图2所示,处理浓度相同的情况下,时间处理不同组的细胞活性各组间差异不显著(P>0.05),然而与12h和48h处理组相比,24h处理组的细胞具有更好的活性,由此说明对于H2O2诱导的受损瘤胃上皮细胞,在L-茶氨酸处理24h时对细胞的保护性最强。
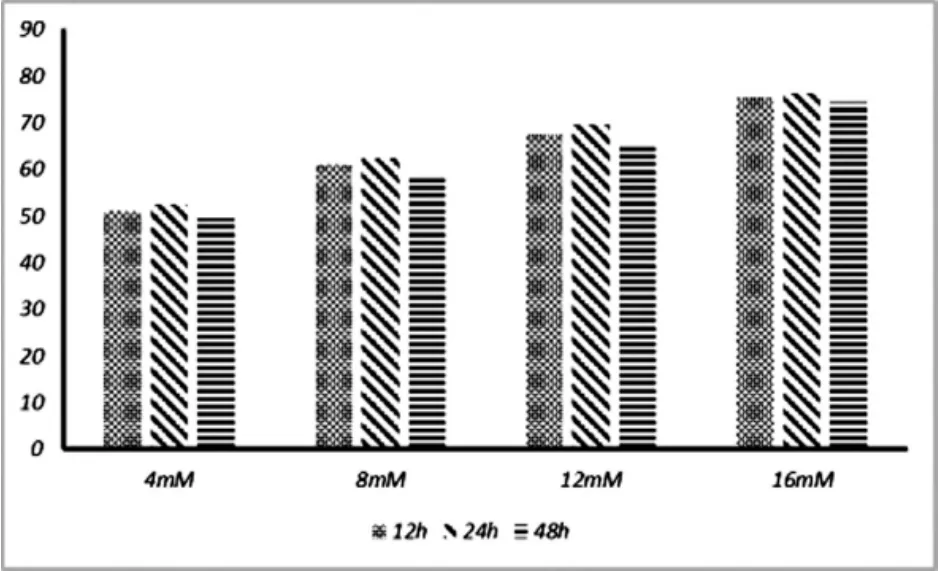
图2 不同浓度茶氨酸不同处理时间瘤胃上皮细胞活性
4 讨论
高浓度的活性氧能够作用于瘤胃上皮细胞,使相关疾病恶化,甚至是诱导细胞发生凋亡。作为引起细胞损伤的关键因素,氧化自由基的产生因素有很多,例如缺血再灌注、药物代谢,以及一些重金属引起的中毒[11]。氧化自由基的种类有很多,H2O2在占了很大的比例,也是目前研究最为广泛的自由基之一[12]。H2O2可导致细胞损伤的机制涉及的范围比较广,不仅会对通过作用线粒体和DNA来起到损伤作用,而且还可以对细胞内的蛋白和脂质进行氧化,同时消耗大量的ATP,对细胞造成损伤,甚至是诱导细胞发生凋亡[13]。
作为绿茶中天然存在的氨基酸,L-茶氨酸主要起着呈味的作用,并且已经广泛应用在食品行业。研究表明,L-茶氨酸不仅能够抗氧化,还能帮助神经细胞抵御外界的各种刺激[14]。目前对于茶氨酸对氧化应激诱导的受损瘤胃上皮细胞是否起作用,还鲜有文献报道。因为L-茶氨酸是由谷氨酰胺衍生而得的,在代谢过程中可以转化成谷氨酸,进而参加谷胱甘肽(GSH)的合成。除此之外,L-茶氨酸可以保护细胞内的抗氧化酶,减少GSH损耗的同时还能生成GSH,以维持细胞内GSH的稳态,保证细胞内氧化还原状态的正常运转,免受氧化应激造成的应激损伤[15]。
[1]Alarcon de la Lastra C,Nieto A,Martin MJ,et al.Gastric toxicity of racemic ketoprofen and its enantiomers in rat:oxygen radical generation and COX expression [J].Infl amm Res,2002,51:51-57.
[2]Bandyopadhyay D,Biswas K,Bhattacharyya M,et al.Involvement of reactive oxygen species in gastric ulceration:protection by melatonin [J].Indian J Exp Biol,2002,40:693-705.
[3]张凤,安利国,李福荣,等.表没食子儿茶素没食子酸酯测定及其对胃癌细胞增殖的抑制作用研究 [J].时珍国医国药,2010,21(3):524-528.
[4]Desai MJ,Gill MS,Hsu WH,et al.Pharmacokinetics of theanine enantiomersin rats[J].Chirality,2005,17(3):154.
[5]彭彬,刘仲华,林勇,林海燕,黄建安L-茶氨酸改善慢性应激大鼠抑郁行为作用研究[J].茶叶科学,2014,34(4):355-363.
[6]MC Bertolami.Mechanisms of Hepatotoxicity.[J].?Arq?Bras?Cardiol,2005,85(Suppl 5):25-27.
[7]李桂兰,抗晶晶,殷志敏.L-茶氨酸对H202致L02细胞损伤的保护作用及其机制研究 [J].中国细胞生物学学报,2014,36(6):785-790.
[8]Maryam Ahmed,Kristina L.Brzoza,Elizabeth M.Hiltbold.Matrix protein mutant of vesicular stomatitis virus stimulates maturation of myeloid dendritic cells[J].Journal of Virology,2006,80(5):2194-2205.
[9]王尧尧,李冉,李运生,等.Nesfatin-1对初情期雌性大鼠促性腺激素及其mRNA表达的影响 [J].中国农业大学学报,2015,56(3):139-145.
[10]刘思乐,康劲翮,谭支良,等.不同培养方法对山羊瘤胃上皮细胞生长及角蛋白18表达量的影响 [J].动物营养学报,2016,22(4):1225-1232.
[11]叶煦亭,沙继宏,汤莹,等.生物细胞氧化应激模型探讨[J].电子显微学报,2000,19(3):207-208.
[12]蔡善荣,郑树,张苏展,等.过氧化氢诱导肠上皮干细胞DNA氧化损伤模型的建立 [J].浙江大学学报:医学版,2006,35(4):366-369,376.
[13]张丽,李亮,李克忠,等.谷氨酰胺抑制过氧化氢诱导的A549细胞凋亡 [J].山东大学学报 (医学版),2007,45(11):1106-1109.
[14]Di X,Yan J,Zhao Y,Zhang J,Shi Z,Chang Y,et al.L-theanine protects the APP (Swedish mutation)transgenic SHSY5Y cellagainstglutamate-induced excitotoxicity via inhibition of the NMDA receptor pathway[J].Neuroscience 2010,168(3):778-86.
[15]Bhattacharya S,Gachhui R,Sil PC.Hepatoprotective properties of kombucha tea against TBHP-induced oxidative stress via suppression of mitochondria dependent apoptosis[J].Pathophysiology,2011,18(3):221-34.
S852.32
A
1006-4907(2017)05-0041-03
10.3969/j.issn.1006-4907.2017.05.019
2017-09-19

