PARP-1抑制剂下调SIRT1基因表达诱导非小细胞肺癌A549细胞凋亡的机制
徐清华
·论著·
PARP-1抑制剂下调SIRT1基因表达诱导非小细胞肺癌A549细胞凋亡的机制
徐清华
目的观察PARP-1抑制剂Olaparib对非小细胞肺癌A549细胞凋亡的影响及可能机制。方法常规培养A549细胞,分别给予不同剂量Olaparib(0、5、10、20、50 μmol/L)和(或)SIRT1激动剂SRT1720(1 μmol/L)、SIRT1抑制剂EX527(1 μmol/L)处理24 h,MTT法检测细胞增殖,流式细胞术检测细胞凋亡,Western-blot检测细胞SIRT1及凋亡相关基因表达。结果Olaparib处理A549细胞24 h后,细胞存活率、SIRT1及抗凋亡基因Bcl-2蛋白表达逐渐降低,凋亡率及促凋亡基因Bax、Caspase-3蛋白表达逐渐增加,呈剂量依赖性(Plt;0.05)。单独给予EX527处理A549细胞能够模拟Olaparib的上述作用(Plt;0.05),但SRT1720和Olaparib联合组能够拮抗Olaparib的上述作用(Plt;0.05)。结论PARP-1抑制剂Olaparib通过下调SIRT1基因表达抑制A549细胞增殖,并诱导其凋亡。
非小细胞肺癌;PARP-1抑制剂;Olaparib;SIRT1;凋亡
目前,我国肺癌发病率和病死率逐年升高,高居恶性肿瘤死因的首位,其中超过80%的患者为非小细胞肺癌[1]。现阶段,外科手术、放化疗及生物治疗是临床治疗非小细胞肺癌的常用手段,但患者5年生存率低,易复发,且不良反应明显[2,3]。因此,研究疗效确切、不良反应小的分子靶向药物对于非小细胞肺癌的治疗具有广阔应用前景。聚腺苷二磷酸核糖聚合[poly(ADP-ribose) polymerase,PARP]抑制剂是新型抗癌药物,能够靶向抑制DNA损伤修复过程。体外试验和临床试验均证实PARP-1抑制剂具有较强的抗肿瘤效果[4,5]。然而,PARP抑制剂调控肺癌细胞增殖和凋亡的分子机制尚未阐明。沉默信息调节因子1(silent informationregulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖的组蛋白去乙酰化酶,参与调控DNA损伤修复、能量代谢、细胞增殖和凋亡等[6]。已有研究发现,SIRT1在结肠癌、前列腺癌、乳腺癌等恶性肿瘤细胞表达上调,通过调控p53、Noxa等多种蛋白质的去乙酰化过程发挥抗凋亡作用[6]。本研究采用人非小细胞肺癌细胞株A549为研究对象,首先观察PARP-1抑制剂Olaparib对A549细胞增殖和凋亡的影响,并进一步以SIRT基因为靶点,探讨Olaparib调控A549细胞增殖和凋亡的具体分子机制。
1 材料与方法
1.1 试剂与仪器 人非小细胞肺癌细胞株 A549购自中科院细胞库;Olaparib购自美国Selleck 公司;DMEM培养基、胎牛血清购自美国GIBCO公司;MTT试剂盒购自美国Sigma公司;Annexin V-FITC试剂盒购自南京凯基生物科技发展有限公司;小鼠抗人SIRT1、Bax、Bcl-2、Caspase-3多克隆抗体、辣根过氧化物酶标记的山羊抗小鼠二抗购自美国Santa Cruz公司;960型酶标仪购自美国Sigma公司;BD FACSCalibur流式细胞仪购自美国Beckman Coulter公司。
1.2 细胞培养 A549细胞用含10%胎牛血清的DMEM培养基,于37℃、5% CO2培养箱中常规培养。细胞贴壁后加入不同剂量Olaparib(0、5、10、20、50 μmol/L)、SRT1720(1 μmol/L)或EX527(1 μmol/L)处理24 h,选取对数生长期的细胞进行实验。
1.3 MTT法 A549细胞接种于96孔培养板中,调整细胞密度为1×104/孔,药物干预 24 h后弃去培养基,每孔加入20 μl MTT溶液,继续培养4 h后于酶标仪570 nm波长处测定吸光度值。细胞存活率(%)=(试验组A570/对照组A570)×100%。
1.4 流式细胞术 A549细胞接种于6孔培养板中,调整细胞密度为5×104/孔,药物干预 24 h后弃去培养基,收集细胞,加入400 μl Binding buffer重悬细胞,加入AnnexinV和PI溶液,避光孵育15 min,流式细胞仪检测细胞凋亡率。
1.5 Western-blot 收集细胞,提取总蛋白,BCA法测定蛋白浓度,10% SDS-PAGE电转移至PVDF膜上,分别加入小鼠抗人SIRT1、Bax、Bcl-2、Caspase-3多克隆抗体,4℃孵育过夜,PBST洗3次,加入辣根过氧化物酶标记的山羊抗小鼠二抗,室温孵育1 h,PBST洗3次。ECL法显色、定影,用Image Pro.Plus 4.5 软件对蛋白条带的灰度值进行分析。
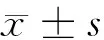
2 结果
2.1 不同剂量Olaparib对A549细胞增殖的影响 MTT实验结果显示,A549细胞在0、5、10、20、50 μmol/L Olaparib干预24 h后细胞OD570、存活率逐渐降低,呈剂量依赖性(Plt;0.05),提示Olaparib能够明显抑制A549细胞增殖。见表1。
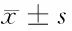

项目Olaparib剂量(μmol/L)对照组5102050OD5700.86±0.130.75±0.11*0.62±0.09#0.44±0.13#0.26±0.13#存活率(%)10087.21±4.57*72.09±4.48#51.16±4.09#30.23±3.53#
注:与对照组比较,*Plt;0.05,#Plt;0.01
2.2 不同剂量Olaparib对A549细胞凋亡的影响 流式细胞术结果显示,A549细胞在0、5、10、20、50 μmol/L Olaparib干预24 h后细胞凋亡率逐渐增加,呈剂量依赖性(Plt;0.05),提示Olaparib能够明显促进A549细胞凋亡。见表2。
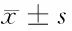

项目Olaparib剂量(μmol/L)对照组5102050凋亡率(%)2.08±0.299.80±1.02*15.76±2.16#24.95±3.31#38.93±4.67#
注:与对照组比较,*Plt;0.05,#Plt;0.01
2.3 不同剂量Olaparib对A549细胞SIRT1基因表达的影响 Western-blot结果显示,A549细胞在0、5、10、20、50 μmol/L Olaparib干预24 h后细胞SIRT1蛋白表达逐渐降低,呈剂量依赖性(Plt;0.05),提示Olaparib能够明显下调A549细胞SIRT1表达。见表3。
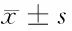

项目Olaparib剂量(μmol/L)对照组5102050SIRT1蛋白1.08±0.140.87±0.11*0.70±0.08#0.52±0.05#0.32±0.04#
注:与对照组比较,*Plt;0.05,#Plt;0.01
2.4 不同剂量Olaparib对A549细胞凋亡相关基因表达的影响 Western-blot结果显示,A549细胞在0、5、10、20、50 μmol/L Olaparib干预24 h后细胞Bax、caspase-3蛋白表达逐渐增加,Bcl-2蛋白表达逐渐降低,呈剂量依赖性(Plt;0.05),提示Olaparib能够明显上调A549细胞促凋亡基因表达,下调抗凋亡基因表达。见表4。
2.5 Olaparib通过下调SIRT1基因表达抑制A549细胞增殖 MTT实验结果显示,A549细胞在SIRT1抑制剂EX527(1 μmol/L)干预后细胞OD570、存活率明显降低(Plt;0.05);与Olaparib组和EX527组比较,SIRT1激动剂SRT1720(1 μmol/L)预处理A549细胞后再给予Olaparib(50 μmol/L)细胞OD570、存活率明显升高,提示Olaparib通过下调SIRT1基因表达抑制A549细胞增殖。见表5。
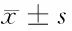
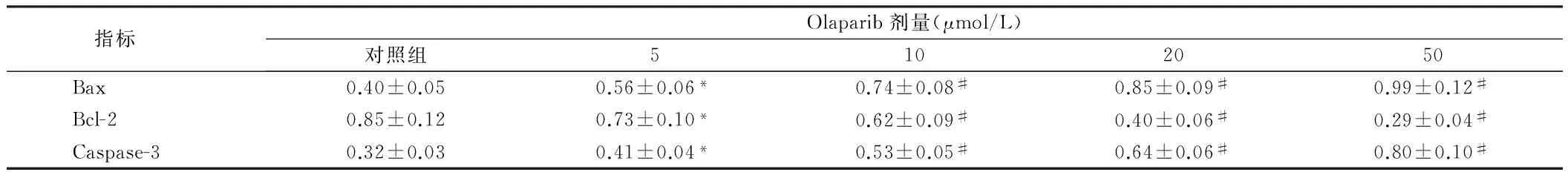
指标Olaparib剂量(μmol/L)对照组5102050Bax0.40±0.050.56±0.06*0.74±0.08#0.85±0.09#0.99±0.12#Bcl-20.85±0.120.73±0.10*0.62±0.09#0.40±0.06#0.29±0.04#Caspase-30.32±0.030.41±0.04*0.53±0.05#0.64±0.06#0.80±0.10#
注:与对照组比较,*Plt;0.05,#Plt;0.01
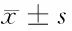

组别OD570存活率(%)对照组0.86±0.13100Olaparib(50μmol/L)组0.26±0.1330.23±3.53#EX527(1μmol/L)组0.23±0.1025.68±3.60#SRT1720(1μmol/L)+Olaparib(50μmol/L)组0.74±0.1169.95±8.79*△
注:与对照组比较,*Plt;0.05,#Plt;0.01;与Olaparib组、EX527组比较,△Plt;0.05
2.6 Olaparib通过下调SIRT1基因表达诱导A549细胞凋亡 流式细胞术结果显示,A549细胞在SIRT1抑制剂EX527(1 μmol/L)干预后细胞凋亡率明显增加(Plt;0.05);与Olaparib组和EX527组比较,SIRT1激动剂SRT1720(1 μmol/L)预处理A549细胞后再给予Olaparib(50 μmol/L)细胞凋亡率明显降低(Plt;0.05),提示Olaparib通过下调SIRT1基因表达诱导A549细胞凋亡。见表6。
2.7 Olaparib通过下调SIRT1基因表达调节A549细胞凋亡相关基因表达 Western-blot结果显示,A549细胞在SIRT1抑制剂EX527(1 μmol/L)干预后细胞Bax、caspase-3蛋白表达明显增加,Bcl-2蛋白表达明显降低(Plt;0.05);与Olaparib组和EX527组比较,SIRT1激动剂SRT1720(1 μmol/L)预处理A549细胞后再给予Olaparib(50 μmol/L)细胞Bax、caspase-3蛋白表达明显降低,Bcl-2蛋白表达明显升高(Plt;0.05),提示Olaparib通过下调SIRT1基因表达调节A549细胞凋亡相关基因表达。见表7。
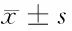

组别凋亡率(%)对照组2.08±0.29Olaparib(50μmol/L)组38.93±4.67#EX527(1μmol/L)组40.58±5.02#SRT1720(1μmol/L)+Olaparib(50μmol/L)组8.69±0.93*△
注:与对照组比较,*Plt;0.05,#Plt;0.01;与Olaparib组、EX527组比较,△Plt;0.05
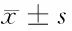

组别BaxBcl-2Caspase-3对照组0.40±0.050.85±0.120.32±0.03Olaparib(50μmol/L)组0.99±0.12#0.29±0.04#0.80±0.10#EX527(1μmol/L)组1.05±0.14#0.24±0.03#0.86±0.11#SRT1720(1μmol/L)+Olaparib(50μmol/L)组0.55±0.07*△0.64±0.08*△0.48±0.08*△
注:与对照组比较,*Plt;0.05,#Plt;0.01;与Olaparib组、EX527组比较,△Plt;0.05
3 讨论
PARP是存在于真核细胞中的一种多功能酶超家族,在单链DNA断裂修复和凋亡中发挥重要作用。PARP缺失或抑制PARP能够降低DNA修复效率,并增强肿瘤细胞对化疗的敏感性。目前,有关PARP抑制剂在肿瘤治疗中的研究已经进入临床试验阶段,结果显示PARP抑制剂单药能够有效发挥抗肿瘤活性。国内外研究发现PARP抑制剂DPQ、3-AB能够抑制肝癌细胞、骨肉瘤细胞增殖,并促进其凋亡[7,8]。Olaparib是2014年美国FDA批准上市的一种PARP抑制剂。临床研究结果显示,Olaparib联合铂类化疗方案能够明显延长卵巢癌、乳腺癌、输卵管癌患者无进展生存期,且毒副作用小,患者耐受性好[9-11]。王维等[12]研究发现,Olaparib能够增强Lewis肺癌细胞及移植瘤对放疗的敏感性,其机制可能与Olaparib促进肿瘤细胞DNA双链断裂及Bax/Bcl-2促凋亡体系蛋白表达有关。然而,Olaparib对肺癌细胞增殖和凋亡的影响及具体分子机制尚不清楚。
SIRT1基因是Ⅲ型组蛋白去乙酰化酶sirtuin家族的重要成员,具有催化转录因子、信号分子、DNA修复蛋白等非组蛋白去乙酰化作用,参与调控物质代谢、神经保护、慢性炎症等生理和病理过程[13,14]。 近年来,多项证据表明SIRT1基因与肿瘤形成密切相关,其表达上调在肿瘤生长、侵袭和迁移中发挥重要作用[15]。然而,SIRT1基因表达在肺癌发生发展中的作用尚存在不一致的结论。Chen等[16-18]研究发现SIRT1在肺腺癌组织表达升高,与肿瘤细胞的侵袭转移及预后密切相关,而SIRT1抑制剂通过上调促凋亡基因的表达抑制肿瘤生长。相反,Lim等[19]研究发现SIRT1通过去乙酰化缺氧诱导因子HIF1-α发挥抗肿瘤作用。张春艳等[20]研究发现,白藜芦醇通过上调人肺齿槽上皮细胞HPAECs中SIRT1的表达,从而抑制活性氧簇(ROS)的产生及其介导的肺损伤过程。因此,对SIRT1在诱导肺癌发生发展中的作用有待阐述清楚。
本研究表明,与对照组比较,Olaparib组A549细胞存活率显著降低,凋亡率显著增加,且有明显的剂量依赖关系,同时SIRT1、Bcl-2基因表达显著降低,Bax基因表达显著增加,说明Olaparib具有促进A549细胞凋亡的作用。这与章俊等[21]报道的PARP-1抑制剂ABT-888抑制VP-16诱导的A549细胞增殖并促进其凋亡的研究结果一致。本研究还发现,Olaparib促凋亡的机制可能与SIRT1基因有关,因为SIRT1激动剂SRT1720能够模拟Olaparib的作用,相反SIRT1抑制剂EX527能够逆转或阻断Olaparib的作用,结果均提示Olaparib可能通过下调SIRT1表达调控A549细胞活力和凋亡。
综上所述,PARP抑制剂作为新型肿瘤靶向治疗药物,通过抑制DNA损伤修复诱导A549细胞凋亡,其促凋亡机制与下调SIRT1基因表达有关。但是PARP抑制剂是如何调控SIRT1基因表达的尚待后续研究。本研究为非小细胞肺癌的防治提供了新思路和新策略。
1 Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015.CA Cancer J Clin,2016,66:115-132.
2 Besse B,Le Chevalier T.Developments in the treatment of early NSCLC:when to use chemotherapy.Ann Oncol,2012,23:52-59.
3 Wang Y,Liu ZD,Zhao LM,et al.Individualized treatment of NSCLC:from research to clinical practice.Neoplasma,2013,60:538-545.
4 Buege M,Mahajan PB.Clinical trials of poly(ADP-Ribose) polymerase inhibitors for cancer therapy:a review.Rev Recent Clin Trials,2015,10:326-339.
5 Bang YJ,Im SA,Lee KW,et al.Randomized,double-blind phase II trial with prospective classification by ATM protein level to evaluate the efficacy and tolerability of olaparib plus paclitaxel in patients with recurrent or metastatic gastric cancer.J Clin Oncol,2015,33:3858-3865.
6 Chang HC,Guarente L.SIRT1 and other sirtuins in metabolism.Trends Endocrinol Metab,2014,25:138-145.
7 Quiles-Perez R,Munoz-Gamez JA,Ruiz-Extremera A,et al.Inhibition of poly adenosine diphosphate-ribose polymerase decreases hepatocellular carcinoma growth by modulation of tumor-related gene expression.Hepatology,2010,51:255-266.
8 郑亚东,彭飞,徐西强,等.PARP-1抑制剂对骨肉瘤细胞增殖及凋亡的影响.骨科,2011,2:13-16.
9 Lheureux S,Bowering V,Karakasis K,et al.Safety evaluation of olaparib for treating ovarian cancer.Expert Opin Drug Saf,2015,4:1305-1316.
10 Liu JF,Tolaney SM,Birrer M,et al.A Phase 1 trial of the poly(ADP-ribose) polymerase inhibitor olaparib(AZD2281)in combination with the anti-angiogenic cediranib(AZD2171)in recurrent epithelial ovarian or triple-negative breast cancer.Eur J Cancer,2013,49:2972-2978.
11 Bang YJ,Im SA,Lee KW,et al.Randomized,double-blind phase Ⅱ trial with prospective classification by ATM protein level to evaluate the efficacy and tolerability of olaparib plus paclitaxel in patients with recurrent or metastatic gastric cancer.J Clin Oncol,2015,33:3858-3865.
12 王维,段碧霞,曾丽.PARP抑制剂对Lewis肺癌细胞及移植瘤放疗增敏作用及其机制.中国肺癌杂志,2016,19:16-23.
13 Chen IC,Chiang WF,Huang HH,et al.Role of SIRT1 in regulation of epithelial-to-mesenchymal transition in oral squamous cell carcinoma metastasis.Mol Cancer,2014,13:254.
14 Rahman S,Islam R.Mammalian Sirt1:insights on its biological functions.Cell Commun Signal,2011,9:11.
15 Yang H,Bi Y,Xue L,et al.Multifaceted modulation of SIRT1 in cancer and inflammation.Crit Rev Oncog,2015,20:49- 64.
16 Chen X,Hokka D,Maniwa Y,et al.Sirt1 is a tumor promoter in lung adenocarcinoma.Oncology Letters,2014,8:387-393.
17 Liu G,Su L,Hao X,et al.Salermide up-regulates death receptor 5 expression through the ATF4-ATF3-CHOP axis and leads to apoptosis in human Cancer cells.Journal of Cellular and Molecular Medicine,2012,16:1618-1628.
18 Li C,Wang L,Zheng L,et al.SIRT1 expression is associated with poor prognosis of lung adenocarcinoma.Onco Targets Ther,2015,8:977-984.
19 Lim JH,Lee YM,Chun YS,et al.Sirtuin 1 modulates cellular responses to hypoxia by deacetylating hypoxia-inducible factor 1alpha.Mol Cell,2010,38:864-878.
20 张春艳,李清平,康兰,等.白藜芦醇上调人肺泡上皮细胞SIRT1表达抑制高氧诱导的细胞凋亡.细胞与分子免疫学杂志,2015,31:590-595.
21 章俊,刘赞朝.PARP-1抑制剂ABT-888对依托泊苷诱导A549细胞增殖及凋亡的影响.中国免疫学杂志,2013,29:588-592.
Theapoptosisofnon-smallcelllungcancerA549cellsinducedbyPARPinhibitor-Olaparibinvitrothroughdown-regulatingtheexpressionofSIRT1gene
XUQinghua.
DepartmentofPharmacy,People’sHospitalofLangfangCity,Hebei,Langfang065000,China
ObjectiveTo investigate the effects of PARP inhibitor-Olaparib on the growth and apoptosis of non-small cell lung cancer A549 cells and its possible action mechanism.MethodsThe A549 cells were routinely cultured and treated with different doses of Olaparib (0、5,10,20,50μmol/L) and/or SRT1720(1μmol/L),EX527(1μmol/L)for 24h.Then MTT method was used to evaluate the proliferation of A549 cells.Flow cytometer was used to analyze the apoptosis of A549 cells,and Western Blot was performed to detect the expressions of SIRT1 and apoptosis-related genes.ResultsAfter A549 cells were treated by different concentrations of Olaparib for 24h,the survival rate,the expression levels of SIRT1 and Bcl-2 of A549 cells were gradually decreased with the increase of Olaparib dosage,meanwhile the apoptosis rate,the expression levels of Bax and Caspase-3 of A549 cells were also gradually increased with the increase of Olaparib dosage,with a dose-dependent manner (Plt;0.05). Moreover simple EX527 could simulate the effects of Olaparib on A549 cells (Plt;0.05),however, the SRT1720 combined with Olaparib could resist the effects of Olaparib as mentioned above.ConclusionPARP inhibitor-Olaparib can inhibit cell proliferation and induce apoptosis of A549 cells by down-regulating the expression levels of SIRT1 gene.
non-small cell lung cancer; PARP inhibitor; Olaparib; SIRT1; apoptosis
10.3969/j.issn.1002-7386.2017.22.003
065000 河北省廊坊市人民医院药学部
R 734.2
A
1002-7386(2017)22-3374-04
2017-05-16)

