羟基自由基氧化降解水中二-甲基异莰醇
成建国,白敏冬,余忆玄,田一平,张芝涛*
羟基自由基氧化降解水中二-甲基异莰醇
成建国1,白敏冬2*,余忆玄1,田一平1,张芝涛1*
(1.大连海事大学轮机学院环境工程研究所,辽宁大连 116026;2.厦门大学环境与生态学院海洋生物资源开发利用协同创新中心,福建厦门 361102)
二-甲基异莰醇(2-MIB)是一种由蓝绿藻以及放线菌等微生物产生,具有桥环结构的饱和叔醇,在水中具有令人厌恶的土霉味,常规水处理工艺难以对其氧化降解.利用大气压强电离放电生成羟基自由基(·OH),对2-MIB进行氧化降解,确定了其氧化剂剂量效应、时间效应关系,并利用GC-MS对2-MIB氧化降解过程中间产物的分析,推断其氧化降解机制.结果表明:对初始浓度为150,300ng/L的2-MIB,分别投加总氧化剂TRO 1.8,2.3mg/L,接触反应6s去除率分别为96%和97.6%,处理后残余浓度低于10ng/L (低于人类嗅阈值).在2-MIB水样中加入•OH淬灭剂叔丁醇(TBA)后,2-MIB的去除效果明显降低,证明氧化降解2-MIB的主要为•OH.另外通过对氧化降解过程中间产物分析表明,•OH 能破坏2-MIB的桥环结构,并最终矿化生成CO2和H2O.
二-甲基异莰醇;羟基自由基;氧化降解;矿化
我国饮用水来源以大的河流湖泊为主,全国70%以上的河流湖泊遭受了不同程度污染.在水华爆发时藻类大量繁殖、死亡过程中会产生致嗅物质导致饮用水变臭,水质质量下降.其中由蓝绿藻以及放线菌产生的次级代谢产物2-MIB是导致饮用水水体产生令人厌恶的土霉味的原因之一[1-3].在夏季和初秋季节饮用水中2-MIB浓度可达到100ng/L或更高,武汉东湖2-MIB最高时达317ng/L[4].日本霞浦水库污染严重时2-MIB含量超过500ng/L[5].我国新《生活饮用水卫生标准(GB5749 2006)》[6]中规定2-MIB检出限值为10ng/L.
2-MIB是一种桥环结构的饱和叔醇,化学结构稳定极难氧化降解,常规的饮用水处理工艺:混凝沉淀、沙滤、氯消毒等都无法有效去除2-MIB,另外常规氧化剂如:O3、HClO、ClO2、KMnO3、H2O2也难以有效的氧化降解2- MIB[7-8].研究表明,Cl2、ClO2对2-MIB去除能力很弱,反应72h去除率低于50%[9];另有研究表明, KMnO4、H2O2以及NaClO对2-MIB的氧化降解效果均较差[10].
近年来,高级氧化技术在水中嗅味物质的去除研究较多.研究表明,以羟基自由基为主的高级氧化技术能有效的氧化降解2-MIB.例如李学艳等人报道得O3/H2O2高级氧化技术[11],Tran等人报道得TiO2/UV光催化技术[12],都能对水中2-MIB进行有效的氧化降解.
以羟基自由基(•OH)为主的高级氧化剂技术,其优势为•OH的氧化还原电位高(2.80V),是仅次于氟的强氧化剂,而且•OH与2-MIB反应速率常数高达109M-1s-1,它可以断开2-MIB的桥环结构对其快速氧化降解.本文采用大气压强电离放电电解氧高效生成•OH的方法,对水中嗅味物质2-MIB进行快速氧化降解.研究了不同初始浓度2-MIB的去除氧化剂剂量效应和时间效应,并通过利用GC-MS对2-MIB氧化降解过程中间产物的分析进一步深入研究了•OH氧化降解2-MIB机制.
1 实验原理与方法
1.1 实验原理
羟基自由基快速氧化降解2-MIB实验原理如图1所示,首先 O2经过减压阀通入到等离子体源中,在高频高压电源(7kV,10kHz)激励条件下, 在等离子体源窄间隙(0.2mm)中形成微流柱和微辉光强电离放电[13].通入的O2在窄间隙放电通道内被电离和电解生成O2+、O(1D)、O、O2-、O2(a1∆g)、O3等氧活性粒子[14-16],然后氧活性粒子经过检测仪和流量计,利用射流器注入水中.注入过程中在快速射流和空穴效应下氧活性粒子与水分子迅速反应生成氧化能力更强的•OH及其它氧自由基包括H2O2、HO2ˉ、O2·ˉ、O3·ˉ、HO3·等,氧活性粒子在水中等离子体反应过程如式(1)~式(9)所示[14,17-19].
O2++ H2O + M → O2+·H2O + M (1)
O2+·H2O + H2O → HO3++ ·OH + O2(2)
O3+ H2O → O2+ H2O2(3)
H2O2→ H++ HO2−(4)
O3+ HO2-→ O2-· + ·OH + O2(5)
O2-·+ O3→ O3-· (6)
O3-· + H2O → ·OH +OH-+ O2(7)
O3+ H2O + M → H2O2+ O2+ M (8)
O3+ H2O2→ HO2-· + ·OH+ O2(9)
含2-MIB水样由水泵泵入管路中,在射流器中与生成的氧自由基接触反应,生成的•OH对2-MIB进行快速氧化降解(见式(10)),管路中设置6个取样点,每个取样点接触反应时间间隔1s.另外为了研究•OH对2-MIB氧化降解的贡献,选择叔丁醇(TBA)作为•OH淬灭剂[20],在含2-MIB水样中加入不同浓度TBA,然后水样按照图1实验流程进行处理.
·OH + 2-MIB →产物 (10)

图1 •OH氧化降解2-MIB装置示意
1.2 分析方法
溶于水中的氧自由基统称总氧化剂用TRO (mg/L)表示,测试方法采用KI–4-氨基-N,N-二乙基苯胺 (DPD)分光光度法,该方法依据美国EPA 330.5标准,由紫外可见分光光度仪测定(美国EPA Method 330.5, US)[15].
水中2-MIB(Wako, Japan)采用HP-SPME吸附浓缩后用GC-MS分析.取处理后水样20mL 移入40mL带聚四氟乙烯涂层的顶空瓶中,加入6g NaCl(使用前450℃烘烤4h),插入SPME萃取头(聚二甲基硅氧烷/二乙烯基苯涂层纤维65µm PDMS/DVB) (Supelco, USA),于65℃、搅拌速度1200r/min条件下进行样品富集30min,然后拔出萃取头迅速插入GC进样口对样品解析进行分析[21].
GC-MS(Agilent 7890A-5975C, USA)条件: 采用不分流进样模式,进样口温度250℃,解析时间3min(1min进样时间, 2min吹扫清理萃取头).毛细管柱(HP-5MS;30m×0.250mm× 0.25μm): 载气高纯He,流量1.0mL/min,升温条件: 40℃(保持2min)然后升高到140℃(4℃/min)继续升高到280℃(10℃/min)保持5min.MS四级杆150℃、离子源230℃.定性分析:质谱全扫描/30-500, 2-MIB特征离子95、108、168定量分析:选择性离子扫描2-MIB选择性特征离子/:95[22].
2 实验结果与讨论
2.1 氧化剂剂量对2-MIB去除的影响
按照图1所示,对不同浓度2-MIB水样进行处理.2-MIB初始浓度分别为150和300ng/L,处理后水样在第6个取样点取样检测,接触氧化降解时间为6s.2-MIB去除效果与氧化剂剂量效应关系如图2所示,随着注入的总氧化剂TRO浓度的增加,2-MIB氧化降解率也逐渐增加.当TRO为0.8mg/L时,初始浓度为150,300ng/L的2-MIB处理后分别剩余38,148ng/L;当TRO提高到1.8mg/L时,150ng/L的2-MIB降解到6ng/L,降解率为96%;继续提高TRO到2.3mg/L, 300ng/L的2-MIB处理后残余浓度为7ng/L,低于人类嗅阈值.可见2-MIB初始浓度越高需要投加的TRO剂量也越高,最终处理后水中2-MIB残余低于《生活饮用水卫生标准(GB5749 2006)》[6]要求限值.
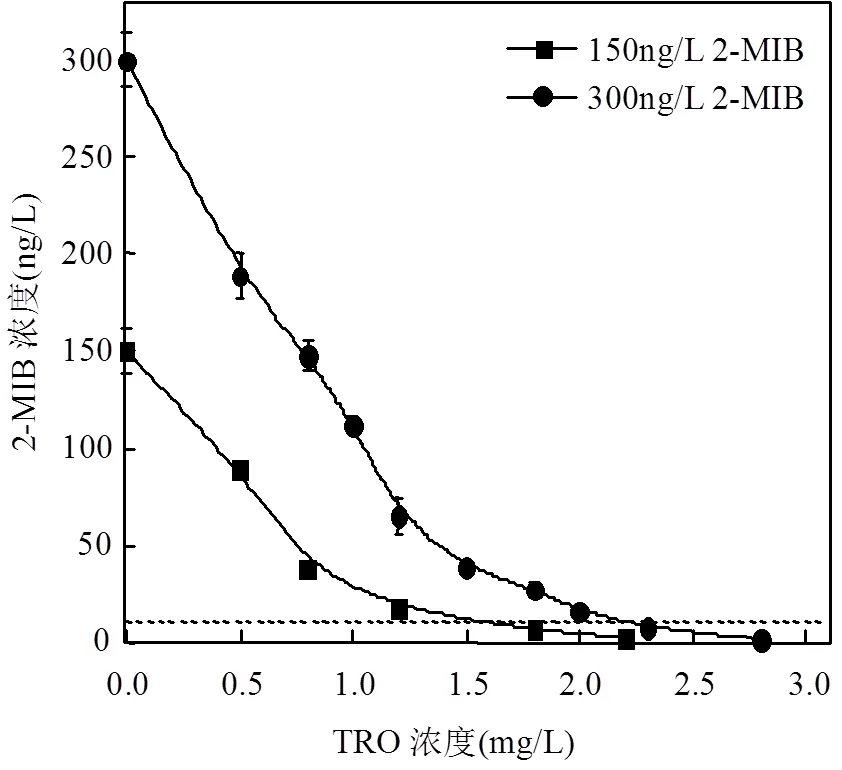
图2 不同浓度2-MIB的氧化降解结果
2.2 •OH对2-MIB氧化降解的贡献
在以往的研究中TBA作为•OH淬灭剂,用来研究高级氧化过程中•OH对有机污染物氧化降解作用,TBA与•OH反应速率常数TBA, •OH为6×108M-1s-1,在•OH 氧化降解2-MIB(2-MIB, •OH=4.3×109M-1s-1)过程是有效的•OH淬灭剂[20].本实验选择在水样中加入0.1和4.0mmol/L的TBA来研究•OH对2-MIB的氧化降解作用.将300ng/L的2-MIB水样通入到•OH氧化降解装置(图1)中,注入2.3mg/L的TRO, 在管路中1、2、3、4、5、6取样点取样检测(40mL取样品预先加入0.1mL 0.1mol/L的Na2S2O3用于瞬间终止反应),对应的•OH氧化降解时间为1~6s.另外用大烧杯取第6点样品避光保存,检测离开管路2-MIB的降解效果.•OH降解2-MIB的时间效应关系如图3所示,不加TBA时,对2-MIB有很好的氧化降解效果,接触反应时间6s对300ng/L的2-MIB去除率可达到98.7%,60s后可以完全氧化降解;加入TBA后对2-MIB的去除效果明显降低,当TBA浓度为0.1mmol/L时,反应6s与未加TBA相比去除率由98.7%降到59.7%,接触反应时间延长到180s对2-MIB去除效率增加到63.6%;当TBA浓度为4.0mmol/L时,反应6s对2-MIB去除率仅为8.3%,延长反应时间到180s并无明显去除效果.可以得出在基于强电离放电生成氧自由基氧化降解水中2-MIB过程中,对2-MIB起氧化降解作用的为•OH,且•OH对2-MIB的氧化降解作用主要发生在管路气液混匀过程中.
根据Chick-Watson方程[23],用时刻2-MIB含量(C)与初始2-MIB(0)比值取对数值,对时间作图,即
ln (C/0) = -kc
式中:为•OH氧化降解2-MIB反应速率常数,M-1s-1;为反应时间,s;为•OH浓度,mg/L;为非一级拟合参量.
从图3内小图ln(C/0)对反应时间作图,2>0.98,6s内线性拟合良好,所以•OH对2-MIB的氧化降解反应为一级反应动力学过程.
与以往Yuan等[24]研究的O3法,Mizuno等[25]研究的O3/H2O2高级氧化技术,Bang等[26]研究的H2O2/UV方法以及Park等[27]研究的H2O2/ FeO42-等高级氧化相比,强电离放电生成•OH技术氧化降解相同浓度水平的2-MIB需要投加的氧化剂更少, 同时氧化降解速率更快.分析原因为,强电离放电过程生成的高浓度氧活性粒子溶于水时,与水分子的等离子体反应过程中能生成更多的•OH,同时射流器气液混匀提供的水力空化作用也进一步促进•OH的生成,另外高速射流也大大提高了气液传质效率,所以经过图1实验装置处理可以快速的氧化降解水中嗅味物质2-MIB.
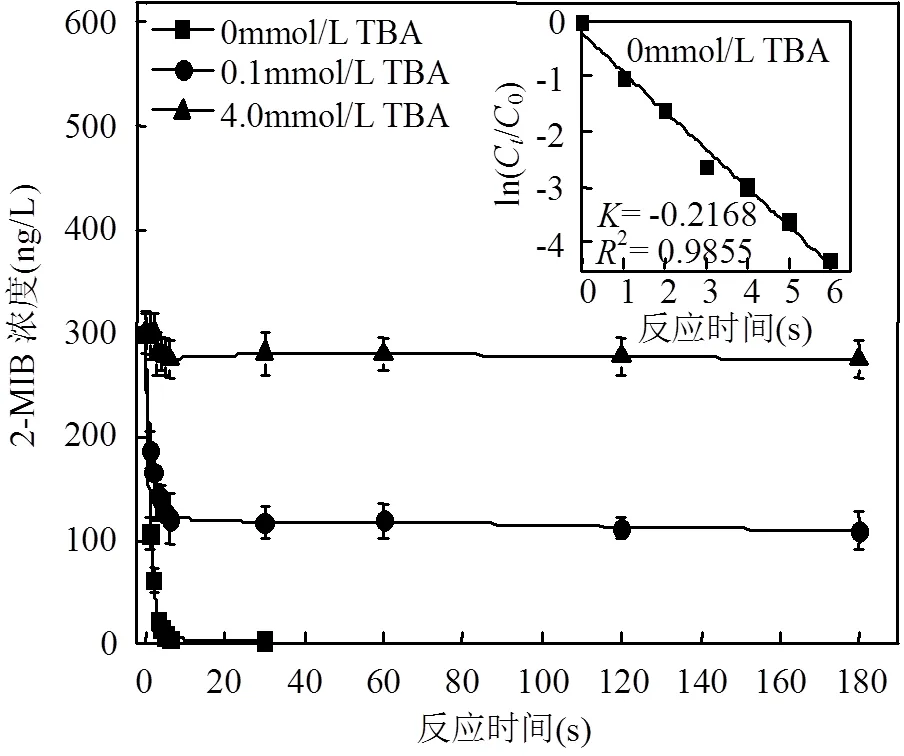
图3 •OH氧化降解2-MIB的时间效应关系
2.3 •OH氧化降解2-MIB机制
选取浓度为1000ng/L的2-MIB进行•OH氧化降解机制研究,在图1管路分别投加总氧化剂TRO剂量为1.0,3.5mg/L,在第6取样点取样,用0.1mol/L的 Na2S2O3立刻终止反应.采用GC-MS全扫面模式分析•OH氧化降解2-MIB过程生成的中间产物.实验结果如图4所示,TRO为1.0mg/L时,检测到9种中间产物;TRO为3.5mg/L降解2-MIB时,处理后未检测到任何中间产物,TRO为3.5mg/L是降解1000ng/L的2-MIB阈值浓度,可以把2-MIB完全氧化降解为小分子物质并最终完全氧化矿化生成CO2和H2O.中间产物与NIST11质谱数据库匹配结果如表1所示,检测到的中间产物匹配度均大于80%.
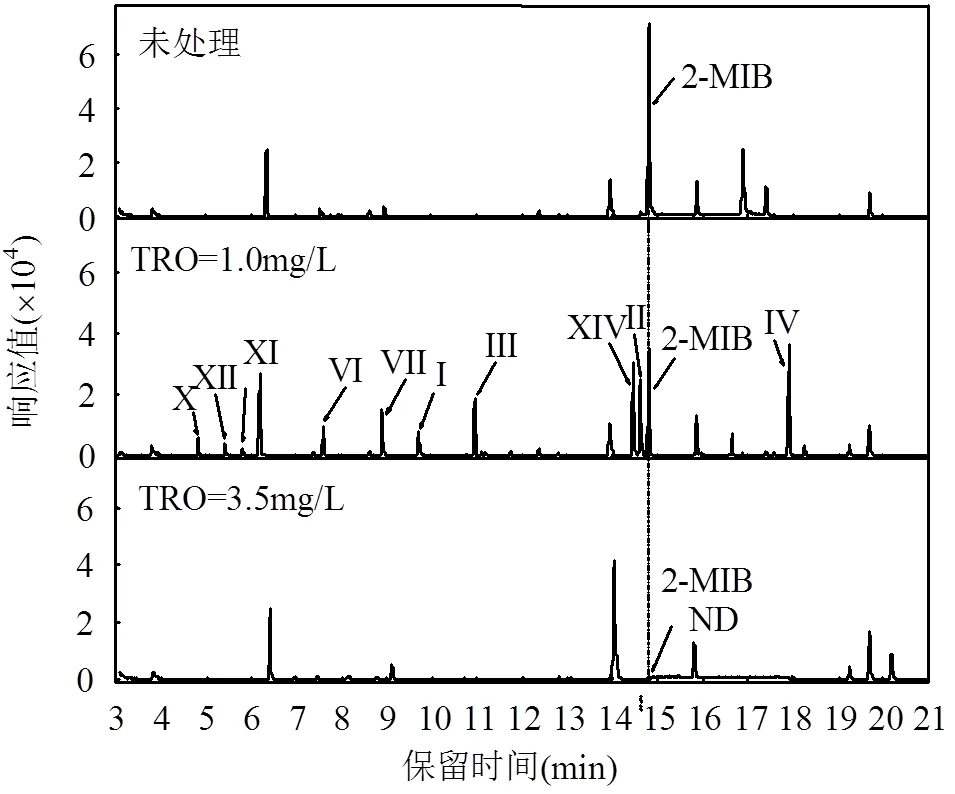
图4 •OH氧化降解2-MIB过程气相色谱图
•OH氧化降解2-MIB过程主要步骤如下:第一步•OH攻击2-MIB侧链,经过脱水和脱甲基破坏其稳定结构,形成含酮基和环内双键的一级桥环产物,如I: 2-甲基-2-菠烯,II:樟脑,III:1,7,7-三甲基-2-亚甲基降冰片,IV:2-甲基环己稀-1-醛;第二步•OH攻击双桥环产物,在C=C位置上加成并转移自由电子到桥环上,导致桥环结构断裂形成二级单环醛、酮类产物,如VI:2-甲基环己稀-1-醛, VII:2,2-二甲基-1,3-环戊二酮等;第三步•OH通过环内加成转移自由电子,使环状结构断键生产三级小分子醛类、酮类以及酸类产物,如X:4-甲基-2-己酮,XI:3-甲基丁醛, XII:叔丁基乙酸以及XIV: 6-甲基-2,6-二烯醇,这与李学燕等人研究的H2O2/O3氧化降解2-MIB得出的结论较为相近[10].最后•OH进一步氧化降解链状产物,最终矿化成CO2和H2O.

表1 •OH氧化降解2-MIB过程中间产物匹配结果
•OH对2-MIB氧化降解机制分析如图5所示:2-MIB是一种桥环结构的饱和叔醇,在2号位有未配对电子,且电子云密度较高,而-OH是唯一的亲水基团.•OH具有极强的电负性和电子亲和性,首先攻击2号位-OH夺取-H生成H2O,•OH的自由电子转移到2号位侧链,破坏2-MIB稳定结构.而且2-MIB侧链2号位C-C键解离能约为(81kcal/mol)低于桥环内C-C解离能(88~ 90kcal/mol)更容易断键[28-29],在•OH攻击下, 2-MIB的2号位侧链会发生脱水和脱甲基,生成一级中间产物1,7,7-三甲基-2-亚甲基降冰片(III)和2-莰醇(V*),产物(III)异构化生成更稳定的2-甲基-2-菠烯(I),在形成2-莰醇(V*)过程中部分化学键重组生成葑醇(IV),其中部分V*侧链的-OH与•OH继续反应脱氢而生成樟脑(II).这与其它相关研究类似[8,11,30].
然后•OH进一步攻击桥环结构,进行亲和加成形成不稳定的过渡态中间体,中间体在更多•OH存在条件下,断键破坏桥环结构,生成2-甲基环己稀-1-醛(VI)、2,2-二甲基-1,3-环戊二酮(VII))、2,2,3-三甲基-3-环戊烯-醛(VIII)以及2,2-二甲基-3环戊烯-醛(IX)等单环中间产物,这些单环中间产物大多数含有不饱和C=C,不饱和双键更容易被•OH攻击.例如•OH对一级中间产物2-甲基-2-菠烯(I)的氧化降解(如图6所示):首先在•OH作用下,在3号位加成形成羟基,•OH的自由电子转移到I的2号位,由于含有自由电子,I的过渡中间产物结构容易断键,桥环结构被破坏,同时侧链被多余的•OH进攻,脱去H2O以及CO2,而形成单环的二级中间产物如VII、VIII*、IX*.
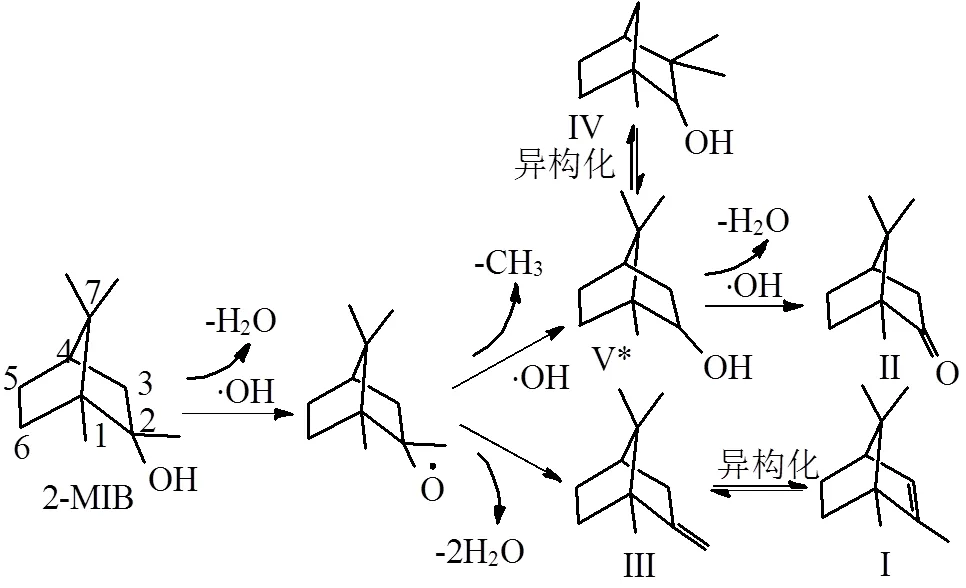
图5 •OH氧化降解2-MIB反应过程
*未检测到物质
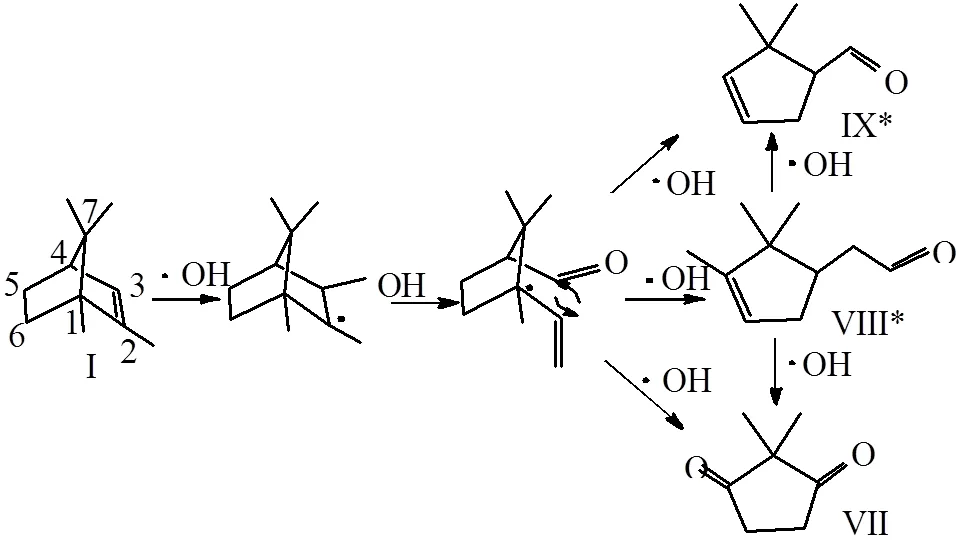
图6 •OH对桥环结构中间产物I的开环过程
•OH对单环的二级中间产物醛酮类物质的氧化降解过程.以VII为例,VII在•OH的攻击下进行环内加成,在5号位生成羟基,同时•OH自由电子转移到4号位,在自由电子作用下C-C化学键断裂,生成单链的小分子醛、酮、酸类物质,如3-甲基丁醛(XI)、叔丁基乙酸(XII),最后这些小分子化合物被•OH矿化形成CO2和H2O.
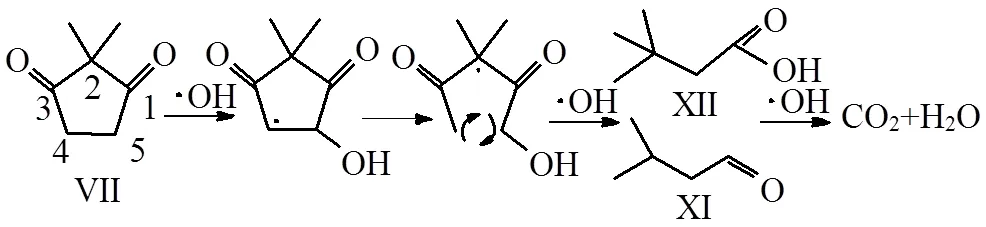
图7 •OH对单环中间产物VII的开环及矿化过程
3 结论
3.1 利用大气压强电离放电生成·OH能快速有效的氧化降解水中嗅味物质2-MIB.对初始浓度为150,300ng/L的2-MIB,投加1.8,2.3mg/L的总氧化剂,接触反应时间6s,均可降到10ng/L以下,处理后残余2-MIB低于人类嗅阈值.
3.2 分析不同浓度氧化剂氧化降解2-MIB过程得到的中间产物表明,•OH可以破坏2-MIB稳定的桥环结构,对其进行断键开环并逐步氧化降解生成小分子有机物,最终矿化成为CO2和H2O无任何有毒副产物残留.
[1] Su M, Yu J, Zhang J, et al. MIB-producing cyanobacteria (sp.) in a drinking water reservoir: distribution and odor producing potential [J]. Water Research, 2015,68:444-453.
[2] Sun D, Yu J, An W, et al. Identification of causative compounds and microorganisms for musty odor occurrence in the huang pu river, China [J]. Journal of Environmental Science-China, 2013, 25(3):460-465.
[3] 邵 晨,黎 雷,于水利,等.产嗅藻类对东太湖某地原水中嗅味物质2-MIB的贡献[J]. 中国环境科学, 2014,34(9):2328-2333.
[4] 徐 盈,黎 雯,吴文忠,等.东湖富营养水体中藻菌异味性次生代谢产物的研究[J]. 生态学报, 1999,19(2):212-216.
[5] Norio S, Kazunori N. Causative microorganisms for musty odor occurrence in the eutrophic lake kasumigaura [J]. Hydrobiologia, 2000,434(1):145-150.
[6] GB5749-2006 生活饮用水卫生标准 [S]. 中国人民共和国卫生部, 2006.
[7] Zoschke K, Dietrich N, Bornick H, et al. UV-based advanced oxidation processes for the treatment of odour compounds: efficiency and by-product formation [J]. Water Research, 2012, 46(16):5365-5373.
[8] Fotiou T, Triantis T M, Kaloudis T, et al. Photocatalytic degradation of water taste and odour compounds in the presence of polyoxometalates and TiO2: Intermediates and degradation pathways [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2014,286(15):1-9.
[9] Jung S W, Baek K H, Yu M J. Treatment of taste and odor material by oxidation and adsorption [J]. Water Science and Technology, 2004,49(9):289-295.
[10] 李学艳,马 军,陈忠林,等.若干氧化剂对水中嗅味物质2-MIB的氧化去除[J]. 黑龙江大学自然科学学报, 2007,24(1):76-80.
[11] 李学艳,高乃云,沈吉敏,等.O3/H2O2降解水中致嗅物质2-MIB的效能与机理[J]. 环境科学学报, 2009,29(2):344-352.
[12] Tran H, Evans G M, Yan Y, et al. Photocatalytic removal of taste and odour compounds for drinking water treatment [J]. Water Science and Technology, 2009,9(5):477-483.
[13] Zhang Y B, Bai M D, Chen C, et al. ·OH Treatment for killing of harmful organisms in ship’s ballast water with medium salinity based on strong ionization discharge [J]. Plasma Chemistry and Plasma Processing, 2013,33(4):751-763.
[14] Bai M, Zhang Z, Bai M. Simultaneous desulfurization and denitrification of flue gas by ·OH radicals produced from O2+and water vapor in a duct [J]. Environmental Science & Technology, 2012,46(18):10161-10168.
[15] Bai M, Zheng Q, Tian Y, et al. Inactivation of invasive marine species in the proce ss of conveying ballast water using ·OH based on a strong ionization discharge [J]. Water Research, 2016, 96:217-224.
[16] Lowke J J, Morrow R. Theoretical analysis of removal of oxides of sulphur and nitrogen in pulsed operation of electrostatic precipitators [J]. IEEE Transactions on Plasma Science, 1995, 23(4):661-671.
[17] Staehelin J, Hoigne J. Decomposition of ozone in water: rate of initiation by hydroxide ions and hydrogen peroxide [J]. Environmental Science & Technology, 1982,16(10):676-681.
[18] Yang Y, Jiang J, Lu X, et al. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate: a novel advanced oxidation process [J]. Environmental Science & Technology, 2015,49(12):7330-7339.
[19] Bai M, Bai X, Zhang Z, et al. Treatment of red tide in ocean using non-thermal plasma based advanced oxidation technology [J]. Plasma Chemistry and Plasma Processing, 2005,25(5):539-550.
[20] Xie P, Ma J, Liu W, et al. Removal of 2-MIB and geosmin using UV/ persulfate: contributions of hydroxyl and sulfate radicals [J]. Water research, 2015,69:223-233.
[21] 成建国,刘开颖,白敏冬,等.顶空固相微萃取-气相色谱-质谱联用测定饮用水中的2-甲基异莰醇和土臭素[J]. 色谱, 2015, 33(12):1287-1293.
[22] Watson S B, Brownlee B, Satchwill T, et al. Quantitative analysis of trace levels of geosmin and MIB in source and drinking water using headspace SPME [J]. Water Research, 2000,34(10):2818- 2828.
[23] Gunten V U. Ozonation of drinking water: part II. Disinfection and by-product formation in presence of bromide, iodide or chlorine [J]. Water Research, 2003,37(7):1469-1487.
[24] Yuan B, Xu D, Li F, et al. Removal efficiency and possible pathway of odor compounds (2-methylisoborneol and geosmin) by ozonation [J]. Separation and Purification Technology, 2013,117(30):53-58.
[25] Mizuno T, Shiya O, Fumitake N. O3/H2O2Process for both removal of odorous algal-derived compounds and control of bromate ion formation [J]. Ozone: Science & Engineering. 2011, 33(2):121-135.
[26] Bang H, Slokar Y M, Ferrero G, et al. Removal of taste and odor causing compounds by UV/H2O2treatment: effect of the organic and inorganic water matrix [J]. Desalination and Water Treatment, 2016,57(57):1-10.
[27] Park G, Yu M, Go J, et al. Comparison between ozone and ferrate in oxidising geosmin and 2-MIB in water [J]. Water Science & Technology, 2007,55(5):117-125.
[28] Luo Y. Handbook of bond dissociation energies in organic compounds [M]. United States of America: CRC Press LLC, 2003:170-210.
[29] Smith M B, March J. March's advanced organic chemistry: reactions, mechanisms, and structure [M]. 6th edition. New Jersey: John Wiley & Sons Inc, 2007:28-35,1736-1750.
[30] Qi F, Xu B, Chen Z, et al. Efficiency and products investigations on the ozonation of 2-methylisoborneol in drinking water [J]. Water Environment Research, 2009,81(12):2411-2419.
Degradation of 2-methylisoborneol in water by hydroxyl radical.
CHENG Jian-guo1, BAI Min-dong2*, YU Yi-xuan1, TIAN Yi-ping1, ZHANG Zhi-tao1*
(1.Environmental Engineering Institute, Marine engineering college, Dalian Maritime University, Dalian 116026, China;2.Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, College of Environmentand Ecology, Xiamen University, Xiamen 361102, China)., 2017,37(11):4166~4172
2-methylisoborneol (2-MIB) produced by cyanobacteria and actinomycetes is a saturated bicyclic-tertiary alcohol, which can cause earthy/musty taste and odor in surface water. Moreover, 2-MIB is usually difficult to be decomposed and removed by conventional water treatment process. In this paper, hydroxyl radical (•OH) generated by a strong ionization discharge process at atmosphere pressure was used to degrade 2-MIB in water, of which the removal efficiency including dose effects and contact reaction time were investigated. The intermediate products formed in •OH treatment process were analyzed by GC-MS, and the oxidative degradation mechanism of 2-MIB by •OH was discussed. Results show that the removal rate for 2-MIB with initial concentration of 150and 300ng/L could reach 96% and 97.6% within 6.0s, while the total reactive oxidant (TRO) dose were 1.8and 2.3mg/L, respectively. After •OH treatment, the concentration of 2-MIB in water was lower than 10ng/L (lower than the human olfactory threshold). The degradation effects of 2-MIB were obviously reduced by the •OH scavengers tertiary butyl alcohol (TBA), indicating that •OH should be the main oxidant for 2-MIB oxidative degradation. By analyzing the intermediates produced in the oxidative degradation process, it was found that the bridge ring structures of 2-MIB could be destroyed by •OH and finally mineralized to CO2and H2O.
2-methylisoborneol;hydroxyl radical;oxidative degradation;mineralization
X131.2
A
1000-6923(2017)11-4166-07
成建国(1985-),男,山西晋中人,大连海事大学博士研究生,主要从事高级氧化技术应用研究.发表论文3篇.
2017-04-07
国家科技支撑计划项目(2013BAC06B01,2013BAC06B02);国家重大科研仪器研制项目(NSFC:61427804);科技部创新人才推进计划重点领域创新团队(2015RA4008);辽宁省重点实验室基础研究项目(LZ2015008)
* 责任作者, 白敏冬, 教授, mindong-bai@163.com; 张芝涛, 教授, newzhangzhitao@163.com

