吸收式工质对R152a+DMETrEG的汽液相平衡特性
方一波,管文洁,华超,王琰铚,韩晓红,陈光明
(浙江省制冷与低温技术重点实验室,浙江大学制冷与低温研究所,浙江 杭州 310027)
吸收式工质对R152a+DMETrEG的汽液相平衡特性
方一波,管文洁,华超,王琰铚,韩晓红,陈光明
(浙江省制冷与低温技术重点实验室,浙江大学制冷与低温研究所,浙江 杭州 310027)
R152a(ODP=0,GWP=124)对环境友好,热力性能完善,而吸收剂三乙二醇二甲醚(DMETrEG)沸点较高,毒性较弱,对较多制冷剂都有很好的溶解能力。因此,R152a与DMETrEG的二元混合物是一种具有潜在应用价值的吸收制冷工质对。采用气液双循环法,实验研究了R152a+DMETrEG在293.15~353.15 K温度范围内的汽液相平衡特性;分别采用NRTL模型和Wilson模型对测得的汽液相平衡(VLE)数据关联对比。实验结果与关联结果具有良好的一致性,NRTL模型拟合计算结果与实验结果的平均相对偏差为1.80%,而Wilson模型拟合计算结果与实验结果的平均相对偏差为1.83%。当混合溶液中R152a摩尔分数大于0.8时,R152a活度系数接近1,混合溶液可近似视为理想溶液。
汽液平衡;R152a;三乙二醇二甲醚;吸收式工质对;色谱;活度系数
引 言
根据《中国建筑能耗研究报告(2016)》,我国建筑能耗占据总能耗20%左右,其中暖通空调行业能耗占据了非常大的一部分。在倡导节能的背景下,吸收式制冷凭借其可以有效利用余热、太阳能、废热等低品位热源的优势,受到了研究学者越来越多的关注[1-2]。吸收式制冷以热能为动力,通过吸收剂吸收低压制冷剂蒸汽,由溶液泵升压,再通过发生器中加热,实现制冷剂从低压向高压蒸汽的转变。吸收式制冷中采用的工作流体通常称为吸收式工质对,多以二元、三元溶液为主,对制冷剂、吸收剂所要求具备的性质各有不同[3-4]。在吸收式工质对的研究历程中,按制冷剂种类不同,大致可以分为水类工质对、氨类工质对、醇类工质对以及卤代烃类工质对 4种[5]。水类工质对的研究历史最久远,LiBr+H2O就是其中典型的一种。虽然LiBr+H2O具有蒸发潜热大的优势,且吸收剂 LiBr不挥发,但LiBr也有易结晶、腐蚀性强和蒸发温度比较高等不足,这在很大程度上限制了它的使用范围[6]。氨类工质对中以NH3+H2O工质对为代表,优点是NH3和H2O互溶性强、NH3蒸发潜热大[7],但是它存在工作压力较高、毒性较强、高温下不易分离等不足。同时由于NH3和H2O之间沸点差较小,存在精馏问题。醇类工质对相对来说环保性能、安全性能都较为良好,且工作压力适中、无须精馏。目前研究较多的醇类制冷剂有甲醇、乙醇、TFE(三氟乙醇)、HFIP(六氟异丙醇)等,而相应的吸收剂除 LiBr等盐类外,还包括有机溶剂与离子液体[8-11]。但其中一些工质如TFE仍存在有毒、易燃、腐蚀性较强等问题[6]。卤代烃类工质对(包括HCFCs类、CFCs类及HFCs类等制冷剂与吸收剂的组合)的汽化潜热虽然较氨类、水类工质对小,但它们热力性能好,且无毒或毒性很小,特别是卤代烃类工质对温度适应范围较宽,能够利用低品位热,其在太阳能、废热等领域都有良好的应用潜力,从节能和环保的角度看都具有很高的研究价值[12]。由于CFCs、HCFCs类制冷剂ODP不为0,且GWP较高,对环境不友好,已被淘汰或正逐步被淘汰。HFCs类制冷剂,由于其ODP为0、GWP较低或很低(如R134a、R152a、R32、R161),获得了更为广泛的关注。
吸收式工质对在吸收制冷系统中的主要部件如吸收器、发生器、蒸发器、冷凝器中都存在相变过程。因此工质对的汽液相平衡(vapor liquid equilibrium,VLE)特性对吸收式制冷循环的研究有非常重要的参考价值。特别是在吸收式制冷系统的理论模拟计算时,各部件的流体热力参数如温度、压力、组分、焓值无法完全从实验中获得,很大一部分需要依赖于汽液相平衡计算获得。因此,测量制冷剂与吸收剂工质对的汽液相平衡实验数据,获取工质对的热力性能,就成为研究吸收式制冷循环性能的基础。已有很多研究学者对HFCs类吸收式工质对的汽液相平衡进行了相关研究,其中以有机溶剂作为吸收剂的研究最多,如文献[12-20]分别针对R134a、R32、R161等制冷剂与不同吸收剂的相平衡展开研究。最早在1994年,Tseregounis等[13]研究了在温度范围268.15~353.15 K下,R134a在三甘醇(TRIG)、四乙二醇二甲醚(TGDE)、己二醇(HEXG)、四甘醇(TETG)中的溶解度,结果表明R134a在TGDE中溶解度最大,而在TRIG中溶解度最小。之后Coronas等[21]采用静态法测量了温度范围283.15~353.15 K内R134a在DMETrEG(三乙二醇二甲醚)中的溶解度,研究表明这两种物质在研究温度压力范围内完全互溶。Han等[14-16]对 R134a+DMF、R32+DMF、R23+DMF在温度范围293.15~363.15 K间的汽液相平衡实验数据进行了测定,并提出了新型混合法则用于计算分子结构差异较大的混合物的汽液相平衡。Deng等[22]对制冷剂 R161与吸收剂 DMF(二甲基甲酰胺)和DMEDEG(二乙二醇二甲醚)在温度范围293.15~353.15 K之间的汽液相平衡特性进行了研究,并结合NRTL模型关联实验数据,认为实验结果偏差较小。另外,部分离子液体也被考察了它们作为吸收剂的潜力[23-28]。Shiflett等[24-25]在这方面进行了一系列的研究,他们测量了R32、R125、R134a、R143a、R152a、R23等在多种离子液体中的溶解度。Ren等[26]和 Dong等[27]分别研究了 R134a在[HMIM][Tf2N]、[HMIM][BF4]、[HMIM][PF6]中,以及 R32和R152a在[EMIM]OTf、[BMIM]OTf中的溶解度。Liu等[28]获取了 R32、R152a、R125在离子液体[HMIM][Tf2N]中的溶解度,采用Krichevsky-Kasarnovsky方程进行关联,发现溶解度R152a > R32 > R125。在这些研究中,以R134a的研究最多,涵盖的温度压力区间也最广。R161、R32以及 R245fa等作为制冷剂分别与多种吸收剂组合为工质对,已经得到了较好的研究,并且实验研究的温度以及压力范围涵盖也较广。但一些制冷剂如R152a、R23、R114相关研究内容相对较少,而如R1234yf、R290等尚未有过相关研究。本文主要针对以R152a为制冷剂的吸收式工质对的相平衡进行研究。
R152a化学名称为 1,1-二氟乙烷(CAS No.75-37-6),其由于具有环保性能较好、价格适中、热力性能完善的优势已经吸引了众多研究人员的关注,以R152a作为制冷剂的相关研究报道涵盖了换热性能、汽液相平衡、黏度等方面[29],已经积累了丰富的研究成果及实验数据。在吸收式系统中,R152a与有机吸收剂的组合也被作为潜在的吸收式工质对而得到关注。如文献[4,18]对R152a与DMF(二甲基甲酰胺)、DMAC(二甲基乙酰胺)等有机吸收剂的相平衡进行了研究。吸收剂 DMETrEG的沸点较高,毒性较弱,对较多制冷剂都有很好的溶解能力,且性质稳定,黏度较低,对环境友好,是较具潜力的吸收剂,但到目前为止,尚未有关于R152a与DMETrEG相平衡研究的公开报道。基于此,本文将展开吸收式制冷工质对 R152a+DMETrEG在温度范围293.15~353.15 K内的汽液相平衡实验研究,并采用 Wilson和NRTL模型对VLE数据进行关联,本文的研究结果将为丰富R152a与吸收剂工质对的研究成果提供有价值的补充。
1 实 验
1.1 实验装置
常见有机吸收剂,如 DMF、DMEDEG、DMETrEG等的标准沸点较高(大多在400 K以上),而制冷剂的标准沸点大多在220~250 K之间,两者之间存在一个较大的沸点差。在实验温度下(一般为260~370 K之间),混合体系的气相中几乎没有有机吸收剂,含量通常在0.01%以下[14,21-22],气相中的制冷剂含量可以近似看作 100%。因此对于采用DMF、DMEDEG、DMETrEG作为吸收剂的吸收式工质对,在汽液相平衡实验测量过程中可以忽略气相组分的测量,只需要测量混合物体系的T、p、x1,即可得到在实验温度范围下的汽液相平衡相图。因此对于这几类有机溶剂与制冷剂的汽液相平衡实验可看作制冷剂在吸收剂中的溶解度研究。本文在前文[30-31]研究基础上,对原有的装置进行了更进一步的改进与完善,使之能更好地适用于吸收式制冷工质对汽液相平衡研究。改进 1:本文选择了美国Valco仪器有限公司出产的四通阀代替原有的六通阀。这种四通阀的定量环为内置的且为固定容积,定量环长度和内径减小,因而能够实现定量环的体积缩减至 0.5 μl。新安装的四通阀成功避免了进样量过大可能带来的影响,避免了色谱峰过宽、拖尾、平峰等现象。改进2:由于原有液相四通阀的存在,液相循环回路的内径相对于液相循环回路的其他部分来说较小,流体阻力较大,这就导致液相循环出现了液柱不连续、液相循环泵负荷大等问题。因此,本文在原有液相四通阀处增设了一段并行的旁通管路,起到对液相循环中吸收式制冷工质对的分流作用,减轻了液相循环泵的负荷。改进 3:由于制冷剂与吸收剂的沸点差较大,在进入色谱分析时,采用普通的恒温分析无法在合适的测试时间内使得两种组分得到较好的分离。因此,本文采用程序升温法,实验表明,采用程序升温法分析提高了色谱柱的选择性,提高了分离度并缩短了分析时间。
改进后的实验装置流程图如图1所示。它主要由恒温系统(恒温浴、搅拌器、制冷系统、加热棒、温控仪、电气控制系统等)、循环系统[平衡釜、气相循环泵自制微量磁力泵[32]、液相循环泵(Micro Pump GAH-T23.PVS.B)、液相四通阀等]、测量系统(体系的温度、体系的压力、体系液相组分)组成。本实验采用四线制铂电阻温度计测量恒温浴内的温度,温度计的来源为云南仪表厂。该铂电阻温度计型号为 WZPB-1,Rtp为(25±1.0)Ω,测温不确定度为 ± 0.001 K。压力测量采用压力传感器直接测量平衡釜内的压力,型号为Druck公司生产的PMP4010型压力传感器,量程为0~3.5 MPa,最大误差 ±0.04%F.S.。数据采集系统主要包括Keithley 2002型数字万用表、计算机及采集程序,能够在计算机上实时显示和记录实验数据。实验中制冷剂和吸收剂的液相组分通过气相色谱仪(杭州科晓GC1690,FID检测)进行测量。

图1 实验装置示意图Fig.1 Schematic diagram of experimental apparatus
1.2 实验装置误差分析
1.2.1 温度测量不确定度 温度测量不确定度由 4部分组成:①铂电阻温度计误差,由于WZPB-1型铂电阻温度计精度为0.001 K,故uT,1= 0.001 K;②恒温浴温度波动,通过实验测量发现恒温浴温度波动小于0.01 K·h-1,故uT,2= 0.01 K;③数字万用表分辨误差,Keithley 2002型数字万用表uT,3= 0.005 K;④温度测量可重复性误差,由多次测量冰水混合物的温度计算得到标准误差,取n= 10,uT,4=0.0051 K。则总的温度测量不确定度为
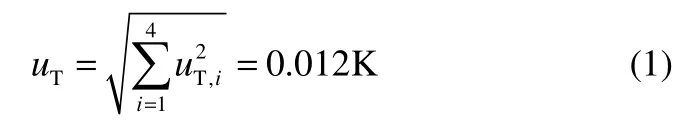
1.2.2 压力测量不确定度 压力测量不确定度由 2部分组成:①压力传感器自身的误差,由PMP4010型压力传感器的量程和最大误差可计算得到,up,1=1.4 kPa;②数字万用表的仪表误差,Keithley 2002型数字万用表分辨率为八位半,up,2= 0.002 kPa。则总的压力测量不确定度为

1.2.3 组分测量不确定度 组分测量不确定度由 2部分组成:①气相色谱仪 GC1690的测量精度为0.3%,故ux,1= 0.003;②组分测量可重复性误差,在测量过程中,通常多次取样相互之间的误差在1%之内,故ux,2= 0.01。则总的组分测量不确定度为

1.3 实验步骤
实验步骤如下:①实验前需要先清洗系统。采用酒精清洗平衡釜,将平衡釜烘干后重新安装在实验装置上。将恒温水浴降温至10℃后,往系统中充灌制冷剂(如R152a)。打开气相循环泵和液相循环泵,使制冷剂在系统内循环,溶解吸收管路内残留的吸收剂,循环10 min后,排空系统内的制冷剂。重复用制冷剂清洗系统2次后关闭循环泵。②检测完系统气密性后,用真空泵对实验系统抽真空(较短时间)。然后打开平衡釜顶部吸收剂注液口,用玻璃进样器往平衡釜中加入适量的吸收剂,关闭注液口。③为了确保平衡釜中只有待测物质,需持续抽真空1 h左右,清除系统内的杂质气体。为使平衡釜内的杂质更易逸出,抽真空时需将恒温浴升温至60℃。④将恒温浴的温度降至10℃,向平衡釜中充灌入适量的制冷剂,关闭进气阀门。⑤依次打开气相、液相循环泵、压力传感器、启动色谱仪并设置其参数。⑥ 打开温控仪并设定到实验温度,通过计算机监控系统的温度及压力,当温度达到设定值,且温度和压力稳定时间超过0.5 h后,认为制冷剂+吸收剂体系已经达到平衡,记录下此刻的温度、压力值。⑦ 通过液相四通阀取样并作好记录。由于单次取样数据的准确性较低,故实验中对样品多次取样分析,直至前后3次相对偏差小于0.03%。计算平均值作为最终的实验结果。⑧ 调整温控仪的设定温度。⑨ 重复步骤⑥~⑧,直到测量完成该比例下的所有温度点。⑩ 改变初始充注制冷剂与吸收剂的比例,从步骤①重新进行实验。
1.4 改进后实验装置可靠性验证
为了验证该吸收制冷工质对相平衡实验装置的可靠性,本文测定了R134a+DMETrEG在303.15 K时汽液相平衡实验数据(注:实验所用的R134a为美国Honeywell公司生产,质量分数>99.99%;DMETrEG为阿拉丁公司提供,质量分数>99%),并将其与文献[21, 33]在相近温度下的实验数据进行了比较。文献结果和实验结果见表1和图2。从图2中可以看出,本文实验结果和两篇文献结果基本一致。为了更进一步通过量化来说明实验结果的可靠性,本文选择将Coronas等[21]实验数据中p-x1拟合成二次函数关系式(4)来进一步分析(其主要原因是文献[21]中所测混合物的组分范围为 0.1~0.9,而文献[33]的实验数据中所测混合物组分集中在0.63~1的范围内,这可能给拟合公式的使用范围带来局限性,影响分析结果的评判)。式(4)计算值与实验值的对比结果见表1。

图2 R134a(1)+DMETrEG(2)饱和蒸气压(T = 303.15 K)Fig. 2 Vapor pressure data of R134a(1) + DMETrEG(2) at T = 303.15 K

表1 R134a(1)+DMETrEG(2)饱和蒸气压数据Table 1 Vapor pressure data of R134a(1)+DMETrEG(2) mixtures

本文测量结果与式(4)计算结果的平均相对偏差为 2.7%,最大相对偏差为 5.8%。本装置测量所得到的实验值与文献中的数据基本吻合。这表明,采用该装置测量制冷剂+吸收剂工质对的汽液相平衡实验结果是准确可靠的。
2 实验结果与数据处理
2.1 实验样品
表2给出了本实验中采用 R152a、DMETrEG的基本信息。所有样品的纯度在实验前没有进一步提纯。

表2 实验样品参数Table 2 Parameters of experiment samples
2.2 R152a + DMETrEG相平衡实验数据
本文测得了 R152a(1)+DMETrEG(2)在温度范围293.15~353.15 K的相平衡实验数据,表3中给出了实验结果。
实验测试与数据处理时,皆忽略气相中的DMETrEG组分。这一假设成立的原因如下。
Coronas等[21]给出了 DMETrEG 在 273.15~473.15 K时的蒸气压方程

其中,蒸汽压p的单位为kPa,温度T的单位为K。方程的标准偏差小于0.08 kPa。
根据式(5),本文实验工况293.15~353.15 K下,纯DMETrEG蒸气压仅在0.02~0.67 kPa之间。而R152a的标准沸点(249.13 K)远小于DMETrEG的标准沸点(489.15 K),基于此,气相中的DMETrEG组分可忽略。Coronas等[21]和Han等[34]分析混合体系R134a+DMETrEG 和 R161+DMETrEG的相平衡特性时(R134a标准沸点247.08 K,R161标准沸点235.6 K),也有类似的结论。
2.3 实验数据处理及实验结果分析
相平衡实验数据的关联计算方法较多,主要分为状态方程法(EOS法)和活度系数法。这两种计算方法各有其优缺点。EOS法易采用对比态原理,适用于近临界区甚至临界区的计算,可在中高压的相平衡计算中取得良好的结果。但状态方程往往无法同时很好地关联气液两相。另外,EOS法在关联极性、电解质等非理想体系时精度不高。而对于活度系数法来说,尽管它能够适用于各种混合物的相平衡计算,但是难以应用于中高压体系以及含超临界组分的体系。还有一些研究学者通过混合法则(如HV混合法则[35]、WS混合法则[36]等)将状态方程与活度系数模型进行结合,得到新的混合模型——EoS/GE,并在汽液相平衡的计算中取得了良好的成效。

表3 R152a (1) + DMETrEG (2)在温度范围293.15~353.15 K内的相平衡实验数据Table 3 Experimental results of R152a (1) + DMETrEG (2) at temperature from 293.15 K to 353.15 K

Table 3(continued)
由于本文所研究的体系压力不高,故选用Wilson方程和NRTL模型对实验数据进行关联,关联结果见表3与图3、图4,NRTL模型参数见表4,Wilson模型参数见表5。

表4 R152a(1) + DMETrEG(2)体系的NRTL模型参数Table 4 Parameters of NRTL model for R152a(1)+DMETrEG(2)

表5 R152a(1) + DMETrEG(2)体系的Wilson模型参数Table 5 Parameters of Wilson model for R152a(1)+DMETrEG(2)
对于二元系统,NRTL模型可表示为如下形式


G12和G21的表达式如下

α,τ12,τ21为NRTL模型的参数。在关联计算中发现,当τ12和τ21作为温度的函数,采用以下的表达式时,能取得较好的关联结果

对于二元系统,Wilson方程可表示为如下形式

在关联计算中发现,当模型参数Λij作为温度的函数,采用以下表达式时,能取得较好的关联结果

从图3及表3可以发现,NRTL模型能够较好地关联R152a(1) + DMETrEG(2)体系的实验数据,不同温度下的压力偏差分布较为均匀。计算得到的平均压力相对偏差为 1.80%,最大压力相对偏差为3.72%。从图4及表3可以发现,Wilson模型同样能够较好地关联R152a(1) + DMETrEG(2)体系的实验数据,不同温度下的压力偏差分布较为均匀。计算得到的平均压力相对偏差为 1.83%,最大压力相对偏差为3.60%。
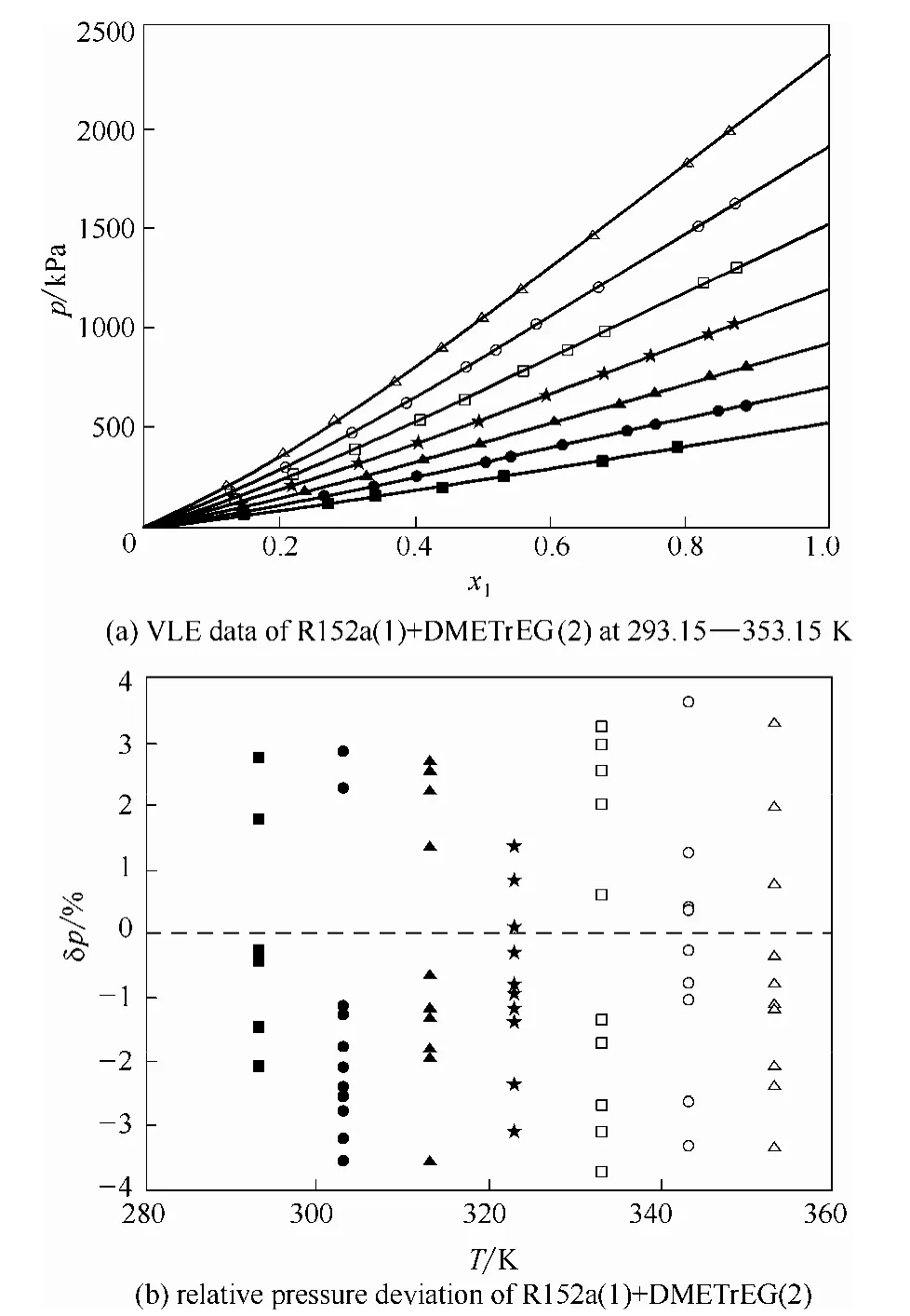
图3 R152a(1)+DMETrEG(2)体系的NRTL模型拟合结果Fig. 3 Fitting results of NRTL model for R152a(1)+DMETrEG(2)
R152a (1) + DMETrEG(2)体系在各温度时活度系数 γ1随 x1的变化关系在图5中得到了良好的展示。从图5中可以看到,R152a(1) + DMETrEG(2)体系整体相对于遵循拉乌尔定律的理想溶液呈现一个轻微的负偏差,体系的实际压力整体略微低于理想溶液在同浓度下的压力;但在制冷剂高浓度区域(x1> 0.8)时,该混合溶液与拉乌尔定律吻合,接近于理想溶液性质。这意味着当R152a组分浓度大于 0.8时,在预测计算过程中,R152a(1) +DMETrEG(2)混合溶液可以在一定允许误差范围内,视为理想溶液进行处理,此时体系中组分i在平衡气相中的分压符合Raoult定律,即pi= pisxi,其中pis表示纯组分i的饱和蒸气压。而该溶液的摩尔性质和混合过程中的性质变化都可以根据相应的纯组分性质和组成得到。
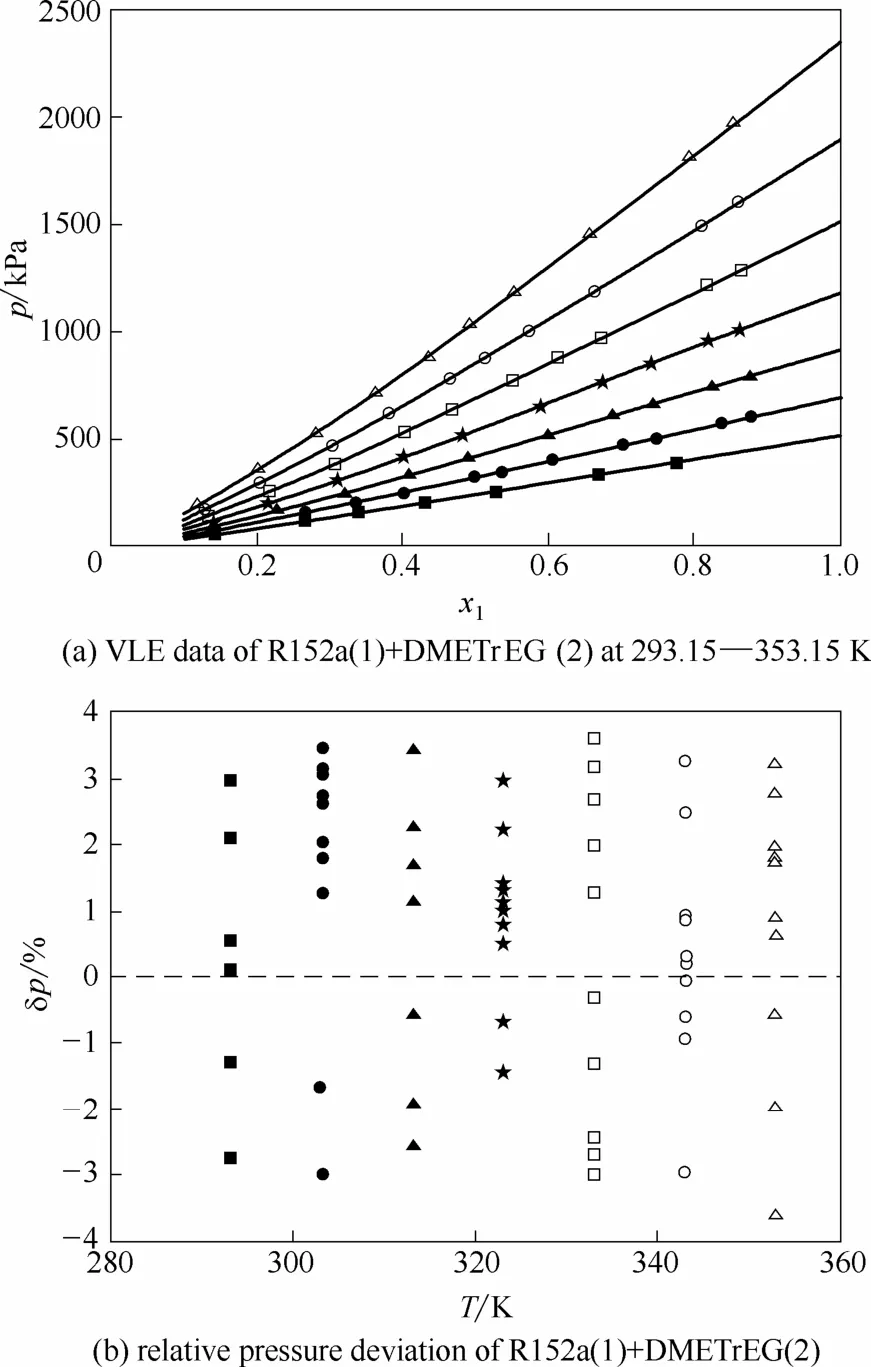
图4 R152a(1)+DMETrEG(2)体系的Wilson模型拟合结果Fig. 4 Fitting results of Wilson model for R152a(1)+DMETrEG(2)
3 结 论
(1)在原有相平衡实验装置的基础上进行改进,改善了色谱图峰形、减小了实验误差,使之适用于HFCs类吸收式制冷工质对的相平衡测量。实验装置总的温度测量不确定度为 ± 0.012 K,总的压力测量不确定度为 ± 1.4 kPa,总的组分测量不确定度为 ± 0.01。

图5 NRTL模型计算得到R152a(1) + DMETrEG(2)在各温度下γ1随x1的变化Fig. 5 Activity coefficient of R152a calculated by NRTL model in DMETrEG as a function of mole fraction at various temperatures
(2)开展了 R152a + DMETrEG 在 293.15~353.15 K温度范围内的汽液相平衡实验研究,并采用NRTL模型和Wilson模型对所测得的VLE数据进行关联。R152a + DMETrEG体系的实验值与NRTL模型计算值的平均压力相对偏差为 1.80%,最大压力相对偏差为3.72%,与Wilson模型计算值的平均压力相对偏差为 1.83%,最大压力相对偏差为 3.60%。两种模型的关联结果与实验数据都具有良好的热力学一致性,表明 NRTL模型与 Wilson模型都能够较好地预测R152a + DMETrEG这一体系在温度范围 293.15~353.15 K的汽液相平衡数据。通过观察R152a的活度系数在293.15~353.15 K温度范围内随其液相组分的变化趋势,发现该体系整体相对于遵循拉乌尔定律的理想溶液呈现一个轻微的负偏差,体系的实际压力略低于同浓度下的理想溶液的压力;但在制冷剂高浓度区域(> 0.8),该混合溶液与拉乌尔定律基本吻合,接近理想溶液性质。
符 号 说 明
A,B,G12,G21——NRTL模型参数
C,D——Wilson模型参数
p——压力
δp——压力相对偏差
T——温度
u——不确定度
v——液相摩尔体积
x——液相摩尔分数
α,τ——NRTL 模型参数
γ——活度系数
Λ——Wilson模型参数
下角标
cal ——计算值
exp ——实验值
i——组分i
NRTL——NRTL模型
p——压力
T——温度
Wilson——Wilson模型
x——液相摩尔组分
[1] ZHAI X Q, QU M, LI Y,et al.A review for research and new design options of solar absorption cooling systems[J]. Renewable and Sustainable Energy Reviews, 2011, 15(9): 4416-4423.
[2] IBARRA-BAHENA J, ROMERO R. Performance of different experimental absorber designs in absorption heat pump cycle technologies: a review[J]. Energies, 2014, 7(2): 751-766.
[3] 陈国邦, 陈光明. 制冷与低温原理[M]. 2版. 北京: 机械工业出版社, 2012: 126-238.CHEN G B, CHEN G M. Principles of Refrigeration and Cryogenics[M]. 2nd ed. Beijing: China Macine Press, 2012: 126-238.
[4] 孟学林. 热功复合驱动逆循环机理与 HFC/酰胺类工质对汽液相平衡研究[D]. 北京: 北京化工大学, 2013.MENG X L. Mechanisms of hybrid reverse cycle and vapor-liquid equilibrium of HFC/amides working pairs[D]. Beijing: Beijing University of Chemical Technology, 2013.
[5] 陈曙辉, 陈光明, 郑飞. 吸收式制冷工质的发展[J]. 制冷学报,1998, (2): 45-52.CHEN S H, CHEN G M, ZHENG F. Development of working pair in absorption refrigeration[J]. Journal of Refrigeration, 1998, (2): 45-52.
[6] 洪大良. 新型吸收式制冷循环构建理论及其应用研究[D]. 杭州:浙江大学, 2013.HONG D L. Fundamentals and applications for creating novel absorption refrigeration cycles[D]. Hangzhou: Zhejiang University,2013.
[7] 李国栋. 添加纳米颗粒的溴化锂溶液热物性及换热特性的实验研究[D]. 北京: 北京建筑工程学院, 2009.LI G D. Experimental investigation on thermophysical properties and heat transfer characteristics of LiBr solution adding nano-particles[D].Beijing: Beijing University of Civil Engineering and Architecture,2009.
[8] SARAVANAN R, MAIYA M P. Comparison of methanol-based working fluid combinations for a bubble pump-operated vapour absorption refrigerator[J]. International Journal of Energy Research,1998, 22(8): 715-731.
[9] LI M, WANG L, WANG K,et al.Experimental measurement and modeling of solubility of LiBr and LiNO3in methanol, ethanol,1-propanol, 2-propanol and 1-butanol[J]. Fluid Phase Equilibria, 2011,307(1): 104-109.
[10] GENSSLE A, STEPHAN K. Analysis of the process characteristics of an absorption heat transformer with compact heat exchangers and the mixture TFE-E181[J]. International Journal of Thermal Sciences,2000, 39(1): 30-38.
[11] NOWACZYK U S F. Thermophysical properties of new working fluid systems for absorption processes[J]. International Journal of Refrigeration, 1992, 1(15): 10-15.
[12] 李逍霄, 张敏, 李喆, 等. 吸收式动力循环工质R245fa+DMF体系汽液相平衡实验研究[J]. 工程热物理学报, 2014, (7): 1260-1264.LI X X, ZHANG M, LI Z,et al.Measurement of vapor-liquid equilibria of a potential working pair of absorption power cycle-1,1,1,3,3-pentafluoropropane+N,N-dimethyl formamide[J].Journal of Engineering Thermophysics, 2014, (7): 1260-1264.
[13] TSEREGOUNIS S I, RILEY M J. Solubility of HFC-134a refrigerant in glycol-type compounds: effects of glycol structure[J]. AIChE Journal, 1994, 40(4): 726-737.
[14] HAN X, GAO Z, XU Y,et al.Solubility of refrigerant 1,1,1,2-tetrafluoroethane in theN,N-dimethyl formamide in the temperature range from (263.15 to 363.15) K[J]. Journal of Chemical& Engineering Data, 2011, 56(5): 1821-1826.
[15] HAN X H, XU Y J, GAO Z J,et al.Vapor-liquid equilibrium study of an absorption heat transformer working fluid of (HFC-32 + DMF)[J].Journal of Chemical & Engineering Data, 2011, 56(4): 1268-1272.
[16] GAO Z, XU Y, LI P,et al.Solubility of refrigerant trifluoromethane inN,N-dimethyl formamide in the temperature range from 283.15 K to 363.15 K [J]. International Journal of Refrigeration, 2012, 35(5):1372-1376.
[17] ZEHIOUA R, COQUELET C, MENIAI A,et al. p-T-xmeasurements for some working fluids for an absorption heat transformer:1,1,1,2-tetrafluoroethane (R134a) + dimethylether diethylene glycol(DMEDEG) and dimethylether triethylene glycol (DMETrEG)[J].Journal of Chemical & Engineering Data, 2010, 55(8): 2769-2775.
[18] 李新如, 沈彦曙, 孟学林, 等. R152a-DMF体系汽液相平衡研究[J].工程热物理学报, 2013, (3): 389-392.LI X R, SHEN Y S. MENG X L,et al.Vapor-liquid equilibrium (VLE)for the system 1,1-difluoroethane-N,N-dimethylformamide[J]. Journal of Engineering Thermophysics, 2013, (3): 389-392.
[19] JING X, DENG R, ZHENG D. Measurement and correlation of isothermal vapor-liquid equilibrium of fluoroethane +N,N-dimethylacetamide, fluoroethane +N-methyl-2-pyrrolidone, and 1,1,1,2-tetrafluoroethane +N,N-dimethylacetamide systems[J].Journal of Chemical & Engineering Data, 2013, 58(11): 3289-3296.
[20] ZHANG M, ZHENG D, YANG W,et al.Measurement and correlation of isothermal vapor-liquid equilibrium of 1,1,1,3,3-pentafluoropropane +N,N-dimethylacetamide and 1,1,1,3,3,3-hexafluoropropane +N,N-dimethylacetamide/diethylene glycol dimethyl ether systems[J]. Journal of Chemical & Engineering Data, 2014, 59(11): 3912-3919.
[21] CORONAS A, MAINAR A M, PATIL K R,et al.Solubility of 1,1,1,2-tetrafluoroethane in triethylene glycol gimethyl ether[J].Journal of Chemical & Engineering Data, 2002, 47(1): 56-58.
[22] DENG R, JING X, ZHENG D,et al.Vapor-liquid equilibrium measurements and assessments of fluoroethane +N,N-dimethylformamide and fluoroethane + dimethylether diethylene glycol systems for the hybrid refrigeration cycle[J]. International Journal of Refrigeration, 2014, 43: 176-186.
[23] SHARIATI A, GUTKOWSKI K, PETERS C J. Comparison of the phase behavior of some selected binary systems with ionic liquids[J].AIChE Journal, 2005, 51(5): 1532-1540.
[24] SHIFLETT M B, YOKOZEKI A. Solubility and diffusivity of hydrofluorocarbons in room-temperature ionic liquids[J]. AIChE Journal, 2006, 52(3): 1205-1219.
[25] SHIFLETT M B, YOKOZEKI A. Phase equilibria of hydrofluorocarbon-4310mee mixtures with ionic liquids: miscibility ofthreo-anderythro-diastereomers in ionic liquids[J]. Industrial &Engineering Chemistry Research, 2008, 47(3): 926-934.
[26] REN W, SCURTO A M. Phase equilibria of imidazolium ionic liquids and the refrigerant gas, 1,1,1,2-tetrafluoroethane(R-134a)[J]. Fluid Phase Equilibria, 2009, 286(1): 1-7.
[27] DONG L, ZHENG D, SUN G,et al.Vapor-liquid equilibrium measurements of difluoromethane + [Emim]OTf, difluoromethane +[Bmim]OTf, difluoroethane + [Emim]OTf, and difluoroethane +[Bmim]OTf systems[J]. Journal of Chemical & Engineering Data,2011, 56(9): 3663-3668.
[28] LIU X, HE M, LV N,et al.Vapor-liquid equilibrium of three hydrofluorocarbons with [HMIM][Tf2N][J]. Journal of Chemical &Engineering Data, 2015, 60(5): 1354-1361.
[29] 王旭阳. R152a在微圆管内凝结流型与换热的研究[D]. 北京: 清华大学, 2012.WANG X Y. Study on condensation flow regime and heat transfer of R152a in micro-tubes[D]. Beijing: Tsinghua University, 2012.
[30] WANG Q, XU Y J, CHEN X,et al.Experimental studies on a mixture of HFC-32/125/161 as an alternative refrigerant to HCFC-22 in the presence of polyol ester[J]. Fluid Phase Equilibria, 2010, 293(1):110-116.
[31] HAN X, GAO Z, LEI J,et al.Isothermal vapor-liquid equilibrium of the ternary mixture of 1,1,1,2-tetrafluoroethane +2,3,3,3-tetrafluoroprop-1-ene + dimethyl ether at temperatures from 253.15 K to 323.15 K[J]. Journal of Chemical & Engineering Data,2015, 60(8): 2219-2225.
[32] 韩晓红. 状态方程混合法则及混合制冷剂相平衡研究[D]. 杭州:浙江大学, 2005.HAN X H. Study of mixing rules for equation of state and vapor-liquid equilibrium of mixture refrigerants[D]. Hangzhou:Zhejiang University, 2005.
[33] MARCHI P, SCALABRIN G, IHMELS E C,et al.Bubble pressure measurements for the (1,1,1,2-tetrafluoroethane+triethylene glycol dimethyl ether) system[J]. The Journal of Chemical Thermodynamics,2006, 38(11): 1247-1253.
[34] HAN X H, YANG Z Z, GAO Z J,et al.Isothermal vapor-liquid equilibrium of HFC-161 + DMETrEG within the temperature range of 293.15-353.15 K and comparison for HFC-161 combined with different absorbents[J]. Journal of Chemical & Engineering Data.2016, 61(3): 1321-1327.
[35] HURON M J, VIDAL J. New mixing rules in simple equations of state for representing vapour-liquid equilibria of strongly non-ideal mixtures[J]. Fluid Phase Equilibria, 1979, 3(4): 255-271.
[36] WONG D S H, SANDLER S I. A theoretically correct mixing rule for cubic equations of state[J]. AIChE Journal, 1992, 38(5): 671-680.
date:2017-05-02.
Prof. HAN Xiaohong, hanxh66@zju.edu.cn
supported by the National Natural Science Foundation of China(51576171, 51176166).
Vapor liquid equilibrium of absorption working pair R152a+DMETrEG
FANG Yibo, GUAN Wenjie, HUA Chao, WANG Yanzhi, HAN Xiaohong, CHEN Guangming
(Key Laboratory of Refrigeration and Cryogenic Technology of Zhejiang Province,Institute of Refrigeration and Cryogenics,Zhejiang University,Hangzhou310027,Zhejiang,China)
R152a (ODP = 0, GWP = 124) is environmentally friendly and has good thermal performance. The absorbent, triethylene glycol dimethyl ether (DMETrEG), is less toxic, has high boiling temperature and good dissolution ability for more refrigerants. Therefore, the mixture of R152a and DMETrEG is considered as a potential absorption working pair. The vapor-liquid equilibrium(VLE) of R152a+DMETrEG in the temperature range of 293.15—353.15 K was studied by gas-liquid double-cycle method. NRTL model and Wilson model were used to correlate the experimental results. The results were in good agreement with the correlated results. The average relative deviation between the calculated results and the experimental results is 1.80% for NRTL model,and the average deviation between the calculated results and the experimental results is 1.83% for Wilson model.When mole faction of R152a in the solution of R152a and DMETrEG is larger than 0.8, activity coefficient of R152a is close to 1, therefore, this solution can be considered as an ideal solution approximately.
vapor liquid equilibrium; R152a; DMETrEG; absorbent-refrigerant pair; chromatography; activity coefficient
TB 61+6
A
0438—1157(2017)11—4025—10
10.11949/j.issn.0438-1157.20170516
2017-05-02收到初稿,2017-06-05收到修改稿。
联系人:韩晓红。
方一波(1992—),男,博士研究生。
国家自然科学基金项目(51576171,51176166)。

