无机相变材料CaCl2·6H2O的过冷特性
何媚质,杨鲁伟,张振涛
(1中国科学院理化技术研究所,北京 100190;2中国科学院大学,北京 100049;3热力过程节能技术北京市重点实验室,北京 100190)
无机相变材料CaCl2·6H2O的过冷特性
何媚质1,2,杨鲁伟1,3,张振涛1,3
(1中国科学院理化技术研究所,北京 100190;2中国科学院大学,北京 100049;3热力过程节能技术北京市重点实验室,北京 100190)
CaCl2·6H2O作为一种常见的常温无机水合盐相变材料,由于成本低、易获取、蓄热强而受到广泛的关注。按无水CaCl2与H2O的质量比为1.027:1制备了CaCl2·6H2O,经X射线衍射(XRD)表征其晶体结构;通过添加成核剂SrCl2·6H2O和Ba(OH)2对CaCl2·6H2O改性,发现两者的联合作用可抑制过冷,10次熔化-冷却循环平均过冷度1.07℃。采用差示扫描量热仪(DSC)测定CaCl2·6H2O添加成核剂前后相变潜热,发现潜热由223.54 J·g-1降至160.41 J·g-1;为了扩大CaCl2·6H2O相变温度的范围,通过添加质量分数分别为5%、10%、15%、20%和25%的MgCl2·6H2O,发现相变温度随MgCl2·6H2O质量分数的升高呈线性降低,但不宜超过20%;选取CaCl2·6H2O-20%MgCl2·6H2O二元共晶盐相变储热体系为改性目标,通过添加1% SrCl2·6H2O和0.5% CMC,过冷度降至0.57℃,相变潜热为 141.09 J·g-1,低于单独组成盐 CaCl2·6H2O 的潜热 223.54 J·g-1和 MgCl2·6H2O 的潜热 163.35 J·g-1。研究表明,CaCl2·6H2O作为无机相变材料具有显著的应用价值。
CaCl2·6H2O;相变;制备;过冷;成核;潜热;MgCl2·6H2O;二元共晶盐
引 言
热能储存体系为当今世界的能源问题提供了行之有效的解决办法,相变材料作为潜热储存媒介用于热能储存体系[1]。由于潜热储存量大,相变材料不仅能满足能量需求,还能根据需求随时随地释放能量[2]。目前潜热储存技术广泛应用于各个领域,包括太阳能利用[3-6]、住宅建筑物[7-9]、温室[10]、空调系统[11-12]、制冷[13]、电子业[14]、纺织业[15-16]等。
相变材料(phase change materials, PCMs)根据物质的属性可以分为有机相变材料、无机相变材料或共晶体相变材料[17]。对于无机相变材料,常见的为无机水合盐,无机水合盐不仅蓄热能力强、近似等温相变,且不可燃,因此相比于易燃的有机相变材料,在热能储存应用中具有更强的适用性和安全性[18]。
CaCl2·6H2O 作为常见的无机水合盐相变材料之一,其理论熔点为29.92℃,由于成本低、易获取、蓄热强而受到研究者们的青睐,然而过冷和相分离是限制无机水合盐相变材料广泛应用的两大因素[19]。早期,Lane[20]就报道了SrCl2·6H2O能作为CaCl2·6H2O 相变体系的有效成核剂而抑制过冷;Bilen等[21]在CaCl2·6H2O相变体系中添加3%(质量)KNO3作成核剂,发现相变性能有明显提高;Li等[22]制备了 CaCl2·6H2O/SrCl2·6H2O/EGO 复合相变储热体系,通过添加1.0%(质量) EGO,可将过冷度降至1℃以下,且材料具有良好的循环稳定性;Tyaji等[23]研究了pH对CaCl2·6H2O过冷的影响,发现通过调节体系的pH可以降低甚至消除过冷;Tyaji等[24]为了测试CaCl2·6H2O作为相变材料的热循环稳定性,进行了1000次连续熔化-冷却实验后,发现其相变温度和熔化潜热变化范围小,有希望在建筑储能体系中发挥作用。
虽然相变材料 CaCl2·6H2O 抑制过冷的研究日益成熟,但有关成核剂联合作用抑制过冷的报道却相对较少,本研究选取报道较多的SrCl2·6H2O为成核剂之一,联合加入Ba(OH)2,对CaCl2·6H2O相变材料进行改性,通过熔化-冷却循环实验,观察结晶过程,记录步冷曲线,分析过冷度变化,而成核剂的加入会因为影响相变材料有效成分而降低相变潜热值,因此采用差示扫描量热仪测定添加成核剂前后CaCl2·6H2O的DSC曲线,分析相变潜热变化。
CaCl2·6H2O的理论熔点为 29.92℃,为了扩大其在室温范围内的应用空间,根据文献[18],CaCl2·6H2O和MgCl2·6H2O形成的二元共晶盐相变储热体系能实现相变温度的调节。本研究具体分析了MgCl2·6H2O质量分数对相变温度的影响,并对CaCl2·6H2O-20% MgCl2·6H2O 二元共晶盐相变材料进行了改性研究,分析了二元共晶盐相变潜热相比于单独组成盐相变潜热的变化。
1 实验材料和方法
1.1 材料
无水CaCl2(AR,国药集团化学试剂有限公司,中国)、MgCl2·6H2O(AR,国药集团化学试剂有限公司,中国)、SrCl2·6H2O(AR,国药集团化学试剂有限公司,中国)、Ba(OH)2(AR,天津市致远化学试剂有限公司,中国)、硼砂 Na2B4O7·10H2O(AR,国药集团化学试剂有限公司,中国)、去离子水、羧甲基纤维素钠CMC(CP,800~1200 mPa·s,上海源叶生物科技有限公司,中国)。
1.2 仪器
X射线衍射仪(D8 focus,Bruker公司,德国)、差示扫描量热仪(DSC1,Mettler Toledo公司,瑞士)、恒温冷却槽(CC-K6 with Pilot ONE,Huber 公司,德国)、电子天平(FA2104N,上海菁海仪器有限公司,中国)、夹套结晶器、研钵、量筒、烧杯、药勺、玻璃棒。
1.3 制备与分析
1.3.1 CaCl2·6H2O 的制备与表征 用研钵将无水CaCl2研磨成粉末,按无水CaCl2与H2O的质量比为 1.027:1进行取样,将去离子水倒入烧杯中,分量加入无水CaCl2并搅拌,溶解过程放热,根据表1所示无水CaCl2的溶解度,放热有助于无水CaCl2的溶解,溶解完全后,取少量样品待测XRD,当熔体在室温下降至35℃后,转移至20℃冷浴下冷却,观察结晶过程,记录步冷曲线。
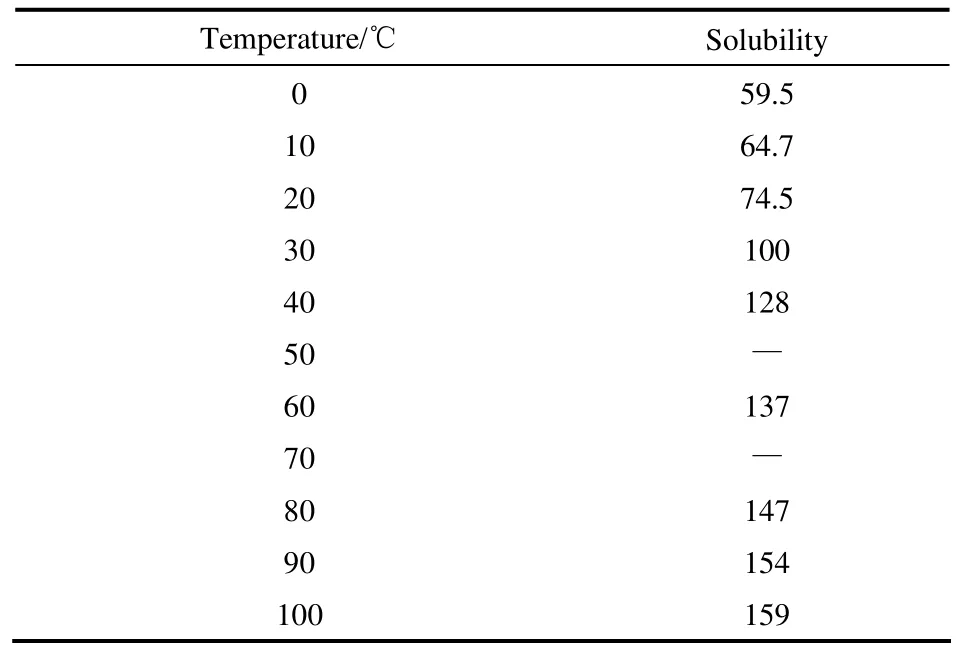
表1 无水CaCl2溶解度Table 1 Solubility of anhydrous calcium chloride
1.3.2 CaCl2·6H2O的改性 将研磨的无水CaCl2与H2O按质量比1.027:1进行取样,将去离子水倒入烧杯中,分量加入无水CaCl2并搅拌至溶解完全后,取少量样品待测XRD和DSC,加入称取的成核剂1.5%(质量) SrCl2·6H2O 和 1.5%(质量) Ba(OH)2并搅拌后,取少量样品待测DSC。当熔体在室温下降至35℃后,转移至20℃冷浴下冷却,观察结晶过程,记录步冷曲线,熔化-冷却过程循环10次后,取少量样品待测XRD。冷却实验装置如图1所示。

图1 冷却实验装置Fig.1 Setup of cooling experiment
1.3.3 CaCl2·6H2O-MgCl2·6H2O 二元共晶盐相变储热体系制备与改性 将研磨的无水CaCl2与H2O按质量比1.027:1进行取样,MgCl2·6H2O按质量分数分别为5%、10%、15%、20%和25%取样,将称取的 MgCl2·6H2O 溶于去离子水中,分量加入无水CaCl2并搅拌至溶解完全,熔体在室温下降至35℃后,转移至18℃冷浴下冷却,观察结晶过程,记录步冷曲线。
将CaCl2·6H2O-20% MgCl2·6H2O相变储热体系分别加入1%(质量)硼砂和1%(质量) SrCl2·6H2O改性,观察结晶过程,记录步冷曲线。改变 1%SrCl2·6H2O 添加顺序,先于 MgCl2·6H2O 加入去离子水中,观察结晶过程,记录步冷曲线。同时加入1%(质量) SrCl2·6H2O 和 0.5%(质量) CMC 改性,观察结晶过程,记录步冷曲线。
分 别 取 样 MgCl2·6H2O 和 CaCl2·6H2O-20%MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC,测定 DSC曲线,分析二元共晶盐相变潜热相比于单独组成盐相变潜热的变化。
2 实验结果与讨论
2.1 CaCl2·6H2O 的表征
通过X射线衍射仪对制备的CaCl2·6H2O晶体结构进行表征,XRD谱图见图2。从图2中可以发现样品的特征峰位与标准谱图特征峰位一致,表明制备的样品为CaCl2·6H2O。由于本研究采用质量配比法制备CaCl2·6H2O,相比于重结晶法,将降低此次研究的成本,因为通过重结晶法制备CaCl2·6H2O,总有一部分无水 CaCl2溶解在母液中而造成浪费,如果是质量配比法,则无水CaCl2和水都能转化为CaCl2·6H2O。可能由于无水CaCl2能完全溶于去离子水中,初次熔化-冷却过程无相分离,而多次循环实验相分离问题有待进一步研究。CaCl2·6H2O步冷曲线如图3所示,可发现冷却过程过冷现象严重,没有发生相变,主要由于溶液澄清,无有效晶核产生。
2.2 成核剂对CaCl2·6H2O过冷的影响

图2 制备的CaCl2·6H2O XRD谱图Fig.2 XRD patterns of CaCl2·6H2O prepared

图3 CaCl2·6H2O步冷曲线Fig.3 Cooling curve of CaCl2·6H2O prepared
由于CaCl2·6H2O本身成核性能较差,如果发生均相成核,过冷度很大,这使得CaCl2·6H2O相变材料的潜热不能得到有效及时的释放。根据文献[25],非均相成核方法众多,包括冷指法、添加成核剂法、超声波成核法、弹性势能法和搅拌法等。这些方法都是为了降低相变材料的过冷度,使潜热得到有效及时的释放,延长相变材料使用周期。本研究采取添加成核剂法,选取 SrCl2·6H2O和Ba(OH)2作为防过冷剂,为提高数据信服度,熔化-冷却过程循环10次。

图4 加入成核剂的CaCl2·6H2O循环10次步冷曲线Fig.4 Cooling curves of CaCl2·6H2O prepared with nucleating agents for 10 cycles

图5 加入成核剂的CaCl2·6H2O循环10次相变温度变化Fig.5 Variations of phase change temperature of CaCl2·6H2O prepared with nucleating agents for 10 cycles

表2 加入成核剂的CaCl2·6H2O循环10次冷却相变特性Table 2 Cooling phase change characteristics of CaCl2·6H2O prepared with nucleating agents for 10 cycles
初始温度、冷浴温度、终了温度、冷浴时间、理论熔点、相变温度、过冷度如表2所示,循环10次步冷曲线如图4所示,相变温度变化如图5所示。从表2可以看出10次循环实验条件一致,初始温度保持在35.00℃,冷浴温度保持在20.00℃,终了温度范围为 20.25~20.84℃,冷浴时间范围为 207~236 min,相变温度范围为28.26~29.05℃,接近理论熔点29.92℃,过冷度范围为0.87~1.66℃,平均过冷度为 1.07℃,说明成核剂 SrCl2·6H2O 和Ba(OH)2联合作用能有效地抑制过冷,使相变材料CaCl2·6H2O有效及时地释放潜热。根据文献[25],在结晶过程中,必须形成晶核并且不断生长,过程才能继续。均相成核指的是在没有外部固态表面的帮助下,晶核的形成分散在整个液体表面,且以过冷度作为结晶驱动力,因此过冷度必须大。非均相成核是指在外部固体,例如在其他物质的晶粒、杂质颗粒,或者是在容器和换热器的凸点等的表面形成晶核,非均相成核要求的过冷度非常小。本研究选择非均相成核中的添加成核剂法解决过冷问题,成核剂 SrCl2·6H2O 和 Ba(OH)2之间不发生化学反应,属于物理协同作用,防过冷效果是可以叠加的。从图4可以看出循环10次的步冷曲线具有重叠性,说明实验具有复现性,数据具有信服度,10条重叠的步冷曲线在29℃附近有一拐点,在1500 s附近有一小凹槽,通过观察冷却结晶实验现象,熔体在拐点处已发生液-固相变,从容器壁面能看到明显的白色结晶体,小凹槽说明熔体先小幅降温后再升温,小幅降温跟熔体温度与冷浴温度温差较大有关,而随着相变的进行,热量的释放,熔体温度逐渐升高至29℃附近,所以认为相变温度在29℃左右,有待增加熔化-冷却循环实验次数以进一步确认此变化趋势。从图5可以直观地看出循环10次相变温度变化波动小,通过计算,相变温度的平均值为 28.85℃,标准差为0.22℃。
循环前和循环后样品XRD谱图如图6所示,从图6中可以发现循环前和循环后样品的特征峰位与标准谱图特征峰位一致,表明相变材料CaCl2·6H2O的晶体结构没有发生变化,具有良好的热循环稳定性。

图6 CaCl2·6H2O循环前后XRD谱图比较Fig.6 Comparison of XRD patterns of CaCl2·6H2O before and after cycling
相变材料CaCl2·6H2O添加成核剂前后DSC熔化曲线如图7所示,以图中曲线与水平基线所包含的面积积分得到熔化过程相变潜热分别为 223.54 J·g-1和 160.41 J·g-1,说明成核剂的添加确实会降低相变材料相变潜热,但潜热值仍然较大,具有实际应用价值。
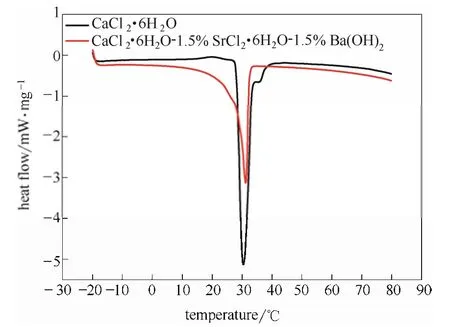
图7 CaCl2·6H2O添加成核剂前后DSC熔化曲线Fig.7 DSC melting curves of CaCl2·6H2O before and after adding nucleating agents
2.3 不同配比 CaCl2·6H2O-MgCl2·6H2O 二元共晶盐相变储热体系
2.3.1 不同质量分数MgCl2·6H2O对CaCl2·6H2O相变温度的影响 纯 CaCl2·6H2O 相变材料理论熔点为29.92℃,通过2.2节可知CaCl2·6H2O循环10次相变温度平均值为 28.85℃,为了扩大 CaCl2·6H2O相变温度范围,以适应不同应用需求,在CaCl2·6H2O中添加质量分数分别为5%、10%、15%、20%和25%的MgCl2·6H2O,制备二元共晶盐相变储热体系。

图8 CaCl2·6H2O-(5%、10%、15%、20%、25%)MgCl2·6H2O 步冷曲线Fig.8 Cooling curves of CaCl2·6H2O-(5%, 10%, 15%, 20%,25%) MgCl2·6H2O

表3 CaCl2·6H2O-(5%、10%、15%、20%、25%) MgCl2·6H2O冷却相变特性Table 3 Cooling phase change characteristics of CaCl2·6H2O-(5%, 10%, 15%, 20%, 25%) MgCl2·6H2O

图9 MgCl2·6H2O质量分数对CaCl2·6H2O相变温度的影响Fig.9 Influence of mass fraction of MgCl2·6H2O on phase change temperature of CaCl2·6H2O
初始温度、冷浴温度、终了温度、冷浴时间、相变温度、过冷度如表3所示,步冷曲线如图8所示,MgCl2·6H2O质量分数对CaCl2·6H2O相变温度的影响如图9所示。从表3可以看出5次实验条件一致,初始温度保持在35.00℃,冷浴温度保持在18.00℃,终了温度范围为18.47~19.54℃,冷浴时间范围为165~225 min,相变温度范围为23.20~27.41℃,表明随MgCl2·6H2O质量分数增加,相变温度呈下降趋势,即MgCl2·6H2O的添加能有效地调节CaCl2·6H2O的相变温度,过冷度范围为1.20~7.68℃。从图8可以直观地看出相变温度随MgCl2·6H2O 质量分数增加逐渐降低,但过冷现象明显,应采取相应措施降低过冷度。从图9可以看出,添加0%、5%、10%、15%、20% MgCl2·6H2O样品的相变温度与MgCl2·6H2O质量分数之间具有一定的线性关系,而添加20% MgCl2·6H2O样品和25% MgCl2·6H2O样品的相变温度接近,从添加25%MgCl2·6H2O 样品的结晶实验中也发现,过量的MgCl2·6H2O沉降至容器底部,说明MgCl2·6H2O的添加量应控制在20%以下为佳。取添加0%、5%、10%、15%、20% MgCl2·6H2O样品的相变温度与对应的MgCl2·6H2O质量分数作图,如图10所示,拟合曲线为

相关系数R2为0.9953,接近1,表明实验数据和拟合曲线具有很好的相关性。
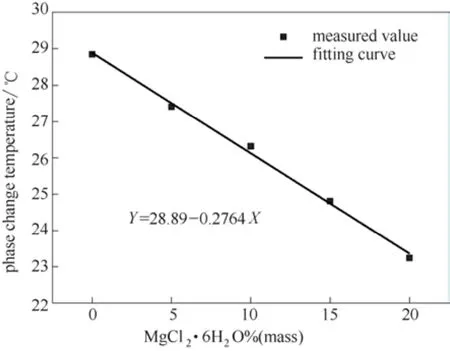
图10 CaCl2·6H2O-(0%、5%、10%、15%、20%) MgCl2·6H2O相变温度与MgCl2·6H2O质量分数的关系Fig.10 Relationship between phase change temperature of CaCl2·6H2O-(0%, 5%, 10%, 15%, 20%) MgCl2·6H2O and mass fraction of MgCl2·6H2O
2.3.2 不同成核剂对 CaCl2·6H2O-20% MgCl2·6H2O过冷的影响 取CaCl2·6H2O-20% MgCl2·6H2O为改性样品,通过分别添加成核剂硼砂和SrCl2·6H2O比较成核性能,添加 1%硼砂的记为样品 1,添加1%SrCl2·6H2O的记为样品2。从表4可以看出添加1%硼砂的 CaCl2·6H2O-20% MgCl2·6H2O 过冷度为3.40℃,而添加 1% SrCl2·6H2O 的 CaCl2·6H2O-20%MgCl2·6H2O 过冷度为 0.91℃,说明在此实验条件下 SrCl2·6H2O 的成核性能优于硼砂。根据文献[26-27],如果相变材料与成核剂之间的晶格参数之差小于15%,此成核剂为有效成核剂的可能性大。从结构上看,SrCl2·6H2O带有6个结晶水,而硼砂带有10个结晶水,且CaCl2·6H2O、SrCl2·6H2O 和MgCl2·6H2O都属于六水合氯化盐,元素Ca、Sr和Mg属于同主族元素,所以SrCl2·6H2O在结构上更接近 CaCl2·6H2O 和 MgCl2·6H2O,因此能成为CaCl2·6H2O-20% MgCl2·6H2O 的有效成核剂。步冷曲线的比较见图11,初始温度保持在35℃,冷浴温度保持在18℃。

表4 改性的CaCl2·6H2O-20% MgCl2·6H2O冷却相变特性Table 4 Cooling phase change characteristics of CaCl2·6H2O-20% MgCl2·6H2O modified

图11 不同成核剂对CaCl2·6H2O-20% MgCl2·6H2O过冷的影响Fig.11 Influence of different nucleating agents on supercooling degree of CaCl2·6H2O-20% MgCl2·6H2O
2.3.3 成核剂 SrCl2·6H2O 添加顺序对 CaCl2·6H2O-20% MgCl2·6H2O 过冷的影响 样品 3为 1%SrCl2·6H2O先于MgCl2·6H2O添加,从表4可以看出如果1% SrCl2·6H2O先于MgCl2·6H2O添加,过冷度高达6.30℃,在进行冷却实验过程中,观察到样品溶液澄清且无明显悬浮物。如果1% SrCl2·6H2O后于MgCl2·6H2O添加,观察到部分SrCl2·6H2O沉降至容器底部,过冷度为 0.91℃,说明沉降的SrCl2·6H2O有助于晶核的生成,降低了过冷度。步冷曲线的比较见图12,初始温度保持在35℃,冷浴温度保持在18℃。样品3相变温度为25.02℃,而其余3样品相变温度在23.5℃左右,这可能与其过冷度大造成相变材料放热不稳定有关。

图12 SrCl2·6H2O 添加顺序对 CaCl2·6H2O-20% MgCl2·6H2O过冷的影响Fig.12 Influence of adding order of SrCl2·6H2O on supercooling degree of CaCl2·6H2O-20% MgCl2·6H2O
2.3.4 成核剂 SrCl2·6H2O 和增稠剂 CMC 共存对CaCl2·6H2O-20% MgCl2·6H2O过冷的影响 由2.3.3节可知,起到防过冷作用的成核剂SrCl2·6H2O大部分是沉降在容器底部的,说明SrCl2·6H2O在样品溶液中的分散性不佳,主要是由于SrCl2·6H2O受到重力作用而容易发生聚沉,为了提高SrCl2·6H2O的悬浮稳定性,根据文献[28-30],可以通过添加适量增稠剂羧甲基纤维素钠CMC以增加溶液的黏度而使SrCl2·6H2O悬浮于溶液内部,促进晶核的生成,从而加快相变材料的结晶放热,样品4为同时添加1%SrCl2·6H2O和0.5% CMC,从表4可以看出如果同时添加1% SrCl2·6H2O 和 0.5% CMC,CaCl2·6H2O-20% MgCl2·6H2O 过冷度降至 0.57℃,而不加增稠剂CMC过冷度为0.91℃,说明成核剂SrCl2·6H2O 和增稠剂 CMC的共存能改善CaCl2·6H2O-20% MgCl2·6H2O 的成核性能,进一步降低过冷度。在进行冷却实验过程中也发现容器底部沉降物明显减少。步冷曲线的比较见图13,初始温度保持在35℃,冷浴温度保持在18℃。
2.3.5 二元共晶盐相变潜热与单独组成盐相变潜热的比较 CaCl2·6H2O、MgCl2·6H2O、CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC 的DSC熔化曲线如图14所示,以图中曲线与水平基线所包含的面积积分得到熔化过程相变潜热分别为223.54、163.35和141.09 J·g-1,说明二元共晶盐相变潜热低于单独组成盐CaCl2·6H2O和MgCl2·6H2O相变潜热,但仍然较大,具有实际应用价值。
3 结 论
(1)将研磨的无水 CaCl2与 H2O按质量比1.027:1进行配制,经过XRD表征晶体结构,可得到CaCl2·6H2O,相比于重结晶法,质量配比法制备相变材料CaCl2·6H2O更加经济。

图13 增稠剂 CMC 对 CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O过冷的影响Fig.13 Influence of thickener CMC on degree of supercooling of CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O

图14 CaCl2·6H2O、MgCl2·6H2O 和 CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC DSC 熔化曲线Fig. 14 DSC melting curves of CaCl2·6H2O, MgCl2·6H2O and CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC
(2)观察 CaCl2·6H2O 初次结晶过程,无相分离,根据CaCl2·6H2O步冷曲线,冷却过程没有发生相变,这将影响潜热的及时释放,为解决过冷现象,选取SrCl2·6H2O和Ba(OH)2作为成核剂进行改性,经过10次熔化-冷却循环实验,证明SrCl2·6H2O和Ba(OH)2的联合作用可抑制过冷,平均过冷度为1.07℃,测定CaCl2·6H2O添加成核剂前后DSC熔化曲线,相变潜热由 223.54 J·g-1降至 160.41 J·g-1,仍然具有实际应用价值。
(3)纯CaCl2·6H2O相变材料理论熔点为29.92℃,为了扩大CaCl2·6H2O相变温度范围,以适应不同应用需求,分别加入不同质量分数 MgCl2·6H2O形成二元共晶盐相变储热体系,根据步冷曲线,相变温度随 MgCl2·6H2O 质量分数的升高呈线性降低,但MgCl2·6H2O不宜超过20%,且存在过冷。
(4)取 CaCl2·6H2O-20% MgCl2·6H2O 为改性目标,发现SrCl2·6H2O成核性能优于硼砂,成核剂均匀悬浮于液体中有助于促进成核,通过添加增稠剂CMC能明显改善成核剂的悬浮稳定性,进一步降低过冷度,促进相变材料有效及时放热,分别测定CaCl2·6H2O、MgCl2·6H2O 和两者二元共晶盐 DSC熔化曲线,发现二元共晶盐相变潜热低于单独组成盐相变潜热,但仍然达到141.09 J·g-1,不影响实际应用。
研究表明,无机水合盐 CaCl2·6H2O 作为相变材料通过改性处理可以达到实际应用的要求。
[1] FANG G Y, CHEN Z, LI H. Synthesis and properties of microencapsulated paraffin composites with SiO2shell as thermal energy storage materials[J]. Chem. Eng. J., 2010, 163: 154-159.
[2] ŞAHAN N, PAKSOY H. Determining influences of SiO2encapsulation on thermal energy storage properties of different phase change materials[J]. Sol. Energy Mater. Sol. Cells, 2017, 159: 1-7.
[3] MAZMAN M, CABEZA L F, MEHLING H,et al. Utilization of phase change materials in solar domestic hot water systems[J]. Renew.Energy, 2009, 34: 1639-1643.
[4] XU B, LI P W, CHAN C. Application of phase change materials for thermal energy storage in concentrated solar thermal power plants: a review to recent developments[J]. Appl. Energy, 2015,160: 286-307.
[5] WANG T, MANTHA D, REDDY R G. Novel low melting point quaternary eutectic system for solar thermal energy storage[J]. Appl.Energy, 2013, 102: 1422-1429.
[6] KENISARIN M, MAHKAMOV K. Solar energy storage using phase change materials[J]. Renew. Sustain. Energy Rev., 2007, 11:1913-1965.
[7] SOARES N, COSTA J J, GASPAR A R,et al. Review of passive PCM latent heat thermal energy storage systems towards buildings’energy efficiency[J]. Energy Build., 2013, 59: 82-103.
[8] KENISARIN M, MAHKAMOV K. Passive thermal control in residential buildings using phase change materials[J]. Renew. Sustain.Energy Rev., 2016, 55: 371-398.
[9] TYAGI V V, PANDEY A K, BUDDHI D,et al. Thermal performance assessment of encapsulated PCM based thermal management system to reduce peak energy demand in buildings[J]. Energy Build, 2016,117: 44-52.
[10] BENLI H, DURMUS A. Performance analysis of a latent heat storage system with phase change material for new designed solar collectors in greenhouse heating[J]. Sol. Energy, 2009, 83: 2109-2119.
[11] WANG X L, DENNIS M. An experimental study on the formation behavior of single and binary hydrates of TBAB, TBAF and TBPB for cold storage air conditioning applications[J]. Chem. Eng. Sci.,2015, 137: 938-946.
[12] AL-ABIDI A A, MAT S B, SOPIAN K,et al. Review of thermal energy storage for air conditioning systems[J]. Renew. Sustain.Energy Rev., 2012, 16: 5802-5819.
[13] GIL A, ORO E, MIRO L,et al. Experimental analysis of hydroquinone used as phase change material (PCM) to be applied in solar cooling refrigeration[J]. Int. J. Refrig., 2014, 39: 95-103.
[14] TAN F L, TSO C P. Cooling of mobile electronic devices using phase change materials[J]. Appl. Therm. Eng., 2004, 24: 159-169.
[15] ALAY S, GODE F, ALKAN C. Synthesis and thermal properties of poly(n-butylacrylate)/n-hexadecane microcapsules using different cross-linkers and their application to textile fabrics[J]. J. Appl. Polym.Sci., 2011, 120(5): 2821-2829.
[16] SARIER N, ONDER E. Organic phase change materials and their textile applications: an overview[J]. Thermochimica Acta, 2012, 540:7-60.
[17] ŞAHAN N, FOIS M, PAKSOY H. The effects of various carbon derivative additives on the thermal properties of paraffin as a phase change material[J]. Int. J. Energy Res., 2016, 40: 198-206.
[18] LI G, ZHANG B B, LI X,et al. The preparation, characterization and modification of a new phase change material:CaCl2·6H2O-MgCl2·6H2O eutectic hydrate salt[J]. Sol. Energy Mater.Sol. Cells, 2014, 126: 51-55.
[19] DUAN Z J, ZHANG H Z, SUN L X,et al. CaCl2·6H2O/expanded graphite composite as form-stable phase change materials for thermal energy storage[J]. J. Therm. Anal. Calorim., 2014, 115: 111-117.
[20] LANE G A. Adding strontium chloride or calcium hydroxide to calcium chloride hexahydrate heat storage material[J]. Sol. Energy,1981, 1: 73-75.
[21] BILEN K, TAKGIL F, KAYGUSUZ K. Thermal energy storage behavior of CaCl2·6H2O during melting and solidification[J]. Energy Sources, Part A, 2008, 30: 775-787.
[22] LI X, ZHOU Y, NIAN H G,et al. Phase change behavior of latent heat storage media based on calcium chloride hexahydrate composites containing strontium chloride hexahydrate and oxidation expandable graphite[J]. Appl. Therm. Eng., 2016, 102: 38-44.
[23] TYAGI V V, KAUSHIK S C, PANDEY A K,et al. Experimental study of the supercooling and pH behavior of a typical phase change material for thermal energy storage[J]. Indian J. Pure Appl. Phys.,2011, 49: 117-125.
[24] TYAGI V V, BUDDHI D. Thermal cycle testing of calcium chloride hexahydrate as a possible PCM for latent heat storage[J]. Sol. Energy Mater. Sol. Cells, 2008, 92: 891-899.
[25] 张仁元. 相变材料与相变储能技术[M]. 北京: 科学出版社, 2008.ZHANG R Y. Phase Change Materials and Phase Change Energy Storage Technology[M]. Beijing: Science Press, 2008.
[26] GUNTHER E, LI H, MEHLING H,et al. Subcooling in PCM emulsions(part 2): Interpretation in terms of nucleation theory[J].Thermochimica Acta, 2011, 522: 199-204.
[27] RHAFIKI T E, KOUSKSOU T, JAMIL A,et al. Crystallization of PCMs inside an emulsion: supercooling phenomenon[J]. Sol. Energy Mater. Sol. Cells, 2011, 95: 2588-2597.
[28] CABEZA L F, SVENSSON G, HIEBLER S,et al. Thermal performance of sodium acetate trihydrate thickened with different materials as phase change energy storage material[J]. Appl. Therm.Eng., 2003, 23: 1697-1704.
[29] HU P, LU D J, FAN X Y,et al. Phase change performance of sodium acetate trihydrate with AlN nanoparticles and CMC[J]. Sol. Energy Mater. Sol. Cells, 2011, 95: 2645-2649.
[30] SHIN H K, PARK M, KIM H Y,et al. Thermal property and latent heat energy storage behavior of sodium acetate trihydrate composites containing expanded graphite and carboxymethyl cellulose for phase change materials[J]. Appl. Therm. Eng., 2015, 75: 978-983.
date:2017-04-27.
YANG Luwei, lwyang2002@mail.ipc.ac.cn
supported by the National Natural Science Foundation of China(21606244).
Supercooling characteristics of inorganic phase change material CaCl2·6H2O
HE Meizhi1,2, YANG Luwei1,3, ZHANG Zhentao1,3
(1Technical Institute of Physics and Chemistry,Chinese Academy of Sciences,Beijing100190,China;2University of Chinese Academy of Sciences,Beijing100049,China;3Beijing Key Laboratory of Thermal Science and Technology,Beijing100190,China)
As a common room temperature inorganic hydrated salt phase change material(PCM), calcium chloride hexahydrate(CaCl2·6H2O) is being widely focused due to its low cost, easy availability and high thermal energy storage. CaCl2·6H2O was prepared in terms of mass ratio of anhydrous CaCl2and H2O as 1.027:1, whose crystal structure was characterized by X-ray diffraction(XRD). CaCl2·6H2O was modified by adding nucleating agents SrCl2·6H2O and Ba(OH)2. The results showed that the combination of SrCl2·6H2O and Ba(OH)2could suppress supercooling phenomenon. The average supercooling degree was 1.07℃ in the process of melting-cooling for 10 cycles. The phase change latent heat of CaCl2·6H2O before and after adding nucleating agents, characterized by differential scanning calorimetry(DSC), decreased from 223.54 J·g-1to 160.41 J·g-1. In order to enlarge the scope of phase change temperature of CaCl2·6H2O, 5%, 10%, 15%, 20% and 25%(mass) magnesium chloride hexahydrate(MgCl2·6H2O) was added into CaCl2·6H2O respectively, which indicated the phase change temperature of CaCl2·6H2O decreased linearly with the increase of MgCl2·6H2O content, however, not exceeding 20%(mass). The modification of CaCl2·6H2O-20% MgCl2·6H2O binary eutectic salt phase change thermal energy storage material was designed by adding 1% SrCl2·6H2O and 0.5% CMC, and the results suggested that the degree of supercooling was reduced to 0.57℃. The phase change latent heat of this material was 141.09 J·g-1, which was lower than that of CaCl2·6H2O(223.54 J·g-1) and MgCl2·6H2O(163.35 J·g-1). The above study showed that inorganic hydrated salt CaCl2·6H2O had significant application value as an inorganic PCM.
CaCl2·6H2O; phase change; preparation; supercooling; nucleation; latent heat; MgCl2·6H2O; binary eutectic salt
TK 02
A
0438—1157(2017)11—4016—09
10.11949/j.issn.0438-1157.20170490
2017-04-27收到初稿,2017-07-31收到修改稿。
联系人:杨鲁伟。
何媚质(1990—),女,博士研究生。
国家自然科学基金项目(21606244)。

