蒙古羊卵巢中BMPR-IB基因的表达量与血清生殖激素水平的相关分析
武鹤松,张利平,余安妮,邓惜缘
(甘肃农业大学动物科学技术学院,兰州 730070)
遗传育种与繁殖
蒙古羊卵巢中BMPR-IB基因的表达量与血清生殖激素水平的相关分析
武鹤松,张利平,余安妮,邓惜缘
(甘肃农业大学动物科学技术学院,兰州 730070)
为研究不同季节蒙古羊卵巢中骨形态发生蛋白受体IB(bone morphogenetic protein receptor IB,BMPR-IB)基因的表达与血清中生殖激素的关联性,采用酶联免疫法测定了蒙古羊血清中促卵泡素(follicle stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)的浓度,对不同季节蒙古羊卵巢组织中BMPR-IB基因的表达量进行了实时荧光定量PCR(Real-time PCR,RT-PCR)分析。结果表明:发情季节(11月份)蒙古羊血液中FSH和LH的浓度均高于非发情季节(4月份),非发情季节蒙古羊卵巢中BMPR-IB基因的表达量极显著高于发情季节(P<0.01)。说明蒙古羊卵巢中BMPR-IB基因的表达量与血液激素水平有呈负相关的趋势。
蒙古羊;BMPR-IB基因;血清;激素
在养羊业中,绵羊的繁殖力和经济效益直接相关,然而繁殖性状受多个遗传因素与环境因素的综合影响,其中产羔数是一个低遗传力的阈性状,其遗传力只有0.1左右,难以用常规的育种方法在短时间内提高绵羊产羔数,因此研究人员从基因、蛋白等方面对绵羊进行选育,以期选育出双羔或多羔品种,且同时缩短育种年限。
BMPR-IB基因是由Davis等在Booroola美利奴羊中发现的产多羔主效基因,该基因能够在动物多个组织器官中表达,如性腺轴、脑、骨骼肌等,主要在卵巢中表达[1-3]。绵羊BMPR-IB基因发生A746G突变(FecB突变),导致第249位氨基酸由谷氨酰胺(Q)转变为精氨酸(R),进而使绵羊排卵数和产羔数显著增加[4-6]。1989年,该突变基因被绵、山羊遗传命名委员会命名为FecB基因(即 Fec=fecundity,B=Booroola),它对排卵数呈显性加性效应,在FecB三种基因型中,突变纯合型(BB)平均排卵数可增加3枚,使平均产羔数增加1.5只;突变杂合型(B+)平均排卵数可增加1.5枚,使平均产羔数增加1.0只,即BB型(突变型)>B+型(杂合型)>++型(野生型)[7]。
雌性动物的性周期和生殖活动受性腺轴激素的调控,不同繁殖时期的生殖激素分泌水平不同,而生殖激素浓度的差异影响动物的繁殖力[8]。FSH和LH都是由脑垂体嗜碱性细胞合成并释放的一种糖蛋白类激素,都能够促进卵细胞的发育、成熟和排出。FSH能够促进卵泡的颗粒细胞增生与分化,以及卵泡液分泌。LH还能促进雌激素的分泌从而引起雌性动物的正常发情[9]。有研究表明,BMPR-IB基因不同基因型Booroola母羊血液中 FSH 和 LH 含量有差异[10-11]。祁云霞等[12]研究发现,巴美肉羊血清FSH和LH浓度升高,导致产羔数增加。为了解不同时期蒙古羊卵巢中BMPR-IB基因mRNA的表达量和血液中FSH和LH的浓度变化是否存在某种相关,进一步探讨该基因的表达产物调控产羔性状的机制,本试验对不同季节蒙古羊卵巢组织BMPR-IB基因的表达量与血液中生殖激素水平的关联性进行了研究,以期为绵羊繁殖力机理的相关研究提供理论依据。
1 材料与方法
1.1 试验动物和样品采集
试验羊均为蒙古羊经产母羊,年龄均2~3岁,且未经激素处理,饲养条件和管理条件均一致。随机选取蒙古羊单、双羔母羊各3只,在发情季节(11月份)和非发情季节(4月份)分别经颈静脉采集血液5 mL,采血时间均为早上9:00—10:00。血液采集后室温斜面静置,待凝固后分离血清,存放于冰箱-20℃保存。在乏情季节随机选取蒙古羊单、双羔母羊各2只,发情季节随机选取蒙古羊单羔母羊2只、双羔母羊1只,颈静脉放血后采集卵巢组织置于液氮中,运回实验室-80℃保存。
1.2 主要试剂
总RNA提取试剂盒、反转录试剂盒及Taq DNA聚合酶均购自宝生物(大连)工程有限公司,DNA Marker和RNase-freewater由北京全式金生物(TransGen Biotech)提供,其他试剂均为国产分析纯。
1.3 总RNA的提取及cDNA的反转录
按照RNA提取试剂盒操作说明提取卵巢组织总RNA,用超微量分光光度计检测总RNA的浓度和纯度,用1%琼脂糖凝胶电泳检测A260/A280在1.8~2.0之间的RNA样品的完整性。采用大连宝生物公司Prime-Script RT Reagent Kit with gDNA Eraser试剂盒的两步法将前一步中提取的绵羊卵巢组织总RNA进行反转录,反转录产物于-20℃冰箱中保存。
1.4 引物设计与合成
参照王静[13]的方法设计BMPR-IB基因突变位点的特异性引物,引物信息见表1。使用Roche Light Cycler 480Ⅱ荧光定量PCR仪,以GAPDH作为内参基因进行RT-PCR。反应总体系为 20 μL:10 μL SYBR Premix ExTaqⅡ,7 μLddH2O,上下游引物各 0.5 μL,2 μLcDNA。反应程序:预变性 95℃ 5 min;95℃ 10 s,58℃ 10 s,72℃10 s,40个循环。对每个样品均进行4个技术重复。通过公式2-△△Ct计算BMPR-IB基因在不同组织中的表达量,采用SPSS 19.0对试验数据进行单因素方差分析。

表1 引物序列
1.5 激素检测
使用艾莱萨生物科技(上海)有限公司的FSH和LH的酶联免疫检测试剂盒测定,每个样本均进行3个重复试验。根据标准品浓度和OD值做出标准曲线,将检测样品的OD值代入标准曲线算出样品中2种激素的浓度。测定结果用Mean±SE表示,并用SPSS 19.0统计软件对数据进行方差分析和t检验。
2 结果与分析
2.1 BMPR-IB基因mRNA在蒙古羊卵巢组织中的表达
2.1.1 引物特异性及扩增产物 PCR产物通过2%的琼脂糖凝胶电泳检测,发现BMPR-IB基因引物与GAPDH基因引物所扩增的产物大小与预期一致,条带单一无杂带,可用于RT-PCR实验。
2.1.2 BMPR-IB基因mRNA的表达 BMPR-IB基因与内参GAPDH基因的扩增产物Tm值均一,熔解曲线呈单峰,无其他杂峰(见图1~4),说明荧光信号来源于特异性扩增产物。
对发情季节和非发情季节蒙古羊单、双羔母羊卵巢组织BMPR-IB基因的相对表达量分析可知,非发情季节蒙古羊卵巢中BMPR-IB基因的相对表达量极显著高于发情季节(P<0.01),非发情季节蒙古羊单羔母羊卵巢BMPR-IB基因的表达量是双羔的6倍,发情季节蒙古羊单羔母羊BMPR-IB基因的表达量是双羔的1.5倍。
2.2 蒙古羊血液中激素的检测
2.2.1 标准曲线 蒙古羊非发情季节FSH标准曲线Y=5.766X-0.388(R2=0.996),发情季节 FSH 标准曲线Y=5.997X-0.442(R2=0.997);非发情季节 LH 标准曲线Y=8.438X-0.655(R2=0.998),发情季节LH标准曲线Y=8.556X-0.688(R2=0.998)。可知4组标准曲线线性关系良好,可用于激素浓度的计算。

图1 GAPDH基因熔解曲线1

图2 蒙古羊BMPR-IB基因熔解曲线1

图3 GAPDH基因熔解曲线2
图4 蒙古羊BMPR-IB基因熔解曲线2
2.2.2 蒙古羊血液中FSH和LH的浓度 对发情季节和非发情季节蒙古羊血液中FSH和LH浓度分析可知,发情季节蒙古羊血液中以上两种激素浓度均高于非发情季节,蒙古羊双羔母羊血液中这两种激素的浓度均大于单羔母羊。其中,发情季节蒙古羊双羔母羊血液中FSH浓度极显著高于单羔母羊(P<0.01),非发情季节蒙古羊双羔母羊血液中FSH浓度也极显著高于单羔母羊(P<0.01);发情季节蒙古羊血液中LH浓度极显著高于非发情季节(P<0.01),发情季节蒙古羊单羔母羊血液中LH浓度与双羔母羊间差异不显著(P>0.05),非发情季节蒙古羊单羔母羊血液中LH浓度与双羔间差异不显著(P >0.05)。
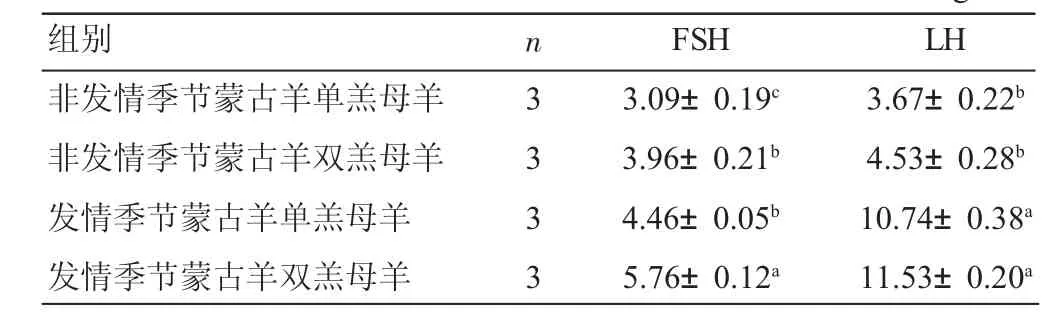
表2 不同季节蒙古羊血清FSH和LH的浓度ng/mL
3 讨论
BMPR-IB是转移生长因子β亚基(TGF-β)受体家族成员之一,作为一种重要的跨膜受体蛋白,主要参与TGF-β通路,在调控成骨分化、细胞扩散及卵巢卵泡发育等过程中起重要作用,并直接影响绵羊等动物的繁殖性状[14]。FSH和LH与雌性动物卵泡发育和排卵密切相关。各种动物血浆中LH的水平在卵泡早期比较平稳,到达中期稍有升高,于排卵前达到最高峰。LH可使卵巢上的卵泡全部破裂,但只有配合FSH时才能排出成熟卵子[9]。贺建宁等[15]发现,发情季节滩羊血液中 FSH 和LH的分泌量高于非发情季节(P<0.05);本试验与贺建宁等的研究结果一致,且发情季节和非发情季节LH的浓度均高于FSH。何小龙等[16]的研究表明,发情期蒙古羊卵巢组织中BMPR-IB基因的表达量是非发情期的2.65倍;本试验中非发情季节蒙古羊卵巢中BMPR-IB基因的表达量极显著高于发情季节(P<0.01),这与何小龙等的结果相反,可能是由于发情周期中卵巢BMPR-IB基因的表达量并不一直维持在一个较高水平,其表达产物可能在发情周期不同阶段发挥不同作用,而表达量呈现不同的变化,也可能是由于羊的个体差异产生该结果。蒙古羊属于季节性发情,且以产单羔为主,由于BMPR-IB基因的表达产物对蒙古羊发情排卵的调控机制尚不明确,产生该结果的具体原因还有待进一步研究。
4 结论
发情季节(11月份)蒙古羊血液中FSH和LH浓度均高于非发情季节(4月份)。非发情季节蒙古羊卵巢中BMPR-IB基因的相对表达量极显著高于发情季节(P<0.01)。说明蒙古羊卵巢中BMPR-IB基因的相对表达量与血液激素含量有呈负相关的趋势。
[1]Davis G H.Fecundity genes in sheep[J].Animal Reproduction Science,2004,82/83:247-253.
[2]ZhangX,Li W,Wu Y,et al.Disruption of the sheep BMPR-IB gene by CRISPR/Cas9 in in vitro-produced embryos1 [J].Theriogenology,2016,91:163-172.
[3]杨华,刘守仁,钟发刚,等.BMPR-IB基因在绵羊不同组织的表达差异性研究[J].中国畜牧杂志,2009,45(11):6-8.
[4]Souza C,Macdougall C C,Campbell B,et al.The Booroola(FecB)phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B(BMPR1B)gene[J].Journal of Endocrinology,2001,169(2):1-6.
[5]Wilson T,Wu X Y,Juengel J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6)that is expressed in both oocytes and granulosa cells[J].Biology of Reproduction,2001,64(4):1225-1235.
[6]Mulsant P,Schibler L,Monget P,et al.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merinoewes[J].Proceedings of the National Academy of Sciences,2001,98(9):5104-5109.
[7]Montgomery G W,Mcnatty K P,Davis G H.Physiology and molecular genetics of mutations that increase ovulation rate in sheep [J].Endocrine Reviews,1992,13(2):309.
[8]杨利国.动物繁殖学[M].北京:中国农业出版社,2003:30-92.
[9]王锋.动物繁殖学[M].北京:中国农业大学出版社,2012:48-53.
[10]Fleming J S,Tisdall D J,Greenwood P J,et al.Expression of the genes for alpha inhibin,beta A inhibin and follistatin in the ovaries of Booroola ewes which were homozygotes or non-carriers of the fecundity gene FecB[J].Journal of Molecular Endocrinology,1992,8(3):265.
[11]Mcnatty K P,Hudson N,Henderson K M,et al.Differences in gonadotrophin concentrations and pituitary responsiveness to GnRH between Booroola ewes which were homozygous(FF),heterozygous(F+)and non-carriers(++)of a major gene influencing their ovulation rate[J].Journal of Reproductionamp;Fertility,1987,80(2):577-588.
[12]祁云霞,何小龙,刘晓芳,等.巴美肉羊发情期血清FSH和LH浓度变化规律及其与产羔数关系分析[J].黑龙江畜牧兽医,2014(7):17-20.
[13]王静.不同产羔性状绵羊的生殖激素和BMPR-IB、GDF9及RXRG基因研究[D].兰州:甘肃农业大学,2015.
[14]潘章源,狄冉,刘秋月,等.绵羊多羔主效基因BMPR1B的研究进展[J].家畜生态学报,2015,36(5):1-6.
[15]贺建宁,王金鑫,狄冉,等.常年发情和季节性发情绵羊在不同季节生殖激素变化规律[J].畜牧兽医学报,2013,44(10):1547-1553.
[16]何小龙,刘永斌,王峰,等.骨形态发生蛋白IB型受体(BMPR-IB)基因在蒙古羊卵巢和子宫组织中的表达分析[J].畜牧与兽医,2010,42(8):6-9.
Relation between Expression of BMPR-IB Gene in the Ovarian Tissue and the Concentration of Reproductive Hormones in Serum of Mongolian Sheep
Wu Hesong,Zhang Liping,Yu Anni,et al
(College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
To explore the relation between expression of BMPR-IB gene in the ovarian tissue and the level of reproductive hormones in serum of Mongolian sheep in different season,ELISA was used to examine the concentrations of FSH and LH in serum of ewes.At the same time,Real-time PCR was used to examine the expression pattern of BMPR-IB gene in the ovarian tissue.The results showed that the concentration of FSH and LH in estrus season(November)was higher than those in anestrus season(April).In anestrus season the expression of BMPR-IB was significantly higher than that in estrus season in ovary of Mongolian ewes.
Mongolian sheep;BMPR-IB gene;serum;hormone
S826.2
A
2095-3887(2017)06-0001-04
10.3969/j.issn.2095-3887.2017.06.001
2017-09-11
甘肃农业大学校级自立项目(GSAU-ZL-2015-027);甘肃农业大学本科生科研训练项目(SRTP)
武鹤松(1995-),女,本科生。
张利平(1962-),女,教授,博士生导师,主要从事绵羊遗传育种与繁殖研究工作。

