超声-微波协同提取庐山石耳多糖条件优化及其功能活性研究
,, ,,*
(1.九江学院药学与生命科学学院,江西九江 332000; 2.九江市区域产业与城市生态重点实验室,江西九江 332000)
超声-微波协同提取庐山石耳多糖条件优化及其功能活性研究
张红芳1,吴次虎1,陈晔1,2,*
(1.九江学院药学与生命科学学院,江西九江 332000; 2.九江市区域产业与城市生态重点实验室,江西九江 332000)
为探索超声波-微波辅助提取庐山石耳多糖的工艺及其功能活性。以超声-微波协同提取方法,分别考察微波功率、超声波-微波协同提取时间、料液比对庐山石耳多糖得率的影响,在单因素实验的基础上,通过L9(33)正交实验,对庐山石耳多糖提取工艺进行优化。结果表明,庐山石耳多糖最佳提取工艺:微波功率为150 W、料液比为1∶30 (g∶mL)、超声波-微波协同提取时间为240 s,庐山石耳多糖得率为12.87%;通过测定清除DPPH·对庐山石耳多糖的体外抗氧化活性评价。结果表明,庐山石耳多糖具有较高的体外抗氧化活性,浓度为 65 μg/mL时对DPPH·的清除率为65.62%;利用MTT法分析庐山石耳多糖对HepG2细胞体外生长增殖的抑制作用,结果显示:庐山石耳多糖对HepG2细胞的抑制作用明显,庐山石耳多糖浓度在0.001~2 mg/mL范围内,对HepG2肿瘤细胞的抑制率呈现出急剧上升,当庐山石耳多糖浓度为10 mg/mL时抑制率为87.79%,IC50值为0. 6637 mg/mL。
超声-微波协同提取,庐山石耳多糖,工艺优化,抗氧化,抗肿瘤
庐山石耳(Umbilicariaesculenta)为石耳科(Umbilicariaceae)石耳属(Umbilicaria)地衣植物,又称美味石耳,是东亚特有种[1-2]。石耳即可食用又可药用,全草入药,具有清热解毒、止咳祛痰、平喘消炎等多种功能。现代医学分析,石耳营养价值极高,富含有石耳多糖、肝糖、胶质、石耳酸、铁、磷、钙及多种维生素,是一种高蛋白滋阴润肺之补品[3]。
近年来,研究表明地衣中所含的地衣多糖均具有抗肿瘤及免疫活性。地衣多糖的抗肿瘤活性是通过增强健康细胞的免疫力、抑制肿瘤细胞的病态增殖,因而克服了在化疗中健康细胞受损的严重副作用[2-3]。石耳作为一种地衣资源,在探索其多糖生物学活性基础上,对其食药用价值进行合理评价和开发利用,将具有较大的社会和经济效益[4-5]。
目前,对石耳多糖提取方法主要有索氏萃取、复合酶法辅助萃取等方法,索氏萃取石耳中多糖的提取率为4.63%~15.07%,而提取时间长[7-10],复合酶法辅助提取石耳中多糖的提取率为 1O.52%,而复合酶法提取多糖需要 1 h,需要多种酶复合[11]。而有关超声波-微波辅助萃取庐山石耳多糖工艺鲜见报道。本实验以水为溶剂,庐山石耳多糖得率为指标,采用正交实验法对超声波-微波辅助提取庐山石耳多糖工艺条件进行了优选并且进行了功能活性的研究,为庐山石耳的进一步开发利用及其多糖的生物活性研究奠定基础。
1 材料与方法
1.1材料与仪器
庐山石耳(U.esculenta) 于2015年5月采集江西庐山(采集后洗净,经干燥、粉碎、过60目筛后,备用);齐墩果酸标准品 上海如吉生物科技公司;维生素C对照品 德国巴斯夫公司;1,1-二苯基-2-三硝基苯肼[1,1-diphenyl-2-picryylhydrazyl(DPPH)]南京奥多福尼生物科技有限公司;HepG-2细胞 中国科学院生物化学研究所;Sevage试剂[氯仿(V)∶正丁醇(V)=4∶1];3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT) Sigma-Aldrich公司;RPMI 1640培养基和胰蛋白酶-EDTA 基诺生物技术公司;胎牛血清(FBS) 杭州四季青生物工程材料有限公司。葡萄糖、无水乙醇、苯酚、浓硫酸、正丁醇、30%过氧化氢、香草醛、冰醋酸、高氯酸等均为分析纯。
CW-2000 型超声-微波协同萃取仪 新拓分析仪器科技有限公司;U-3310紫外-可见分光光度计 岛津;BSA124S电子天平 赛多利斯科学仪器有限公司;TDL-40B低速台式大容量离心机 上海安亭科学仪器厂;AE31倒置生物显微镜 麦克奥迪实业集团有限公司;BioTek酶标仪 美国伯腾仪器有限公司。
1.2实验方法
1.2.1 庐山石耳多糖的提取工艺流程 称取2.00 g庐山石耳粉末,按一定的料液比加入蒸馏水,采用超声波-微波辅助的方法提取庐山石耳多糖,以4000 r/min转速离心15 min,保留上清液,再加入3倍体积的95%冰乙醇,放入冰箱过夜。次日以转速4000 r/min离心15 min,离心得到的沉淀即为庐山石耳的粗多糖,采用Sevag法除去粗多糖中的蛋白质[7]。
1.2.2 庐山石耳多糖检测方法 采用苯酚-硫酸法测定样品中的多糖。准确称取10 mg经烘干的葡萄糖,用蒸馏水溶解并定容至100 mL(浓度为100 μg/mL)。分别吸取上述溶液0、0.1、0.4、0.8、1.2、1.6 mL加入试管中,每管用蒸馏水定容至2 mL,配制成系列标准葡萄糖溶液,各管加1.0 mL 6% 苯酚溶液,再加入浓硫酸5.0 mL,静置10 min,30 ℃水浴15 min,于490 nm处测定各管OD值,得到葡萄糖含量x与吸光度y的回归方程。
将脱蛋白后的庐山石耳多糖用去离子水溶解定容至100 mL,摇匀,从中移取1 mL于10 mL容量瓶,加去离子水至刻度。取样液2.0 mL于10 mL具塞试管中,加入6% 苯酚溶液1.0 mL,再加入浓硫酸5.0 mL,按标准曲线制作相同的方法进行多糖测定,按下式计算样品中石耳多糖的得率。
式中:w为提取到的庐山石耳多糖质量/g;W为石耳质量/g。
1.2.3 单因素实验 在50 W/40 kHz超声波的条件下,固定微波功率150 W,料液比1∶20 g/mL,考察不同提取时间120、180、240、300、360、420 s对庐山石耳多糖得率的影响;固定提取时间180 s,料液比1∶20,考察不同微波功率100、150、200、250、300 W对庐山石耳多糖得率的影响;固定提取时间180 s,微波功率150 W,考察不同料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60 g/mL对庐山石耳多糖得率的影响。
1.2.4 正交实验 根据单因素实验结果,通过L9(33)正交表设计三因素三水平正交实验,从而得出庐山石耳多糖提取的最优工艺条件。因素与水平见表1。
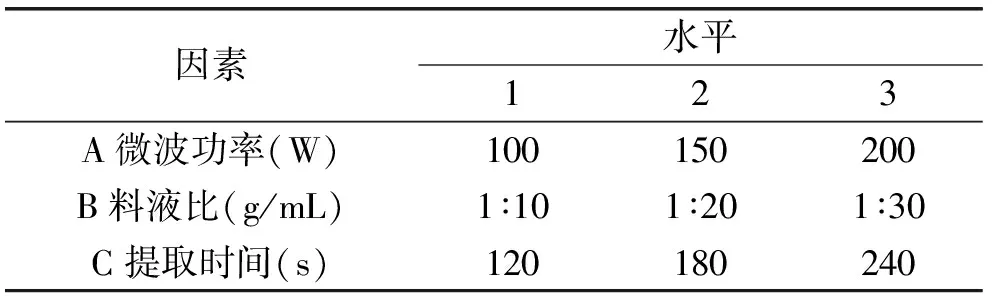
表1 正交实验因素水平Table 1 The levels and factors of orthogonal test
1.2.5 抗氧化实验 采用Mohsen法[11]对庐山石耳多糖提取物的抗氧化活性进行测定。量取样品溶液1 mL于试管中,并加入0.1 mmol/L的DPPH· 甲醇溶液3.0 mL,充分混匀,室温避光静置30 min后于517 nm处测定其吸光值;以维生素C(VC)作阳性对照。DPPH· 清除率(%)=[A对照-(A样品-A空白)]/A对照×100。
1.2.6 庐山石耳多糖抗肿瘤活性测定 利用MTT法分析庐山石耳多糖对HepG2细胞体外生长增殖的抑制作用进行测定。将庐山石耳多糖配制成:0.001、0.01、0.05、0.1、0.25、0.5、1、2、5、10的浓度(mg/mL),进行对数生长期HepG-2细胞抑制作用观察和测定,以细胞空白和溶剂空白为对照,计算不同浓度下的细胞抑制率[12]。上述实验,每个浓度设8个复孔,每组重复3次。
式中:D1为实验组吸光度;D2为细胞空白组吸光度;D0为溶剂空白组吸光度。
1.2.7 数据处理 采用Origin 7.5软件进行数据分析。
2 结果与分析
2.1单因素实验
2.1.1 微波功率对庐山石耳多糖得率的影响 由图1得知,在开启50 W/40 KHz超声波的条件下,随着微波功率的上升,庐山石耳多糖得率呈现出先增加后下降的趋势,当微波功率为150 W时,庐山石耳的多糖得率达到最大值。当微波功率为 150~300 W时,庐山石耳多糖的得率随着功率的上升而降低。当微波功率在某一范围内,微波功率的增加使得庐山石耳多糖与提取剂之间相互作用频率增加,这有利于庐山石耳多糖的浸提,但当微波功率超过某一范围时,由于机械振动过于剧烈,反而导致多糖的稳定性下降,促进多糖的分解,进而导致多糖的提取下降[13]。因此,150 W为最佳的微波功率。
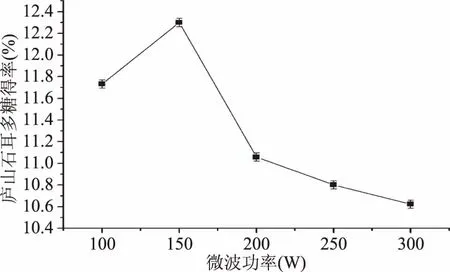
图1 微波功率对庐山石耳多糖得率的影响Fig.1 Effect of micro-wave power on the yield of Polysaccharide from U. esculenta
2.1.2 料液比对庐山石耳多糖得率的影响 由图2得知,料液比的变化对庐山石耳多糖得率的影响较大。随溶剂体积的增加,庐山石耳多糖得率增加,当料液比为1∶20 g/mL,庐山石耳多糖的得率达到最大值,当溶剂体积再增加时,庐山石耳多糖的得率相对比较稳定,这是因为溶剂增加到一定量之后,多糖大都被浸提出来,即使再增加溶剂用量,庐山石耳多糖的得率相对稳定。溶剂用量的增加会增加后续工作的工作量,不经济。因此,筛选1∶20 g/mL为最适宜的料液比。

图2 料液比对庐山石耳多糖得率的影响Fig.2 Effect of solid-liquid ratio on the yield of polysaccharides from U. esculenta
2.1.3 超声-微波协同提取时间对庐山石耳多糖得率的影响 固定微波功率和料液比等因素,考察不同提取时间对庐山石耳多糖得率的影响。由图3得知,当提取时间为180 s时,庐山石耳多糖得率达到最大值。之后,随着提取时间的递增,庐山石耳多糖的得率下降。可能是在一定的时间范围内,提取时间增加有利于多糖的浸提。但当提取时间超过某一范围时,多糖的得率降低,这可能是由于在长时间的超声细胞破碎中,多糖受到超声波机械剪切作用的影响,部分多糖结构被破坏,造成得率下降,另外长时间作用杂质溶出,这也是多糖得率下降的原因[13]。因此,180 s为最佳的提取时间。
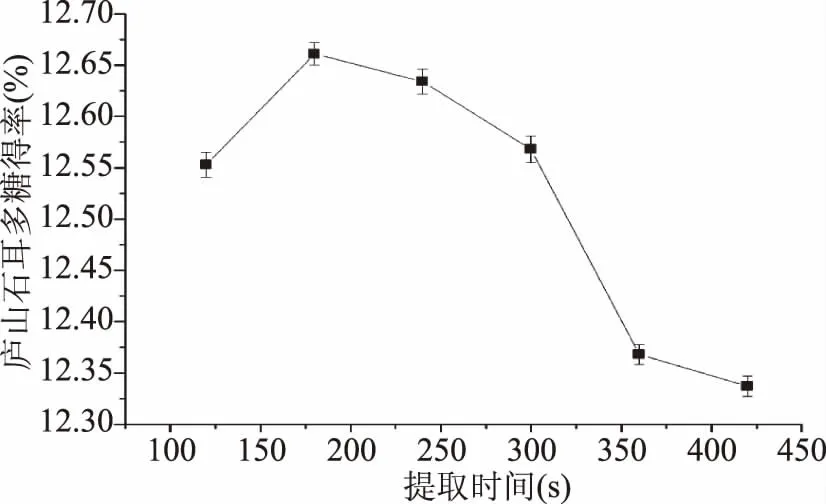
图3 超声波-微波协同提取时间对庐山石耳多糖得率的影响Fig.3 Effect of extraction time on the yield of polysaccharides from U. esculenta
2.2正交实验
在单因素实验结果的基础上,采用L9(33)正交实验对庐山石耳多糖超声波-微波协同提取工艺进行优化,正交实验结果和极差分析结果见表2、表3。
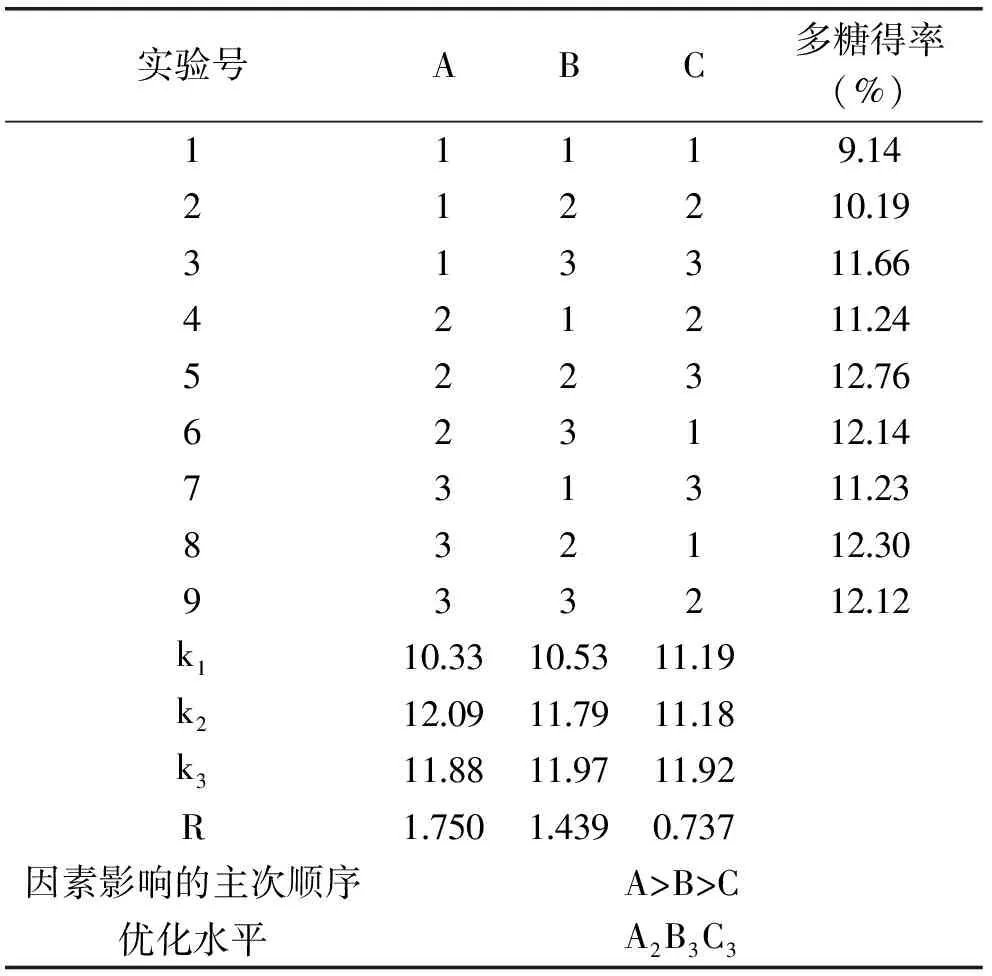
表2 正交实验结果Table 2 The result of orthogonal test
由表2的极差分析与庐山石耳多糖得率的关系结果可知,在实验范围内,各因素对庐山石耳多糖得率的影响为微波功率>料液比>提取时间。各因素对庐山石耳多糖提取效果影响的方差分析结果见表3。根据F值可知,对庐山石耳多糖得率影响因素从大到小依次为微波功率>料液比>提取时间,与极差分析结果一致,因此,通过正交实验可以优选出庐山石耳多糖的最适宜提取工艺条件为正交优化条件为A2B3C3,即超声波-微波辅助提取庐山石耳多糖的最佳工艺参数为:微波功率150 W,提取时间240 s,料液比1∶30 (g∶mL)。按正交实验得到的最佳工艺参数进行3次重复验证性实验,得到庐山石耳多糖得率分别为12.87%、12.84%、12.91%,平均值为12.87%±0.03%。结果表明,在上述工艺条件下庐山石耳多糖得率相对比较稳定,达到了优化的目的。
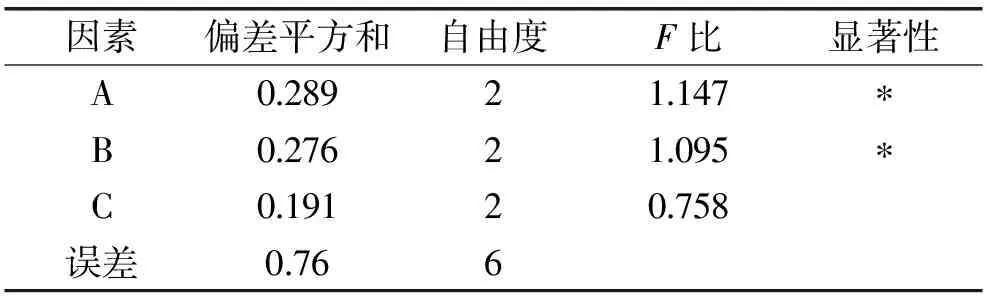
表3 方差分析Table 3 Variance analysis
2.3庐山石耳多糖的功能活性
2.3.1 庐山石耳多糖的抗氧化活性 由图4可知,庐山石耳多糖浓度在10.0~65 μg/mL的浓度范围内,随着庐山石耳多糖浓度的增大而对DPPH· 清除率增强,当庐山石耳多糖浓度为65 μg/mL时,清除率达最大值为65.62%,之后随庐山石耳多糖浓度增加,对DPPH· 清除效果基本稳定。从图5中可知,维生素C在浓度为 9 μg/mL的条件下即可对DPPH·表现出很强的清除能力,维生素C浓度在16~18 μg/mL范围清除率随维生素C浓度的增加清除率下降。总之,庐山石耳多糖具有较强的抗氧化能力,但其对DPPH· 清除效果要小于维生素C作用效果,这可能是提取石耳多糖为粗多糖含有较多其它化合物,从而影响对DPPH· 的清除效果。
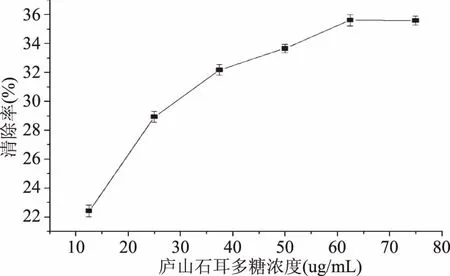
图4 庐山石耳多糖对DPPH·的清除效果Fig.4 DPPH·scavenging activity of polysaccharides of U.esculenta
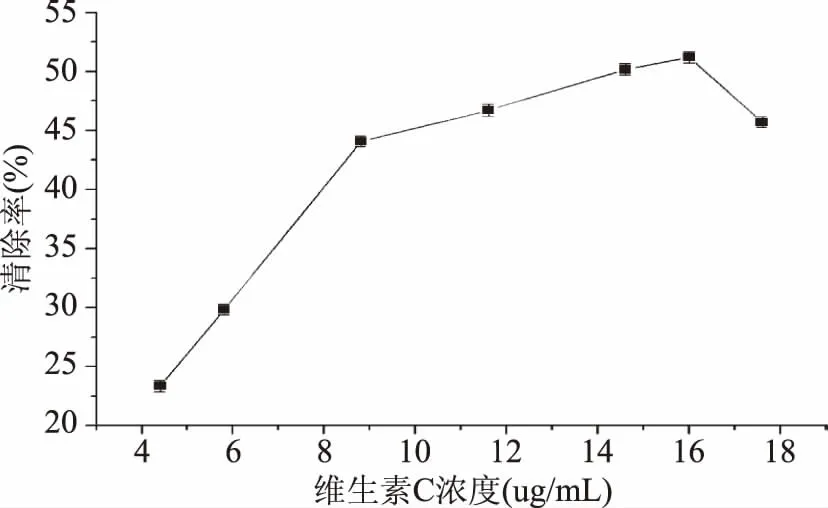
图5 维生素C对DPPH·的清除效果Fig.5 DPPH·scavenging activity of VC
2.3.2 庐山石耳多糖抑制肿瘤细胞增殖 利用MTT法分析庐山石耳中多糖对Hep G2细胞体外生长增殖的抑制作用,结果显示:庐山石耳中粗多糖对Hep G2细胞体外增殖抑制作用明显。由图6可知,石耳多糖浓度为 0.001 mg/mL时,对7.54%的肿瘤细胞有抑制能力,随着石耳多糖浓度的上升,肿瘤细胞的存活率迅速下降,计算IC50值为0. 6637 mg/mL,当浓度为10 mg/mL时,对肿瘤细胞的抑制率达到87.79%。王慧等利用MTT法分析黑石耳、红石耳等2种石耳多糖对Hep G2细胞体外生长增殖的抑制作用,结果显示:黑石耳粗多糖浓度为10 μg/mL对Hep G2细胞的抑制作用为8. 11%(IC50=0. 2567 mg/mL),而红石耳粗多糖浓度为10 μg/mL对Hep G2 细胞没有抑制作用,只有高浓度的条件下才有抑制作用[14]。可见,庐山石耳多糖对肿瘤细胞有较强抑制作用。

图6 庐山石耳多糖对HepG-2细胞抑制率的影响Fig.6 HepG-2control rate of polysaccharides of U. esculenta
3 结论
通过正交实验优化超声-微波辅助提取庐山石耳多糖的工艺,最佳提取工艺为:微波功率为150 W、料液比为1∶30 (g∶mL)、超声波-微波协同提取时间为240 s。庐山石耳多糖得率为12.87%。王卫东[8]等对石耳多糖的热水浸提工艺进行了研究,结果为提取温度80 ℃,提取时间4 h,料液比1∶10 (g∶mL),在此工艺条件下,水溶性石耳多糖的得率为4.63%。古丽扎尔·阿布都克依木等[9]从网脊石耳(U.decussate)和淡肤根石耳(U.virginis)提取了多糖,经蒽酮-硫酸显色,波长615 nm处测定其多糖含量分别为网脊石耳为13.71%,淡肤根石耳为11.52%,并对淡肤根石耳多糖类成分提取工艺进行了研究,得出最佳提取工艺为:乙醇浓度95%,提取温度80 ℃,料液比1∶20 (g∶mL),提取时间3.0 h,在最佳条件下多糖的得率为 15.07%[10],虽然该方法提取多糖得率较高,但提取时间长。可见,本实验采用超声-微波辅助提取多糖具有提取时间短、简便、稳定、重复性好、得率较高等特点。为今后庐山石耳多糖成分研究提供有用的参考价值。
石耳多糖是一类具有抗衰老、抗肿瘤、降血糖、抗凝血及免疫促进等生物活性作用的生物大分子,关于石耳多糖活性的研究已成为热点。王慧等对红石耳不同溶剂提取物的抗氧化活性及其粗多糖的抗肿瘤活性进行了评估,结果显示:红石耳不同溶剂提取物具有很好抗氧化活性和抗肿瘤活性[12];姚玉飞等对黄山石耳多糖的提取及其抗氧化性研究表明,黄山石耳多糖具有较高的体外抗氧化活性[14];丁东宁等对黑石耳多糖对羟自由基的消除作用发现黑石耳多糖具有较好抗氧化作用[15]。本实验初步证实庐山石耳中石耳多糖具有较强抗氧化和抗肿瘤活性,但其抗肿瘤作用的具体机制尚无定论,有关免疫活性的机理也需进一步的探索。
[1]刘瑜琦,陈晔. 庐山石耳利用价值及其保护探讨[J]. 九江学院学报:自然科学版,2005(3):42-43.
[2]崔桂友,段海. 中国食用地衣种类的研究[J]. 江苏农业研究,2000,21(3):59-62.
[3]邱澄,丁怡. 石耳化学成分的研究[J]. 中国中药杂志,2001,26(9):608-610.
[4]Shibata S,Nishikawa Y,Takeda T. Polysaccharides of lichens and fungi Ⅰ. Antitumour active polysaccharide of Gyrophara esculenta Miyoshi and Lasallia papulosa(Ach.)[J]. Chem Pharm Bull,1968,1(6):2362.
[5]Nishikawa Y,Tanaka M,Shibata S,et al. Polysaccharides of lichens and fungi. Ⅳ. Antitumour active O-acetylated pustulan-type glucans from the lichens ofUmbilicariaspecies[J]. Chem Pharm Bull,1970,18(7):1431.
[6]Kunio T,Tadahiro T,Shoji S. Antitumour active polysaccharides of lichens of Stictacea[J]. Chem Pharm Bull,1974,22(2):404-408.
[7]王慧. 4种地衣多糖的分离纯化及生物活性研究[D]. 西安,西北大学,2014.
[8]王卫东,王红云,杨莉,等.石耳多糖的提取工艺研究[J]. 食品科技,2010,35(4):193-195.
[9]古丽扎尔·阿布都克依木,买提哈斯木·吾布力艾山,帕孜来提·拜合提,等. 2种石耳中多糖的提取及含量测定[J]. 中国酿造,2011(7):174-176.
[10]古丽扎尔·阿布都克依木,买提哈斯木·吾布力艾山,帕孜来提·拜合提,等. 淡肤根石耳多糖的提取工艺的研究[J]. 食品科技,2011,36(10):162-165.
[11]姚玉飞,张海林,刘咏,等.黄山石耳多糖的提取及其抗氧化性研究[J].合肥工业大学学报:自然科学版,2014,37(9):1132-1137.
[12]林薇,李巧凤,陈晔,等.响应面法优化紫萁多糖提取工艺及体外抗癌活性研究[J]. 食品工业科技,2016,37(24):329-332,341.
[13]陆文娟,喻晨,王美菊,等. 响应面法优化提取干巴菌多糖的工艺研究[J]. 南京师范大学学报(工程技术版),2015,15(3):84-92.
[14]王慧,王启林,田娇,等. 4种地衣提取物抗氧化和抗肿瘤活性研究[J]. 植物科学学报,2014,32(2):181-188.
[15]丁东宁,靳菊情,边晓丽,等. 四种地衣多糖对羟自由基的消除作用[J]. 西北药学杂志,2000,15(增刊):50.
StudyonthefunctionalactivityandoptimizationofultrasonicmicrowaveassistedextractiontechnologyofpolysaccharidesfromUmbilicariaesculenta
ZHANGHong-fang1,WUCi-hu1,CHENYe1,2,*
(1.College of Life Science,JiuJiang University,Jiujiang 332000,China; 2.Jiujiang Key Laboratory of Regional Industry and Urban Ecology,Jiujiang 332000,China)
To explore the ultrasonic microwave assisted extraction technology and the functional activity of polysaccharides fromUmbilicariaesculenta. The ultrasonic microwave synergistic extraction method was used,and the effects of microwave power,extraction time and the ratio of material to liquid have been investigated on the extraction rate of polysaccharides fromU.esculenta. On the basis of single factor experiment,the extraction technology of polysaccharides fromU.esculentawas optimized by L9(33)orthogonal experiment. The results showed that the optimum extraction process of polysaccharides fromU.esculentaas follows:the micro-wave power was 150 W,the ratio of material to liquid was 1∶30 (g∶mL),and the ultrasonic micro-wave synergistic extraction time was 240 s. The extracted polysaccharides were 12.87%.Invitroantioxidant activity of polysaccharides fromU.esculentawas studied by the scavenging activities of DPPH free radical. The results showed that the polysaccharides had higher antioxidant activityinvitro,and the scavenging rate of DPPH free radical was 65.62% at the concentration of 65 μg/mL.MTT method was used to analyze the inhibitory effect of polysaccharides fromU.esculentaon proliferation of HepG2 cellsinvitro. The results showed that the inhibitory effect of polysaccharides on HepG2 cells was obvious. In the range of 0.001~2 mg/mL,the inhibition rate of HepG2 cells showed a sharp rise. As the concentration of polysaccharides was 10 mg/mL,the inhibition rate was 87.79%. And the IC50value was 0.6637 mg/mL.
ultrasonic microwave assisted extraction;polysaccharides fromU.esculenta;technology optimization;antioxidant;antitumor
2017-05-02
张红芳(1971-),女,硕士,讲师,研究方向:植物资源开发利用,E-mail:939044612@qq.com。
*
陈晔(1966-),男,博士,教授,研究方向:植物资源开发利用,E-mail:chenyejjtc@126.com。
TS201.1
B
1002-0306(2017)21-0229-05
10.13386/j.issn1002-0306.2017.21.045

