超高压提取核桃分心木总黄酮工艺及动力学模型研究
, ,*,,
(1.西南科技大学生命科学与工程学院,四川绵阳 621010; 2.盐亭县金土地农业发展有限公司,四川绵阳 621010)
超高压提取核桃分心木总黄酮工艺及动力学模型研究
何薇1,严成1,*,熊雪媛1,唐周刚2
(1.西南科技大学生命科学与工程学院,四川绵阳 621010; 2.盐亭县金土地农业发展有限公司,四川绵阳 621010)
以核桃分心木为原料,利用响应面法对常温下超高压提取核桃分心木中总黄酮的工艺条件进行优化并建立动力学模型。以乙醇体积分数、压力、保压时间、料液比为主要因素,采用Box-Behnken实验设计,研究各因素及交互作用对总黄酮提取得率的影响;同时根据Fick第一扩散定律建立超高压提取分心木总黄酮的动力学方程。结果表明,响应面优化的最佳工艺参数为:乙醇体积分数62%、压力385 MPa、保压时间9 min,料液比1∶25 (g/mL),此条件下,总黄酮的实际提取得率为12.31%,与模型预测值基本相符;动力学模型的预测值与实际值相关性良好,决定系数R2=0.9875。与传统提取方法相比,超高压提取在提高黄酮提取得率的同时能显著缩短提取时间、降低能耗。
核桃分心木,总黄酮,超高压提取,响应面分析,动力学模型
核桃分心木(walnut diaphragm)也称作胡桃夹、胡桃衣[1],具有利尿清热,安神助眠,健脾固肾,涩精等功效[2],中国是世界核桃生产大国[3],分心木资源蕴含量巨大。目前有关分心木的研究主要集中在化学成分及生物活性等方面[4-5],赵焕新等[6]利用GC/MS法测定出分心木中含有多糖、黄酮、生物碱、有机酸、甾类、皂苷等多种化学成分。其中分心木黄酮类化合物的研究日益引起人们的重视,可应用于医药、食品、化妆品行业,有望在预防和治疗肿瘤、心血管疾病等方面取得进展[7]。但有关分心木黄酮类化合物提取的研究较少,且多采用超声波法研究核桃分心木中总黄酮的提取[8-9],超声波法提取时间长,提取效率不高,主要依靠热力破坏细胞结构,易使提取过程中产生其它生化反应[10];超高压提取[11]可大大缩短提取时间、减少杂质的溶出,而且超高压提取在常温下进行,避免了因热效应引起的有效成分结构变化以及生理活性的降低[12]。本实验选用国家级优良单株核桃新品种“绵核1号”为原料,以乙醇体积分数、压力、保压时间、料液比为主要因素,研究超高压处理对分心木总黄酮提取得率的影响并建立超高压动力学模型进行佐证,为进一步研究、利用分心木黄酮类化合物提供有价值的参考。
1 材料与仪器
1.1材料与仪器
“绵核1号”核桃分心木 2016年9月采收于四川绵阳。芦丁标准品(分析纯) 北京北纳创联生物技术研究院;无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠等 均为分析纯试剂。
电热恒温干燥箱 上海三发科学仪器有限公司;多功能粉碎机 浙江瑞安市永历制药机械有限公司;UV-3150紫外-可见光分光光度计 日本岛津公司;电子天平 赛多利斯科学仪器有限公司;台式离心机 天津广丰科技有限公司;HPP.L2-800/1超高压设备 天津华泰森淼生物工程技术股份有限公司;D2-280/2SE小型真空封装机 东莞市益健包装机械有限公司。
1.2实验方法
1.2.1 核桃分心木预处理 核桃分心木经挑选去杂质、洗净,55 ℃恒温干燥箱干燥6 h,粉碎过80目筛。称取1.00 g分心木样品于透明聚乙烯袋中,加入乙醇溶液,封口混匀,放入超高压容器加压腔内,于不同条件下进行高压处理。卸压后,将萃取液于4000 r/min离心15 min,收集上清液定容,待测。
1.2.2 标准曲线的绘制和最大吸收波长的确定 参照文献[13]中的方法并作相应修改。准确称取烘干至恒重的芦丁标准品10.00 mg,65%乙醇溶解后转移并定容至50 mL容量瓶中,摇匀,即得0.20 mg/mL的标准品储备液;精密量取0.5、1.0、1.5、2.0、2.5 mL上述储备液于10 mL容量瓶中,加入0.3 mL 5% NaNO2,摇匀,放置6 min;分别加入0.3 mL 10% Al(NO3)3,摇匀放置6 min后再加入4 mL 4% NaOH 溶液,混匀,用乙醇定容至刻度,放置15 min。以相应试剂作空白参比,在200~700 nm波长范围内进行扫描,扫描结果在510 nm处有最大吸收峰。以质量浓度(C,mg/m L)为横坐标,吸光度(A)为纵坐标作标准曲线,曲线拟合得方程:A=10.794C+0.0218,R2=0.9995。
1.2.3 核桃分心木黄酮类化合物含量的测定 将离心得到的提取液定容至50 mL,准确吸取0.1~10 mL容量瓶中,按1.2.2项下测定吸光值的方法进行操作,根据下列公式计算分心木中总黄酮提取得率:
式中:C是提取液中黄酮质量浓度(mg/mL);V0是样品提取液定容总体积(mL);V1是量取提取液样品测定定容的体积(mL);V2是测定用样液体积(mL);m为样品质量(g)。
1.2.4 单因素实验 分别以乙醇体积分数(20%、35%、50%、65%、80%、95%)、压力(100、200、300、400、500、600 MPa)、保压时间(5、10、15、20、25、30 min)、液料比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 g/mL)进行单因素实验,在固定单因素条件为乙醇体积分数65%、压力为300 MPa、保压时间为10 min、液料比为1∶25下分别考察各因素对黄酮提取得率的影响。
1.2.5 响应面实验设计 以核桃分心木总黄酮化合物提取得率为指标,建立4因素3水平Box-Behnken中心组合实验,因素及水平见表1。

表1 响应面实验因素与水平表Table 1 Factors and levels table of response surface experiment
1.2.6 数据统计与分析 应用统计软件Origin8.5、Design-Expert 8.0.6.1、SAS 9.4进行数据处理和分析。
2 结果与分析
2.1最大吸收波长的选择
将对照品和样品溶液按“1.2.2”中方法处理,结果表明对照品和样品均在510 nm处有最大吸收,因此选510 nm为测定核桃分心木中黄酮类化合物吸光值的检测波长。

图1 核桃分心木样品及对照品的紫外-可见光扫描图谱Fig.1 Absorption spectrum of walnut diaphragm samples and standard samples
2.2单因素实验
2.2.1 乙醇体积分数对核桃分心木总黄酮提取得率的影响 由图2可知,在提取过程中乙醇体积分数对总黄酮提取得率影响较大,随乙醇体积分数增大总黄酮提取得率呈现先增加后降低趋势。乙醇体积分数达到65%时,提取得率达到最高值,为10.277%这是因为一定范围内随着乙醇体积分数增大,黄酮苷元类化合物的溶解性增加,脂溶性黄酮类化合物的溶解性也随之增加[14]。当乙醇体积分数大于65%后,提取得率降低,则可能是由于其它醇溶性杂质、色素等溶出量增加,抑制了黄酮类物质的溶解[15]。故选体积分数为65%的乙醇为最佳提取溶剂。

图2 乙醇体积分数对总黄酮提取得率的影响Fig.2 Effect of ethanol concentration on the yield rate of total flavonoids
2.2.2 超高压压力对分心木总黄酮提取得率的影响 图3表明,在100~300 MPa压力范围内,总黄酮提取得率随压力的升高而提高,在300 MPa时提取得率最大为11.049%。由多方面原因引起,一方面超高压提取过程先对样品加压,升高压力增加了提取溶剂向固体组织的渗透速率,且随着压力升高,细胞壁和细胞膜被破坏的数量增加,提取溶剂和组织接触面积增大,使得有效成分的溶解更加完全;二是增大压力使细胞组织内外压力差增大,卸压时提供的反向压力差也增大,在有效成分向组织外扩散过程中,提供了足够大的动力,使有效成分快速扩散到组织外[16]。当压力大于300 MPa后,提取得率反而呈下降趋势。这是因为当压力达到300 MPa时,细胞的细胞壁和细胞膜已充分被破坏,再提高压力,反使过多杂质释放出来,而且压力过大某些有效成分也易被破坏[17]。故超高压压力在300 MPa时,有利于分心木中总黄酮的提取。

图3 压力对总黄酮提取得率的影响Fig.3 Effects of different pressures on the yield of total flavonoids
2.2.3 保压时间对分心木总黄酮提取得率的影响 由图4可以得知,总黄酮提取得率随保压时间的延长先增加后呈缓慢下降趋势,当保压时间延长至10 min时,提取得率达到10.26%,再增加保压时间,总黄酮提取得率呈下降趋势。可见超高压法提取活性成分过程快速,这是因为在高压情况下,有效成分很快扩散到溶剂中从而达到平衡[16]。因此拟确定最佳保压时间为10 min。

图4 保压时间对总黄酮提取得率的影响Fig.4 Effect of UHP times on the yield of total flavonoids
2.2.4 料液比对总黄酮提取得率的影响 从图5可知,当料液比在1∶10~1∶25 (g/mL)范围内时,总黄酮提取得率随料液比的增加逐渐升高,这是因为增加溶剂量降低了原料颗粒周围的浓度,使细胞壁内外两侧浓度梯度增大,黄酮化合物扩散速率提高,有利于有效成分的溶出;料液比为1∶25 (g/mL)时,总黄酮提取得率达到11.698%,若继续增大料液比,提取率反而降低。从提取效果和减少溶剂用量等方面综合考虑,用量不宜过大,1∶25 (g/mL)为最佳料液比。

图5 料液比对总黄酮提取得率的影响Fig.5 Effect of solid to liquid ratio on the yield of total flavonoids
2.3响应面实验
2.3.1 响应面实验方案设计结果及方差分析 根据单因素实验,响应面设计与结果见表2。
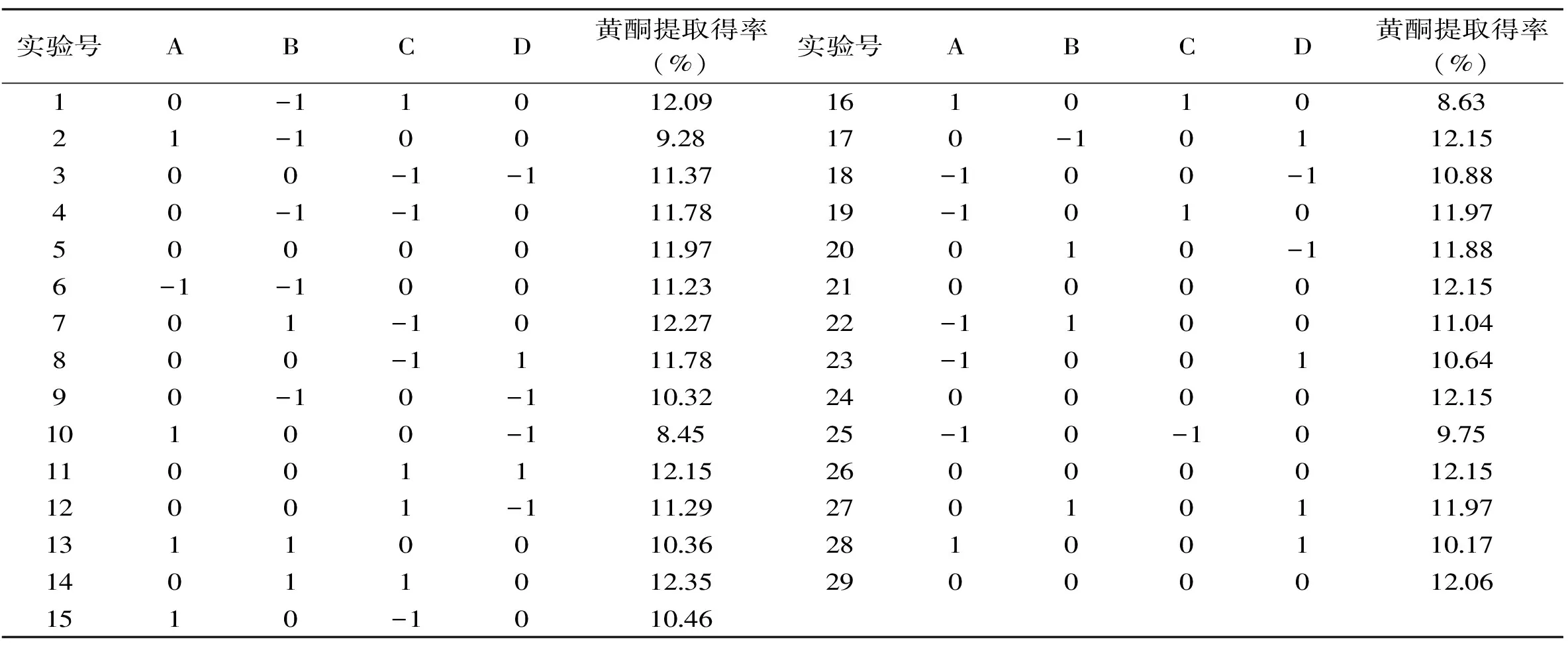
表2 响应面实验设计与结果Table 2 Experimental design and results of response surface analysis

表3 回归方程方差分析Table 3 Analysis of variances for the developed regression equation
注:**.差异极显著(p<0.01);*.差异显著(p<0.05)。
应用Design Expert 8.0.6.1软件对表2的数据进行回归拟合分析,得到提取条件与分心木总黄酮提取得率间的二次多项式:
Y=12.10-0.68A+0.25B+0.089C+0.39D+0.32AB-1.01AC+0.49AD-0.057BC-0.44BD+0.11CD-1.70A2+0.031B2-0.073C2-0.43D2
式中,Y为核桃分心木总黄酮提取得率的预测值;A、B、C、D分别代表乙醇体积分数、压力、保压时间、料液比的编码值,为了说明模型的合理性,对回归方程进行方差分析,结果见表3。
由表3可知,总黄酮提取得率实验设计模型整体呈极显著水平(p<0.0001),能够正确反映核桃分心木中总黄酮提取得率与乙醇体积分数、压力、保压时间及料液比之间的关系;失拟项不显著(p=0.0781),说明实验无失拟因素存在;一次项A、B、D和二次项A2、D2对黄酮提取得率的影响均达到了极显著水平(p<0.01),交互项AB、AC、AD、BD达到了极显著水平(p<0.01)。该模型的决定系数R2为0.9908,表明此模型可以解释99.08%响应值的变化,即样本数据对模型回归方程的拟合度较高,该模型的选择是合理的。各因素对提取得率影响大小顺序依次为:乙醇体积分数>料液比>压力>保压时间。

图6 两因素交互作用对总黄酮提取得率的影响Fig.6 Response surface plots of variable parameters on the extraction yield of total flavonids
2.3.2 两因素间的交互作用分析 分别固定回归模型中任意两个因素在零水平,可得到另外两个因素的双因素模型。等高线图沿某一因素轴方向曲线密度越大,形状趋向椭圆且椭圆轴线与坐标轴的角度越大,反映在响应面上则是曲面坡度越陡峭,说明交互作用越明显[12]。
由表3可知,AB、AC、AD、BD交互作用极显著,其响应曲面图如图6所示,由图中各响应面的陡峭程度可知,乙醇体积分数对核桃分心木总黄酮提取得率的影响最大,其次依次是料液比、压力和保压时间,这一结果与方差分析结果一致。固定压力和液料比在零水平,乙醇体积分数和保压时间交互作用最显著(图6c),其次依次是乙醇体积分数与料液比(图6b)、压力和料液比(图6d)、压力和乙醇体积分数和压力(图6a)。
2.3.3 最佳工艺条件预测及验证实验 经软件进行工艺参数的优化后,得出最佳提取条件为:乙醇体积分数62.38%,提取压力386.66 MPa,保压时间9.42 min,料液比为1∶25.01 (g/mL);此条件下核桃分心木总黄酮提取率最大,达到12.35%,考虑实际操作情况,将最佳工艺调整为:乙醇体积分数62%,提取压力385 MPa,保压时间9 min,料液比1∶25 (g/mL),此条件下进行验证,总黄酮平均提取得率为12.31%,其相对误差为 0.32%,说明该模型可以较好地反映分心木总黄酮提取的实际情况,故用Box-Behnken响应面法对分心木总黄酮提取条件进行优化是可行的。
2.4超高压提取分心木总黄酮的动力学模型
2.4.1 动力学模型的建立 超高压提取过程分3个步骤进行,一是溶剂向溶质组织内部渗透,二是溶质溶解并扩散到固液界面,三是溶质从固液界面向溶剂扩散[]。
由Fick第一扩散定律可得[19]:
式(1)
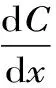
在提取过程中,分心木总黄酮浓度逐渐降低,而溶液中总黄酮浓度逐渐升高。因此,总黄酮的浓度梯度不断减小,即:
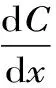
式(2)
超高压提取中,扩散系数与物质浓度及扩散的压力有关[20],可表示为:
D=D0CnPm(n,m>0)
式(3)
式中:为固有扩散系数,与扩散体系的物质特性及温度等有关的常数。
将式(2)、(3)代入式(1)中,假定分心木总黄酮的物质的量在反应初始阶段为0,t时刻为cV,V为溶液体积,由积分可得:

式(4)
设核桃分心木粉粒数目为ω,颗粒度为σ,质量为G,密度为ρ,则
S=κωσ2
式(5)
G=κ′ωρσ3
式(6)


式(7)
设液料比为M,R为分心木粉充分润湿时所需的溶剂体积与质量之比,经实验测定R=1.28。

式(8)
将式(7),(8)代入式(4)中得:
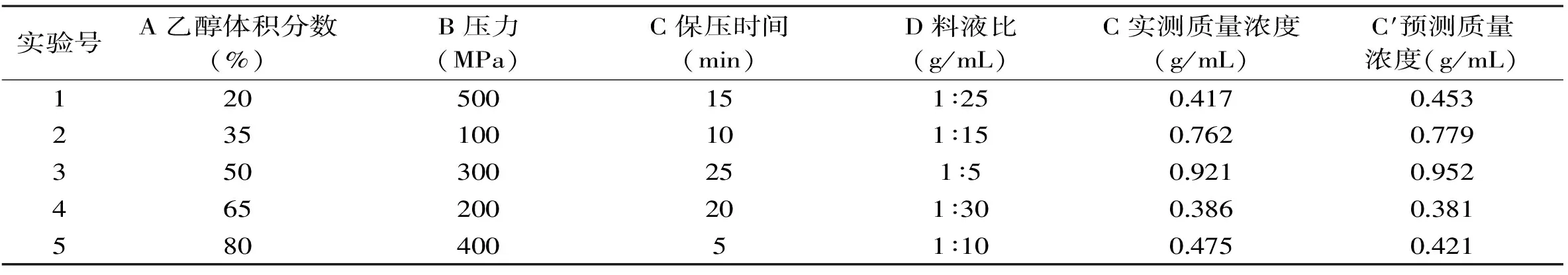
表4 相同条件下实测值与预测值的比较Table 4 Comparison between experimental and predicted values at same condition
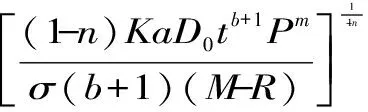
式(9)

C=αγ(M-R)δPβ
式(10)
以响应面实验数据为样本,采用SAS 9.4软件进行回归分析可得:
C=1.1704t0.0041(M-1.21)-4.5135P0.1875
式(11)
R2=0.9472
式(11)为超高压提取核桃分心木总黄酮的动力学方程。
2.4.2 动力学模型的验证 设计均匀实验对模型进行验证,并分析相关性。
经分析所得,动力学模型的预测值与实际值之间相关性良好,决定系数R2=0.9875,由此说明该模型能较好的描述分心木总黄酮提取得率与乙醇体积分数、压力、保压时间及液料比的变化关系。
3 结论
采用响应面法对核桃分心木中总黄酮的提取条件进行优化,建立了分心木总黄酮提取的回归模型,优化得到超高压提取分心木总黄酮的最佳提取工艺参数为:乙醇体积分数62%,压力385 MPa,保压时间9 min,液料比1∶25 (g/mL),此条件下黄酮类化合物平均提取得率为12.31%,与模型预测值相近;以Fick第一扩散定律为基础建立了超高压提取分心木总黄酮的动力学方程,该动力学模型的预测值与实际测量基本相符,进一步验证该模型的可靠性。综上,响应面法优化提取核桃分心木中总黄酮的工艺是可行的。
[1]阿巴拜克热·热合曼. 维吾尔医常用生药(维吾尔文)[M].乌鲁木齐:新疆人民卫生出版社,2004:772.
[2]南京中医药大学. 中药大辞典:上册[M]. 上海:上海科技出版社,2006:638.
[3]李智慧,孙志宏.山西核桃生产现状及优势分析[J]. 内蒙古科技与经济,2014,19(22):23-24.
[4]杨明珠,田新雁,肖朝江,等. 核桃分心木化学成分与生物活性研究[J]. 天然产物研究与开发,2012,35(12):1707-1711.
[5]毕肯·阿不得克里木,韩艳春,阿依吐伦·斯马义. 核桃分心木化学成分的预试验研究[J]. 新疆医科大学学报,2010,49(9):1044-1046.
[6]赵焕新,景援朝,白虹,等. 分心木中的化学成分及抗氧化活性研究[J]. 中国实验方剂学杂志,2016,65(7):54-57.
[7]Middleton E,Kand aswami C,Theoharides TC. The effects of plant flavonoids on mammalian cells:Implications for Inflammation,Heart Disease,and Cancer[J]. Pharmacological Reviews,2000,52(4):673-678.
[8]张淑兰,王国军,唐辉,等. 核桃隔膜中总黄酮的提取工艺优选[J]. 中国实验方剂学杂志,2013,40(14):50-52.
[9]李橙橙,齐洁,杨永建. 分心木中总黄酮的提取工艺考察[J]. 中国药师,2010,65(3):369-371.
[10]樊振江,于旺堂,纵伟. 超高压提取柿叶黄酮的研究[J].食品工程,2008,33(2):46-48.
[11]Jing S,Wang S,Li Q,et al. Dynamic high pressure microfluidization-assisted extraction and bioactivities of Cyperus esculentus(C.esculentusL.)leaves flavonoids[J]. Food Chemistry,2016,39(192):319-327.
[12]Shouqin Z,Junjie Z,Changzhen W. Novel high pressure extraction technology[J]. International Journal of Pharmaceutics,2004,278(2):471-474.
[13]潘兴桥,李力,荆旭慧,等. 超高压技术提取蓝莓总黄酮的工艺研究[J]. 食品工业,2013,25(10):17-19.
[14]李宏伟,张守勤,窦建鹏,等. 超高压提取山楂叶中黄酮类化合物[J]. 吉林大学学报(工学版),2006,78(3):438-442.
[15]Wang Y,Gao Y,Ding H,et al. Subcritical ethanol extraction of flavonoids from Moringa oleifera,leaf and evaluation of antioxidant activity[J]. Food Chemistry,2017,218(42):152-158.
[16]敬思群,任志艳,马泽鑫,等. 响应面法优化超高压提取金鸡菊总黄酮工艺研究[J]. 食品科技,2013,32(6):214-219.
[17]Huang X,Tu Z,Jiang Y,et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J]. International Journal of Biological Macromolecules,2012,51(5):926-32.
[18]Nicolin D J,Rossoni D F,Jorge L M M. Study of uncertainty in the fitting of diffusivity of Fick’s Second Law of diffusion with the use of bootstrap method[J]. Journal of Food Engineering,2016,184(32):63-68.
[19]王居伟,马挺军,贾昌喜. 超高压提取大豆皂苷的工艺优化及动力学模型[J]. 中国食品学报,2012,12(4):8-18.
[20]林亚平,卢维伦. 非溶蚀型药物体系的释放动力学新模型——Fick第一扩散定律的修正及其应用[J].药学学报,1997,32(11):869-873.
Studyontechnologyandkineticmodelforultrahighpressureextractionoftotalflavonoidsfromwalnutdiaphragm
HEWei1,YANCheng1,*,XIONGXue-yuan1,TANGZhou-gang2
(1.College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China; 2.Yanting Golden Land of Agriculture and Forestry Development Co.,Ltd.,Mianyang 621010,China)
Based on walnut diaphragm as the raw material,processing conditions for the ultrahigh pressure extraction of total flavonoids from walnut diaphragm using response surface methodology(RSM)were optimized. Meanwhile,a kinetics model was developed. The major factors included alcohol concentration,pressure,pressure holding time and solid-liquid ratio,Box-Benhnken experimental design was utilized to investigated the influence of different factors and their interactions on the extraction rate of total flavonoids. Also,kinetic equation of extracting total flavonoids under ultrahigh pressure was developed according to Fick’s first law of diffusion. The results indicated that 62%,385 MPa,9 min,and 1∶25 were the optimum extraction parameters for ethanol concentration,extraction pressure,pressure holding time and solid-liquid ratio,respectively. Under such conditions,the actual extraction rate of total flavonoids was 12.31%,which was consistent with the predicted values. The predicted value of kinetic model was well correlated with the actual value,and the coefficient of determinationR2was 0.9875. Compared with the traditional heating method,the ultrahigh pressure extraction process can significantly increase the extraction rate and shorten the extraction time.
walnut diaphragm;total flavonoids;ultrahigh pressure extraction;response surface methodology(RSM);kinetic model
2017-05-08
何薇(1990-),女,硕士研究生,研究方向:农副产品精深加工,E-mail:vivianweie@163.com。
*
严成(1963-) ,男,硕士,教授,研究方向: 食品化学与功能性食品,E-mail:ycx824511@163.com。
四川省科技厅重点项目(2016NZYZF0073)。
TS209
B
1002-0306(2017)21-0186-06
10.13386/j.issn1002-0306.2017.21.037

