超声波辅助复合酶法制备藏系绵羊胎盘肽的工艺优化
, ,,,*,,,,
(1.兰州理工大学生命科学与工程学院 甘肃兰州 730050;2.兰州名德农牧科技有限公司,甘肃兰州 730010)
超声波辅助复合酶法制备藏系绵羊胎盘肽的工艺优化
张丙云1,王聪1,谢言言1,任海伟1,*,范文广1,黄思瑶1,李志忠1,陈伟2
(1.兰州理工大学生命科学与工程学院 甘肃兰州 730050;2.兰州名德农牧科技有限公司,甘肃兰州 730010)
为实现羊胎盘深度开发利用,以肽得率和水解度为指标,筛选确定多种蛋白酶复合水解的最佳组合方案,并利用响应面法优化超声波辅助复合酶法水解制备羊胎盘肽的预处理参数。结果表明,响应面法优化后的超声预处理参数为超声时间18 min、温度28 ℃和功率420 W,超声波预处理后羊胎盘经木瓜蛋白酶和风味酶联合同步复合酶解制备羊胎盘肽的肽得率为39.89%,水解度为21.78%;该最优条件下平均肽链长度为4.59,分子量约500~600。结论:超声波辅助复合酶法制备藏系绵羊胎盘肽的工艺可行且有效。
藏系绵羊,羊胎盘肽,木瓜蛋白酶,风味酶,超声波预处理,工艺优化
我国是养羊大国,每年可供开发利用的羊胎盘潜藏量高达450万个[1]。羊胎盘含有丰富的蛋白质、氨基酸和微量元素,食用和药用价值极高[2]。但大多数羊胎盘被废弃处理,加工利用量不足总资源量的3%。同时,羊的生殖期较为集中,导致大量羊胎盘在短期内难以被加工处理,造成巨大的资源浪费和环境污染[3]。
近年来,一些学者从活细胞素[4]、免疫调节因子[5]、保健品胶囊[6]、活性肽开发[7]等角度对羊胎盘进行开发利用;其中有关活性肽的研究多集于在制备工艺(化学合成法、微生物发酵法、酶解法)和活性研究(抗氧化活性、免疫活性)等方面[1-2,7]。研究表明,酶解法具有生产条件温和、水解程度易于控制、可定位生产特定的肽、产品安全性高、生产成本低廉等特点,是制备生物活性肽最常用的方法之一[8]。然而,酶法制备过程中,蛋白酶具有相对的底物专一性,底物不同对应的酶切作用位点也不一样,有必要针对特定的羊胎盘原料进行蛋白酶筛选,并寻找能够提高胎盘肽得率的预处理方法。
藏系绵羊是我国青藏高原宝贵的遗传资源之一,主要分布于青海、甘南等高海拔寒旱地区,具有耐高寒、耐缺氧、适应性强等生物学特性[9]。本文以藏系绵羊胎盘肽的开发为目标,详细考察木瓜蛋白酶和风味酶制备羊胎盘肽的酶解方案,在此基础上,采用响应面法优化超声波预处理参数,以期得到制备羊胎盘肽的适宜预处理条件,为藏系绵羊胎盘肽的资源化利用奠定技术基础。
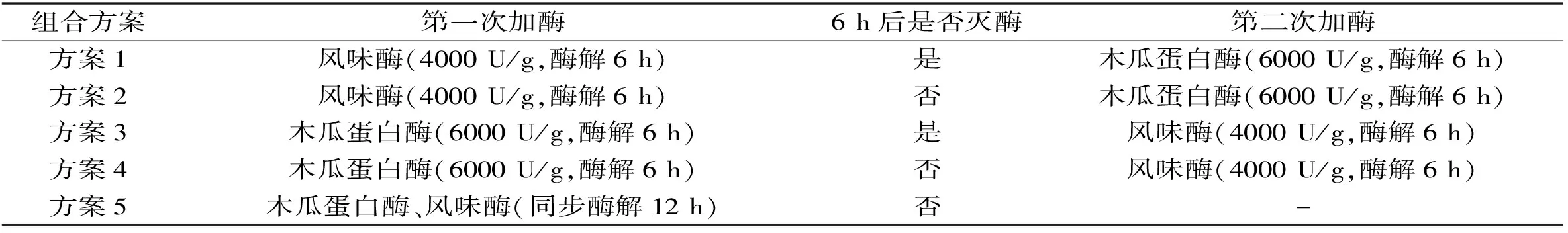
表1 双酶组合酶解的参数设定Table 1 Parameter setting of the two enzymatic combination hydrolysis
注:第一次加酶水解6 h后,灭酶或不灭酶,第二次加酶继续水解。
1 材料与方法
1.1材料与仪器
新鲜藏系绵羊胎盘 羊体内取出后-20 ℃冷库低温速冻保存,兰州名德农牧科技有限公司;木瓜蛋白酶 酶活力800000 U/g,厂家推荐适宜pH6.5~7.0,适宜温度50 ℃;风味酶 酶活力20000 U/g,厂家推荐适宜pH7.0~7.5,适宜温度50 ℃;菠萝蛋白酶 酶活力500000 U/g,厂家推荐适宜pH6.8~7.2,适宜温度45 ℃;中性蛋白酶 酶活力200000 U/g,厂家推荐适宜pH7.0,适宜温度50 ℃;碱性蛋白酶 酶活力20000 U/g,厂家推荐适宜pH8.0~10.0,适宜温度50 ℃。酶 购于南宁庞博生物工程有限公司。
FA25高剪切分散乳化机 上海弗鲁克流体机械制造有限公司;L-550台式低速离心机 湖南湘仪实验仪器开发有限公司;KQ-600DE型数控超声波清洗器 昆山市超声仪器有限公司;SH220N石墨消解仪、K9840自动凯氏定氮仪 山东海能科学仪器有限公司。
1.2实验方法
1.2.1 原料预处理 新鲜羊胎盘洗净、沥干水分后剪碎,用高剪切分散乳化机均质,并以质量比1∶5加入蒸馏水,20 ℃恒温水浴2 h,然后3900 r/min离心20 min,取其沉淀(羊胎盘提取残留物)作为酶解原料[10]。
1.2.2 蛋白水解酶的筛选 以肽得率和水解度为指标,从木瓜蛋白酶、风味酶、菠萝蛋白酶、中性蛋白酶和碱性蛋白酶中筛选适宜的蛋白水解酶,酶解条件依据参考文献统一设置为酶添加量4000 U/g,酶解时间1 h,无酶添加作为对照组[11]。同时,通过酶解液的色泽、浑浊程度和腥味对不同处理组的酶解液进行感官评价[12]。
1.2.3 木瓜蛋白酶和风味酶的酶解条件确定 准确称取2.00 g羊胎盘提取残留物36份置于锥形瓶中,分别加入100 mL、pH分别为6.5(木瓜蛋白酶)和7.5(风味酶)的磷酸缓冲液,再按照酶添加量2000、4000、6000、8000和10000 U/g梯度加入相应的酶进行水解,无酶添加作为对照组。50 ℃恒温酶解,时间分别为1、2、3、4、5和6 h[13]。酶解结束后立即沸水浴10 min灭酶,然后快速冷却到室温并3900 r/min离心20 min,取上清液于100 mL容量瓶中定容,分别用凯氏定氮法和甲醛滴定法测定总氮和氨基氮含量,计算肽得率和水解度,确定适宜的酶添加量和酶解时间[14-15]。
1.2.4 双酶复合酶解的组合方案确定 木瓜蛋白酶的适宜pH6.5~7.0,风味酶的适宜pH7.0~7.5,因此在pH7.0,50 ℃条件下,按照表1中不同酶解组合方案进行实验,水解结束后于3900 r/min离心20 min,取上清液于100 mL容量瓶中定容,分析上清液的总氮和氨基氮含量,根据肽得率和水解度等指标确定适宜的组合方案。
1.2.5 单因素实验 称取一定量羊胎盘提取残留物,以肽得率和水解度为指标,按照以下设计进行单因素实验,确定各因素的取值范围。各单因素水平设计如下:固定超声温度40 ℃、超声功率240 W,超声时间分别取5、10、15、20、25、30 min。固定超声功率240 W、超声时间20 min,超声温度分别取25、30、35、40、45、50 ℃。固定超声时间20 min、超声温度30 ℃,超声功率分别取240、300、360、420、480、500 W。
1.2.6 响应面实验 在1.2.5单因素实验基础上,对超声时间、超声温度、超声功率3个因素进行响应面优化,确定酶解法制备羊胎盘肽的适宜工艺参数。
1.2.7 测定方法 水分测定参照GB/T 6435-2014;蛋白质的测定参照GB/T 5009.5-2010。水解度、肽得率和平均肽链长度分别按式(1)、式(2)、式(3)计算[14-16]。平均分子量的计算参照文献[17]。
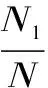
式(1)
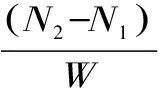
式(2)
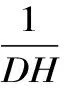
式(3)
式中:DH表示水解度,%;N1表示上清液氨基氮,g;N表示原料总氮,g;PY表示肽得率,%;N2表示上清液总氮,g;PCL表示平均肽链长度;W表示原料总蛋白质,g。
1.2.8 数据处理 用Excel软件处理基础数据,用SPSS软件对实验结果进行数据统计分析,对不同处理组数据进行方差分析,p<0.05代表数据存在显著性差异。用Design~Expert V8.0.6对超声波预处理参数进行优化。
2 结果与讨论
2.1羊胎盘肽蛋白水解酶的筛选
由图1可知,与对照组(未添加蛋白酶)相比,添加5种蛋白酶作用后的肽得率和水解度均显著(p<0.05)提高,且木瓜蛋白酶对应的肽得率和水解度分别为22.93%和13.53%,肽得率显著(p<0.05)高于风味酶(17.25%)、中性蛋白酶(19.18%)、碱性蛋白酶(21.75%)和菠萝蛋白酶(21.70%);水解度也显著(p<0.05)高于风味酶(12.94%)、中性蛋白酶(13.67%)和碱性蛋白酶(11.76%),但显著(p<0.05)低于菠萝蛋白酶(15.79%)。计算不同条件下的平均肽链长度和平均分子量发现,木瓜蛋白酶作用后的平均肽链长度为7.39,肽平均分子量约831.01,明显高于菠萝蛋白酶(6.33,714.64),与中性蛋白酶(7.32,822.68)相近,但明显低于风味酶(7.73,868.08)和碱性蛋白酶(8.50,953.37)。这是因为不同种类蛋白酶的酶解作用位点有很大差异,木瓜蛋白酶酶切位点在Arg-,Lys-,Phe-,X-等位置,特异性广泛;风味酶酶切位点有Arg-,Lys-,Leu-,Val-等,菠萝蛋白酶酶切位点在Lys-,Ala-,Tyr-,Gly-,中性蛋白酶的酶切位点在Leu-,Phe-等,碱性蛋白酶酶切位点在Ala-,Leu-,Val-,Tyr-,Phe-,Trp-[10,18-19]。藏系绵羊胎盘中Asp、Glu、Leu、Lys、Arg和Val等氨基酸含量丰富[9],木瓜蛋白酶和风味酶在Lys、Leu和Arg处均有切割位点,且木瓜蛋白酶能作用的位点较多,使木瓜蛋白酶作用后的肽得率和水解度相对较高。
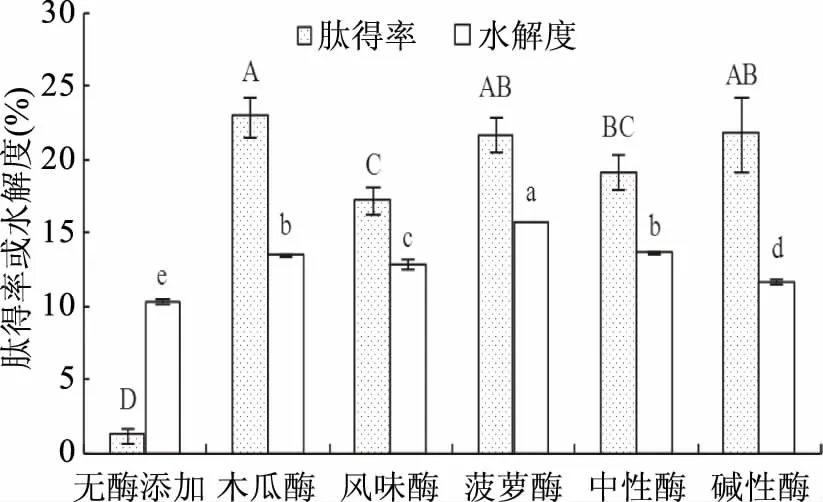
图1 不同种类蛋白酶的筛选Fig.1 Screening of different kinds of protease注:图中不同大写字母表示肽得率差异显著(p<0.05), 不同小写字母表示水解度差异显著(p<0.05);图2~图5同。
从表2酶解液的感官分析结果可知,风味酶具有一定的脱腥和调节风味的作用;与风味酶相比,尽管碱性蛋白酶、中性蛋白酶和菠萝蛋白酶有较好的酶解效果,但这三种酶作用后的酶解液腥味较重,这与朱蓓薇[12]等研究结果一致。综合考虑酶解效果、感官质量等因素,选择木瓜蛋白酶和风味酶进行后续酶解实验。
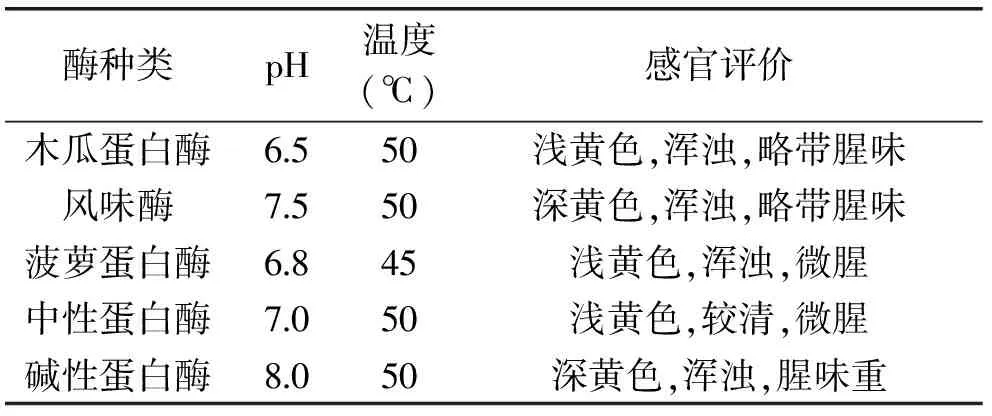
表2 不同种类蛋白酶作用后酶解液的感官评价Table 2 Sensory evaluation of enzymatic hydrolysate by different proteases
2.2木瓜蛋白酶和风味酶的酶解条件确定
2.2.1 木瓜蛋白酶的酶解实验 由表3可知,当酶添加量介于0~6000 U/g时,肽得率随时间的延长逐渐升高,分别在4 h或5 h时达到最高值,之后维持稳定不再增加;当酶添加量为8000 U/g和10000 U/g时,肽得率随时间的延长呈先升高后下降趋势,分别在5 h或4 h时达到最高值。另一方面,肽得率随着酶添加量的增加呈先升高后下降趋势,这可能是因为酶添加量的增加导致酶解产物不断积累,酶活性受到反馈抑制,导致酶解效率有所降低[20]。同时,随着酶剂量的增加,水解效率大幅提高,肽得率到达高峰值的时间逐渐缩短,6000、8000、10000 U/g三种剂量分别在6、5、4 h时最高,分别高达25.40%、30.92%和28.53%。
当酶添加量介于0~4000 U/g时,水解度随时间延长呈先升高后下降的趋势,当酶添加量介于6000~10000 U/g时,水解度随时间延长呈升高趋势,在5 h或6 h时达到最高值;另一方面,水解度随着酶添加量的增加也显著升高,当酶添加量为10000 U/g时的水解度始终显著(p<0.05)高于其余添加量,但过高剂量酶制剂会导致成本上升;当酶添加量为6000 U/g、水解6 h时的水解度也显著(p<0.05)高于其它酶添加量的水解度,且与10000 U/g、6 h时水解度差异不显著(p>0.05)。同时,水解度越高,平均肽链长度越小,相应的分子量越小。酶添加量为6000 U/g、酶解6 h时水解度高达15.82%,此时肽链长度为6.32,相应分子量约713.20,属于小分子肽范畴[17]。
综合考虑水解效果、酶制剂成本等因素,确定木瓜蛋白酶的适宜添加量为6000 U/g,酶解时间为6 h,此时所得酶解液澄清透亮、腥味最弱,感官质量最佳。
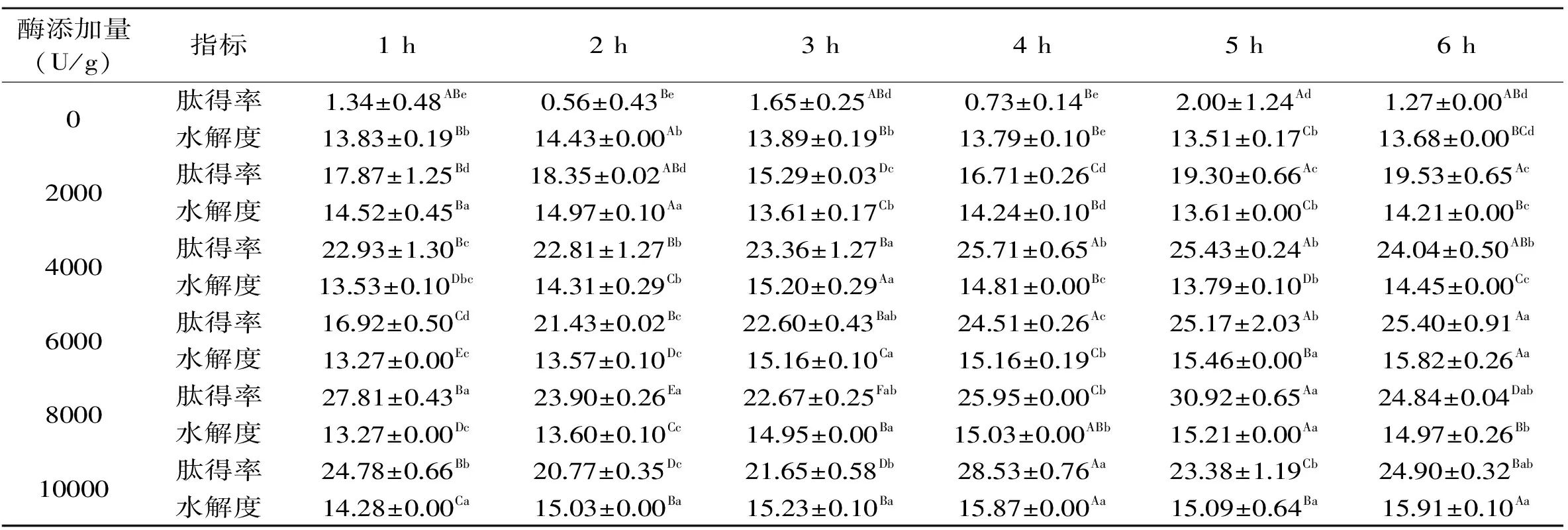
表3 木瓜蛋白酶添加量和酶解时间的筛选Table 3 Screening of the amount and time of enzymatic hydrolysis of papain
注:不同大写字母表示相同酶添加量不同时间差异显著(p<0.05);不同小写字母表示同一时间不同酶添加量差异显著(p<0.05);表4同。
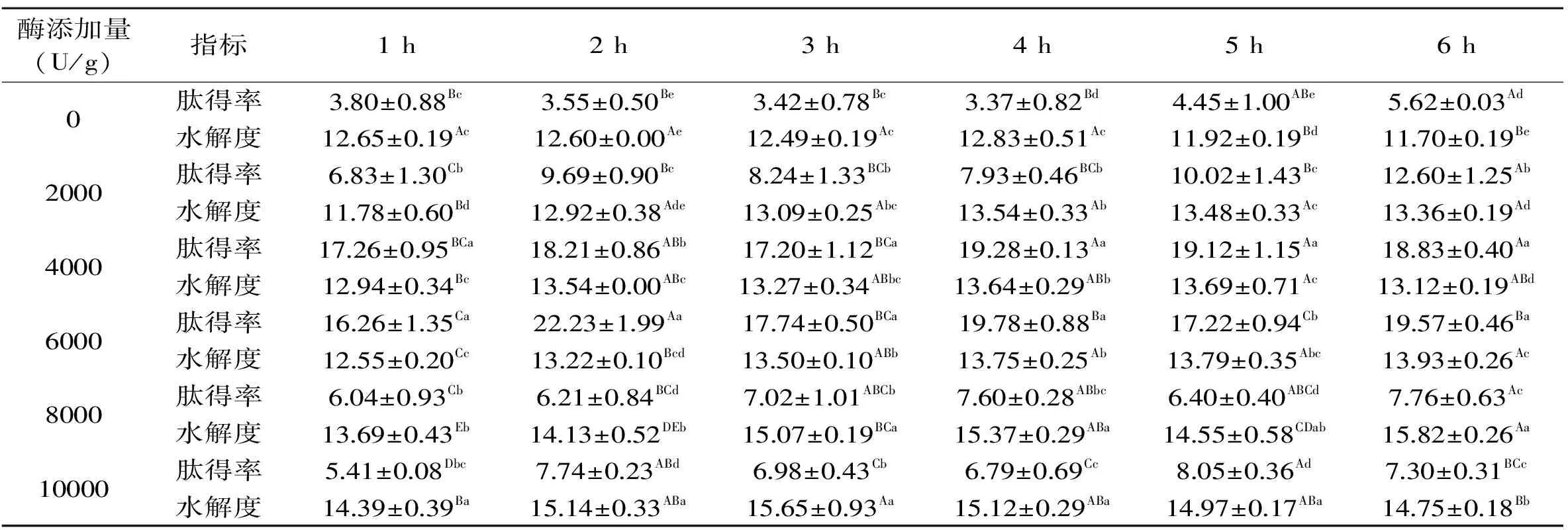
表4 风味酶添加量和酶解时间的筛选Table 4 Screening of the amount and time of enzymatic hydrolysis of flavor enzyme
2.2.2 风味酶的酶解实验 由表4可知,当酶添加量介于0~4000 U/g范围时,肽得率随时间延长逐渐升高;当酶添加量介于6000~10000 U/g范围时,肽得率随时间延长呈先升高后下降趋势;另一方面,肽得率随着酶添加量的提高呈先升高后下降趋势,当酶添加量在4000 U/g或6000 U/g时肽得率达到较高水平;酶添加量增至8000 U/g后,肽得率反而急剧下降至7%左右,这与木瓜蛋白酶变化趋势基本一致。
从水解度角度而言,无论酶添加量多少,水解度均随时间延长呈先增加后稳定的趋势,随酶添加量的增加呈逐渐升高趋势,但添加量为4000 U/g和6000 U/g时的水解度差异始终不显著(p>0.05)。从水解效果分析,尽管风味酶在添加量4000 U/g、时间为4 h条件下肽得率较高,之后随时间延长肽得率变化不显著(p>0.05);但结合4、5、6 h时的酶解液感官评价结果分析,较长时间的酶解反应有利于改善羊胎盘肽液的感官质量。因此,综合考虑确定风味酶的适宜添加量为4000 U/g、适宜酶解时间为6 h。
2.3双酶组合酶解实验
由图2可知,木瓜蛋白酶与风味酶无论同时添加(方案5)或分步添加(方案1~4),两种酶的复合酶解效果均优于单酶作用,且同步复合酶解的方案5效果最好,肽得率和水解度均达到最高值,分别为37.08%和19.52%,比木瓜蛋白酶、风味酶单一酶解时的肽得率分别提高了31.50%和47.22%,水解度分别提高了18.95%和28.64%。因为木瓜蛋白酶属于含巯基(-SH)肽链内切酶,具有蛋白酶和酯酶的活性,有较广泛的特异性,对动植物蛋白、多肽、酯、酰胺等有较强的酶解能力,风味酶起到调节风味的作用,将两种酶组合可以对底物原料进行多位点作用,提高酶与底物的接触频率和作用位点,使其充分酶解,提高酶解效果[10]。因此,确定最优酶解组合方式为同时加入6000 U/g木瓜蛋白酶和6000 U/g风味酶,同步酶解12 h。
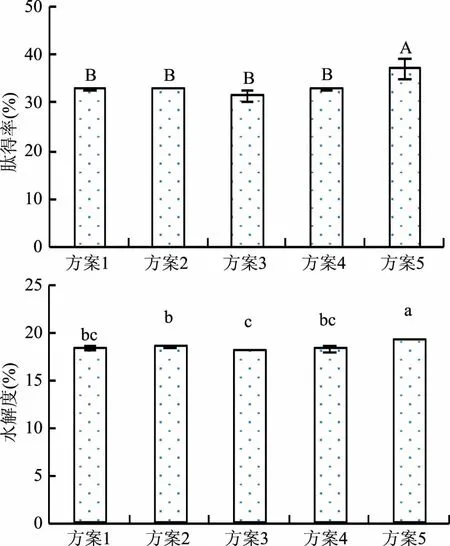
图2 不同酶解方案的肽得率和水解度比较Fig.2 Comparison of the PY and DH for different enzymatic hydrolysis schemes
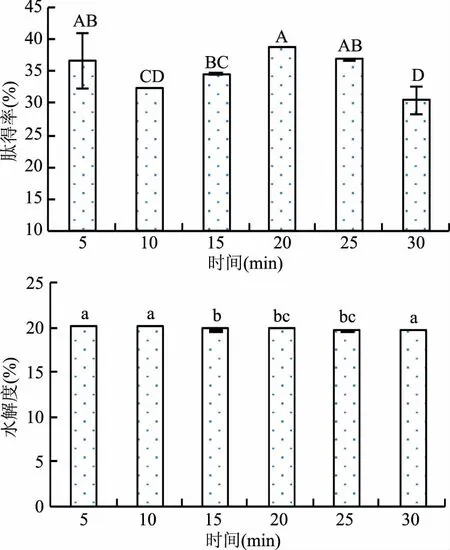
图3 超声时间对肽得率和水解度的影响Fig.3 Effect of ultrasonic time on the PY and DH
2.4超声波预处理辅助酶解单因素实验
2.4.1 超声时间对酶解效果的影响 由图3可知,随着超声时间的增加,肽得率总体呈现先升高后降低的趋势,20 min时肽得率达到最高值。因为随着超声辐射时间的延长,超声波产生的空化效应逐渐增强,使胎盘蛋白质的空间结构发生变化,埋藏在蛋白质内部的活性部位暴露并与酶紧密作用。但时间过长会破坏胎盘组织细胞,反而会降低酶解产物的活性[21]。水解度随着超声时间的延长呈逐渐下降趋势,但作用30 min时的水解度突然增加,原因可能是超声时间过长导致胎盘组织细胞的大量内容物溶出,这与Jia[22]等研究结果一致。初步选择超声时间为20 min。
2.4.2 超声温度对酶解效果的影响 由图4可知,在超声时间范围内,随着温度逐渐升高,肽得率和水解度均呈现先增加后减小趋势,30 ℃时的肽得率最高,高达39.00%,该温度时的水解度(21.04%)显著(p<0.05)高于25 ℃(20.47%)、40 ℃(20.64%)、45 ℃(20.25%)和50 ℃(19.86%),但与35 ℃(20.87%)差异不显著(p>0.05)。由于超声处理可破坏蛋白结构,使蛋白的变性程度增加,适当温度能使底物蛋白与酶作用位点更好接触,但温度过高会导致蛋白质变性过度,使可溶性蛋白含量下降[23-24],故初步选择超声温度30 ℃。
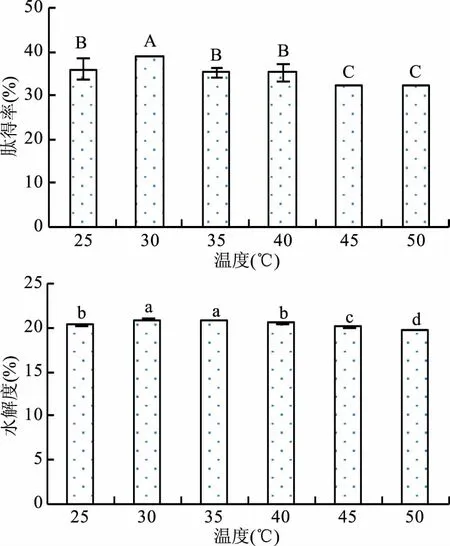
图4 超声温度对肽得率和水解度的影响Fig.4 Effect of ultrasonic temperature on the PY and DH
2.4.3 超声功率对酶解效果的影响 由图5可知,随着超声功率的增加,水解度变化总体呈先增后减趋势,但超声功率对肽得率影响无明显变化规律。这可能是因为超声处理过程中的热效应作用使预处理体系的温度升高,不同超声功率对应的温度增幅有较大差异,多重作用因素对酶解过程的肽得率构成不确定影响,这与彭彬[25]的研究结果一致。但考虑到功率为360 W时水解度最高达20.81%,此时对应的平均肽链长度最小(4.81),平均分子量约546左右,属于小分子肽范畴,人体更容易消化吸收[17]。因此,初步选择超声功率为360 W。
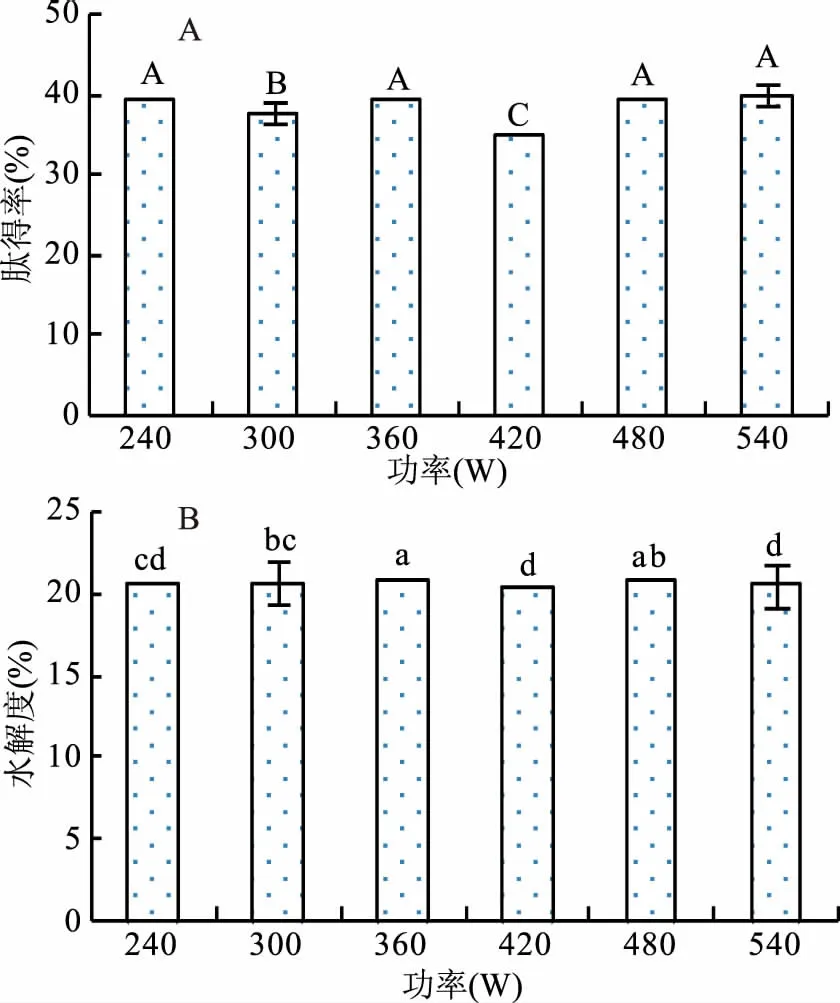
图5 超声功率对肽得率和水解度的影响Fig.5 Effect of ultrasonic power on the PY and DH
2.5响应面优化酶解工艺条件实验
根据2.4中单因素实验结果,以肽得率(Y)为响应值,进行超声时间(A)、温度(B)、功率(C)3个因素的参数优化。响应面设计方案与肽得率结果如表5所示,响应曲面图如图6所示。利用Design-Expert 8.0.6软件进行数据分析,建立二次响应面回归模型:Y=37.356-0.6275A+0.2175B+0.6225C-0.29AB+0.275AC-0.425BC-3.5255A2-2.2955B2+4.0245C2。
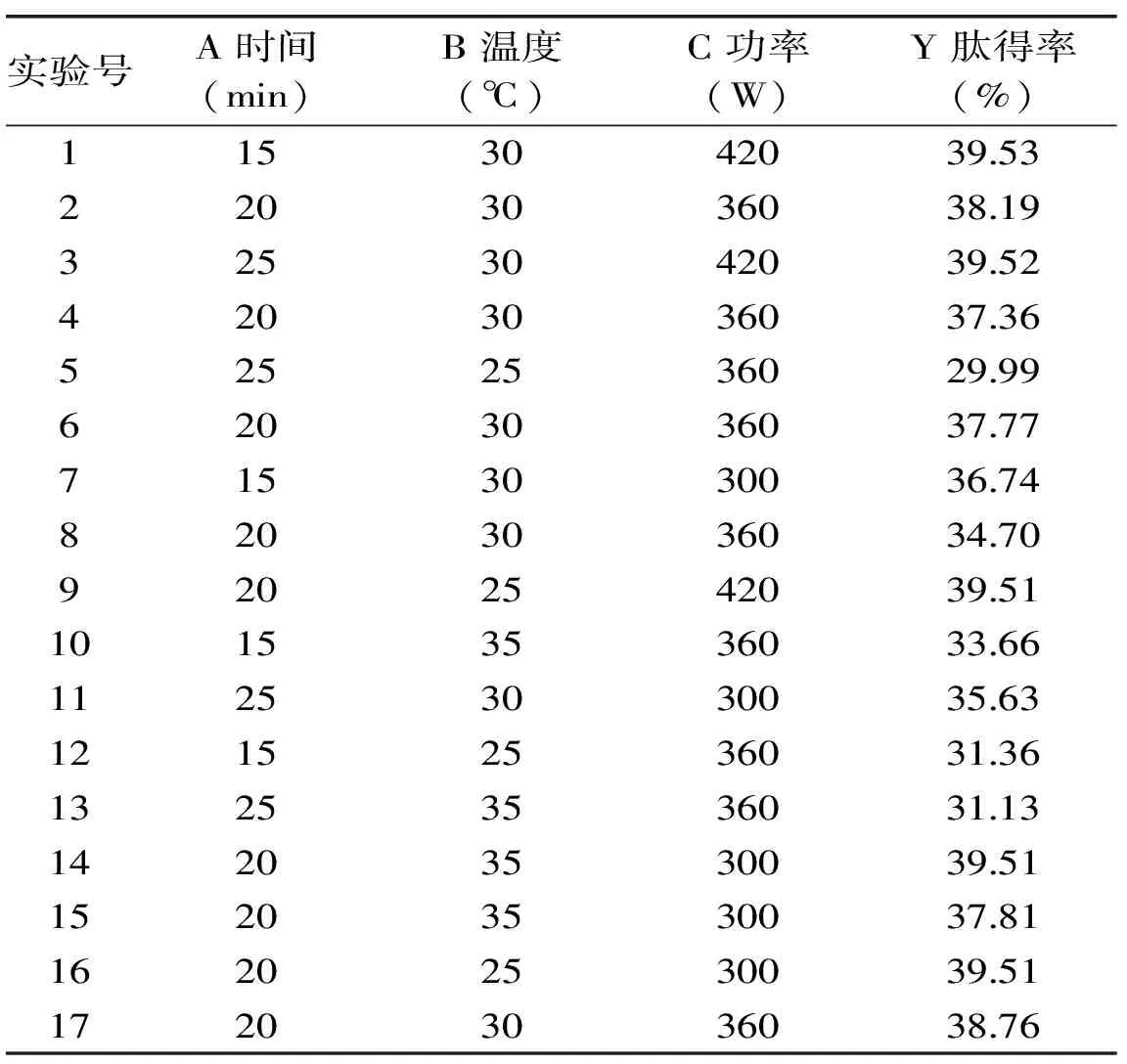
表5 响应面实验设计与结果Table 5 Experimental design and results of RSM
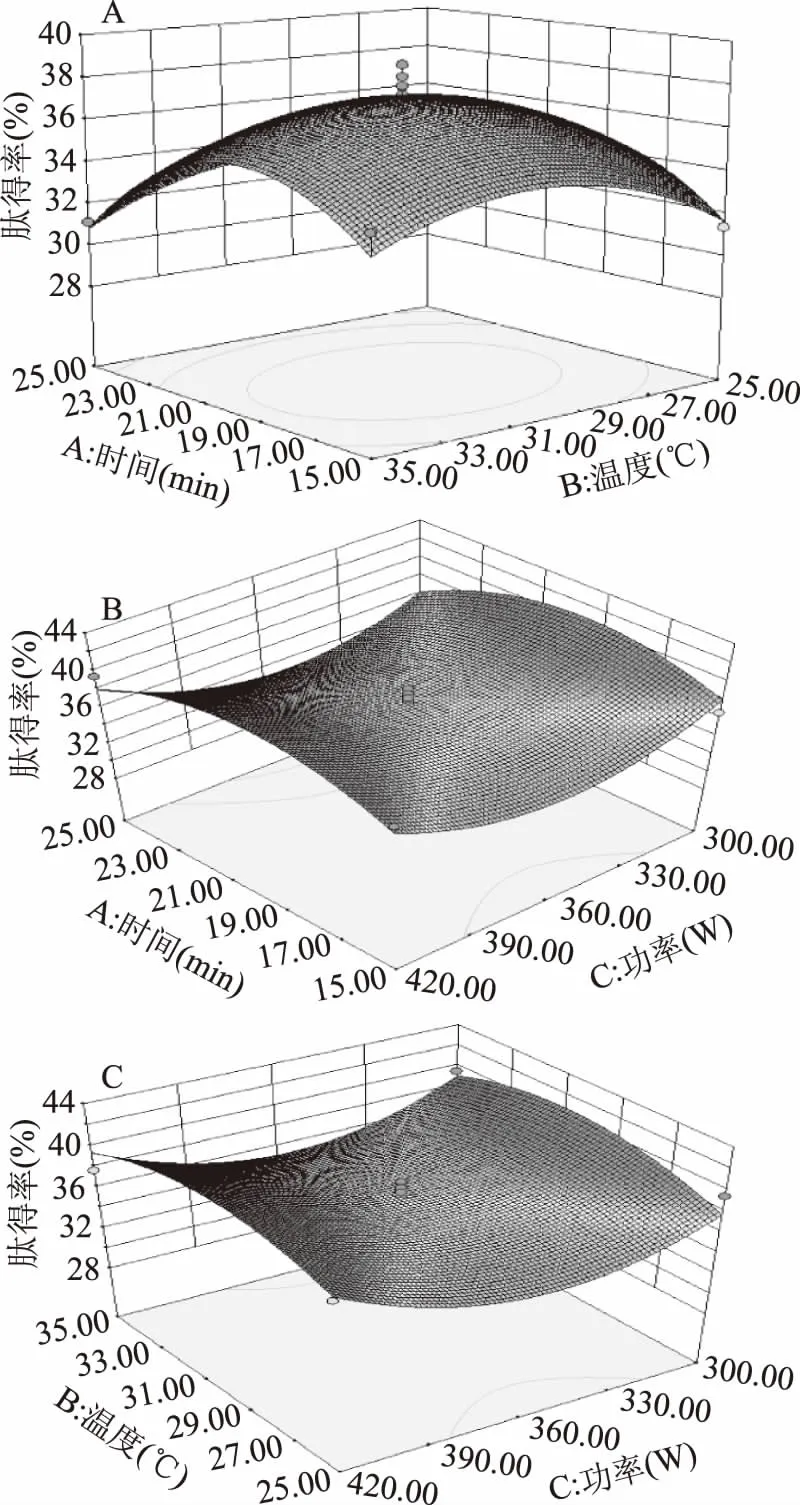
图6 超声时间、功率和温度对肽得率影响Fig.6 Effect of ultrasonic time,power and temperature on the yield of peptide
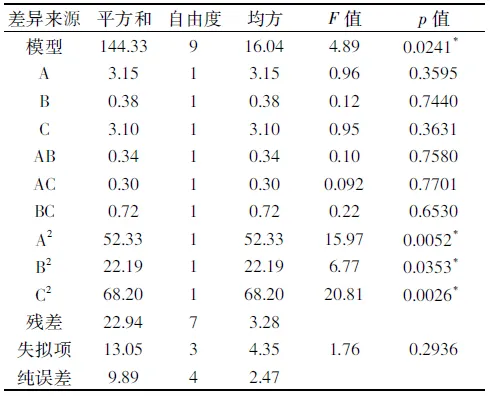
表6 实验结果方差分析表Table 6 Variance analysis of quadratic regression equation
注:复相关系数R=0.9687;离散系数CV=3.51%;*表示差异显著(p<0.05)。
由表6模型方差分析可知,模型的F值为4.89(p<0.05),肽得率模型表现显著;失拟项p值为0.2936(p>0.05),表现不显著,复相关系数R为0.9687,说明该回归方程拟合度良好,可用此模型对超声波辅助酶解工艺进行分析和预测[26]。因子A、B和C及其交互项对肽得率影响不显著(p>0.05),但其二次方A2、B2和C2对肽得率影响显著(p<0.05)。超声预处理的最佳参数条件为时间18.25 min、超声温度28.34 ℃、超声功率405.95 W,该条件下肽得率和水解度的预测值分别为39.66%和21.69%。为便于实验操作,将参数设置为时间18 min、温度28 ℃、功率420 W进行3次平行验证实验,得到的肽得率平均值为39.89%,水解度平均值为21.78%,与预测值接近。与理论值相比,其相对误差值分别为0.58%和0.41%,且重复性较好,结果可靠。计算得到该最优条件下胎盘肽的平均肽链长度为4.59,平均相对分子质量约500~600。
3 结论
响应面法优化后的羊胎盘超声预处理最优参数为温度28 ℃、功率420 W和超声时间18 min,经超声预处理后羊胎盘酶解的肽得率和水解度分别提高至39.89%和21.78%,制备得到了平均肽链长度4.59和平均相对分子质量500~600的小分子羊胎盘肽。说明超声波辅助复合酶法制备羊胎盘肽的工艺可行,且效果明显。
[1]侯银臣,周洁静,刘旺旺,等. 羊胎盘提取剩余物发酵制备活性肽工艺及产物生物活性[J]. 农业工程学报,2015(1):311-316.
[2]刘旺旺,侯银臣,王皓,等. 不同菌种发酵羊胎盘残留物制备活性肽研究比较[J]. 食品工业,2015(8):149-153.
[3]周洁静,侯银臣,刘旺旺,等. 羊胎盘抗氧化肽制备工艺及其体外抗氧化活性研究[J]. 食品工业,2015(5):11-15.
[4]陆晖,李东霞,张双全. 羊胎盘活细胞素对小鼠机体功能的影响[C]. 中国生理学会全国代表大会暨学术会议,2002:85-87.
[5]方廖琼. 羊胎盘免疫调节因子的免疫促进作用及其机理研究[D]. 重庆:第三军医大学,2005.
[6]谷玉. 羊胎盘保健品的制备及主要功效研究[D]. 合肥:安徽农业大学,2007.
[7]Teng D,Fang Y,Song X,et al. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food & Bioproducts Processing,2011,89(89):202-208.
[8]卜汉萍,王璐,许宙,等. 免疫活性肽的酶法制备及其活性机制研究进展[J]. 食品与机械,2014(3):244-248.
[9]金红,陈志成,梁婧娴,等. 藏系绵羊红原、贾洛、欧拉类群mtDNA D-loop区多态性分析[J]. 西南民族大学学报 2012,38(2):235-241.
[10]周洁静,侯银臣,刘旺旺,等. 采用不同蛋白酶制备羊胎盘抗氧化肽的研究[J]. 食品工业科技,2015,36(5):156-161.
[11]张玲. 欧李仁多肽的制备及其功能活性的研究[D]. 晋中:山西农业大学,2014.
[12]朱蓓薇,葛瑞宏. 双酶水解法制备羊胎盘活性肽[J]. 食品与发酵工业,2003,29(11):41-45.
[13]周洁静,侯银臣,刘旺旺,等. 羊胎盘提取残余物免疫肽制备工艺的优化[J]. 食品与发酵工业,2015,41(3):129-134.
[14]黄焕,王欣,刘宝林. 鱼鳞胶原蛋白水解度两种测定方法的比较[J]. 食品工业科技,2010(3):354-356.
[15]游丽君,赵谋明,崔春,等. 酶解泥鳅蛋白制备小分子肽的工艺研究[J]. 食品与发酵工业,2006,32(9):164-167.
[16]吴建中. 大豆蛋白的酶法水解及产物抗氧化活性的研究[D]. 广州:华南理工大学,2003.
[17]张毅. 酶法制备大豆肽工艺条件的研究[D]. 无锡:江南大学,2009.
[18]胡爱军,郑捷. 食品工业酶技术[M]. 北京:化学工业出版社,2014.
[19]丁秀臻. 大豆球蛋白酶解物中巯基肽的分布、制备及其与重金属离子作用的研究[D]. 无锡:江南大学,2016.
[20]苏春燕. 超声波辅助酶解谷朊粉制备抗氧化肽的研究[D]. 无锡:江南大学,2010.
[21]Jia J Q,Ma H L,Zhao W R,et al. The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J]. Food Chemistry,2010,119(1):336-342.
[22]刘政,胡丽菊,赵丽薇,等. 超声波辅助分步酶解法制备大豆肽的研究[J]. 大豆科学,2013,32(3):402-405.
[23]Ozuna C,Paniagua-Martínez I,Castao-Tostado E,et al. Innovative applications of high-intensity ultrasound in the development of functional food ingredients:Production of protein hydrolysates and bioactive peptides[J]. Food Research International,2015,77:685-696.
[24]唐雯倩,成晓瑜,刘文营,等. 超声波辅助酶解制备猪血源抗氧化肽[J]. 肉类研究,2015(11):10-14.
[25]彭彬. 双酶水解蚕蛹蛋白制备多肽的研究[D]. 济南:齐鲁工业大学,2014.
[26]Naqash S Y,Nazeer R A. Optimization of enzymatic hydrolysis conditions for the production of antioxidant peptides from muscles of Nemipterus japonicus and Exocoetus volitans using response surface methodology[J]. Amino Acids,2012,43(1):337-345.
OptimizationofpreparationofTibetansheepplacentapeptidebyultrasonic-assistedcompositeenzymatichydrolysis
ZHANGBing-yun1,WANGCong1,XIEYan-yan1,RENHai-wei1,*,FANWen-guang1,HUANGSi-yao1,LIZhi-zhong1,CHENWei2
(1.School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China; 2.Lanzhou Mingde Agriculture-husbandry Technology Co.,Ltd.,Lanzhou 730010,China)
In order to realize the development and utilization of sheep placenta,the optimal combination scheme for the composite enzymatic hydrolysis of multiple proteases was investigated with the indicators of the yield of peptide(PY)and the degree of hydrolysis(DH). On this basis,the ultrasonic pretreatment parameters of sheep placenta were optimized by response surface methodology(RSM). The results showed that the optimal conditions of ultrasound pretreatment were found as follows:ultrasonic time of 18 min,temperature of 28 ℃and power of 420 W. Under these optimal ultrasound pretreatment conditions,synchronous composite enzymatic preparation by papain and flavor enzyme of the PY was 39.89%,the DH was 21.78%. And the average chain length was 4.59 and the molecular weight was about 500~600. Conclusion:the ultrasonic assisted enzymatic preparation method was feasible and effective in the preparation of Tibetan sheep placenta peptide.
Tibetan sheep;sheep placenta peptide;papain;flavor enzyme;ultrasonic pretreatment;process optimization
2017-03-22
张丙云(1968-),女,硕士,副教授,研究方向:食品科学,E-mail:zhang.b.y@163.com。
*
任海伟(1983-),男,博士,副教授,研究方向:食品科学,E-mail:rhw52571119@163.com。
甘肃省自然科学基金(1606RJZA206,1606RJYA287);兰州市科技计划项目(2014-2-20);兰州理工大学红柳青年教师培养计划(Q201207)。
TS251.95
A
1002-0306(2017)21-0130-07
10.13386/j.issn1002-0306.2017.21.027

