酿酒黄水对枯草芽孢杆菌的抑菌机制研究
,,,,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.威海海洋职业学院食品工程系,山东威海 264300)
酿酒黄水对枯草芽孢杆菌的抑菌机制研究
盛杰1,2,纪海玉1,徐亚超1,刘安军1,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.威海海洋职业学院食品工程系,山东威海 264300)
本论文以枯草芽孢杆菌为例,研究白酒发酵副产物黄水的抑菌机制。通过描绘细菌生长曲线,扫描电镜观察菌体表面形态,电导率实验研究实验菌细胞膜通透性,SDS-PAGE凝胶电泳观察菌内蛋白变化,DAPI荧光染色观察细菌核酸含量变化进行研究。结果证明:酿酒黄水处理的枯草芽孢杆菌生长曲线未出现明显对数生长,扫描电镜观察菌体表面粗糙,电导率实验证明酿酒黄水不能改变细胞膜通透性,SDS-PAGE凝胶电泳分析表明酿酒黄水可抑制菌内蛋白质合成,DAPI荧光染色结果表明酿酒黄水作用9 h后,枯草芽孢杆菌总DNA量减少30.39%,作用3 h后,RNA总量减少39.64%。因此,酿酒黄水抑菌机制主要通过抑制枯草芽孢杆菌菌体内蛋白质和核酸的合成实现的。
酿酒黄水,枯草芽孢杆菌,抑菌机理
食品的防腐保鲜一直是迫于解决的实际问题。一般而言,防腐剂可分为化学合成防腐剂和天然防腐剂,由于化学合成防腐剂的种类和应用范围受到严格限制。因此,人们越来越关注从植物、动物、微生物中提取分离的天然防腐剂,它具有抑菌性强、抑菌谱广、安全低等优点[1-2]。
白酒发酵副产物黄水是能源工业及酿酒业的副产品,产量大并且分布集中。在我国,酿酒黄水每年排放量高达6500多万吨[3]。科学研究者常用酿酒副产物黄水生产酱油、勾调白酒、生产食醋等[4]。而本实验室通过前期实验证明,酿酒黄水对大多数细菌(金黄色葡萄球菌、枯草芽孢杆菌、沙门氏菌、大肠杆菌等)和少部分真菌(青霉菌和曲霉菌)有很强的抑菌效果,也检测到酿酒黄水含有小分子糖、有机酸、少量乙醇、挥发性物质,这与张晓磊[5]酿酒黄水副产物含有丰富氨基酸、维生素和多种微量元素相一致,因此,酿酒黄水作为一种天然的营养化防腐剂,应用于食品中是可行的。
目前有关酿酒黄一个新应用领域水抑菌及抑菌机理的研究较少[6-8],本论文拟对酿酒黄水的抑菌机理进行深入研究,通过菌株生长曲线变化、细胞微观结构变化、膜通透性变化、菌体蛋白变化以及核酸含量变化初步探讨酿酒黄水的抑菌作用途径。研究结果为酿酒黄水作为新型天然防腐剂的开发应用提供实验依据,促进其更有效的利用,除此之外,作为副产物,酿酒黄水的生产成本极低,作为天然防腐剂为推动国民经济发展、实现更高经济价值也起到一定作用。
1 材料与方法
1.1材料与仪器
酿酒黄水 由江苏大风歌酒业有限公司提供;EDTA、十二烷基硫酸钠、丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷、过硫酸铵、巯基乙醇、四甲基乙二胺 北京索来宝科技有限公司;以上试剂 均为分析纯;枯草芽孢杆菌(Bascillussubtilis) 菌种均由天津科技大学食品工程与生物技术学院实验室保藏。
但是,大豆的价格波动还会受到自然灾害、制度等因素的影响,国际进出口的影响,尤其是现在的中美贸易战,会在一定程度上影响大豆价格,本文并没有分析完全,只是找出其中一部分影响因素来分析。因此,本文存在着一定的不足和需要改进的地方,这是以后研究的重点。
YXQ-LS-75SII立式压力蒸汽灭菌锅 上海博迅有限公司医疗设备厂;JSM6380LV扫描电镜 JEOL日本电子;NikonC1激光共聚焦显微镜 尼康有限公司;TI-U倒置荧光显微镜 尼康有限公司;F7000荧光分光光度计 日立高新技术公司;DYY-6C型电泳仪 北京市六一仪器厂;GIS-3500凝胶成像仪 Tanon公司。
1.2实验方法
1.2.1 菌种活化 将在-4 ℃条件下斜面保藏的菌体挑取一环,划线于斜面试管固体培养基中,细菌在37 ℃下培养24 h备用[9]。
1.2.8 菌体DAN、RNA核酸含量变化的测定 取1 mL经酿酒黄水作用1、3、6、9、18 h的菌体样液(OD600 nm=0.5),加入等体积DAPI染色液,振荡10 min,后立即在荧光分光光度计下于DNA的激发波长364 nm和RNA的激发波长400 nm,测定菌体DNA和RNA的荧光强度,每组实验重复三次,以磷酸缓冲液悬浮的菌体样液作为对照[16]。
兼容问题会增大儿童坐姿不正确和紧急情况下受伤风险的几率,而很多家长习惯用毛巾等其他物体绑在汽车座位上,这进一步增大了风险几率。
从图1可看出,对照组枯草芽孢杆菌在生长初期生长缓慢,随后成对数生长,当培养18 h时,OD值达到最大;当加入酿酒黄水后,生长曲线发生明显变化,存在显著性差异(p<0.05)。生长曲线的差异说明酿酒黄水能减缓并最终抑制枯草芽孢杆菌的生长。
1.2.4 细菌微观结构的测定 取生长到对数期的菌悬液,实验组用酿酒黄水处理6 h,对照组加入磷酸缓冲液,各两组。取样时,共准备8个1.5 mL离心管。向每个小试管内加1.5 mL菌悬液,在4 ℃下,以7000 r/min离心5 min,弃去上清液体得菌体,pH6.8的磷酸缓冲液洗3次;戊二醛固定;30%、50%、70%、80%、90%的乙醇梯度脱水各一次,每次4000 r/min离心20 min,再用浓度为100%的乙醇梯度脱水两次;后放置于-80 ℃冰箱冷冻12 h,电镜观察细菌表面变化[11-12]。
1.2.5 细菌膜通透性的测定 将生长对数期的菌离心处理(4500 r/min,15 min),用0.02 mol/L,pH6.8的磷酸缓冲液洗3次;用酿酒黄水释液体将菌体悬浮使其OD600 nm为0.2;以pH6.8磷酸缓冲液悬浮菌液作为空白,于37 ℃,170 r/min摇床中振荡培养,分别于0、2、4、6、8、10 h,分别移取5 mL反应液离心(4500 r/min,15 min),并取上清液测电导率[13-14]。
应用SPSS 19.0统计学软件分析本研究所有数据,计量资料的描述以均数±标准差表示,采用t检验或方差分析进行比较;计数资料的描述以率或构成比表示,采用卡方检验进行比较;生存曲线的绘制采用Kaplan-Meier法,生存率比较采用Log-rank检验,检验水准=0.05,以P<0.05表示差异具有统计学意义。
1.2.6 细菌表达蛋白的测定 蛋白样品制备:将生长对数期测试菌用0.02 mol/L、pH6.8的磷酸缓冲液洗涤3次,实验组做以下处理:取5 mL菌悬液与酿酒黄水充分混合:空白组取5 mL菌悬液体与5 mL、pH6.8、0.02 mol/L的磷酸缓冲液充分混合;两组分别于170 r/min摇床中振荡培养,分别于2、4、6、8 h时取样2 mL(OD600 nm=0.5)并离心(8000 r/min,15 min),取沉淀并用无菌水充分洗涤离心(8000 r/min,15 min),加50 μL上样缓冲液,充分混匀后于沸水浴中加热10 min,再次离心后取15 μL上清液用于SDS-PAGE电泳[15]。
(1)建筑物临边防护管理:本工程施工现场所有的临边区域均设置防护栏杆,采用成型的φ48-51×3.5mm钢管搭设。对于临边区域下放有人员通过的区域,还对栏杆进行了全面的安全网密封处理,避免坠物伤人。
从图2可看出,实验组枯草芽孢杆菌菌体表面在酿酒黄水处理6 h后表面粗糙,明显看出有大颗粒物质与菌体表面结合;而对照组枯草芽孢杆菌菌体表面光滑;因此猜测酿酒黄水可能会影响到细菌的正常细胞代谢,从而起到抑菌的作用[17]。
1.2.2 制备菌悬液 将装有玻璃珠及若干蒸馏水的50 mL三角瓶和装有玻璃珠及9 mL蒸馏水的试管于高压灭菌锅中121 ℃灭菌20 min,待用。已预先活化的供试菌种,用装有无菌水的三角瓶制成菌悬液,于振荡器振荡30 min,使细胞打匀,用血细胞计数板镜检计数,之后用无菌水稀释若干倍,配制成105~106CFU/mL菌悬液,均在24 h内使用[9]。
1.2.9 数据统计分析 每个样品设三个平行,采用SPSS 20.0和Origin 8.0软件进行数据分析,测定结果以平均值±标准差表示。实验数据采用ANOVA进行邓肯氏差异分析,以p<0.05为差异显著。
《规范》第3章针对不同性质的防护区域应采用的系统类型、泵组所负担的系统喷头数量、系统喷雾强度、喷头工作压力、喷头安装高度等均有新的规定。对方案产生较大影响的条文主要包括第3.1.3条、3.4.2条、3.4.3条、3.4.4条、3.4.5条和3.4.10条等,除第3.1.3条外,其他几条的描述中基本都采用了“应”。具体条文及相关分析详见表2。
2 结果与分析
2.3酿酒黄水对细菌膜通透性的影响
1.2.3 菌种生长曲线的测定 取24个试管,分A和B两组,每支15 mL;试管分别加入5 mL液体培养基,并加入100 μL上述菌悬液,放入37 ℃,170 r/min摇床进行振荡监控培养,每隔2 h对A和B组分别取4 mL样品在600 nm下测其吸光值,其中8 h取样测量后A组加入抑菌目标物质样液,B组加入pH6.8的磷酸缓冲液作为对照,继续培养,直至培养22 h结束监测。以培养时间为横坐标、以培养液OD600 nm为纵坐标描点绘图[10]。
式中φi代表载波相位,Ri为接收机到卫星的距离,Ii为电离层误差,Ti为对流层误差,c表示光速,δtr表示卫星钟差,δts表示接收机钟差,Oi表示卫星轨道误差,Mi表示多路径、接收机噪声等测量误差,λ为波长,N为整周模糊度。
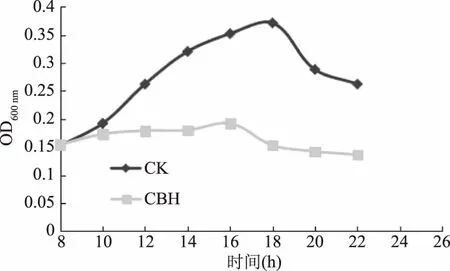
图1 酿酒黄水作用下枯草芽孢杆菌与正常组的生长曲线比较Fig.1 Contrast of Bacillus subtilis growth curves between normal and affected by yellow water注:(CK)对照组枯草芽孢杆菌,(CBH)酿酒 黄水处理组,图2、图3同,图5~图7同。
2.2酿酒黄水对细菌微观结构的影响
1.2.7 酿酒黄水对枯草芽孢杆菌菌体荧光强度变化的检测 将培养至对数期的菌,离心处理(4500 r/min,15 min),并用0.02 mol/L的磷酸缓冲液洗涤3次;用酿酒黄水将菌体悬浮使其OD600 nm为0.5,等量的磷酸缓冲液悬浮的菌液作为空白对照,于37 ℃,170 r/min摇床中振荡培养,培养3 h后,在载玻片上滴加1 mL的DAPI染色液和菌体样液(OD600 nm=0.5),混匀后在黑暗中静置10 min,在荧光倒置显微镜下观察、拍照[16]。

图2 扫面电子显微镜下枯草芽孢杆菌的形态变化Fig.2 The metamorphic of structure of Bacillus subtilis under scanning electron microscope
2.1酿酒黄水对细菌生长曲线的影响
知识内化则主要以课堂教学为主,老师可以结合学生刻苦学习的实质情况,针对学生所存在的不足进行有效的辅导。因此,翻转课堂能够有效地促进学生课前预习时间的延长,在完成主体教学之后,学生可以在课外观看不同的视频,采取不同的手段和途径查阅相关的教学资料和学习资料,对个人所学习的知识进行进一步的巩固。老师则可以结合学生作业完成的实质情况对学生的知识点进行有效的检验,以此来为后续教学活动的开展提供更多的依据。
从图3可看出,实验组枯草芽孢杆菌菌悬液加入酿酒黄水后,与空白对照组相比,存在显著性差异(p<0.05)。起初,电导率立刻高于对照组,这可能是酿酒黄水中本身含有小分子糖、有机酸,在自身环境下本身带正电荷的原因,当处理6 h后,两组电导率几乎相等,之后,随着时间的延长实验组电导率值一直低于对照组,其原因猜测是酿酒黄水没有破坏枯草芽孢杆菌的细胞膜,而是与细胞膜外表面发生了某种静电结合,从而导致带电离子的减少,使培养液总的电导率降低,影响细菌的正常代谢,起到抑菌的作用[18-19]。
在水平井的实际钻探过程中,复合钻进和定向钻进交叉进行,导致平均钻时较大,从而造成10m的钻进时间通常要比一个岩屑迟到时间大,从表2可以看出,地质录井资料相比远钻头地质导向测量数据更具时效性。而地质录井资料的滞后性可通过循环的方式完整获得,而远钻头地质导向测量数据无法通过循环获得井底数据。
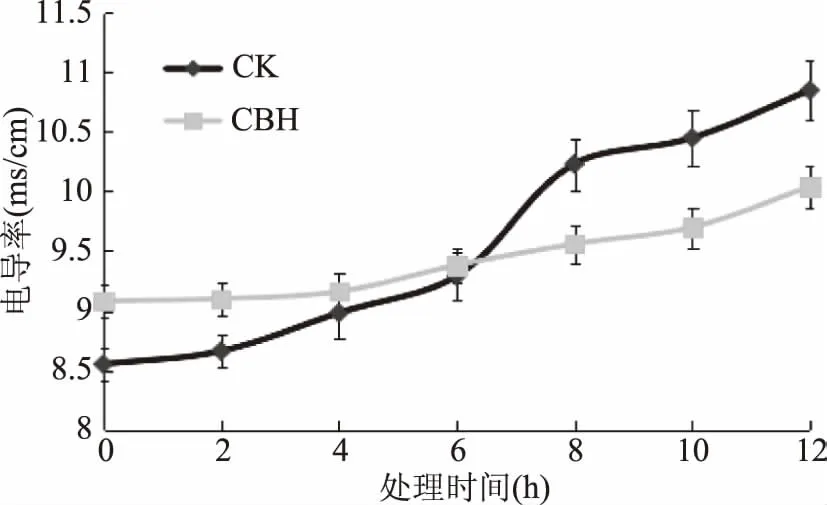
图3 酿酒黄水作用下枯草芽孢杆菌与正常组的电导率比较Fig.3 Contrast of Bacillus subtilis conductivity between normal and affected by yellow water
2.4酿酒黄水对细菌表达蛋白的影响
从图4可看出,酿酒黄水作用后的枯草芽孢杆菌菌体蛋白电泳谱带,与对照组蛋白电泳谱带比较呈现明显差别:对照组的菌体谱带随时间的延长,谱带加深。而酿酒黄水作用后,随时间的延长蛋白谱带明显变浅,这进一步说明酿酒黄水中部分成分抑制了枯草芽孢杆菌菌体某些蛋白的合成,导致细菌胞内蛋白的下降[20]。
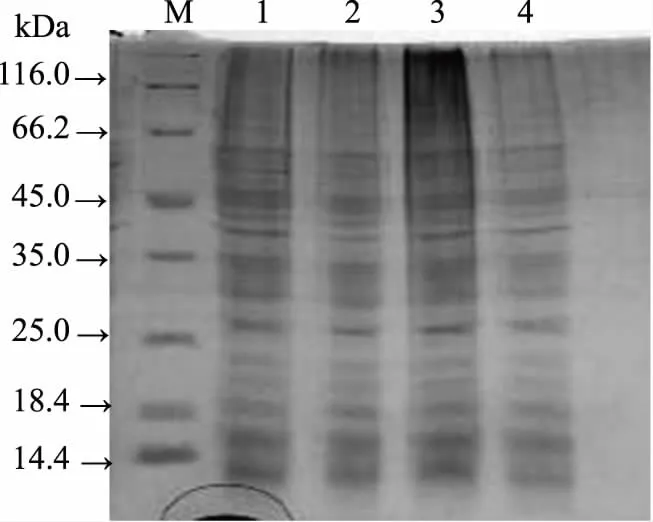
图4 酿酒黄水对枯草芽孢杆菌菌体蛋白的影响Fig.4 Effect of yellow water on protein of Bacillus subtilis注:条带1~4分别为4 h对照、 4 h实验、8 h对照、8 h实验组。
2.5酿酒黄水对菌体核酸的影响
2.5.1 酿酒黄水对菌体荧光强度的影响 DAPI是一种能够与DNA和RNA结合的荧光染料,核酸量越大,荧光亮度越强。通过倒置荧光显微镜观察,DAPI可以穿过细胞膜进入细胞的内部,并与核酸稳定结合。酿酒黄水作用枯草芽孢杆菌3 h后的荧光显微镜观察结果如图5所示,可知,对照组荧光强度明显高于实验组,这是由于酿酒黄水中抑菌成分抑制了菌体核酸的合成,使得实验组核酸含量要明显低于对照组[21]。
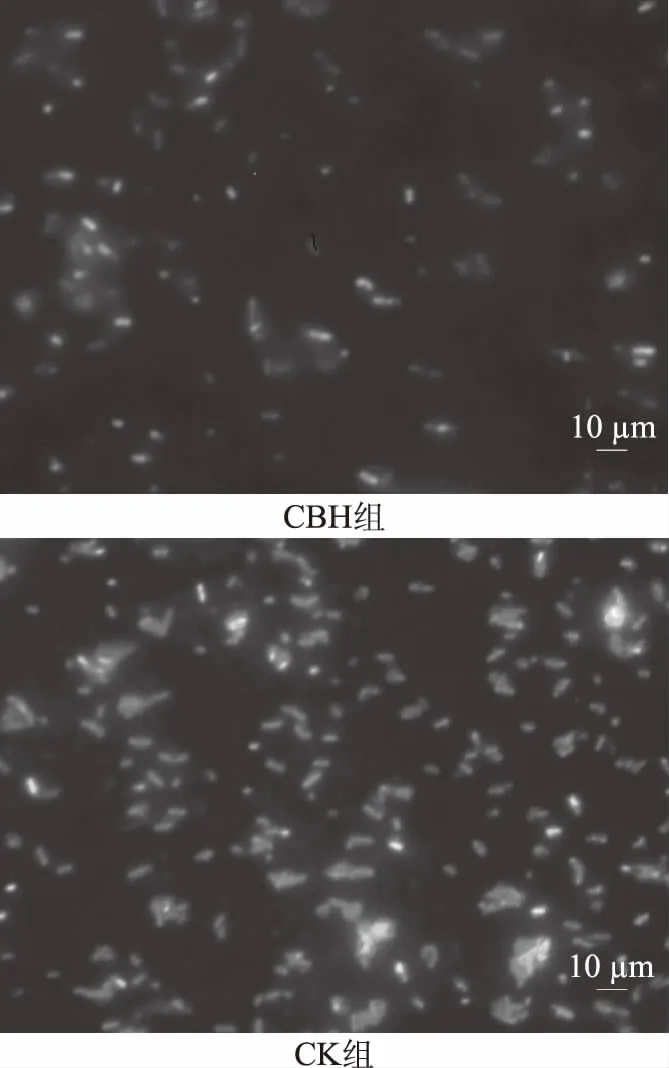
图5 酿酒黄水对枯草芽孢杆菌荧光显微图的影响Fig.5 Effect of yellow water on DAPI stained of Bacillus subtilis
2.5.2 酿酒黄水对菌体DNA、RNA含量的影响 经酿酒黄水作用后,枯草芽孢杆菌的核酸含量明显减少,两组之间存在显著性差异(p<0.05)。其中作用9 h后菌体的DNA含量如图6所示,比对照组减少了30.39%,作用3 h后RNA含量变化,如图7所示,其含量与对照组相比减少了39.64%,这说明酿酒黄水可以阻碍枯草芽孢杆菌核酸的合成。
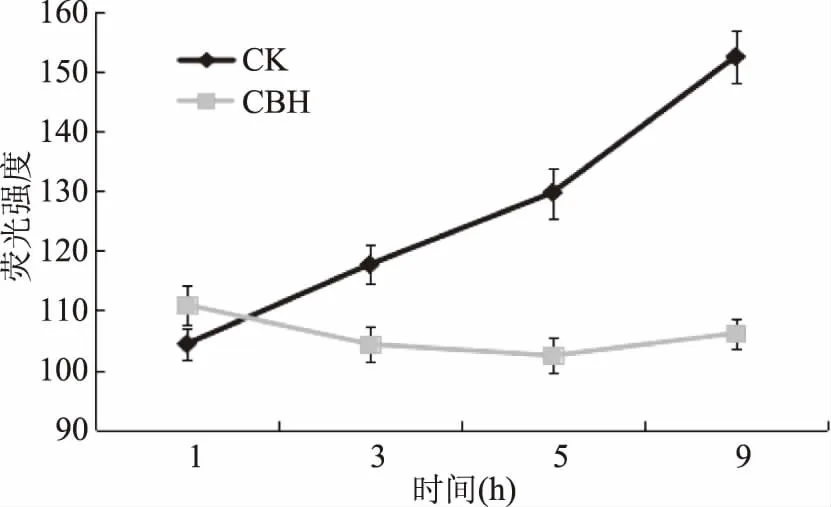
图6 酿酒黄水对枯草芽孢杆菌DNA含量的影响Fig.6 Effect of yellow water on synthesis of DNA on Bacillus subtilis
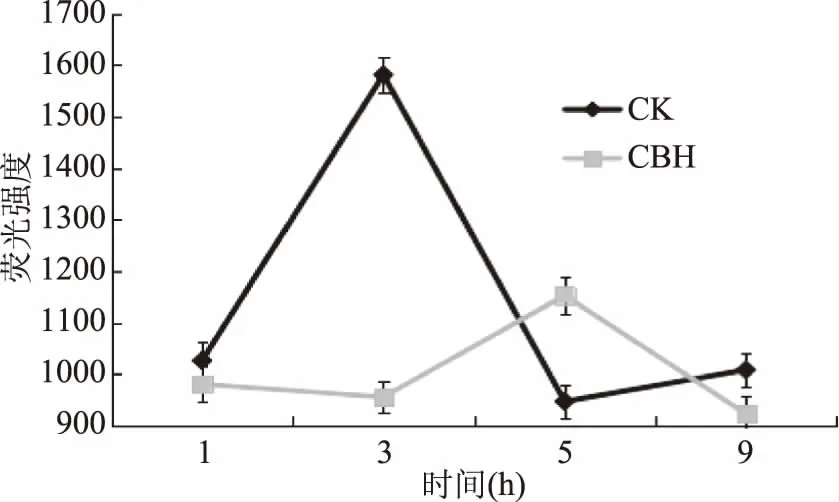
图7 酿酒黄水对枯草芽孢杆菌RNA含量的影响Fig.7 Effect of yellow water on synthesis of RNA on Bacillus subtilis
3 结论
白酒发酵副产物黄水可以明显抑制枯草芽孢杆菌的生长。生长曲线实验表明,经酿酒黄水处理后,枯草芽孢杆菌的生长曲线发生了明显变化;扫描电镜观察,经酿酒黄水处理后,菌体表面粗糙而对照组菌体表面光滑;电导率实验表明酿酒黄水不能改变细胞膜通透性;SDS-PAGE凝胶电泳分析表明,酿酒黄水可抑制枯草芽孢杆菌菌内蛋白质的合成,使菌体内蛋白质总量随作用时间的延长呈下降趋势;DAPI荧光染色结果显示,酿酒黄水可明显抑制核酸的合成。因此,酿酒黄水具有较强的抑菌活性,主要是通过抑制枯草芽孢杆菌蛋白质和核酸的合成实现抑菌的。
[1]段丽丽.新型天然抗菌试剂研究进展[J].中国调味品,2016,27(3):162-165.
[2]邓浩,尹青春,谢桂勉,等.天然食品防腐剂的研究和开发利用[J].轻工科技,2014(6):30-33.
[3]冯兴垚,邓杰,谢军,等.白酒酵造副产物黄水综合利用现状浅析[J].中国酿造,2017,37(2):41-44.
[4]王媚,傅小红,冯学愚,等.不同预处理方式对气相色谱检测黄水挥发性组分影响的研究[J].食品与发酵科技,2015(10):90-92.
[5]张晓磊,史潜玉,王化斌,等.白酒酿造副产物黄水中挥发性化合物的研究[J].酿酒,2010,37(2):41-44.
[6]Zhu Shunying,Yang Yang,Yu Huaidong,et al.Chemical composition and antimicrobial activity of the essential oils of Chrysanthemum indicum[J].Ethnopharmacol,2005,96(1):151-158.
[7]Sperotto R M,Moura D J,Peres V F,et al.Cytotoxic mechanism of essential oil and its major compound nerolidol[J].Food and Chemical Toxicology,2013,57:57-68.
[8]Burt S.Essential oils:their antibacterial properties and potential applications in foods:a review[J].International Journal Food Microbiology,2004,94(3):223-253.
[9]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2017:35-37.
[10]杨红.生物化学实验指导[M].北京:中国医药科技出版社,2016:35-37.
[11]王磊.食品分析与检验[M].北京:化学工业出版社,2017.
[12]周德庆.微生物学教程[Z].北京:高等教育出版社,2011.
[13]Park C B,Yi K S,Matsuzaki K,et al.Structure-activity analysis of buforin II,ahistone H2A derived antimicrobial peptide:thproline hinge is responsible for the cell-penetrating ability of buforin II[J].Proc Natl Acad Sci USA,2000,97(15):8245-8250.
[14]Subbalakshmi C,Sitaram N.Mechanism of antimicrobial action of indolicidin[J].FEMS Microbiol Lett,2008,160:91-96.
[15]Fabbretti A,Brandi L,Petrelli D,et al.The antibiotic furvina argets the Psite of 30s ribosomal subunits and inhibits translation initiation displaying start codonbias[J].Nucleic Acids Research,2012,40(20):10366-10374.
[16]Fabbretti A,Brandi L,Petrelli D,et al.The antibiotic furvina argets the Psite of 30s ribosomal subunits and inhibits translation initiation displaying start codonbias[J].Nucleic Acids Research,2012,40(20):10366-10374.
[17]Zhu Shunying,Yang Yang,Yu Huaidong,et al.Chemical composition and antimicrobial activity of the essential oils of Chrysanthemum indicum[J].Ethnopharmacol,2005,96(1):151-158.
[18]Sperotto R M,Moura D J,Peres V F,et al.Cytotoxic mechanism of essential oil and its major compound nerolidol[J].Food and Chemical Toxicology,2013,57:57-68.
[19]Burt S.Essential oils:their antibacterial properties and potential applications in foods:a review[J].International Journal Food Microbiology,2004,94(3):223-253.
[20]Shao X,Cheng S,Wang H,et al.The possible mechanism of antifungal action of tea tree oil on Botrytis cinerea[J].Journal of Applied Microbiology,2013,114:1642-1649.
[21]Patrzykat A,Friedrich C L,Zhang L,et al.Sublethal concentrations of pleurocidinderived antimicrobial peptides inhibit macromolecular synthesis in Escherichia coli.Antimicrob[J]. Agents Chemother,2002,46:605-614.
权威·核心·领先·实用·全面
Studyonanti-bacterialmechanismofyellowwaterfromliquorfermentationonBacillussubtilis
SHENGJie1,2,JIHai-yu1,XUYa-chao1,LIUAn-jun1,*
(1.College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Department of Food Engineering,Weihai Ocean Vocational College,Weihai 264300,China)
The antibacterial mechanisms of yellow water from liquor fermentation were studied withBacillussubtilisused as the experimental strain. Growth curve ofBacillussubtilis,the surface of the bacteria by means of the scanning electron microscope,the test of the conductivity ofBacillussubtilis,bacterial protein synthesis by SDS-PAGE,fluorescence microscopy and fluorescence spectrophotometer were used to investigate the antibacterial mechanism of yellow water. The resulted indicated that the yellow water could inhibit the logarithmic growth ofBacillussubtilis. The surface of the bacteria treated with yellow water was rough by means of the scanning electron microscope,while the surface of the bacteria in control group was smooth. Yellow water could not change the bacterial membrane permeability by the test of the conductivity ofBacillussubtilis. Yellow water could inhibit bacterial protein synthesis by SDS-PAGE and the band ofBacillussubtiliswith yellow water turned lighter. Fluorescence microscopy and fluorescence spectrophotometer results showed that DAPI integrated withBacillussubtilisand the quantity of DNA after treated with yellow water for 9 h and RNA after treated with yellow water for 3 h were reduced by 30.39% and 39.64% respectively. The results showed that yellow water from liquor fermentation could inhibit the growth of bacteria significantly,the mechanisms of the inhibition activity may include inhibiting synthesis of nucleic acid and protein.
yellow water from liquor fermentation;Bacillussubtilis;antibacterial mechanisms
2017-04-11
盛杰(1989-),女,硕士研究生,研究方向:功能性食品的研究与开发,E-mail:270450819@qq.com。
*
刘安军(1963-),男,博士,教授,研究方向:功能性食品的研究与开发,E-mail:laj@tust.edu.cn。
省部级农业部项目(201303082-3)。
TS201.3
A
1002-0306(2017)21-0126-05
10.13386/j.issn1002-0306.2017.21.026

