医源与动物源肺炎克雷伯菌耐药性和分子特性研究
杨 帆,邓保国,魏纪东,赵永新,李 敏
医源与动物源肺炎克雷伯菌耐药性和分子特性研究
杨 帆1,邓保国1,魏纪东1,赵永新2,李 敏1
目的了解不同宿主来源的肺炎克雷伯菌耐药性和分子特点,探讨其在人与动物间传播的可能性。方法收集2013年3月至2014年12月肺炎克雷伯菌98株(包含动物源67株、医源31株),通过K-B纸片扩散法和肉汤稀释法测定对15种抗菌药物的敏感性;拉丝试验测定产粘液表型;PCR扩增2个毒力基因和7个耐药基因;多位点序列(MLST)分析分子型。结果医源菌株耐药率显著高于动物源菌株,在动物源菌株中,鸡源和猪源菌株耐药率高于兔源和犬源菌株;除犬源菌株外均表现多重耐药,医源菌株多重耐药率最高(74.19%)。98株肺炎克雷伯菌有18个ST型,鸡源菌株主要流行ST37、猪源菌株为ST258、兔源菌株为ST60、犬源菌株为ST11,医源菌株为ST11。ST11为医源、犬源、猪源菌株共有,ST235为医源和鸡源菌株共有,ST258为医源和猪源菌株共有。高粘液菌株主要为ST11、ST235、ST258,且在这些分子型中检测到rmpA、magA基因。医源菌株blaKPC的检出率最高(54.84%),犬源和兔源菌株未检出BlaKPC基因。超广谱β-内酰胺酶基因在医源菌株中检出率高于动物源菌株,qnrA和qnrB基因在鸡源菌株中检出率高于医源菌株。ST11、ST258、ST235携带的多种耐药基因最高。结论不同宿主来源的肺炎克雷伯菌耐药表型、粘液表型及分子特性不同,但ST11、ST235、ST258为人源和动物源肺炎克雷伯菌共有的分子型。
肺炎克雷伯菌;耐药性;MLST;医源;动物源
肺炎克雷伯菌(Klebsiellapneumoniae,KP) 是引起医院和社区感染的重要条件致病菌,全国细菌耐药监测网和全国医院感染监控网报道,临床上肺炎克雷伯菌的分离率居第2位[1]。同时肺炎克雷伯菌也是动物的一种条件致病菌,可引起一些动物的多种感染[2]。随着抗菌药物在临床和动物生产中的广泛应用,肺炎克雷伯菌已对多种抗生素产生了严重的耐药性,特别是一些泛耐药菌株[3-4]、多重耐药菌株[5-6]的出现,给防控该菌引起的疾病带来了很大的挑战。在对其它细菌的一些研究中报道,细菌的耐药性可在人和动物间传播[7]。为了解肺炎克雷伯菌在人和动物中的流行趋势,探讨其在人与动物间传播的可能性。本研究收集本地区不同宿主来源肺炎克雷伯菌,进行了如下研究。
1 材料与方法
1.1菌株来源 收集2013年3月至2014年12月河南省新乡地区多家动物医院及规模化养殖场分离的肺炎克雷伯菌67株,其中猪源28株、鸡源22株、兔源12株和犬源5株;同期收集新乡医学院第三附属医院检验科分离的医源肺炎克雷伯菌31株。所有的菌株经过形态染色、生化试验初步鉴定后,采用Vitek-AMS 60(法国梅里埃生物公司)全自动细菌鉴定系统进行菌种鉴定后进入后续试验。质控菌株分别为:E.coliATCC25922、肺炎克雷伯菌ATCC700603、肺炎克雷伯菌ATCC27853购自卫生部临床检验中心。
1.2粘液表型检测 将肺炎克雷伯菌转接至哥伦比亚血平板上37 ℃培养过夜,用接种环蘸取菌落,将接种环向上提起,若形成的黏丝长度大于0.5 cm则判定为阳性,反之则阴性。拉丝试验阳性的菌株为高粘液表型菌株。
1.3ESBLs菌株表型检测 采用美国临床实验室标准化协会(CLSI 2013)推荐的双纸片协同法检测产ESBLs菌株,即在M-H药敏琼脂平板上贴上含克拉维酸及不含克拉维酸的头孢他啶及头孢噻肟纸片,任何一种加克拉维酸纸片比其不加克拉维酸纸片抑菌圈直径大于5 mm,则判读为产ESBLs菌株,反之为非产ESBLs菌株。
1.4药物敏感性试验 按照CLSI推荐的K-B纸片扩散法和肉汤稀释法测定受试菌株对15种常用抗菌药物的敏感性,药物包括阿米卡星、氨苄西林、阿莫西林-克拉维酸、头孢他啶、头孢氨苄、卡那霉素、复方新诺明、克林霉素、阿奇霉素、红霉素、环丙沙星、加替沙星、四环素、亚胺培南、美罗培南,药物均购自Oxoid公司。药敏结果根据CLSI 2013年版的标准判断结果。在药敏试验结果中,对3种及3种以上药物产生耐药的菌株即可认为是多重耐药菌。
1.5耐药基因和毒力基因的检测 按照试剂盒说明提取上述菌株的基因组DNA,以此为PCR模板扩增耐药基因和毒力基因。耐药基因包括blaKPC、blaNDM、blaCTX-M、blaTEM、blaSHV,qnrA和qnrB,毒力基因包括magA和rmpA。耐药基因和毒力基因的引物序列参照文献[8-10]合成。阳性扩增产物送生工生物(上海)股份有限公司进行测序,测序结果上传GenBank数据库比对分析。
1.6多位点序列分型(MLST) 根据Diancourt等[11]2005年提出的肺炎克雷伯菌MLST方案,用PCR扩增基因组上的7个管家基因:rpoB、gapA、mdh、pgi、phoE、infB与tonB。将PCR扩增的阳性产物经纯化后送生工生物工程(上海)股份有限公司测序。测序结果上传到网站进行比对(http://bigsdb.web.pasteur.fr/klebsiella/klebsiella.html),确定菌株的序列基因型即MLST类型。
2 结 果
2.1抗菌药物敏感性试验 98株不同来源的肺炎克雷伯菌对15种常用抗生素的耐药性见表1。总的来看,这些细菌对15种抗菌药物的耐药率为12.24%~66.33%,但来源不同的菌株对抗生素耐药性存在明显差异。医源菌株的耐药率显著高于动物源菌株;在动物源菌株中,鸡源与猪源菌株的耐药率明显高于兔源和犬源菌株。医源菌株对15种抗生素的耐药率较高,除亚胺培南、美罗培南和磺胺甲氧苄啶外,对其它抗生素的耐药率均大于50%。猪源菌株耐药率大于50%的药物有头孢氨苄、氨苄西林、红霉素、环丙沙星。鸡源菌株耐药率大于50%的药物有阿米卡星、氨苄西林、红霉素、阿莫西林-克拉维酸、四环素、环丙沙星和头孢氨苄;兔源菌株对红霉素耐药率最高(83.33%),其次为四环素(66.67%)、头孢氨苄和氨苄西林(均为50%)。犬源菌株对大部分抗生素敏感,仅检出2株对环丙沙星耐药。大部分动物源菌株对碳青酶烯类(亚胺培南、美罗培南)敏感,仅猪源菌株、鸡源菌株有耐碳青酶烯类菌株出现,而医源菌株对亚胺培南、美罗培南的耐药率分别达到38.71%和32.26%。从表1可见,除犬源菌株外,其余菌株均表现出多重耐药,多重耐药率从高到底顺序为医源菌株(74.19%)、鸡源菌株(59.09%)、猪源菌株(39.29%)和兔源菌株(25%)。
表1 不同来源的肺炎克雷伯菌对15种抗生素的耐药率
Tab.1 Distribution of resistance to 15 antibiotics of KP isolated from different hosts
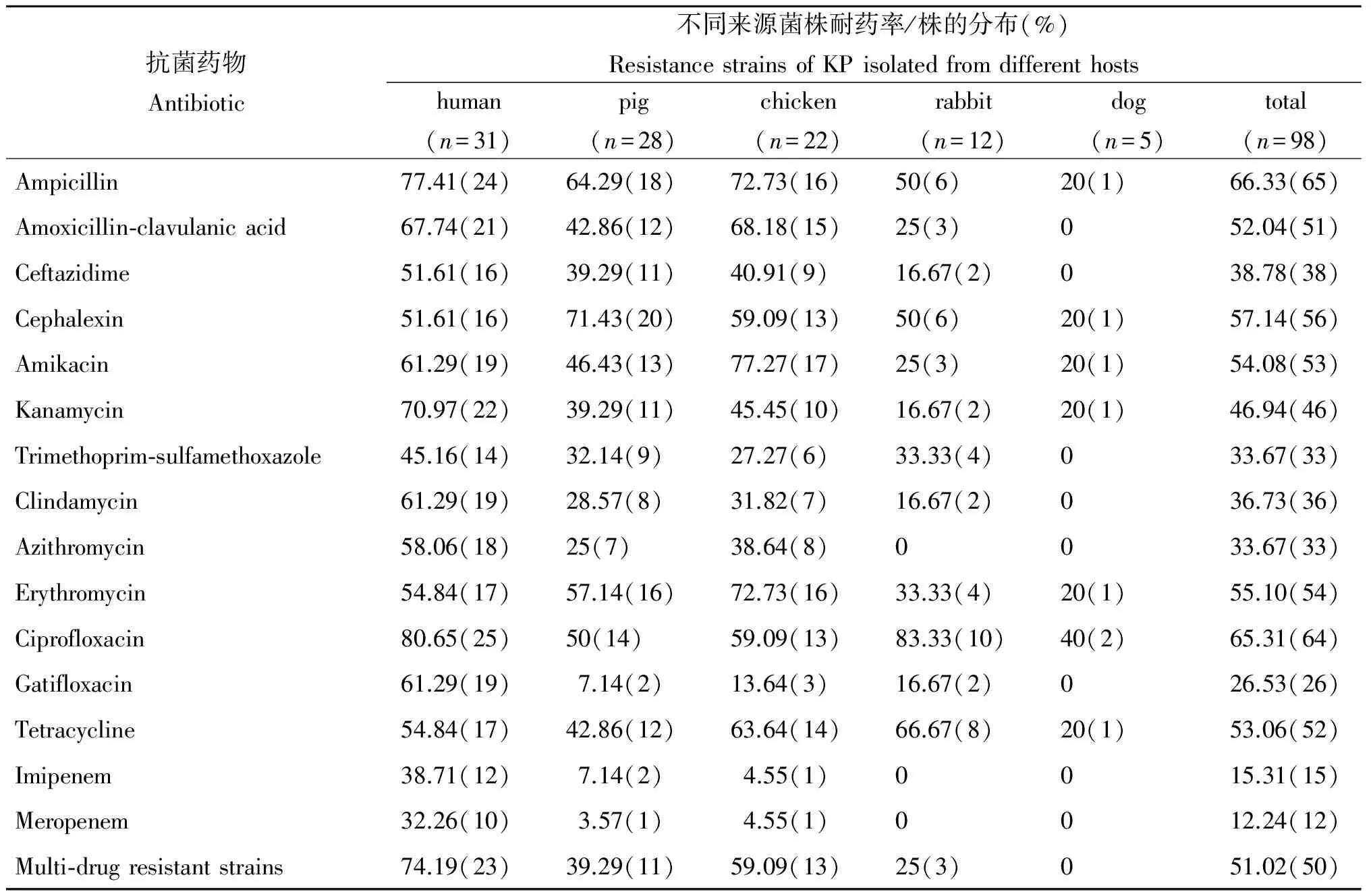
抗菌药物Antibiotic不同来源菌株耐药率/株的分布(%)ResistancestrainsofKPisolatedfromdifferenthostshuman(n=31)pig(n=28)chicken(n=22)rabbit(n=12)dog(n=5)total(n=98)Ampicillin77.41(24)64.29(18)72.73(16)50(6)20(1)66.33(65)Amoxicillin⁃clavulanicacid67.74(21)42.86(12)68.18(15)25(3)052.04(51)Ceftazidime51.61(16)39.29(11)40.91(9)16.67(2)038.78(38)Cephalexin51.61(16)71.43(20)59.09(13)50(6)20(1)57.14(56)Amikacin61.29(19)46.43(13)77.27(17)25(3)20(1)54.08(53)Kanamycin70.97(22)39.29(11)45.45(10)16.67(2)20(1)46.94(46)Trimethoprim⁃sulfamethoxazole45.16(14)32.14(9)27.27(6)33.33(4)033.67(33)Clindamycin61.29(19)28.57(8)31.82(7)16.67(2)036.73(36)Azithromycin58.06(18)25(7)38.64(8)0033.67(33)Erythromycin54.84(17)57.14(16)72.73(16)33.33(4)20(1)55.10(54)Ciprofloxacin80.65(25)50(14)59.09(13)83.33(10)40(2)65.31(64)Gatifloxacin61.29(19)7.14(2)13.64(3)16.67(2)026.53(26)Tetracycline54.84(17)42.86(12)63.64(14)66.67(8)20(1)53.06(52)Imipenem38.71(12)7.14(2)4.55(1)0015.31(15)Meropenem32.26(10)3.57(1)4.55(1)0012.24(12)Multi⁃drugresistantstrains74.19(23)39.29(11)59.09(13)25(3)051.02(50)
2.2肺炎克雷伯菌粘液表型及毒力基因 粘液表型试验结果显示医源菌株有15株阳性,占48.39%;猪源菌株阳性有5株,占17.86%;鸡源菌株阳性有3株,占13.64%;兔源和犬源菌株均为阴性。毒力基因magA和rmpA检测结果表明,98株不同来源肺炎克雷伯菌中携带magA基因有24株、rmpA基因有35株,其中医源菌株检出率最高,分别占38.71%(12/31)和61.29%(19/31);犬源菌株检出率最低,各检出1株携带这两种毒力基因,结果见表2。
2.3ESBLs菌株表型试验与耐药基因 产ESBLs试验结果显示,98株肺炎克雷伯菌中有57株阳性,其中医源菌株为22株,占38.60%;其次为鸡源菌株有16株,占28.07%;猪源菌株有15株,占26.32%;犬源和兔源分离株各有2株,占3.51%,结果见表2。耐药基因碳氢酶烯酶(blaKPC、blaNDM)、超广谱β-内酰胺酶(blaCTX-M、blaTEM、blaSHV)和喹诺酮耐药基因(qnrA、qnrB)的PCR扩增结果见表2。由表2可知医源菌株blaKPC的检出率最高,占54.84%,犬源菌株和兔源菌株未检出blaKPC基因。blaNDM基因仅在医源菌株中检出2株。98株肺炎克雷伯菌中,超广谱β-内酰胺酶基因的检出率分别为blaCTX-M23.47%,blaTEM29.59%、blaSHV15.31%,各耐药基因在不同菌株中检出率的分布见表2。qnrA基因的检出率在鸡源菌株中最高为72.73%(16/22),其次为猪源菌株39.29%(11/28)、医源菌株22.58%(7/31)。qnrB基因在猪源菌株检出率最高为50%(14/28),犬源菌株中未检测到qnrB基因。
2.4MLST分型 98株不同宿主来源的肺炎克雷伯菌归为18个ST型。其中猪源菌株有6个ST型,鸡源菌株有5个ST型、医源菌株和兔源菌株各有4个ST型、犬源菌株有3个ST型(表2)。由表2可见,ST11为医源、犬源、猪源菌株共有的序列型,ST235为医源和鸡源菌株共有,ST258为医源和猪源菌株共有。来源不同的菌株ST型流行趋势也不同,总的来看,肺炎克雷伯菌在鸡源菌株中主要流行为ST37(40.9%)、猪源菌株为ST258(35.7%)、兔源菌株为ST60(50%)、犬源菌株为ST11(60%),医源为ST11(67.74%)。
2.5分子型与耐药基因、毒力基因的相关性 粘液表型结合分子型分析发现,高粘液菌株主要为ST11、ST235、ST258,分别占52.17%、17.39%和17.39%。对毒力基因分析发现rmpA基因在ST11、ST235、ST258 3种分子型中共检出25株,占71.43%,magA基因检出17株,占70.83%。由此可见,携带的毒力基因rmpA、magA和粘液表型与细菌的分子分型有一定的相关性。
耐药基因分析发现有22株肺炎克雷伯菌检出blaKPC基因,分布在5个ST型中,其中ST11最多,占54.55%(12/22)。blaCTX-M、blaSHV、blaTEM基因分别分布在7个、6个、8个ST型中,而qnrB、qnrA基因各自分布在不同的10个ST型中(见表2)。同时检出2个及2个以上耐药基因的ST型有ST11、ST258、ST235、ST37、ST23、ST106、ST60、ST1863、ST270,结合耐药表型发现,多重耐药菌株大多属于这些ST型。ST11和ST258型是检出携带耐药基因最多的,但发现不同来源的菌株其携带的基因也不同,医源ST11、ST258菌株携带blaCTX-M、blaTEM基因高,而猪源菌株ST11、ST258携带qnrA、qnrB高。
表2 不同来源肺炎克雷伯菌MLST分型、耐药基因、毒力基因分布
Tab.2 Virulence gene and resistent gene and MLST types of KP isolated from different hosts

菌株来源strainsoriginST型STtype菌株数numberofstrains拉丝试验(+)stringingtestESBLs表型试验(+)ESBLstypestest耐药基因分布distributionofresistantgene毒力基因分布distributionofvirulencegeneblaKPCblaNDMblaCTX⁃MblaTEMblaSHVqnrAqnrBmagArmpAHuman(31)ST232----1-1121-ST235a2222--11-112ST11b2110161111071064713ST258c6344112--334Chicken(22)ST235a3231-12-3112ST379161-16-7511ST20194-4---1-4-2ST20215-21--1-2211ST7261-1----1-1--Pig(28)ST11b6241-11-2423ST258c10181-42-4221ST2703-----2--21-ST106523--13-3412ST18633-------22--ST2631------1--1-Rabbit(12)ST174----------ST1481---------1-ST606-1--3-121-2ST1681-1--------1Dog(5)ST11b3-1---1---1-ST651-1-----1--1ST741-----------合计18∗98235722223291537342435
注:相同字母表示同一ST型,“*”ST型的总数,“-”为阴性
Notes: the same letter showed the uniform ST type; “*” is the numbers of ST types; “-” is not detected
3 讨 论
本研究对98株不同来源的肺炎克雷伯菌的药敏试验分析发现,医源菌株的耐药率高于动物源菌株,同时在动物源菌株中,鸡源与猪源菌株的耐药率明显高于兔源和犬源的菌株,这主要是细菌所处的环境压力所导致的。在医院临床上,常常联合使用多种抗生素治疗各种感染,导致细菌抗生素选择压力增加,产生耐药性。在动物源菌株中,由于在养鸡和养猪生产过程常使用抗生素来促生长和预防疾病,而兔和犬接触抗生素的几率相对较少,所以兔源、犬源菌株的耐药率较低。在抗生素的使用上,一些新合成的、价格昂贵的药物,很少在动物中使用,故对其产生的耐药性较低,如加替沙星、亚胺培南、美罗培南等药物在动物中很少使用,本研究发现医源菌株对这些的耐药率要显著高于动物源菌株。为进一步减少耐药性,需要生产中减少抗生素的使用、临床上合理使用抗生素,同时开发一些新型药物或抗生素的替代品来防控该菌。
高粘液性的肺炎克雷伯菌被认为是高毒力菌株,这些菌株往往携带magA、rmpA毒力基因[12]。在本研究中发现粘液表型阳性的菌株有23株,而携带有magA、rmpA毒力基因分别有24株、35株,尽管大部分高粘液菌株均同时携带这两种基因,但有一些菌株只携带其中之一,而携带有magA、rmpA毒力基因的菌株表型不一定表现出高粘液特征,由此可推测可能还有其它因子或机制参与了粘液表型的形成。另外本研究发现即使是同一类ST分子型,医源菌株产生高粘液特性大于动物源菌株,这暗示粘液特性的产生可能与宿主有关,这一问题有待后续研究。一些研究表明医院流行的高粘液菌株主要为ST23、ST65和ST86[13],但在本研究中高粘液菌株主要为ST11、ST258和ST235,而ST23并未表现高粘液特性,与文献报道不一致。进一步分析发现,本研究的ST23菌株只检测到magA基因,未检测到rmpA基因,可见rmpA基因可能是形成粘液表型的重要因素之一。
MLST分析表明,在医源菌株中主要流行型ST11型,这与有关文献报道相一致[14-15];ST258是猪源菌株主要流行的分子型,与Jolene等(2015)[16]报道相似。本研究发现ST11为医源、犬源、猪源菌株共有的分子型,ST235为医源和鸡源菌株共有,ST258为医源和猪源菌株共有。结合表型特征、耐药基因和毒力基因分布发现,这些共有的ST型表现出相似的高粘液、高毒力、多重耐药的共同特点,揭示了分子型相同的菌株其表型特征也相似。分子型ST11、ST235、ST258为人源和动物源菌株交叉存在分子型,表明这些分子型菌株存在人与动物间传播的风险。
综上,本研究在对不同来源肺炎克雷伯菌耐药性及分子特性调查表明,一些在不同宿主间流行的菌株具有交叉的分子型和相似的表型,表明携带这些分子型的菌株存在人与动物间传播的风险。因此,在医院临床和动物生产中不仅要合理使用抗生素来防止耐药性的产生,更要加强这些细菌分子流行病学的监测,来减少该菌在人和动物间传播的风险。
[1] China Antimicrobial Resistance Surveillance System. Reports of CHINET surveillance of bacterial resistance in 2015[EB/OL](2015-12-25)[2016-12-27]. http://www.carss.cn/Sys/res/ ( in Chinese)
全国细菌耐药监测网. 2015 年全国细菌耐药监测报告.http://www.carss.cn/Sys/res/[EB/OL](2015-12-25)[2016-12-27]
[2] Lin XY, Wang Y, Yang ZX, et al. Isolation and identification ofKlebsiellapneumoniaefrom swine[J]. Chin J Prevent Vet Med, 2015, 37(5): 375-378. (in Chinese)
林星宇,王印,杨泽晓,等.猪源肺炎克雷伯菌的分离鉴定[J].中国预防兽医学报, 2015,37(5):375-378.
[3] Wang YY, Liu H, Du X, et al. The study on epidemic characteristics of an outbreak of pan-resistanceKlebsiellapnermoniae[J]. Chin J Microbiol Immunol, 2011, 31(3): 208-212. (in Chinese)
王艳艳,刘红,杜昕,等.泛耐药肺炎克雷伯菌株的医院内流行特性的研究[J].中华微生物学和免疫学杂志, 2011,31(3): 208-212.
[4] Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance[J]. Clinical Microbiol Infect, 2012, (18): 268-281.
[5] Lu HY, Zhang HQ, Yao XD, et al. Sequence analysis of plasmid inKlebsiellapneumoniaeKF3[J]. Chin J Microbiol Immunol, 2010, 30(10): 892-896. (in Chinese)
陆红云,张洪勤,姚晓鼎, 等.一株多重耐药肺炎克雷伯菌KF3的质粒研究[J].中华微生物学和免疫学杂志, 2010, 30(10):892-896.
[6] Chen IL, Lee CH, Su LH, et al. Antibiotic consumption and healthcare-associated infections caused by multidrug-resistant Gram-negative Bacilli at a large medical center in Taiwan from 2002 to 2009: Implicating the importance of antibiotic stewardship[J]. PLoS One, 2013(8): e65621.
[7] Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168.
[8] Ma LC, Fang CT, Lee CZ, et al. Genomic heterogeneity inKlebsiellapneumoniaestrains is associated with primary pyogenic liver abscess and metastatic infection[J]. J Infect Dis, 2005, 192(1): 117-128.
[9] Yu WL, Ko WC, Cheng KC, et al. Association between rmpA and magA genes and clinical syndromes caused byKlebsiellapneumoniaein Taiwan[J]. Clin Infect Dis, 2006, 42(10): 1351-1358.
[10] Wu JJ, Ko WC, Tsai SH, et al. Prevalence of plasmid-mediated quinolone resistance determinants QnrA, QnrB, and QnrS among clinical isolates of Enterobacter cloacae in a Taiwanise hospital[J]. Antimicrob Agents Chemother, 2007, 51(4): 1223-1227.
[11] Diancourt L, Passet V, Verhoef J, et al. Multilocus sequence typing ofKlebsiellapneumoniaenosocomial isolates[J]. J Clinical Microbiol, 2005, 43(8): 4178-4182.
[12] Luo Y, Wang Y, Ye L, et al. Molecular epidemiology and virulence factors of pyogenic liver abscess causingKlebsiellapneumoniain China[J]. Clin Microbiol infect, 2014, 20: 0818-0824.
[13] Qu TT, Zhou JC, Jiang Y, et al. Clinical and microbiological characteristics ofKlebsiellapneumonialiver abscess in East China[J]. BMC Infect Dis, 2015, 15(1): 161.
[14] Wang F, Zhu DM, Hu FP, et al. 2012 CHINET surveillance of bacterial resistance in China[J]. Chin J Infect Chemother, 2013, 13(5): 321-329. (in Chinese)
汪复,朱德妹,胡付品,等. 2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志, 2013(5):321-329.
[15] Yang M, Wang P, Xu XQ, et al. Resistance genes distribution and molecular typing characteristics of carbapenem-risistantKlebsiellapneumonia[J]. Chin J Zoonoses,2016,32(12):1039-1043.DOI:10.3969/j.issn.1002.2694.12.001 (in Chinese)
杨梦,王鹏,徐晓倩,等.碳青霉烯类抗生素耐药肺炎克雷伯菌耐药基因分布和分子分型[J].中国人兽共患病学报, 2016,32(12):1039-1043.
[16] Jolene R, Bowers L, Brandon K, et al. Genomic analysis of the emergence and rapid global dissemination of the clonal group 258Klebsiellapneumoniaepandemic[J]. PLoS One, 2015, 10(7): e0133727.
Drug-resistantandmolecularcharacteristicofKlebsiellapneumoniaeisolatedfromnosocomialandanimalorigins
YANG Fan1, DENG Bao-guo1, WEI Ji-dong1, ZHAO Yong-xin2, LI Min1
(1.DepartmentofMicrobiology,XinxiangMedicalUniversity,Xinxiang453003,China;2.ThethirdHospitalofXinxiangMedicalUniversity,Xinxiang453003,China)
We aimed to detect the drug-resistant and molecular characteristic ofKlebsiellaPneumoniae(KP) isolated from different hosts origin, and to investigate the infection possibility between animals and humans. A total of 98 KP strains were collected in Henan Province from March 2013 to December 2014. Drug-resistance to 15 antibiotics was detected by K-B diffusion methods. The phenotype of produce mucus was determined by stringing test. Seven drug-resistant gene and 2 virulence gene were amplified by PCR technique. Molecular types were analysis by MLST. The resistant rate of KP isolated from nosocomial was higher than those isolated from animals. Among animal strains, the resistant rate of KP isolated from chickens and pigs were higher than that from rabbits and dogs. The multidrug resistant (MDR) of nosocomial isolates were the highest (74.19%). There were 18 STs among 98 KP strains. The main prevalent types were ST37 in chicken, ST258 in pigs, ST60 in rabbits, ST11 in dogs and nosocomial respectively. ST11 was common epidemic types among nosocomial, dogs and pigs. ST235 was common molecular types among chicken and human. ST258 existed in both nosocomial and pigs. ThermpA gene andmagA gene were detected in ST11, ST235 and ST 258, producing higher mucus. TheblaKPCgene was 54.84% in nosocomial strains, but not been detected in dog and rabbit strains. The distribution of ESBLs gene in nosocomial was higher than those in animals, butqnrA gene andqnrB gene were higher in chicken than in human. The multidrug resistant gene was the highest distribution in ST11, ST258 and ST235. There were some differences in phenotype of drug-resistance, producing mucus and molecular characteristics, but ST11, ST258 and ST235 were common types of KP isolates from different host origins.
Klebsiellapneumoniae; drug-resistant; MLST; nosocomial; animal origin
10.3969/j.issn.1002-2694.2017.10.007
河南省高等学校青年骨干教师资助项目(No.2015GGJS-134)
1.新乡医学院微生物学教研室,新乡 453003;
2.新乡医学院第三附属医院检验科,新乡 453003
Email:yangf77@163.com
R378
A
1002-2694(2017)10-0888-05
Supported by the University Youth Backbone Teachers Projects of Henan Province (No. 2015GGJS-134).
2016-12-28编辑张智芳

