黄药子配伍甘草对LO2细胞膜通透性影响的研究
卓实,江川,黄玉芳,潘艳琳
(福建中医药大学 附属人民医院 药学部,福建 福州 350004)
·基础研究·
黄药子配伍甘草对LO2细胞膜通透性影响的研究
卓实,江川*,黄玉芳,潘艳琳
(福建中医药大学 附属人民医院 药学部,福建 福州 350004)
目的研究甘草配伍能减轻黄药子对人肝细胞(LO2)膜通透性的影响。方法激光扫描共聚焦显微镜(LSCM)对经二乙酸荧光素(FDA)染色后的LO2细胞进行实时动态荧光强度检测。通过比较荧光强度的降低率来考察黄药子及其甘草配伍后含药血清在短时间内对细胞膜通透性的影响。结果LSCM记录细胞荧光强度变化,在10 min扫描停止时,黄药子各组荧光强度降低率与空白组有统计学差异(P<0.05),而甘草配伍组对荧光强度的影响较黄药子组有统计学差异(P<0.05),与空白组无差异(P>0.05)。结论黄药子含药血清短时间内即影响肝细胞膜通透性,甘草配伍后可明显减弱损伤作用,黄药子引起肝损伤的机制可能是其对肝细胞膜的直接损伤作用,甘草配伍减毒作用与此途径有关。
黄药子;甘草;膜通透性
黄药子原名黄独,又名零余薯、黄狗头、土芋、狗嗽、土首乌,为薯蓣科薯蓣属植物黄独DioscoreabulbiferaL.的块茎。黄药子味苦、辛,性凉,具有解毒消肿、化痰散结、凉血止血的作用,用于瘿疾瘤肿、喉痹、吐血、衄血、咯血等[1-2]。现主要用于治疗各种原因引起的甲状腺肿、各型癌症、银屑病、乳腺增生等症,应用广泛,疗效确切[3]。历代医书对黄药子毒性就有所记载,《全国中草药汇编》明确记载“苦,辛,凉,有小毒。”为更加合理利用黄药子药理活性而制约其有毒成分的危害,发挥黄药子的治疗效果,笔者通过前期实验已明确黄药子配伍甘草降低对肝脏的毒性[4]。本实验通过黄药子及其配伍甘草含药血清对肝细胞膜损伤实验,为配伍减毒增效机制的研究提供了前提,同时也为临床合理与安全应用中药提供理论与实验依据。
1 材料
1.1 试剂
黄药子饮片:产地广西,经福建中医药大学药学院中药鉴定教研室卢伟教授鉴定为薯蓣科植物黄独DioscoreabulbiferaL.的块茎;甘草饮片:产地甘肃,经福建中医药大学药学院中药鉴定教研室卢伟教授鉴定为豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎;中药饮片均购自福建回春医药连锁有限公司。DMEM培养基、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶(HyClone生物化学制品有限公司),胎牛血清(FBS,杭州四季青公司)。二乙酸荧光素(FDA,Solarbio公司)。
1.2 仪器及设备
LSM-710激光扫描共聚焦显微镜(德国ZEISS公司),Airtech超净工作台(苏州净化设备有限公司),HF212UV二氧化碳恒温培养箱(Thermo Forma公司),ECLIPSE生物显微镜(日本OLYMPUS)等。
2 方法
2.1 样品处理
黄药子饮片烘干,粉碎,10倍量水浸泡30 min,煎煮1 h,倒出药液过滤;药渣用8倍量水二次煎煮,煎煮1 h,合并2次药液;过滤除去药渣,后浓缩,以3000 r·min-1离心,除去药渣,再次浓缩至0.5 g·mL-1(以生药量计),用时稀释。
黄药子与甘草(1∶2)合煎剂同法煎煮制备药液,浓缩至0.5 g·mL-1(以黄药子生药量为计)。
2.2 动物分组及含药血清制备
雄性SD大鼠,清洁级,由福建中医药大学实验动物中心提供,许可证号:SCXK(沪)2007000520049。体重(200±20)g,随机分为5组,每组5只,黄药子高、中、低剂量组(给药剂量分别为10、5、1 g·kg-1)、配伍组(给药剂量10 g·kg-1,以黄药子量计)和正常对照组(蒸馏水)。灌胃给药7 d,最后一次灌胃全天量,灌胃后1 h,麻醉,腹主动脉采血。血液室温静置,离心,取上清液,过滤除菌,冻存。
2.3 细胞培养及荧光染色
细胞株:人正常肝细胞(LO2),购自中科院上海细胞库。于37 ℃、5%CO2培养箱中正常培养。
精密称取0.010 7 g二乙酸荧光素(FDA),溶于2 mL丙酮溶液,配制成5 mg·mL-1的准备液,取10 μL准备液用培养基配制成10 mL的工作液(10 μmol·L-1)。
取贴壁生长状况良好的细胞,调整细胞密度为1.5×105个·mL-1,取共焦显微镜培养皿(玻底),每孔加入1.5 mL单细胞悬液,待细胞贴壁后吸掉原培养基,用PBS溶液清洗2~3次,每孔加入FDA工作液1 mL,避光孵育2 h,每组重复3次。
2.4 LSCM监测细胞内荧光强度变化
激光扫描共聚焦显微镜选定细胞分布均匀、染色良好的视野;在开始检测时同时加入含药血清,获取时间序列图像(每隔10 s记录1次,连续记录10 min)。扫描停止后,每组选定6个细胞,由系统记录自动生成荧光强度曲线,导出细胞荧光强度数据,按公式(1)计算荧光强度降低率。
荧光强度降低率=[(初始荧光强度-测定时间荧光强度)/初始荧光强度]×100%
2.5 统计学分析
3 结果
各组细胞荧光染色后10 min内荧光强度见图1。每组扫描取6个细胞作为分析对象,5组细胞荧光强度在2、4、6、8、10 min时变化率见表1。

注:A.黄药子高剂量组;B.黄药子中剂量组;C.黄药子低剂量组;D甘草配伍组;E空白血清组。图1 各组LO2细胞荧光强度图(×400)
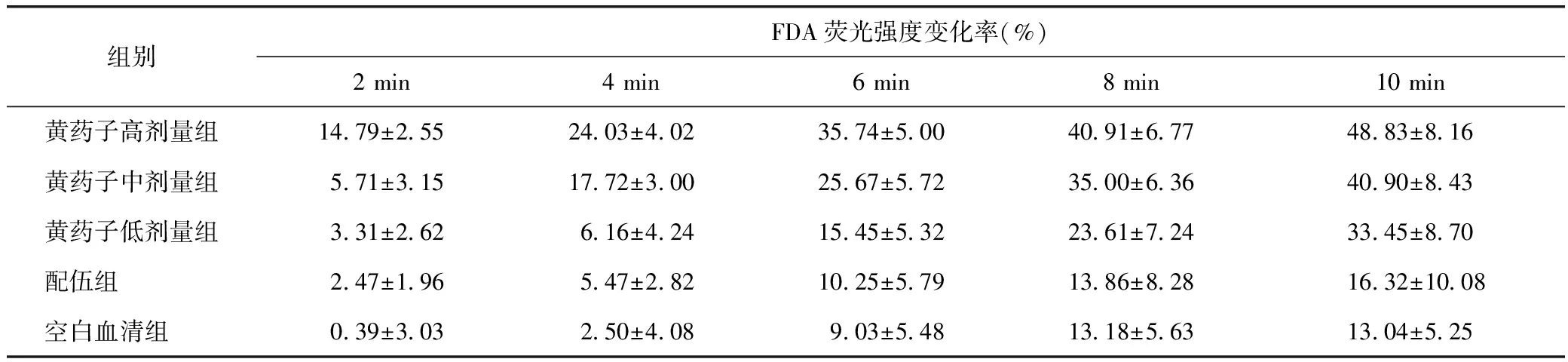
组别FDA荧光强度变化率(%)2min4min6min8min10min黄药子高剂量组1479±2552403±4023574±5004091±6774883±816黄药子中剂量组571±3151772±3002567±5723500±6364090±843黄药子低剂量组331±262616±4241545±5322361±7243345±870配伍组 247±196547±2821025±5791386±8281632±1008空白血清组 039±303250±408903±5481318±5631304±525
4 讨论
激光扫描共焦显微镜(LSCM),是在显微镜基础上配制激光光源、扫描装置、共轭聚焦装置和检测系统形成的新型显微镜。与荧光显微镜相比,LSCM具有高分辨率、高灵敏度的特点[5]。二乙酸荧光素(FDA)是一种本身并没有荧光的酯酶底物,只有被活细胞摄取后,在细胞非特异性酯酶的催化下才生成荧光素,经480 nm激光激发出波长为530 nm左右的绿色荧光。如果细胞膜受损而不完整,生成的荧光素很快从细胞中扩散,细胞内荧光强度将减弱[6-7]。
本实验采用LSCM对经过FDA荧光染色的细胞进行动态监测,通过持续记录加药前后较短时间内细胞荧光强度的变化,直观监测黄药子在配伍甘草后对细胞影响状况的变化。经过前期预试验,发现长时间的激光扫描损伤细胞,出现荧光强度减弱的情况;后期会出现细胞漂移的现象,从而影响结果分析,综合考虑设定激光扫描时长为10 min。实验结果显示:与空白血清组对比,黄药子各组对细胞的荧光强度均有较大的影响,随着扫描时间增长,各组细胞内荧光强度降低率增大;10 min扫描停止时,黄药子高、中、低剂量组荧光强度分别降低了(48.83±8.16)%、(40.90±8.43)%、(33.45±8.70)%,与空白组荧光强度降低率相比有统计学差异(P<0.01);配伍组荧光强度降低了(16.32±10.08)%,与黄药子各组荧光降低率相比有统计学差异(P<0.01),与空白血清组荧光强度降低率没有统计学差异(P>0.05)。黄药子高剂量组细胞荧光强度降低明显,与配伍组及空白对照组均有统计学差异(P<0.01);中剂量组细胞荧光强度较空白组差异显著,较配伍组显著升高(P<0.01);低剂量组在8 min时,与配伍组及空白组相比荧光强度降低率有统计学差异(P<0.05),而黄药子配伍甘草组细胞荧光强度降低率与黄药子高、中剂量组有统计学差异,在后期其与黄药子低剂量组也出现明显差异,与空白血清组没有明显差异。另外,空白血清组的荧光降低率随着扫描时间的延长而降低,这一结果考虑LSCM扫描会导致细胞内荧光强度减弱,与激光扫描导致荧光淬灭有一定的关系。
通过黄药子在10 min内导致荧光外泄引起细胞内荧光强度减弱的结果可以推断,短时间内黄药子影响细胞膜通透性,在细胞膜上形成孔洞,孔洞的大小至少可以通过该荧光分子,说明黄药子引起肝毒性早期机制可能与其增加肝细胞膜通透性、影响细胞膜的完整性有关;而配伍组含药血清对细胞的荧光强度的影响与空白血清组没有差别,说明甘草配伍黄药子后保护肝细胞膜的作用与此机制有关。
[1] 国家中医药管理局《中华本草》编委会.中华本草:下册[M].精选本.上海:上海科学技术出版社,1998:2103-2107.
[2] 《全国中草药汇编》编写组.全国中草药汇编:上册[M].北京:人民卫生出版社,1996:796-798.
[3] 杜丽霞,罗明媚,刘树民.黄药子现代毒理学研究进展[J].辽宁中医药大学学报,2007,9(3):71-72.
[4] 华碧春,卓实,史道华.等.甘草减轻黄药子肝毒性的研究[J].福建中医药大学学报,2013,23(1):23-25.
[5] 陈文列,吴锦忠.中西医结合科研实验方法学导读[M].北京:科学出版社,2011:111.
[6] 管增伟,王盛兰,李勇,等.凋亡细胞细胞膜和线粒体的动态变化[J].卫生研究,2000,129(2):83-86.
[7] 高新起,任秋萍,王转斌.保卫细胞液泡活体标记方法的比较[J].细胞生物学杂志,2008,30(3):41-44.
StudyonEffectofSynergyofGlycyrrhizauralensisandDioscoreabulbiferaonLO2CellsMembranePermeability
ZHUO Shi,JIANG Chuan*,HUANG Yufang,PAN Yanlin
(DepartmentofPharmacy,People'sHospitalAffiliatedtoFujianUniversityofTraditionalChineseMedicine,Fuzhou350004,China)
Objective:To study the synergic effect ofGlycyrrhizauralensisandDioscoreabulbiferaon LO2 Cells Membrane Permeability.MethodsThe real-time dynamic detection method LSCM was applied to monitor the fluorescence intensity of the LO2 cells staining by fluoesceim diacetate with the laser scanning confocal microscope,then the synergic effect ofD.bulbiferaandG.uralensison LO2 cells membrane permeability was observed by comparing the reduced rate of fluorescence intensity.ResultsWhen scanning was stopped at the tenth minutes,there was a significant difference between the blank group andD.bulbiferagroups in reducing the fluorescence intensity of cells (P<0.05),while theG.uralensisgroups had no obvious influence on the fluorescence intensity of cells.The changes of fluorescence intensity of cells were recorded by LSCM.ConclusionD.bulbiferacontaining serum has an effect on the hepatocyte membrane permeability in a short time after administration,while its compatibility group ofG.uralensisand the serum group have no significant effects on it.The hepatic injuries caused byD.bulbiferamay be via a coup injury mechanism,but this injury can be weaken by synergy ofG.uralensis.
DioscoreabulbiferaL.;GlycyrrhizauralensisFisch.;membrane permeability
*
江川,副主任中药师,研究方向:药事管理;E-mail:jc0591@163.com
10.13313/j.issn.1673-4890.2017.10.009
2017-02-27)

