血根碱对大鼠结肠炎及炎症通路中相关因子的影响△
柳亦松,唐昭山,刘兆颖,蒋昊航,段志贵,曾建国
(1.湖南农业大学 动物医学院,湖南 长沙 410128;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;3.湖南师范大学 生命科学学院,湖南 长沙 410081;4.湖南省植物功能成分利用协同创新中心,湖南 长沙 410128)
·基础研究·
血根碱对大鼠结肠炎及炎症通路中相关因子的影响△
柳亦松1,2,唐昭山1,刘兆颖1,2,蒋昊航1,段志贵3,曾建国2,4*
(1.湖南农业大学 动物医学院,湖南 长沙 410128;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128;3.湖南师范大学 生命科学学院,湖南 长沙 410081;4.湖南省植物功能成分利用协同创新中心,湖南 长沙 410128)
目的探讨血根碱对葡聚糖硫酸钠致溃疡性结肠炎的疗效及可能的机制。方法建立葡聚糖硫酸钠致溃疡性结肠炎大鼠模型,随机分为空白组、模型组、柳氮磺吡啶组、血根碱组。观察各组大鼠体质量、腹泻及隐血情况;通过荧光定量PCR(qPCR)分析炎症因子IL-1β、IL-6、IL-10、TNF-α在结肠组织中的表达量;利用免疫组化实验检测NF-κB通路中关键因子p65。结果与模型组相比,血根碱组和阳性组大鼠的结肠组织中炎症因子IL-1β、IL-6表达降低,而IL-10的表达升高;同时,免疫组化实验发现血根碱组与模型组相比,其核内转入因子核蛋白p65显著下调。结论血根碱可能通过调节NF-κB通路中的核转入因子p65,降低炎症因子IL-1β、IL-6的表达,同时提高炎症因子IL-10的表达,从而对炎症起到抑制作用。
血根碱;结肠炎;炎症因子;NF-κΒ(p65)
肠道与动物的健康生长有着密切的联系,保护好肠道的健康[1],对动物生长有着重要的作用。目前动物炎性肠病(IBD)主要包括溃疡性结肠炎(UC)和克罗恩病,这种疾病防治越来越困难。炎性因子在溃疡性结肠炎的发展过程中起着关键性的作用。促炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)在溃疡性结肠炎的血清中显著增加。IL-10是一种多能干细胞因子,它在炎症过程中起重要的抑制作用;在炎症性肠病患者中,可以检测到IL-10的表达水平超出正常值。NF-κB是炎症发生的重要信号通路之一[2-3],尤其对于促炎性细胞因子的调节。NF-κB家族包括5个成员:KRelA(P65)、RelΒ、c-Rel、P(105/50/52)和P100。在未受刺激的细胞中,NF-κB是以p50和p65二聚体形式处于失活状态。刺激后,核蛋白二聚体磷酸化或降解,核转入因子NF-κB由胞浆转入细胞核[4],进而产生更大的炎症反应。有文献表明[5-6],在炎性疾病患者的结肠黏膜中巨噬细胞增加,同时炎症因子TNF-α,IL-1和IL-6的表达也增加,表明NF-κB的活化增加了炎性细胞因子的表达。因此,有效抑制NF-κΒ途径、调节细胞因子的表达,有利于减轻炎性疾病。
血根碱是一种主要存在于罂粟科、蓝堇科及芸香科植物中的苯并菲啶类生物碱,主要来源植物为血水草、博落回和白屈菜,化学结构见图1,具有抗炎、抗菌、促进动物生长、抗肿瘤及杀虫等作用[7-9],其作为一种植物源成分,还具有低残留、无环境污染等优点,在兽医领域具有抗菌作用和促进动物生长等的应用前景。近年许多实验研究表明,血根碱在抑制炎症的发生发展中具有重要价值[2-3]。
血根碱(Sanguinarine,SA)图1 血根碱结构式
溃疡性结肠炎临床症状为腹泻和黏液脓血便等特征,病变在肠道黏膜及黏膜下层,在病变部位形成溃疡、隐窝脓肿、杯状细胞减少、炎性细胞浸润等。常见的人造动物溃疡性结肠炎模型有葡聚糖硫酸钠(DSS)模型、乙酸模型、角叉菜胶模型等。DSS模型广泛用于研究腹泻及炎症[10-12]。该方法采用5% DSS水溶液给大鼠自由饮用,连续7 d,大鼠的病变从肛门开始自后而前地发展,黏膜充血水肿,散在性糜烂或溃疡;在4~5 d出现腹泻,用隐血试纸检测成阳性,在5~7 d可出现不同程度的肉眼便血。大鼠出现腹泻的同时,体质量也会减轻,呈现以淋巴细胞浸润为主的非特异性炎症,与人类的溃疡性结肠炎(UC)病变类似。本实验采用DSS模型来验证血根碱的抑制或缓解大鼠结肠炎的作用并说明其可能的机制。
1 材料
1.1 动物
SD大鼠,SPF级,体质量(200±10)g、雄性,由湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK湘2011-0003。
1.2 主要药品与试剂
葡聚糖硫酸钠(DSS,MP Biomedicals,LLC,Cat No.160110 M.W=36 000~50 000)、便隐血(FOB)检测试纸(艾博生物医药有限公司,批号:2015020127)、柳氮磺吡啶肠溶片(上海中西三维药业有限公司,批号:20141115)、98%氯化血根碱(湖南美可达生物资源股份有限公司,批号:1408011)、羧甲基纤维素钠CMC-Na(北京北瑞达医药科技有限公司,批号:20121015)、qPCR Master Mix 2×(Cat:#K0361)购自Thermo Scientific 公司;动物组织RNA提取试剂盒(Cat:#DP431)购自天根生物科技有限公司;Prime ScriptTM RT Master Mix第一链合成试剂盒(Cat:RR036A)购自TaKaRa公司。p65 免疫组化试剂盒(上海科彩生物科技有限公司,批号:20120406)。
1.3 主要仪器
7300荧光定量PCR仪器(美国应用生物系统公司),MILLI-Q纯水仪(德国默克-密理博实验室设备有限公司),J12-21M型离心机(Beckman Model),CR21型高速立式离心机(HITACHI),DRP-9271型电热恒温培养箱(上海森信试验仪器有限公司)。
2 方法
2.1 分组
选取健康大鼠32只,全部雄性,体质量为(200±10)g,恒温25 ℃适应性饲养3 d后,随机分为4组:空白组、模型组、柳氮磺吡啶组、血根碱组。
2.2 实验模型建立与给药方式
第1天到第14天血根碱组和柳氮磺吡啶组大鼠每天分别按体质量灌胃75 mg·kg-1的血根碱(该剂量设定来自于前期研究基础)[10]和225 mg·kg-1的柳氮磺吡啶[13],灌胃体积为1 mL,空白组、模型组灌胃等体积的CMC-Na溶液;模型组、柳氮磺吡啶组和血根碱组在第8天到第14天自由饮用含5% DSS的蒸馏水,空白组饮用蒸馏水。
2.3 实验观察与记录
每天定时(早上9时)称量并记录每只大鼠体质量,大便性状及出血级别,并计算每只大鼠的日常疾病活动指数(DAI)。DAI具体评分指标见表1,DAI=(体质量+大便性状+便血)评分/3。

表1 DAI具体指标评价方法
注:大便正常:正常成形的;大便松软:黏糊状,但并不黏在肛门上;腹泻:粪便呈液体状,在肛门处有残留;粪便潜血检测:使用便隐血(FOB)快速检测试纸检测。
2.4 动物处理
第15天处死大鼠,取出结肠,一部分保存于甲醛溶液中,用于观察结肠部位的病理变化;一部分结肠组织和血清于-80 ℃保存,用于炎症因子的检测。
2.5 荧光定量PCR
总RNA提取:每组大鼠结肠组织各自于-80 ℃取50 mg立即放入装有液氮的研钵,用研钵棒研磨成粉末状,加入RNA提取试剂盒对应量体积的RL裂解液,后续步骤按试剂盒提取操作说明,获得总RNA。各组取1 μg RNA进行cDNA第一链的合成。利用表2设计好的引物对炎症因子IL-1β、IL-6、IL-10、TNF-α进行荧光定量(qPCR)分析。qPCR条件:95 ℃ 30 s 1个循环;95 ℃ 15 s,60 ℃ 30 s,40个循环。数据采用2-ΔΔCt方法处理,对每个组织设立3个重复,首先计算各组织的目的基因与β-actin的Ct差值,即ΔCt=Ct(目的基因)-Ct(β-actin),选取空白组的平均ΔCt作为对照,用其他基因的ΔCt减去其平均ΔCt,即为ΔΔCt;2-ΔΔCt表示各组织基因的表达相对于空白组基因的变化倍数。
2.6 免疫组化和HE染色
2.6.1 石蜡制片 取保存在10%甲醛溶液中的结肠组织进行石蜡切片:第一步,石蜡包埋,取结肠组织进行方块修整用纱布包好置流水下冲洗过夜,再进行70%、80%、95%、100%乙醇进行脱水,二甲苯进行透明,置于溶好的石蜡中进行包埋。第二步,将包埋好的组织在切片机上切成厚度4 μm并贴片到载玻片上。制成好的切片将进行HE染色和免疫组化。

表2 相关炎症因子的引物
2.6.2 免疫组化 切片脱蜡、水化:二甲苯10 min→100%乙醇5 min→95%乙醇5 min→90%乙醇5 min→85%乙醇5 min→80%乙醇5 min→75%乙醇5 min→60%乙醇5 min→50%乙醇5 min→30%乙醇5 min→自来水1 min;PBS洗2~3次各5 min;3%H2O2(80%甲醇)滴加在切片上,室温静置10 min;PBS洗2~3次各5 min。抗原修复:利用枸橼酸钠缓冲液(pH=6.0)在微波炉中加热至沸腾,然后将脱腊、水化的组织切片放入,断电,间隔5~10 min,反复1~2次;PBS洗2~3次各5 min;滴加正常山羊血清封闭液,室温静置20 min,甩去多余液体;滴加Ι抗(p65抗体)50 μL,室温静置1 h或4 ℃过夜或37 ℃ 1 h;4 ℃过夜后需在37 ℃复温45 min;PBS洗3次每次2 min;滴加Ⅱ抗45~50 μL,室温静置或37 ℃1 h;PBS洗3次各5 min;DAB显色5~10 min,在显微镜下掌握染色程度;PBS或自来水冲洗10 min;苏木精复染2 min,盐酸乙醇分化;自来水冲洗10~15 min;脱水、透明,30%乙醇3 min→50%乙醇3 min→70%乙醇3 min→80%乙醇3 min→90%乙醇3 min→95%乙醇3 min→100%乙醇3 min→二甲苯20 min;封片、镜检。免疫组化后观察p65蛋白在结肠中的表达情况。
免疫组化结果评判标准:1)阳性着色细胞数:每只大鼠观察5张切片、每张切片上观察5个高倍视野(×200),计数阳性细胞百分比,阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。2)阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。3)两者计分相乘即为阳性等级。
2.6.3 HE染色 脱蜡:二甲苯Ⅰ10 min→二甲苯Ⅱ5 min;水化:100%乙醇Ⅰ5 min→100%乙醇Ⅱ5 min→95%乙醇Ⅰ5 min→95%乙醇Ⅱ5 min→85%乙醇3 min→5%乙醇2 min→蒸馏水冲洗1 min;染色:苏木精染色5 min→自来水洗→盐酸乙醇分化15 s→自来水洗15 min→蒸馏水洗2 min→75%乙醇2 min→85%乙醇2 min→0.5%伊红染色1 min→95%乙醇Ⅰ5 min→95%乙醇Ⅱ5 min→100%乙醇Ⅰ 5 min→100%乙醇Ⅱ5 min→二甲苯Ⅰ5 min→二甲苯Ⅱ5 min;封片:中性树胶封片,上述处理好的玻片,取中性树胶滴入载玻片的组织上,取盖玻片从一端逐步盖下去,避免发生气泡。HE染色后观察结肠组织病理情况。
2.7 统计方法
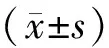
3 结果
3.1 DAI指数
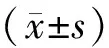

注:与模型组相比,*P<0.05;下同。图2 各组大鼠DAI
3.2 炎症因子的表达


图3 IL-1β炎症因子表达
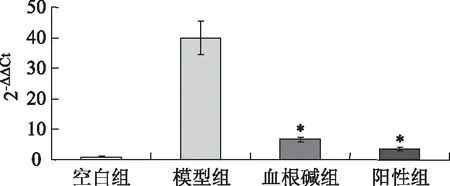
图4 IL-6炎症因子表达


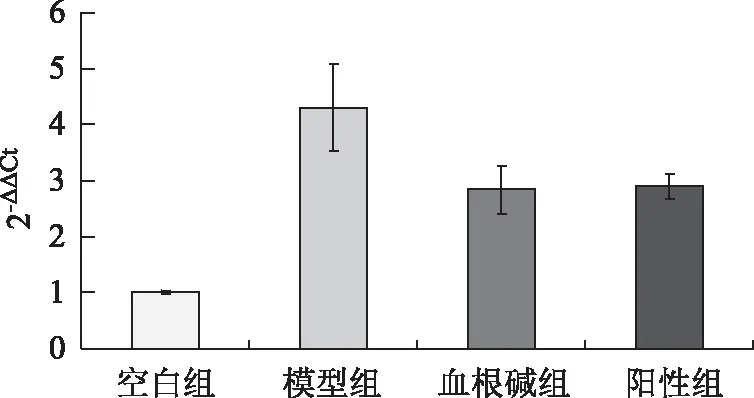
图5 TNF-α炎症因子表达

图6 IL-10抑炎因子表达
3.3 HE染色和免疫组化
3.3.1 HE染色 根据图7可见空白组杯状细胞较多,具有纹状缘;模型组纹状缘消失,杯状细胞减少,并且有许多炎性细胞产生。该实验结果表明葡聚糖硫酸钠对大鼠造模成功,符合实验预期结果。
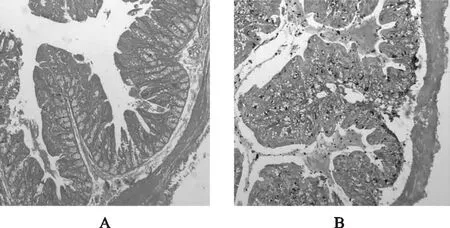
注:A.空白组;B.模型组。图7 大鼠结肠组织HE染色
3.3.2 免疫组化 空白组大鼠NF-κB(p65)蛋白阳性细胞正常表达(见图8A),模型组中NF-κB(p65)蛋白阳性细胞最多(见图8B);血根碱组(见图8C)和阳性组(见图8D)NF-κB(p65)蛋白阳性细胞低于模型组,差异具有统计学意义,但高于空白组。通过表3组织免疫评分结果分析:模型组阳性等级为强阳性(+++,10.26±1.61),血根碱组的阳性等级为弱阳性(+,3.20±0.96),统计学分析P=0.009,差异具有统计学意义,血根碱组大鼠炎症情况明显得到了缓解,趋于正常大鼠。结果表明在正常情况下,大鼠炎症因子NF-κB(p65)也有表达,在给予血根碱后大鼠炎症因子NF-κB(p65)表达显著降低。分析血根碱可能降低炎症因子NF-κB(p65)表达,抑制或缓解炎症发生。
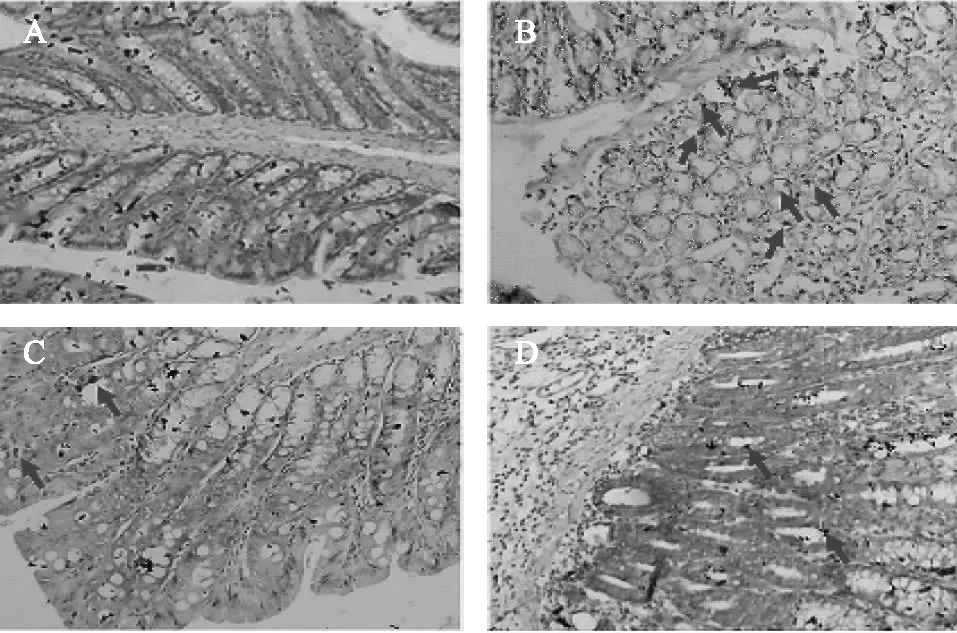
注:A.空白组;B.模型组;C.血根碱组;D.阳性组;箭头指的为阳性细胞。图8 大鼠NF-κB(p65)蛋白免疫组化
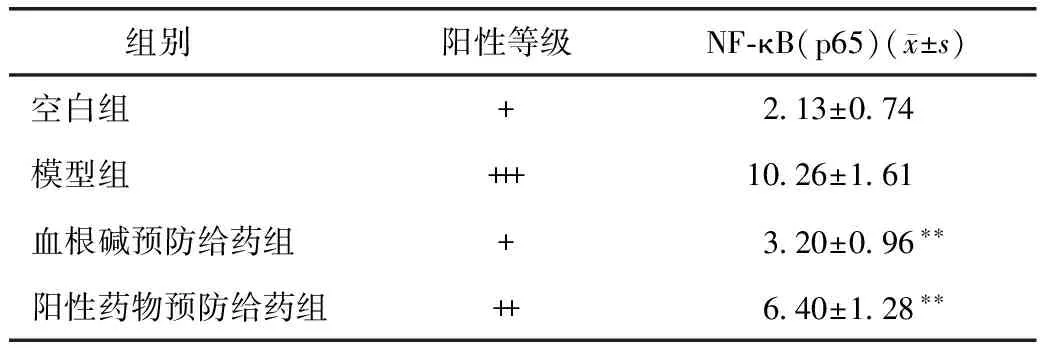
组别 阳性等级NF⁃κB(p65)(x±s)空白组+213±074模型组+++1026±161血根碱预防给药组+320±096∗∗阳性药物预防给药组++640±128∗∗
注:与模型组相比,**P<0.01。
4 讨论
本研究主要基于葡聚糖硫酸钠(DSS)诱导大鼠结肠炎模型,这种结肠炎造模方式已经得到了大量的实验验证,并且被普遍接受[12-13]。在此基础之上,实验通过预防灌胃75 mg·kg-1·d-1血根碱14 d,其中在第8天进行DSS诱导结肠炎大鼠模型,大鼠的DAI与模型组比较具有统计学差异。该结果表明血根碱在临床症状上能起到影响体质量、减缓便血的产生,说明血根碱对治疗大鼠结肠炎具有一定的保护作用。
DAI测量的指标主要包括体质量、粪便的软硬和粪便中的隐血[13],这3个指标能够较好地反映所检测动物的生理机能。本实验中的结果表明,血根碱能够显著减缓葡聚糖硫酸致大鼠炎症的产生和增强大鼠对疾病的抵抗,在生长过程中保持健康。动物临床表现为血根碱组大鼠较模型组的大鼠更活跃和日增重高。该结果说明血根碱能够预防动物疾病和保持动物的日增重。
组织病理变化能较客观地反映机体的防御表现。在免疫系统中上皮细胞具有先天的天然屏障作用,同样也具有许多与免疫相关的细胞,比如巨噬细胞、淋巴细胞、杯状细胞,这些细胞数量和形态的改变对机体免疫的第一道防御功能具有重要意义。该实验病理切片表明,血根碱能较好地保护上皮细胞中的杯状细胞,能使得杯状细胞的形态保持完整,同时保障其发挥正常的生理反应。
白介素调节因子(IL)和肿瘤坏死因子(TNF-α)在机体的免疫系统具有非常重要的作用,如IL-1、IL-6和IL-10在炎症通路上能影响NF-κB(p65)蛋白的表达,从而影响NF-κB炎症通路。在该实验中,我们从荧光定量和免疫组化的实验结果来看,血根碱可能抑制IL-1、IL-6和TNF-α的表达,联级反应后能使NF-κB的表达降低。从机体中多种蛋白质分子中的表达来看,血根碱在抑制炎症上可能是通过下调IL-1、IL-6和TNF-α的表达来抑制炎症的产生。同样,IL-10在炎症通路上是抑制炎症发展的重要调节因子。因此该实验表明,血根碱能够显著提高IL-10调节因子的表达。基于以上结果,我们认为血根碱不仅能下调促炎因子的表达,还能提高抑炎因子的表达,通过这两条途径来共同减缓炎症的发生发展。血根碱通过影响白介素和肿瘤坏死因子的表达来调节炎症的变化,是否还通过其他途径来调节机体免疫机制,还需要结合转录组学和蛋白质组学技术等动态变化分析技术进行更深入的研究。
[1] 郑璇,郑育洪.国内外超级细菌的研究进展及防控措施[J].中国畜牧兽医文摘,2013,28(1):69-75.
[2] Niu X,Fan T,Li W,et al.Protective effect of sanguinarine against acetic acid- induced ulcerative colitis in mice[J].Toxicol Appl Pharmcaol,2013,267(3):256-265.
[3] Blackwell T S,Christman J W.The role of nuclear factor-κB in cytokine gene regulation[J].Am J Respir Cell Mol Biol,1997,17:3-9.
[4] Madan M Chaturvedi,Ashok Kumar,Bryant G Darnay,et al.Aggarwal Sanguinarine (Pseudochelerythrine) Is a Potent Inhibitor of NF-κB Activation,IkBa Phosphorylation,and Degradation[J].THE JOURNAL OF BIOLOGICAL CHEMISTRY,1997,272(48):30129-30134.
[5] Rogler G,Andus T.Cytokines in inflammatory bowel disease[J].World J Surg,1998,22:382-389.
[6] Rogler G,Brand K,Vogl D,et al.Nuclear factor-κB is activated in macrophages and epithelial cells of inflamed intestinal mucosa[J].Gastroenterology,1998,115:537-569.
[7] Mitscher L A,Park Y H,Clark D,et al.Antimicrobial agents from higher plants.An investigation of Hunnemannia fumariaefolia pseudoalcoholates of sanguinarine and chelerythrine[J].Lloydia,1978,41:145-150.
[8] 徐丽,曾建国,程辟,等.血根碱-黄芩苷、白屈菜红碱-黄芩苷离子对化合物体外抗菌活性和急性毒性研究[J].中南药学,2012,10(1):10-13.
[9] Steven E Newman,Michael J Roll.A naturally occurring compound for controlling powdery mildew of greenhouse roses[J].Hort Science,1999,34(4):686-689.
[10] E Vrublova,J Vostalovea,J Ehrmann,et al.The phytogenic feed additive Sangrovit modulates dextran sulfate sodium-induced colitis in rats[J].Veterinarni Medicina,2010,55(12):610-618.
[11] Hamed Laroui1,Sarah A Ingersoll,Hong Chun Liu.Dextran Sodium Sulfate (DSS) Induces Colitis in Mice by Forming Nano-Lipocomplexes with Medium-Chain Length Fatty Acids in the Colon[J].Plos One,2012,7(3):1-12.
[12] 徐丽红,肖芳,兰小琴,等.葡聚糖硫酸钠诱导 C57BL/6J 小鼠急性结肠炎模型的建立与评价[J].医学研究生学报,2014,27(9):918-922.
[13] 肖娴,李秀琼,刁建新,等.白芍总苷对葡聚糖硫酸钠致大鼠实验性结肠炎作用机制研究[J].佛山科学技术学院学报,2012,30(2):78-81.
EffectsofSanguinarineonInflammatoryFactorsinRatColitisandInflammatoryPathway
LIU Yisong1,2,TANG Zhaoshan1,LIU Zhaoying1,2,JANG Haohang1,DUAN Zhigui3,ZENG Jianguo2,4*
(1.CollegeofVeterinaryMedicine,HunanAgriculturalUniversity,Changsha410128,China;2.NationalandProvincialUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,HunanAgriculturalUniversity,Changsha410128,China;3.CollegeofLifeScience,HunanNormalUniversity,Changsha410081,China;4.HunanCo-innovationCenterforUtilizationofBotanicalsFunctionalIngredients,Hunan,Changsha410128,China)
Objective:To explore the regulatory effect of sanguinarine on inflammation,and provide the foundation for research of sanguinarine for its anti-inflammatory effect.MethodsWith dextran sulfate sodium induced colitis in rats as a model,the regulating mechanism of sanguinarine on rat body weight,diarrhea and colitis and the occult blood detection factor was observed.The expression of IL-1,IL-6,IL-10 and TNF-αin colonic tissue was analyzed by fluorescence quantitative PCR (qPCR).ResultsCompared with the model group,the nuclear factor p65 protein in the sanguinarine group significantly decreased.ConclusionSanguinarine can up-regulate IL-10 and down-regulate IL-1β,IL-6,and inhibits inflammation.The nuclear factor p65 was also down-regulated.
Sanguinarine;colitis;inflammatory factors;NF-κΒ(p65)
国家自然科学基金(31200615);国家重点实验室培育基地开放项目(15KFXM09)
*
曾建国,教授,研究方向:中药资源与综合利用;Tel:(0731)84673824,E-mail:zengjianguo@hunau.edu.cn
10.13313/j.issn.1673-4890.2017.10.008
2017-02-26)

