食盐对肉制品脂质氧化影响的研究进展
周洋+谷大海+王桂瑛+徐志强+王雪峰+程志斌+范江平+普岳红+朱仁俊+廖国周
摘 要:脂质氧化是肉制品中的主要生化反应,适当的脂质氧化可以提升产品风味,而过度氧化不仅会导致肉制品产生不良气味,而且会影响其安全性。盐作为一种食品添加剂被广泛应用在食品工业中,其能够通过降低食品的水分活度达到防腐抑菌的效果,盐的添加还可以提高产品的保水性,增加產品风味;同时盐也能够促进肉制品的脂质氧化,导致产品品质下降。本文综述了不饱和脂肪酸和胆固醇的氧化机理以及盐对肉制品脂质氧化的影响,阐述了盐促氧化作用的机制与抑制措施,为降低肉制品的含盐量提供参考。
关键词:盐;肉制品;脂质氧化
Progress in Research on the Effect of Salt on Lipid Oxidation in Meat Products
ZHOU Yang1,2, GU Dahai1,2, WANG Guiying1,2, XU Zhiqiang1,2, WANG Xuefeng1,2, CHENG Zhibin2,
FAN Jiangping1,2, PU Yuehong1,2, ZHU Renjun1,*, LIAO Guozhou1,2,*
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. Livestock Product Processing Engineering and Technology Research Center of Yunnan Province, Yunnan Agricultural University, Kunming 650201, China)
Abstract: Lipid oxidation is one of the major biochemical reactions occurring in meat products. Proper lipid oxidation can improve the flavor of meat products, and excessive lipid oxidation can not only lead to off-flavor development, but also have a detrimental effect on the safety of meat products. Sodium chloride, commonly known as salt, is a widely used additive in the food industry due to its preservation and antimicrobial properties provided by its ability to reduce water activity. Moreover, the addition of salt to meat aims at improving water retention capacity and enhancing flavor. However, salt added in meat can favor lipid oxidation, which is one of the main causes for quality deterioration in meat products. This review summarizes the major mechanisms of oxidation of unsaturated fatty acids as well as the effect of salt on lipid oxidation in meat products. In addition, the mechanism of action and inhibition of salt oxidation and the feasible alternatives to reduce salt content in food are also discussed.
Key words: salt; meat products; lipid oxidation
DOI:10.7506/rlyj1001-8123-201710009
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2017)10-0046-07
天然存在或添加于食品中的脂质对食品营养和特征风味的形成具有重要作用,然而脂质氧化又是导致食品品质下降的主要原因之一。食品中的脂质发生氧化后会生成重要的香味物质,如醛、酮、醇等,但过度氧化会对食品的风味、色泽及质构等产生不良影响,脂溶性维生素和其他生物活性成分也会有所损失,并且产生多种自由基、氢过氧化物(hydroperoxides,ROOH)和有毒聚合物[1-3]。此外,脂质氧化的次级产物能够与蛋白质、肽类和氨基酸反应,加速蛋白质的氧化,导致必需氨基酸的丢失,且蛋白质或多肽结构的改变还会导致机体功能或生物学功能的丧失,从而诱发诸多疾病,危害消费者的健康[4-7]。
脂质氧化从动物屠宰结束后便立即开始发生,在宰后肌肉发生尸僵及转变为成熟肉期间继续进行,并一直持续到肉制品加工及贮藏时期。影响肉制品脂质氧化速率及强度的因素包括内部与外界工艺等因素。内部因素主要包括肉制品本身的脂肪含量及脂肪酸组成、过渡态金属离子(铁、铜等)浓度等;外部因素则包括动物屠宰前受到的压力和物理伤害、屠宰后肌肉的pH值、胴体温度变化、为防止肉的冷收缩和肉嫩化处理而采取的电刺激技术以及食盐、亚硝酸盐、香料和抗氧化剂等添加剂的使用[8]。
氯化钠(NaCl),俗称盐,其成本较低且功能多样化,是肉制品加工行业应用最为广泛的添加剂之一。盐能够降低食物的水分活度,因此具有防腐效果和抑菌特性;盐还可以提高产品的保水能力,并通过影响一些产风味物质的酶活性来增强肉制品的风味。然而,盐普遍被认为会加速肉制品的脂质氧化,导致肉和肉制品的色泽及风味发生改变,缩短其货架期[9]。
1 不饱和脂肪酸的氧化机理
不饱和脂肪酸的氧化是不饱和脂肪酸在有氧条件下以酶或非酶物质(光、热、光敏剂、金属离子、O2或N2)作为催化剂被催化后所发生的反应[10]。
非酶氧化包括自动氧化和光氧化,这2 种反应机制都依赖于O2的存在。自动氧化在O2分子或三线态氧(3O2)中进行,光氧化则在单线态氧(1O2)中进行[11]。酶促氧化则是通过脂肪氧化酶的作用发生的,通常在肉和肉制品的氧化反应中酶促反应不占主导优势。
1.1 自动氧化
肉类食品中脂质氧化的主要机制是自动氧化,脂质的自动氧化是一个由自由基催发的链式反应,通常被表述为起始、传播、终止3 个步骤[12]。
起始阶段发生于有诱发剂(光、热、感光剂或金属离子等)存在的情况下,与O2或N2发生进一步反应产生自由基。脂肪酸的氧化速率与其双键数目有关,吴海燕[13]
发现脂肪酸的光氧化速率顺序为α-亚麻酸>亚油酸>
油酸。进入传播期后,自由基與3O2形成过氧自由基,与其他脂肪酸发生反应,最终形成的较不稳定的ROOH又分解产生新的自由基[14]。铁元素是肉与肉制品中主要的过渡金属元素,过渡金属元素氢能使过氧化物的分解速率加快[8]。Carlsen等[15]发现Fe2+与脂质过氧化物的反应速率比Fe3+更快。在传播期,食品的感官特征开始发生改变。终止期是自动氧化的最后一步,在这个阶段,前期大量累积的氢过氧自由基之间相互发生反应,产生新的非自由基化合物,主要包括脂肪烃、醛、酮、醇、羧酸、内酯及呋喃等杂环类化合物[16-17]。终止期阶段食品的耗氧量和过氧化氢含量均有所下降,食品的感官特征变化较为显著,并且理化特性也开始改变。
1.2 光氧化
基态的氧分子是3O2,它可以通过电子激发生成1O2。1O2的生成途径较多,而光氧化过程只需要O2,只要有波长合适的光源和光敏剂就可以进行,例如紫外线与光敏剂的组合[18-21]。1O2相较于3O2具有更强的电子亲和能力,因此反应能力更强,例如亚油酸与1O2的反应速率比其与3O2的反应速率高1 450 倍[22]。1O2可以通过环加成反应直接和不饱和脂肪酸反应生成脂肪酸ROOH,并且与位于双键之间的碳原子相互作用,引起双键位置和构型的改变。
1.3 ROOH裂解
不饱和脂肪酸通过发生自动氧化、光氧化和酶促氧化等过程形成的ROOH,会进一步裂解成脂质氧化次级产物。
ROOH通过2 个氧原子之间的均裂产生烷氧基和一个羟自由基。烷氧基自由基比烷基更容易和过氧自由基发生反应,其机理主要是烷氧基可以攻击不饱和脂肪酸分子或经历β-裂解,而β-裂解产生的自由基又能与多种产物发生反应产生次级氧化产物[23]。Kangsadan等[24]从海藻中提取脂肪氧合酶(lipoxygenase,LOX),以花生四烯酸为原料生成了12-花生四烯酸ROOH,并同时伴随少量的15-花生四烯酸ROOH生成,在裂解酶的存在下,前者裂解成3-(Z)-己烯醛,后者裂解成己醛。
通过脂质氧化形成的醛中,4-羟基壬烯醛(4-hydroxy-2-nonenal,HNE)较为特别。HNE是ω-6多不饱和脂肪酸自动氧化过程中形成的主要醛类物质,然而,其在肉类中的形成和降解机制尚未被完全阐明[25-26]。
HNE与生物活性、酶的抑制作用以及对蛋白质合成的抑制作用都有关联,HNE通过加成反应能够使许多酶的活性下降甚至完全丧失,包括甘油醛-3-磷酸脱氢酶、蛋白酶体、组织蛋白酶B、脂氧合酶-1、钠-钾泵等[27-29]。另外,反式-4-羟基-2-己醛(trans-4-hydroxy-2-hexanal,HHE)衍生自ω-3多不饱和脂肪酸的氧化。HNE和HHE均被认为具有细胞毒性[30]。诸如亚麻酸和花生四烯酸等具有3 个及以上双键的多不饱和脂肪酸均可生成具有腐臭味的挥发性化合物丙二醛,它是脂质氧化期间形成量最多的醛,可以与蛋白质、DNA、RNA和其他生物分子发生反应,对人体健康有害。丙二醛通常作为比色法测定硫代巴比妥酸反应物质(thiobarbituric acid reactive substances,TBARs)值的反应物质,并用其来判断肉制品的脂质氧化程度[31]。
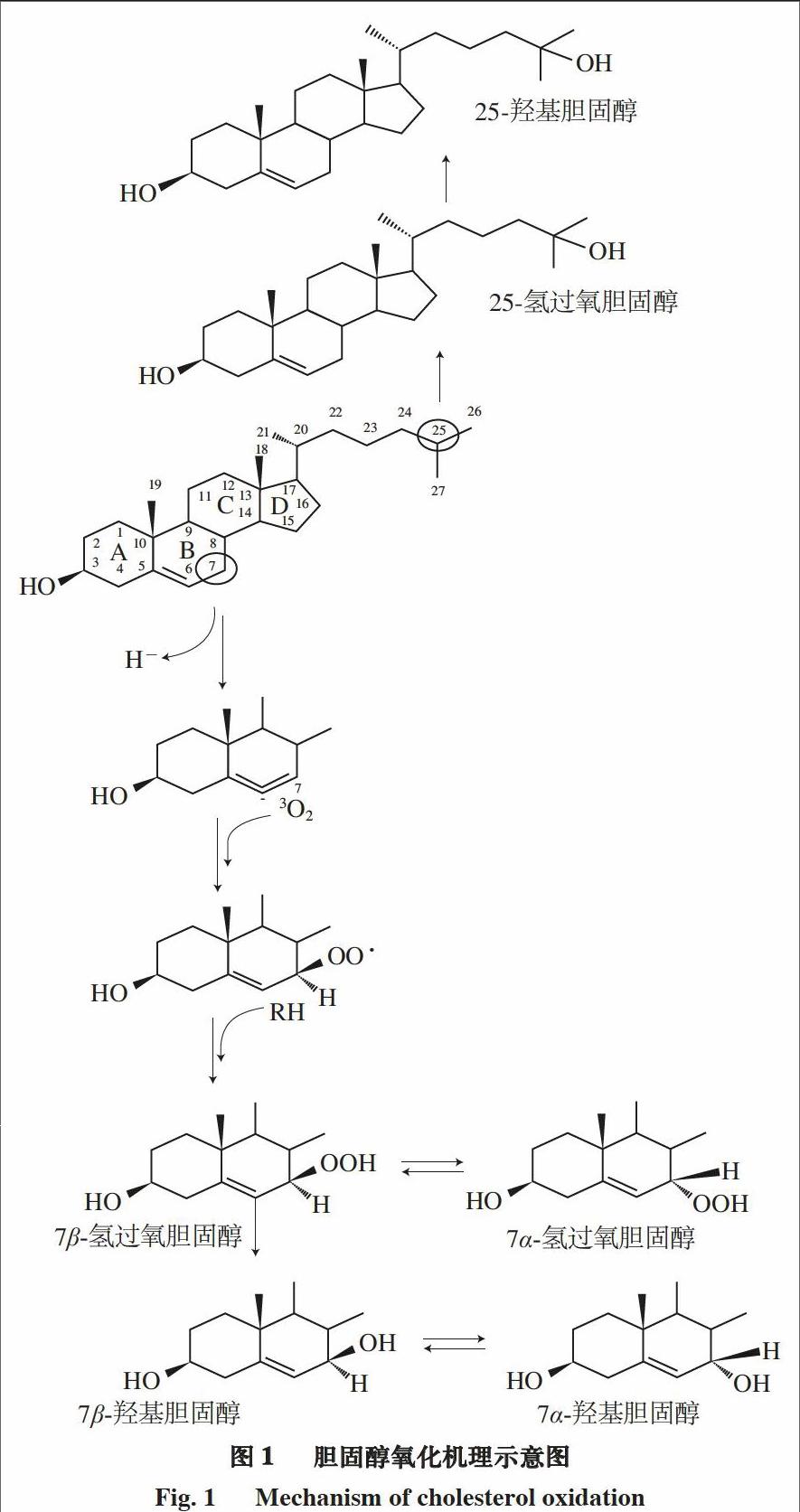
1.4 胆固醇氧化机理
胆固醇具有由4 个环(A、B、C和D)和含8 个碳原子的侧链组成的类固醇结构(图1)。B环的C5和C6之间存在一对双键,使胆固醇分子更容易发生氧化。胆固醇氧化的产物为氧化胆固醇或羟固醇,目前已知的胆固醇氧化产物有70 种,胆固醇氧化产物的生成有酶促和非酶2 种反应机制。
胆固醇氧化类似于脂肪酸的自动氧化,即通过取代丙烯基双键上的氢原子,在C5、C6和C7之间生成一个丙烯基自由基的离域。之后,氧分子优先攻击丙烯基B环C7上的双键,因为这个反应更倾向于低活化能的夺氢反应。最后,形成差向异构体7α-和7β-氢过氧胆固醇
(7-OOH),但构型转换之后,7β-氢过氧胆固醇将占主导地位,这是因为它在热动力学上更稳定。由于C19上的甲基以及C13上的羟基的位阻,O2可能会对C4进行攻击,差向异构体7α-氢过氧胆固醇和7β-氢过氧胆固醇是这个反应的初级产物,它们将会分解为对应的醇类7α-和7β-羟基胆固醇(7α-OH和7β-OH)。
侧链的氧化反应优先发生在C25(叔碳原子)上,形成25-氢过氧胆固醇(25-hydroperoxycholesterol,
25-OOH),由于其受热易分解的性质很容易降解为相应的25-羟基胆固醇(25-hydroxycholesterol,25-OH)。此外,侧链氧化还可以在C20、C22、C24和C27上生成单氢过氧化物,并且它们还会分解生成相对应的产物,如醇、酮、醛和羧酸等。
胆固醇氧化物可以通过饮食被摄入体内,其潜在的致动脉粥样硬化性、致毒性、致突变性和致癌性会对人体健康产生较大影响。此外,它们与退行性疾病(如帕金森病和阿尔茨海默病)的产生有关,并且能够抑制参与胆固醇合成的3-羟基-3-甲基-呋喃基-辅酶A还原酶的生成。在胆固醇氧化物中,7α-OH、7β-OH、7-酮和三元醇被认为是最具有细胞毒性的胆固醇氧化物[32]。
2 盐对脂质氧化的作用
食品中的盐含量通常在1%~2%左右,腊肠和红肠等肉制品的含盐量较高。盐不仅对肉制品货架期的延长、风味及嫩度等方面有积极的促进作用,还能增加其持水力和多汁性。在许多肉制品及水产品中,盐都被当做一种促氧化剂[33-36]。龙门等[37]发现增加盐的用量能够降低蛋黄中脂质初始氧化反应的活化能,从而促进脂质氧化。但Kong等[38]认为盐对于脂质的促氧化作用存在一定的浓度范围,随着盐浓度的逐渐增加,高浓度的离子环境反而会抑制脂质氧化的进行。靳国锋[39]的研究表明,在高温风干条件下,随着盐含量的升高,干腌培根的脂质氧化作用被抑制。为了加快脂质氧化初级产物的形成,使肉制品在腌制期间产生风味物质,以缩短加工时间,Jin Guofeng等[9]研究了含盐量和加工温度之间的关系,通过建立数学模型,发现在高温35 ℃以及含盐量约为2.77%的条件下可以有效加快猪肉的脂质氧化效率,
tmax(可达到的最快脂质氧化效率)=1.03 d。
此外,通过脂质氧化形成的挥发性化合物,如1-戊烯-3-醇(来自ω-3多不饱和脂肪酸)、戊醛、己醛、1-戊醇、2-戊二酮、1-己醇、1-辛烯-3-醇和2-辛烯-1-醇(来自ω-6多不饱和脂肪酸)等,这些物质的形成能够导致产品的营养及感官特性发生改变[3]。
2.1 盐在脂质氧化过程中的作用机制
肉中的脂质氧化是由自由基的形成而引发的,并且受到食品加工的类型、条件以及盐和其他添加剂等因素的影响。例如,将高静水压技术应用于鸡胸肉和鸡腿肉是导致自由基形成的原因,当鸡肉中的盐含量达到3%时会产生更多的自由基[40]。
NaCl的促氧化作用机制主要是由于其能够破坏细胞膜的完整性,这会促使氧化剂进入脂质基质,从含铁的分子中释放铁离子,如血红蛋白;NaCl也能通过影响其他氧化反应进程来促进脂肪氧化,如通过影响肌肉细胞的内源抗氧化酶活性来间接影响脂质氧化或抑制過氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶的活性[41-43]。
一般来说,被铜和铁等金属离子污染过的盐对肉制品的脂质氧化有促进作用。Rahimi等[44]发现当金属和金属盐中卟啉环络合物的浓度为10-8 mol/L时,可以发生强氧化反应,当铜含量为0.02 mg/kg时,可催化奶油产生刺激性气味。Johnson等[45]将鸡肉中添加1%盐(混有0.118~1.995 mg/kg铁、0.005~0.019 mg/kg铜或0.100~1.700 mg/kg锰)的实验组与不含盐的对照组分别处理后,冻存9 周,并在贮藏期间测定2 组鸡肉的TBARs值变化,发现盐确实具有一定的促氧化作用,但含有不同浓度金属污染物的样品没有显著差异。Overholt等[36]将含有不同金属污染物(铜、铁、锰、钙和镁)的3 种未精制盐(2 种岩盐和1 种海盐)添加到猪肉中,也没有发现猪肉样品脂质氧化的气味或风味差别。此外,Torres等[46]的研究表明,与纯盐相比,碘盐的使用并不会使混合肉(牛肉和猪肉)更易发生脂质氧化,含有2%碘盐的鸡肉在-12 ℃条件下贮藏90 d期间没有发生脂质氧化。
氯离子是磷脂酰胆碱脂质体模型体系中促氧化作用的重要成分。将含有不同一价阳离子(钠、钾、锂)的氯盐进行比较,发现它们对于脂质氧化几乎没有影响,而氯化钙和氯化锶表现出的氧化能力均强于氯化钠。在氯盐、硫酸盐、氟化物、溴化物、碘酸盐和硝酸盐等不同的阴离子盐中,只有硫酸盐能够在相同的氯离子浓度下加速脂质的氧化。在腌肉成熟过程中,使用相同量的NaCl和其他盐(氯化锂、氯化镁、氯化钙和氯化钾)对其进行处理,结果表明,这些氯化物都可以不同程度地加快脂质氧化,说明氯离子并不是盐中导致脂质氧化的原因[47]。
内源性酶也有助于抑制氧化反应,特别是在肉制品贮藏期间。谷胱甘肽过氧化物酶是一种含硒的酶,它可以催化脂质和过氧化氢还原成酒精或水等更为无害的化合物。过氧化氢酶是一种含有血红素基团的酶,它可以催化过氧化氢分解,产生水和氧分子,还可以抑制由过氧化氢作用形成的高铁肌红蛋白的生成。通常,一些用于肉类产品中的添加剂(如盐)会影响抗氧化酶的抗氧化效果,例如降低谷胱甘肽过氧化物酶或过氧化氢酶的活性。食品脂质氧化的程度(通过TBARs值和过氧化物指数测定)与贮藏期间谷胱甘肽过氧化物酶或过氧化氢酶的活性呈负相关[48]。
2.2 降低盐促氧化作用的方法
可以采用改进气体包装(真空包装或充入二氧化碳或氮气)或添加抗氧化剂的方法来抑制盐的促氧化活性。Sánchez-Molinero等[49]通过降低加工环境中O2的含量来降低产品加工过程中脂质的氧化程度,并且通常使用采用聚氯乙烯(polyvinyl chloride,PVC)的二次包装保护肉制品免受脂质氧化,同时防止由肉和O2接触造成的损害。
抗氧化剂可以通过直接添加到肉制品中或在饲料中添加2 种方式来达到抑制肉制品脂质氧化的作用。常用的人工合成抗氧化剂有丁基羟基茴香醚(butyl hydroxyanisd,BHA)和二丁基羟基甲苯(butylated hydroxytoluene,BHT),但由于合成抗氧化剂具有一定的安全问题,使用天然抗氧化剂将成为食品加工行业的新趋势。常用的天然抗氧化剂有α-生育酚、抗坏血酸钠、草本萃取液和植物精油等。Brewer[50]将葡萄籽提取物添加到牛肉香肠中,添加量分别为100、300、
500 mg/kg,70 ℃煮制至熟后,采用PVC包裝,于-18 ℃贮藏4 个月,结果表明,添加葡萄籽提取物的香肠样品的哈败味显著低于空白组,保持新鲜熟牛肉风味的时间也显著长于空白组。Vaithiyanathan等[51]将石榴果汁酚滴液添加到鸡肉中,4 ℃贮藏28 d,每隔2 d测定样品的TBARs值,结果表明,添加石榴果汁酚鸡肉的TBARs值显著低于空白组。蒋兰宏等[52]的研究表明,新鲜鱼肉经不同浓度的茶多酚溶液处理后,其挥发性盐基氮含量、pH值均与贮藏时间呈正相关,表明茶多酚能够延长鱼肉的保鲜期,具有很强的抗氧化作用。曹娟等[53]发现绿茶提取物能够显著抑制意大利发酵香肠的氧化,而对其pH值、色泽和感官品质的影响不显著。Ahn等[54]的研究表明,松树皮提取物具有抗氧化性,其能够增加熟牛肉的红度值。廖婵等[55]采用迷迭香、茶多酚、VE及其复合物作为抗氧化剂,喷淋于干腌火腿切块表面,研究其对切块火腿脂质氧化的抑制作用和护色效果,结果表明,贮藏4 个月后,喷淋单一迷迭香、茶多酚和VE火腿样品的过氧化值及TBARs值均有所降低,其中迷迭香的抗氧化效果最佳;喷淋迷迭香+茶多酚、茶多酚+VE和迷迭香+VE火腿样品的过氧化值分别降低了40%、39%和30%,TBARs值分别降低了46%、57%和48%,表明抗氧化剂复合物具有更好的抗氧化效果,与BHT的效果相当。
不同抗氧化剂具有不同的作用机制,这些机制包括清除活性氧和氮等物质、淬灭1O2、使激发态的光敏剂失活、螯合金属离子或生成另一种抗氧化分子。可以在食品中添加具有不同作用机制的抗氧化剂混合物,通过协同作用增强其抗氧化作用。例如,将金属螯合剂(柠檬酸)和自由基清除剂(生育酚)同时添加于食品中。
抗氧化剂的类型、浓度及含盐量都是影响肉制品加工和贮藏期间脂质氧化程度的决定性因素。Mariutti等[34]通过添加0.1%的干鼠尾草叶,有效控制了含盐量为0.5%的鸡胸肉的脂质氧化和胆固醇氧化物的形成。
Bragagnolo等[56]发现向含盐量为0.5%的鸡肉丸中添加0.1%的干燥迷迭香对于降低其促氧化作用有一定效果,经过高温、高压处理后的鸡肉丸在5 ℃条件下可以贮藏9 d。Lin等[35]发现烘烤咖啡富含类黑色素和绿原酸,将其添加到含盐量为2 g/100 g的牛肉馅中具有很好的抗氧化效果,其中黑咖啡的抗氧化效果最为显著。Rojas等[57]的研究表明,将0.02%的迷迭香精油加入到相同条件加工和贮藏的相同肉制品中并不能降低盐的促氧化作用,而添加0.02%的水溶性牛至叶提取物能够有效减缓牛肉馅中的氧化反应;将0.01%和0.02%的葡萄提取物加入到含盐量2%的牛肉和猪肉饼中,在4 ℃条件下贮藏8 d期间均可以有效控制样品的脂肪氧化。
2.3 盐的替代物
随着社会的进步,人们对食品安全的关注度越来越高,对低盐食品的诉求也越来越强烈。通过饮食摄入过多的盐会引发高血压,从而导致心血管疾病的患病风险增加。因此,寻找出能够在食品加工过程中完全或部分替代盐的有效措施很有必要。张雅玮等[58]对咸味肽和酵母型咸味剂进行了介绍,但较高的成本限制了其大规模普及。目前可行的能够降低食物中含盐量的解决方案主要有3 种。
2.3.1 用KCl代替NaCl
Wu Haizhou等[59]用KCl代替40%的NaCl生产干腌培根,发现产品质构、风味及色泽等方面的差异不显著。Gheisari等[33]的研究表明,将NaCl(0.625%~2.500%)和KCl(0.8%~3.2%)以不同的浓度添加到鸡肉和牛肉中,它们对应的离子强度相等,样品在4 ℃贮藏4 d时的脂质氧化没有差异。Horita等[60]的研究表明,盐浓度为2%、5 ℃贮藏60 d时,KCl和CaCl2盐溶液组合比NaCl和MgCl2盐溶液组合的促氧化作用更弱。然而,KCl具有轻微的苦味,这可能会影响产品的感官品质,导致消费者接受度较低。
2.3.2 添加风味增强剂
虽然风味增强剂本身不具有咸味,但在与盐结合使用后可以增加食品的咸味。例如磷酸盐、谷氨酸镁和柚皮苷等通常被添加在低盐肉制品中,用于帮助其增强持水力,并增加咸味[61]。具有类似作用的高温(35 ℃)添加剂还包括有机酸和其他糖类,例如海藻糖和蔗糖。
2.3.3 改变NaCl的物理结构
通过改变NaCl的物理结构,使得盐晶体可以在口中更快地溶解,使食品产生更显著的咸味。此种方法目前还在研究阶段。
3 结 语
盐是食品加工行业使用最早、应用范围最广的食品添加剂之一,在肉制品中添加食盐对改善其感官品质和抑制致病微生物的生长具有重要作用,但盐也能促进肉制品的脂质氧化,过度氧化便会导致产品品质下降。目前,国内外研究人员针对盐的促氧化作用机制提出了几种假说,然而为了印证现有理论仍有必要继续进行更加深入的研究,以准确阐明盐促氧化作用的机制。此外,盐的重金属污染和氯离子浓度对于脂质氧化并没有显著影响。今后肉制品加工企业所面临的挑战不仅是寻找出能够降低肉制品中盐含量的有效措施,还需要寻找出更为合适的盐替代物或方法。一般来说,在肉制品中用其他盐替代NaCl在氧化效果方面并没有显著差异,但是还需要考虑产品的质地、乳液稳定性、持水力和感官品质变化等其他因素,以保证这些替代物不会对产品造成较大影响。与此同时,针对盐在胃、肠道消化过程中对于脂质氧化的作用,以及它对消化过程中产生的有害次级脂质氧化产物的形成和同化的影响,还有待进行进一步深入、详细的研究。
参考文献:
[1]吴娜, 王锡昌, 陶宁萍, 等. 动物源食品中脂质氧化降解对香气物质形成的作用[J]. 中国食品学报, 2016, 16(7): 209-215. DOI:10.16429/j.1009-7848.2016.07.028.
[2]BARTOSZ G. Food oxidants and antioxidants: chemical, biological, and functional properties[M]. Boca Raton: CRC Press, 2013: 189.
[3]SOUZA H A, BRAGAGNOLO N. New method for the extraction of volatile lipid oxidation products from shrimp by headspace-solid-phase
microextraction-gas chromatography-mass spectrometry and evaluation of the effect of salting and drying[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 590-599. DOI:10.1021/jf404270f.
[4]EST?VEZ M. Oxidative damage to poultry: from farm to fork[J]. Poultry Science, 2015, 94(6): 1368-1378. DOI:10.3382/ps/pev094.
[5]EST?VEZ M, LUNA C. Dietary protein oxidation: a silent threat to human health?[J]. Critical Reviews in Food Science and Nutrition, 2016, 57(17): 3781-3793. DOI:10.1080/10408398.2016.1165182.
[6]HEADLAM H A, DAVIES M J. Cell-mediated reduction of protein and peptide hydroperoxides to reactive free radicals[J]. Free Radical Biology and Medicine, 2003, 34(1): 44-55. DOI:10.1016/S0891-5849(02)01181-4.
[7]VALKO M, RHODES C J, MONCOL J, et al. Free radicals, metalsand antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1): 1-40. DOI:10.1016/j.cbi.2005.12.009.
[8]ERICKSON M C. Food lipids[M]. Boca Raton: CRC Press, 2002: 365-411. DOI:10.1201/9780203908815.ch12.
[9]JIN Guofeng, HE Lichao, ZHANG Jianhao, et al. Effects of temperature and NaCl percentage on lipid oxidation in pork muscle and exploration of the controlling method using response surface methodology (RSM)[J]. Food Chemistry, 2012, 131(3): 817-825. DOI:10.1016/j.foodchem.2011.09.050.
[10]張迎阳. 干腌肉制品中脂质自动氧化机理及调控机制研究[D]. 南京:
南京农业大学, 2014: 26.
[11]HUVAERE K, CARDOSO D R, HOMEM-DE-MELLO P, et al.
Light-induced oxidation of unsaturated lipids as sensitized by flavins[J]. Journal of Physical Chemistry B, 2010, 114(16):
5583-5593. DOI:10.1021/jp9121744.
[12]SCHAICH K M, SHAHIDI F, ZHONG Y, et al. Biochemistry of foods[M]. 3rd ed. Manhattan: Academic Press, 2013: 421.
[13]吴海燕. 单线态氧与不饱和化合物的反应及其过氧化产物的化学发光研究[D]. 无锡: 江南大学, 2012: 71.
[14]BELITZ H D, GROSH W, SCHIEBERLE P. Food chemistry[M]. 4th ed.
Berlin: Springer Verlag, 2009: 203.
[15]CARLSEN C U, M?LLER J K S, SKIBSTED L H. Hemeiron in lipid oxidation[J]. Coordination Chemistry Reviews, 2005, 249: 485-498. DOI:10.1016/j.ccr.2004.08.028.
[16]文志勇, 孙宝国, 梁梦兰, 等. 脂质氧化产生香味物质[J]. 中国油脂, 2004(9): 41-44. DOI:10.3321/j.issn:1003-7969.2004.09.012.
[17]LIN J M, BLANK I. Odorants generated by thermally induced degradation of phospholipids[J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4364-4369. DOI:10.1021/jf034300m.
[18]DEROSA M C, CRUTCHLEY R J. Photosensitized singlet oxygen and its applications[J]. Coordination Chemisty Reviews, 2002,
233/234: 351-371. DOI:10.1016/S0010-8545(02)00034-6.
[19]KOCHEVAR I E, REDMOND R W. Photosensitized production of singlet oxygen[J]. Methods in Enzymology, 2000, 319(1): 20-28. DOI:10.1016/S0076-6879(00)19004-4.
[20]BAIER J, FUSS T, P?LLMANN C, et al. Theoretical and experimental analysis of the luminescence signal of singlet oxygen for different photosensitizers[J]. Journal of Photochemistry and Photobiology B, 2007, 87(3): 163-173. DOI:10.1016/j.jphotobiol.2007.02.006.
[21]TANG W, XU H, PARK E J, et al. Encapsulation of methylene blue in polyacrylamide nanoparticle platforms protects its photodynamic effectiveness[J]. Biochemical and Biophysical Research Communications, 2008, 369(2): 579-583. DOI:10.1016/j.bbrc.2008.02.066.
[22]MIN D B, BOFF J M, AKOH C C, et al. Lipid oxidation of edible oil[J].
Food Lipids Chemistry Nutrition and Biotechnology, 1998, 88:
283-296. DOI:10.1201/9780203908815.pt3.
[23]WILAILUK C, RYAN E D, JULIAN M, et al. Role of physical structures in bulk oils on lipid oxidation[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(3): 299-317. DOI:10.1080/10408390600754248.
[24]KANGSADAN B, KENJI M, YOSHIHIKO A, et al. Hydroperoxy-arachidonic
acid mediated n-hexanal and (Z)-3-and (E)-2-nonenal formation in Laminaria angustata[J]. Phytochemistry, 2003, 64(3): 809-818. DOI:10.1016/S0031-9422(03)00026-8.
[25]MEHTA B M. Nutritional and toxicological aspects of the chemical changes of food components and nutrients during heating and cooking[M]. Berlin: Springer Berlin Heidelberg, 2015: 898.
[26]SAKAI T, SHIMIZU Y, KAWAHARA S. Effect of NaCl on the lipid peroxidation-derived aldehyde, 4-hydroxy-2-nonenal, formation in boiled pork[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(4): 815-820. DOI:10.1271/bbb.70.815.
[27]UCHIDA K, STADTMAN E R. Covalent attachment of 4-hydroxynonenal to glyceraldehyde-3-phosphate dehydrogenase: a possible involvement of intra- and intermolecular cross-linking reaction[J]. Journal of Biological Chemistry, 1993, 268(9): 6388-6393.
[28]CRABB J W, OEIL J, MIYAGI M, et al. Hydroxynonenal inactivates capthepsin B by forming Michael adducts with active site residues[J]. Protein Science, 2002, 11(4): 831-840. DOI:10.1110/ps.4400102.
[29]SCHAUR R J. Basic aspects of the biochemical reactivity of 4-hydroxynonenal[J]. Molecular Aspects of Medicine, 2003, 24(4): 149-159. DOI:10.1016/S0098-2997(03)00009-8.
[30]LONG E K, SR P M. Trans-4-hydroxy-2-hexenal, a product of n-3 fatty acid peroxidation: make some room HNE[J]. Free Radical Biology and Medicine, 2010, 49(1): 1-8. DOI:10.1016/j.freeradbiomed.2010.03.015.
[31]任雪梅, 王文特, 田洪芸, 等. 比色法测定鸭油中的丙二醛[J]. 山东农业科学, 2014(1): 117-119.
[32]OTAEGUIARRAZOLA A, MEN?NDEZCARRE?O M, ANSORENA D, et al. Oxysterols: a world to explore[J]. Food and Chemical Toxicology, 2010, 48(12): 3289-3303. DOI:10.1016/j.fct.2010.09.023.
[33]GHEISARI H R, MOTAMEDI H. Chloride salt type/ionic strength and refrigeration effects on antioxidant enzymes and lipid oxidation in cattle, camel and chicken meat[J]. Meat Science, 2010, 86(2): 377-383.
DOI:10.1016/j.meatsci.2010.05.020.
[34]MARIUTTI L R B, NOGUEIRA G C, BRAGAGNOLO N. Lipid and cholesterol oxidation in chicken meat are inhibited by sage but not by garlic[J]. Journal of Food Science, 2011, 76(6): C909-C919. DOI:10.1111/j.1750-3841.2011.02274.x.
[35]LIN C, TOTO C, WERE L. Antioxidant effectiveness of ground roasted coffee in raw ground top round beef with added sodium chloride[J]. LWT-Food Science and Technology, 2015, 60(1): 29-35. DOI:10.1016/j.lwt.2014.08.010.
[36]OVERHOLT M F, MANCINI S, GALLOWAY H O, et al. Effects of salts of varying purity on lipid oxidation, sensory characteristics, and textural properties of fresh, ground pork patties[J]. Meat Science, 2016, 112: 890-896. DOI:10.1016/j.meatsci.2015.08.063.
[37]龍门, 宋野, 杜庆飞, 等. 腌制温度和食盐用量对咸鸭蛋蛋黄脂质的影响[J]. 农业工程学报, 2015(18): 281-288. DOI:10.11975/j.
[38]KONG F B, OLIVEIRA A, TANG J M, et al. Salt effect on heat-induced
physical and chemical changes of salmon fillet (O.gorbuscha)[J].
Food Chemistry, 2008, 106(3): 957-966. DOI:10.1016/j.foodchem.2007.07.008.
[39]靳国锋. 干腌培根加工过程中脂质氧化调控机制研究[D]. 南京: 南京农业大学, 2011: 104.
[40]BRAGAGNOLO N, DANIELSEN B, SKIBSTED L H. Combined effect of salt addition and high-pressure processing on formation of free radicals in chicken thigh and breast muscle[J]. European Food Research and Technology, 2006, 223(5): 669-673. DOI:10.1007/s00217-006-0251-y.
[41]XIONG Y L, TANG H C, SHAHIDI F. Quality attributes of muscle foods[M]. New York: Springer US, 1999: 95-113.
[42]KANNER J, HAREL S, JAFFEE R. Lipid peroxidation of muscle food as affected by NaCl[J]. Journal of Agricultural and Food Chemistry, 1991, 39(6): 1017-1021. DOI:10.1021/jf00006a002.
[43]HERN?NDEZ P, PARK D, SOON R K. Chloride salt type/ionic strength, muscle site and refrigeration effects on antioxidant enzymes and lipid oxidation in pork[J]. Meat Science, 2002, 61(4): 405-410. DOI:10.1016/S0309-1740(01)00212-1.
[44]RAHIMI A, AZARPIRA A, KIM H, et al. Chemoselective metal-free aerobic alcohol oxidation in lignin[J]. Journal of the American Chemical Society, 2013, 135(17): 6415-6418. DOI:10.1021/ja401793n.
[45]JOHNSON H K, MCKEITH F K, KILLEFER J, et al. Texture, lipid oxidation and sensory characteristics of ground pork patties prepared with commercially available salts[J]. LWT-Food Science and Technology, 2013, 50(2): 408-413. DOI:10.1016/j.lwt.2012.09.004.
[46]TORRES E A F S, RIMOLI C D, OLIVO R, et al. Papel do sal iodado na oxida??o lipídica em hambúrgueres bovino e suíno (misto) ou de frango[J]. Sociedade Brasileira De Ciência E Tecnologia De Alimentos, 1998, 18(1): 49-52. DOI:10.1590/S0101-20611998000100011.
[47]ELLIS R, CURRIE G T, THORNTON F E, et al. Carbonyls in oxidizing fat. 11. the effect of the pro-oxidant activity of sodium chloride on pork tissue[J]. Journal of Food Science, 2006, 33(6): 555-561.
DOI:10.1111/j.1365-2621.1968.tb09073.x.
[48]GHEISARI H R, MOTAMEDI H. Chloride salt type/ionic strength and refrigeration effects on antioxidant enzymes and lipid oxidation in cattle, camel and chicken meat[J]. Meat Science, 2010, 86(2): 377-383.
DOI:10.1016/j.meatsci.2010.05.020.
[49]S?NCHEZ-MOLINERO F, GARC?A-REGUEIRO J A, ARNAU J.
Processing of dry-cured ham in a reduced-oxygen atmosphere: effects on physicochemical and microbiological parameters and mite growth[J]. Meat Science, 2010, 84(3): 400-408. DOI:10.1016/j.meatsci.2009.09.008.
[50]BREWER M S. Effect of grape seed extract on oxidative, color and sensory stability of pre-cooked, frozen, re-heated beef sausage model system[J]. Meat Science, 2011, 88(1): 139-144. DOI:10.1016/j.meatsci.2010.12.014.
[51]VAITHIYANATHAN S, NAVEENA B M, MUTHUKUMAR M, et al. Effect of dipping in pomegranate (Punica granatum) fruit juice phenolic solution on the shelf life of chicken meat under refrigerated storage (4 ℃)[J]. Meat Science, 2011, 88(3): 409-414. DOI:10.1016/j.meatsci.2011.01.019.
[52]蔣兰宏, 周友亚. 茶多酚作为抗氧化剂在鱼肉中的应用[J].
河北师范大学学报, 2003(6): 606-607. DOI:10.3969/j.issn.1000-5854.2003.06.018.
[53]曹娟, 高红亮, 常忠义, 等. 绿茶提取物对意大利发酵香肠品质的影响[J]. 安徽农业科学, 2010, 38(11): 5882-5884. DOI:10.13989/j.cnki.0517-6611.2010.11.047.
[54]AHN J, GRIIN L U, MUSTAPHA A. Effects of plant extracts on microbial growth, color change, and lipid oxidation in cooked beef[J]. Food Microbiology, 2007, 24(1): 7-14. DOI:10.1016/j.fm.2006.04.006.
[55]廖婵, 靳国锋, 章建浩, 等. 迷迭香、茶多酚、VE对干腌火腿贮藏过程中抗脂质氧化及护色效果的研究[J]. 食品工业科技, 2008(8): 82-86.
DOI:10.13386/j.issn1002-0306.2008.08.022.
[56]BRAGAGNOLO N, DANIELSEN B, SKIBSTED L H. Effect of rosemary on lipid oxidation in pressure-processed, minced chicken breast during refrigerated storage and subsequent heat treatment[J]. European Food Research and Technology, 2005, 221(5): 610-615. DOI:10.1007/s00217-005-0013-2.
[57]ROJAS M C, BREWER M S. Effect of natural antioxidants on oxidative stability of cooked, refrigerated beef and pork[J]. Journal of Food Science, 2007, 72(4): S282-S288. DOI:10.1111/j.1750-3841.2007.00335.x.
[58]张雅玮, 郭秀云, 彭增起. 食盐替代物研究进展[J]. 肉类研究, 2011, 25(2): 36-38.
[59]WU Haizhou, ZHANG Yingyang, LONG Men, et al. Proteolysis and sensory properties of dry-cured bacon as affected by the partial substitution of sodium chloride with potassium chloride[J]. Meat Science, 2014, 96(3): 1325-1331. DOI:10.1016/j.meatsci.2013.10.037.
[60]HORITA C N, MORGANO M A, CELEGHINI R M S, et al. Physico-chemical
and sensory properties of reduced-fat mortadella prepared with blends of calcium, magnesium and potassium chloride as partial substitutes for sodium chloride[J]. Meat Science, 2011, 89(4): 426-433.
DOI:10.1016/j.meatsci.2011.05.010.
[61]吳海舟, 张迎阳, 黎良浩, 等. KCl部分替代NaCl腌制对干腌肉制品蛋白质水解和感官品质的影响[J]. 食品科学, 2014, 35(1): 39-43. DOI:10.7506/spkx1002-6630-201401008.

